有机酸不仅是啤酒风味的影响因子之一[1],也是啤酒感官品评中酸味的主要来源[2-4],同时还决定了啤酒总酸含量、pH值等理化指标。啤酒中的有机酸主要来源于麦芽、酒花等原材料[5],啤酒中适度的酸能够使酒体具有缓冲性,对啤酒风味起到稳定的作用[4];酿造过程中有机酸的变化规律以及后发酵阶段有机酸含量的控制也是酿造工艺合理性的评价指标[6-7]。因此,有机酸的组成与含量分析近年来受到越来越多的啤酒生产企业关注。
目前GB/T 4927—2008《啤酒》对啤酒总酸含量有具体要求,但尚未有啤酒中有机酸含量的测定方法。GB 5009.157—2016《食品有机酸的测定》适用于果汁及果汁饮料、碳酸饮料、固体饮料等食品,但不包含啤酒。啤酒有机酸分析的方法有电位滴定法[8]、分光光度法、离子色谱法[9-11]等,但一般前处理步骤繁琐,且能同时分离的有机酸种类较少[4]。气相色谱法进行有机酸分析时,由于有机酸的沸点较高、不易气化,因此需要先对其衍生再进行测定[12-13];同时又因有机反应不易定量而直接影响测定结果的准确性。反相高效液相色谱法(reversed phase high performance liquid chromatography,RP-HPLC)分析啤酒[14-15]、黄酒[16]、果酒[17-18]、苹果醋[19]等发酵食品中有机酸组成及含量,方法简便、准确度高,具有较好的选择性且分析时间短。
本研究建立一种RP-HPLC分析啤酒中有机酸含量的方法,针对影响有机酸分离效果的主要因素如检测波长、流动相、流速等进行考察,确定RP-HPLC分析测定啤酒中9种有机酸组成的优化条件,并将该方法应用到啤酒酿造过程中有机酸组成及含量检测,结合发酵机理对发酵液中的有机酸组成进行了RP-HPLC动态分析,以期为最终改善啤酒过酸的现象、改进酿造工艺提供依据。
1 材料与方法
1.1 材料与试剂
某品牌10°啤酒样品(酒精度4.2%vol;总酸含量1.1 mL/100 mL;pH 4.3)、主酵至后酵阶段共10 d发酵液(为该品牌10度啤酒生产过程发酵液样品);甲醇(色谱纯)、乙酸、磷酸、磷酸二氢钾(KH2PO4)(均为分析纯):上海恒信化学试剂有限公司;草酸、乳酸、酒石酸、乙酸、苹果酸、α-酮戊二酸、抗坏血酸、柠檬酸、琥珀酸标准品(纯度均>99%),美国Sigma-Aldrich公司。
1.2 仪器与设备
Agilent1100型高效液相色谱仪(配有G1314可变波长紫外检测器(variable wavelength detector,VWD)、LiChrospher 100RP-18反相色谱柱(5μm,250mm×4mm)、BONDⅡODS-C18固相萃取柱(规格100 mg/mL):美国安捷伦公司;350型pH计:瑞士Mettler公司;Millipore Synergy185超纯水设备、0.45 μm混合纤维素酯微孔滤膜及微孔过滤器、SEP-PAK C18 Cartridge固相萃取柱(规格500 mg/3 mL):德国默克公司。
1.3 方法
1.3.1 混合标准品溶液及流动相的配制
有机酸混合标准样品溶液的配制:精密称取草酸(49.0 mg)、乳酸(158.8 mg)、酒石酸(141.8 mg)、乙酸(154.0 mg)、苹果酸(150.6 mg)、柠檬酸(159.6 mg)、α-酮戊二酸(5.0 mg)、抗坏血酸(39.8 mg)、柠檬酸(159.6 mg)、琥珀酸(200.2 mg)9种有机酸标准品,置于1 000 mL容量瓶中,用超纯水溶解、充分混匀并定容至1 000 mL。配制成有机酸混合标准样品溶液[4,20]。
流动相溶液的配制:精密称取13.609 g KH2PO4置于1000mL容量瓶中,用磷酸调节pH值至3.0后定容至1000mL,最终配制的KH2PO4溶液浓度为0.10 mol/L。混匀后经0.45 μm混合纤维树酯膜抽真空进行过滤、脱气后使用[4,16]。
1.3.2 样品预处理
啤酒样品预处理:啤酒在(20±0.5)℃水浴中静置平衡后,吸取4 mL酒液,加入超纯水于10 mL容量瓶中定容。再经混合纤维树酯膜(0.45 μm)过滤得到啤酒样品。经SEPPAK C18 Cartridge固相萃取柱处理后进样。
发酵液预处理:发酵液取样自主发酵第1天起至后发酵期,共10 d,对酿造过程有机酸含量进行动态分析。取100 mL发酵液10 000 r/min离心10 min,吸取上清液并在(20±0.5)℃水浴中平衡。平衡后的样品经滤纸过滤后,吸取4 mL上清液,用超纯水定容至10 mL。再经混合纤维树酯膜(0.22 μm)过滤备用[19]。进样前经SEP-PAK C18 Cartridge预处理柱处理后进样。
1.3.3 啤酒中有机酸含量的分析检测
采用反相高效液相色谱分析啤酒中有机酸含量,其色谱条件如下:LiChrospher 100 RP-18反相色谱柱(5 μm,250 mm×4 mm);流动相为0.1 mol/L KH2PO4水溶液(用磷酸调pH 值至3.0);二极管阵列检测器(diode array detector,DAD);紫外波长215 nm、带宽16 nm,参比波长360 nm、带宽50nm;流速0.6mL/min;进样量5μL;柱温25℃。定性定量方法:同一物质在相同色谱条件下保留时间一致,通过保留时间与对照品比对定性。同一物质的浓度与峰面积成正比例关系,所以根据对照品的浓度和峰面积,可以定量得出样品的浓度。
1.3.4 方法学考察
(1)精密度试验
以某品牌10°啤酒为有机酸重复性试验的检测样品。对同一样品平行取5份按1.3.3色谱条件进行精密度试验。分别计算9种有机酸测定结果的相对标准偏差(relative standard deviation,RSD)。
(2)加标回收率试验
以某品牌10°啤酒为酒基,分别加入一定量不同浓度的有机酸标准系列溶液,按1.3.3色谱条件进行加标回收率的测定。加标量分别为:草酸29.4 mg/L、乳酸95.28 mg/L、酒石酸37.31 mg/L、乙酸92.40 mg/L、苹果酸90.36 mg/L、α-酮戊二酸3.00 mg/L、抗坏血酸23.88 mg/L、柠檬酸95.76 mg/L、琥珀酸120.12 mg/L。
2 结果与分析
2.1 有机酸混合标样反相高效液相色谱分析
9种有机酸混合标样RP-HPLC分析色谱图见图1。

图1 9种有机酸混合标样反相高效液色谱分析色谱图
Fig.1 Chromatogram of 9 organic acids mixed standard samples analyzed by reversed-phase high performance liquid chromatography
1为草酸,2为酒石酸,3为苹果酸,4为α-酮戊二酸,5为抗坏血酸,6为乳酸,7为乙酸,8为柠檬酸,9为琥珀酸。下同。
由图1可知,9种有机酸分离效果良好,草酸、酒石酸、苹果酸、α-酮戊二酸、抗坏血酸、乳酸、乙酸、柠檬酸、琥珀酸的出峰时间分别为3.369 min、3.731 min、4.876 min、5.376 min、5.894 min、6.267 min、7.267 min、7.916 min、11.760 min。
2.2 反相高效液相色谱条件优化
2.2.1 检测波长的选择
一元有机酸(如甲酸、乙酸等)因其羧基中羰基氧和羟基氧上孤对电子的共轭作用[16],吸收带主要分布在波长205~215 nm范围内;二元有机酸(如草酸、琥珀酸等)以及多元有机酸(如苹果酸、柠檬酸等),这两类有机酸中大部分的有机酸在波长210 nm处有吸收[4,21]。由于啤酒中的有机酸组成复杂、种类较多,为兼顾各有机酸的分布,确定采用215 nm波长检测有机酸组分。
2.2.2 流动相缓冲溶液的种类及浓度的选择
磷酸盐溶液的缓冲能力直接影响溶液的离子强度以及酸在流动相中的存在形式,从而影响RP-HPLC的分离效果。因此选择恰当浓度的磷酸盐缓冲溶液尤为重要[21]。采用反相高效液相色谱(RP-HPLC)进行有机酸分析时,由于有机酸具有较大的极性,常用的流动相主要成分为水,因此弱酸解离现象易导致不能保留在固定相上。为了使有机酸不出现解离现象,通常流动相选择偏酸性,从而达到抑制有机酸解离的目的[5]。常用的酸性缓冲溶液如醋酸-醋酸钠缓冲液、三氟乙酸(trifluoroacetic acid,TFA)等在波长210 nm有较强吸收,由于本底值过高会降低检测的灵敏度,从而影响检测结果的准确性[19]。磷酸盐缓冲溶液由于吸收波长<200 nm,特别是KH2PO4缓冲溶液作为测定有机酸组成的流动相效果最好。由于缓冲液浓度过高容易析出,对色谱柱产生损害,同时可能对流动相的背景吸收产生影响,使灵敏度减弱,因此,选择流动相为浓度0.10 mol/L的KH2PO4缓冲液[4,21]。
2.2.3 流动相缓冲溶液pH值的选择
酸度系数又名酸离解常数(代号Ka值),是指一个特定的平衡常数,以代表一种酸离解氢离子的能力。由于在不同的酸这个常数会有所不同,所以酸度系数会以常用对数的加法逆元,以符号pKa来表示。一般来说,较大的pKa值(或较小的pKa值)代表较强的酸,这是由于在同一的浓度下,离解的能力较强。本研究的9种有机酸因其解离常数(pKa值)跨度范围较大(1.20~5.70)[21],增加了色谱分离的难度。通过研究流动相缓冲溶液pH值对分离效果影响,确定缓冲溶液pH值,从而达到准确定量9种有机酸的目的。依据各种有机酸的pKa,配制0.1 mol/L KH2PO4溶液,用磷酸调节pH值分别为2.1、2.5、3.0,在柱温25 ℃、流速0.5 mL/min时,考察不同的流动相pH值对有机酸分离效果的影响,结果见图2。
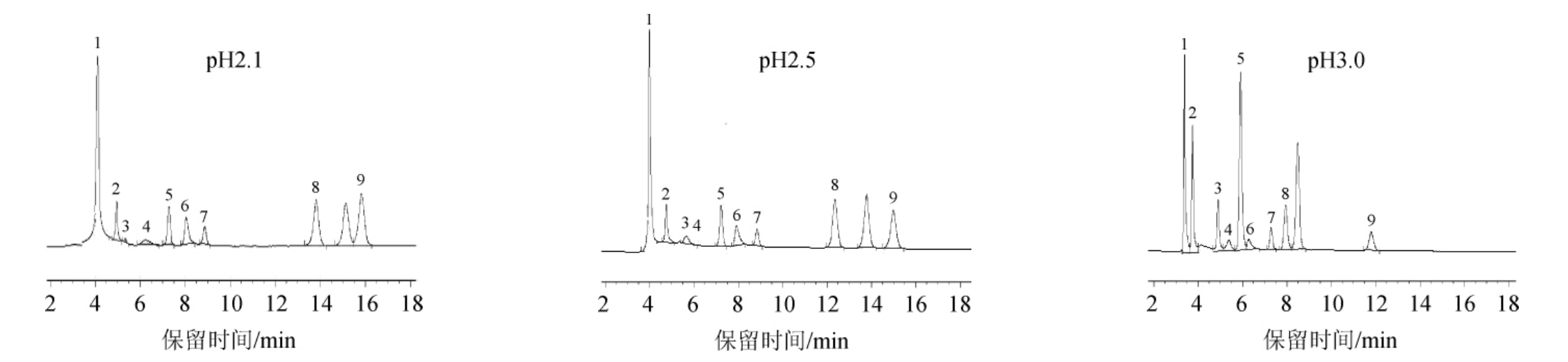
图2 流动相缓冲溶液pH值对9种有机酸分离效果的影响
Fig.2 Effect of pH value of mobile phase buffer on separation effect of 9 organic acids
由图2可知,随着流动相pH值增加,各种有机酸的保留时间均有不同程度的减少,从而降低分离效果。当pH值为2.1时,虽然分离效果较为理想,但较低的pH值会降低物质响应值,对色谱柱的损害较大,严重时可能引起硅烷化键合相降解;当pH值为2.5时,酒石酸和苹果酸未能分开。这是由于有机酸的解离程度随着pH值的增加而增大,从而使其与ODS柱表面烷基作用减弱;当pH值为3.0时,分离效果理想。因此,选择流动相的pH值为3.0。
2.2.4 流速对分离效果的影响
分别采用流速0.5 mL/min、0.6 mL/min、0.7 mL/min进行9种有机酸分离效果试验,考察不同流速对有机酸分离效果的影响,结果见图3。
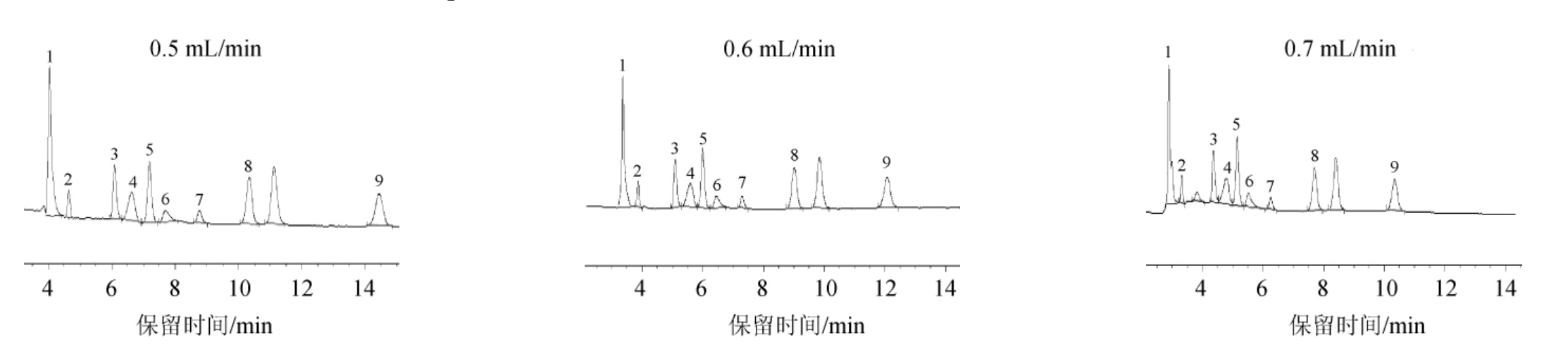
图3 流速对9种有机酸分离效果的影响
Fig.3 Effect of flow rate on separation effect of 9 organic acids
由图3可知,流动相的流速对有机酸的分离效果有一定的影响,随着流速的增加,保留时间缩短,柱压随之增大,分离度降低。由于啤酒样品中的成分较为复杂,综合考虑保留时间与分离度,当流速为0.6 mL/min时分离效果最佳。因此,流动相的流速选择为0.6 mL/min。
2.3 标准曲线线性方程,线性范围,相关系数,检出限及定量限
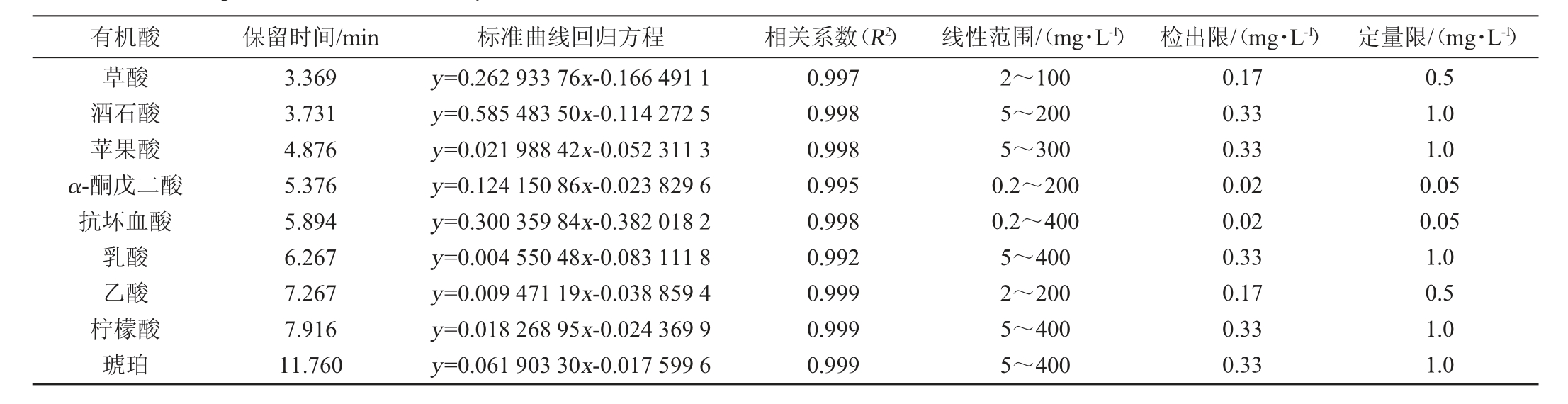
9种有机酸的保留时间、标准曲线回归方程、相关系数、线性范围、检出限与定量限见表1。以信噪比(S/N)=3计算检出限(limit of detection,LOD),以S/N=10计算定量限(limit of quantitation,LQD)。由表1可知,9种有机酸在质量浓度0.2~400.0 mg/L范围内线性关系良好,相关系数(R2)均在0.992~0.999之间,表明有机酸的质量浓度与峰面积呈良好的线性关系,可满足准确定量的要求。9种有机酸的检出限(LOD)为0.02~0.33 mg/L,定量限(LQD)0.05~1.0 mg/L。
表1 9种有机酸标准品的保留时间、标准曲线回归方程、相关系数、线性范围、检出限与定量限
Table 1 Retention time,regression equation of standard curve,correlation coefficient,linear range,detection limit and quantification limit of 9 organic acids standard samples
2.4 方法学考察
2.4.1 精密度试验
以某品牌10°啤酒为有机酸重复性试验的检测样品。对同一样品平行取5份进行精密度试验。
表2 9种有机酸精密度试验结果
Table 2 Results of precision tests of 9 organic acids mg/L

结果如表3所示,方法精密度试验结果相对标准偏差(RSD)为0.3%~11.5%,除α-酮戊二酸的变异系数(coefficient of variation,CV)为7.6%外,其他几种有机酸的变异系数(CV)均≤5.1%。说明该方法精密度较高。
2.4.2 加标回收率试验
以某品牌10°啤酒为酒基,分别加入一定量不同浓度的有机酸标准系列溶液,进行加标回收率的测定。加标回收率试验结果见表3。
由表3可知,在啤酒样品中,除草酸和抗坏血酸的回收率稍低外,其他有机酸的回收率均在90%~110%的范围内,加标回收率结果RSD为0.3%~11.5%。草酸的回收率稍低主要是由于啤酒中的脱氢抗坏血酸与草酸发生可逆反应,引起草酸含量降低[22-23]。抗坏血酸的回收率稍低的主要原因是由啤酒中这种成分含量甚微。
表3 9种有机酸分析的加标回收率试验结果
Table 3 Results of recovery rate tests of 9 organic acids

2.5 啤酒酿造过程中有机酸含量的动态分析
2.5.1 啤酒酿造过程中有机酸总量动态分析
啤酒中有机酸的组成、含量与啤酒的感官评价密切相关。作为啤酒风味物质之一,有机酸在麦汁中的含量多少主要取决于麦芽等主料,酒花、大米等对有机酸含量影响甚微[7]。麦汁中的可发酵性糖作为酵母的碳源,小分子的氮作为酵母的氮源,啤酒酵母充分利用进行生理代谢,有机酸的含量变化同时也受酵母的种类、性能以及发酵工艺的影响。麦汁中糖类含量约占90%,除了部分多糖以外,均能够通过糖酵解途径(glycolytic pathway,EMP)进入三羧酸循环(tricarboxylic acid cycle,TCA)或无氧酵解[23-24]。啤酒酿造过程中有机酸总量动态分析结果见图4。

图4 啤酒酿造过程中有机酸总量动态分析
Fig.4 Dynamic analysis of total organic acids contents in beer brewing process
由图4可知,啤酒酿造过程中有机酸总量随着发酵时间(0~10 d)的延长呈现先增长后平稳的趋势,特别是在发酵初期(发酵前2 d),随着啤酒酵母的大量繁殖,有机酸含量增幅最大,在发酵2~10 d内,有机酸含量平稳增长,在发酵第6天左右,有机酸总含量趋于平衡,有机酸总量约为450 mg/L,此时发酵基本结束,进入后发酵阶段。发酵过程中的有机酸总量的变化趋势与发酵度先快速增长后平稳的趋势基本一致。
2.5.2 啤酒酿造过程中乙酸、琥珀酸、苹果酸含量的动态分析
由图5可知,乙酸、琥珀酸、苹果酸含量的变化与有机酸总量的变化规律相似。在酿造过程中,乙酸含量变化为先快速增加后稳定,与发酵度变化规律保持一致。由于发酵初期麦汁中含氧,乙醛和乙醇氧化形成了大量乙酸,此外酵母代谢过程中利用丙酮酸后也产生了部分乙酸[5]。在此期间,琥珀酸含量先大幅增长后平缓,琥珀酸含量增至130 mg/L左右,由于酿造过程中三羧酸循环使酵母产生了大量的琥珀酸,因此,琥珀酸在啤酒成品中有机酸总量中占有较大的比重,约占54%;苹果酸在整个发酵过程中呈平稳增长的趋势,增长至45.2 mg/L;苹果酸为丙酮酸脱羧后的中间代谢产物,大部分苹果酸分泌于细胞外无法回收细胞内[25]。因此,苹果酸含量的变化趋势较为平稳。
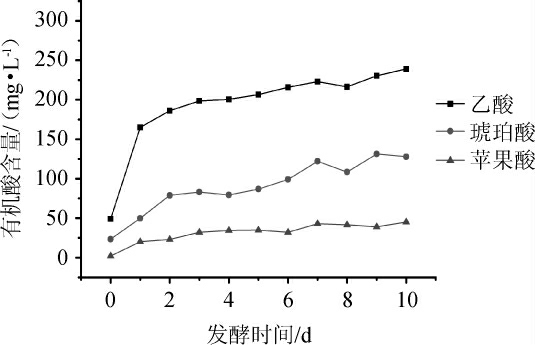
图5 啤酒酿造过程中乙酸、琥珀酸、苹果酸含量的动态分析
Fig.5 Dynamic analysis of acetic acid,succinic acid and malic acid contents in beer brewing process
2.5.3 啤酒酿造过程中草酸、乳酸、柠檬酸、酒石酸含量的动态分析
由图6可知,在啤酒酿造过程中,草酸、酒石酸含量的变化不大,处于相对稳定的状态;柠檬酸含量增长幅度相对平缓,特别是后发酵期间含量变化较小;乳酸含量一直增加,与发酵程度保持一致。乳酸主要产生于发酵后期,酵母对丙酮酸利用发生歧化反应得到乳酸;草酸主要来源于麦汁,其含量随麦芽用量的增加而增加,发酵过程中草酸含量波动不大,当原料麦芽中草酸浓度过高时,可能会与酿造水中的钙离子形成草酸钙,引起啤酒的非生物性浑浊。因此加强对原料年份和品种的控制,应尽可能监测麦芽中的草酸含量,选择含量相对较低的麦芽作为原料[6];柠檬酸为TCA循环中的中间产物,也是在啤酒中含量较高的有机酸,高含量的柠檬酸可能是啤酒感官分析中酸味的主要来源之一;酒石酸是酵母代谢过程中的产物,被分泌于细胞外,含量相对较少,在发酵初期一经形成便趋于稳定。

图6 啤酒酿造过程中草酸、乳酸、柠檬酸、酒石酸含量的动态分析
Fig.6 Dynamic analysis of oxalic acid,lactic acid,citric acid and tartaric acid contents in beer brewing process
2.5.4 啤酒酿造过程中α-酮戊二酸、抗坏血酸含量的动态分析
α-酮戊二酸、抗坏血酸含量两种有机酸在啤酒中含量较低。由图7可知,在酿造过程中,α-酮戊二酸含量在主发酵阶段大幅提升,进入后发酵阶段含量趋于平稳,而抗坏血酸含量变化保持相对稳定。α-酮戊二酸含量低的原因是酵母从有氧呼吸转入厌氧发酵后,α-酮戊二酸脱氢酶合成受阻,因此影响了α-酮戊二酸的形成[24-25];而抗坏血酸主要来源于酒花,在酿造过程中并不会形成更多的抗坏血酸,因此抗坏血酸含量保持相对稳定。
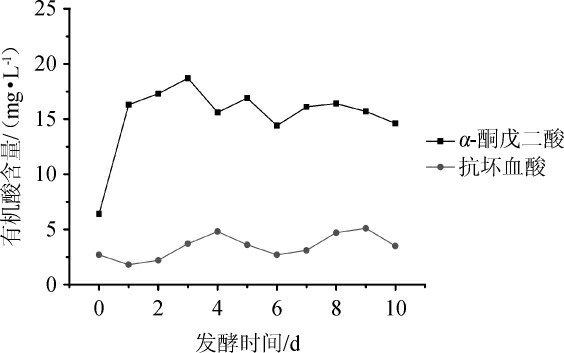
图7 啤酒酿造过程中α-酮戊二酸、抗坏血酸含量的动态分析
Fig.7 Dynamic analysis of α-ketoglutaric acid and ascorbic acid contents in beer brewing process
3 结论
本实验对啤酒中有机酸的反相高效液相色谱法(RP-HPLC)分析条件进行了优化,优化色谱条件为检测波长215 nm、流动相缓冲液浓度0.10 mol/L KH2PO4、pH值3.0、流速0.6 mL/min,该方法可实现啤酒中9种有机酸一次性分离(草酸、酒石酸、苹果酸、α-酮戊二酸、抗坏血酸、乳酸、乙酸、柠檬酸、琥珀酸)。该检测方法精密度高,重复性及准确性良好,操作简便、快速,可用于啤酒中有机酸含量定量分析。在啤酒酿造过程中,乙酸、琥珀酸、苹果酸、乳酸、柠檬酸、α-酮戊二酸含量的变化与有机酸总量的变化规律相似,均呈现先增长后平稳的趋势。草酸、抗坏血酸、酒石酸含量变化相对平稳。啤酒中的有机酸含量与啤酒感官评价密切相关。在啤酒酿造过程中有机酸的含量变化,主要源于啤酒酵母对麦汁中各种可发酵性糖的利用。对酿造过程中各种有机酸进行动态分析,了解啤酒酿造过程中有机酸含量的变化规律,为最终改善啤酒过酸的现象和改进酿造工艺提供了依据。
[1]刘佳,黄淑霞,余俊红,等.基于电子舌技术的啤酒口感评价及其滋味信息与化学成分的相关性研究[J].食品与发酵工业,2019,45(2):196-201,206.
[2]胡淑敏,黄淑霞,余俊红,等.啤酒口感特性与风味化学成分的关系[J].食品与发酵工业.2019,45(1):70-76.
[3]吴婕.啤酒花萃余物中黄腐酚的提取分离及其应用拓展[D].乌鲁木齐:新疆大学,2015.
[4]何桂芬.浑浊小麦啤酒贮存老化的初步研究[D].泰安:山东农业大学,2013.
[5]邢宝立,林智平,贾凤超,等.啤酒有机酸含量的影响因素研究[J].中外酒业,2016(11):32-39.
[6]单军,李红,郭玉蓉.麦汁组成对啤酒有机酸的影响[J].酿酒,2008,35(1):54-56.
[7]韩芳,吴秋燕,赵雪.有机酸在发酵过程中的变化规律[J].中外酒业·啤酒科技,2015(8):9-12.
[8]刘一菲,苏小琴,李晶晶,等.电位滴定法测定注射用益气复脉(冻干)中总有机酸[J].药物评价研究,2018,41(3):493-495.
[9]施超欧,姚宝龙,胡咪,等.离子转换色谱-紫外检测法测定啤酒中的无机阴离子和有机酸[J].色谱,2016,34(10):951-955.
[10]宋卫得,杨立明,李兆杰,等.电导抑制-梯度淋洗离子色谱法同时测定啤酒中多种有机酸和阴离子[J].化学研究与应用,2018,30(3):426-431.
[11] KOZAKI D,TANIHATA S,YAMAMPTO A,et al.Single injection ionexclusion/cation-exchange chromatography for simultaneous determination of organic/inorganic anions,inorganic cations,and ethanol in beer samples[J].Food Chem,2019 274:679-685.
[12] DAS A J,KHAWAS P,MIYAJI T,et al.HPLC and GC-MS analyses of organic acids,carbohydrates,amino acids and volatile aromatic compounds in some varieties of rice beer from northeast India[J].J Inst Brew,2014,120(3):244-252.
[13] PARK J M,SHIN J A,LEE J H,et al.Development of a quantitative method for organic acid in wine and beer using high performance liquid chromatography[J].Food Sci Biotechnol,2017,26(2):349-355.
[14]韩东,李红,景建洲.不同酵母对苹果啤酒发酵及风味的影响[J].食品工业科技,2015,36(15):179-183.
[15] NOUR V,TRANDAFIR I,IONICA M E.HPLC organic acid analysis in different Citrus juices under reversed phase conditions[J].Not Bot Hort Agrobot Cluj,2010,38(1):44-48.
[16]冯德明,张洋,赵惠明,等.反相高效液相色谱法测定黄酒中的有机酸[J].中国酿造,2009,28(3):157-161.
[17]马丽娜,龚霄,殷俊伟,等.基于RP-HPLC 法测定水果及其果酒中有机酸含量[J].食品工业,2018,39(1):328-330.
[18]曾竟蓝,马胤鹏,秦丹,等.果酒中有机酸的作用及检测方法研究[J].中国酿造,2018,37(6):183-187.
[19]饶静,李春扬,张晓磊,等.高效液相色谱法同时测定苹果醋及原料中的17 种有机酸[J].中国酿造,2018,37(4):169-173.
[20] LIU Q,WANG L,HU J,et al.Main organic acids in rice wine and beer determined by capillary electrophoresis with indirect UV detection using 2,4-dihydroxybenzoic acid as chromophore[J].Food Anal Method,2017,10:111-117.
[21]杨毅,李崎,陈蕴,等.反相高效液相色谱法(RP-HPLC)测定啤酒中有机酸[J].食品与发酵工业,2003,29(8):6-12.
[22] TYRELL T,FISCHER F.Influencing the organic acid profile of beer by application of adsorbent materials[J].J Inst Brew,2014,120:459-466.
[23]赵雪,杨刚,宋丹,等.不同配比麦芽的麦汁中有机酸含量差异及酿造过程中变化规律的研究[J].啤酒科技,2014(3):18-24.
[24]马岩石,姜明,刘振艳,等.酿酒酵母QY-1 发酵过程中有机酸及游离氨基酸变化分析[J].中国酿造,2019,38(10):125-128.
[25]孙付保,任洪艳,赵长新.啤酒酵母发酵产有机酸的生理代谢机制[J].食品工业科技,2005,26(5):70-72.