蓝莓果实中含有大量果胶、微量元素、原花青素等,营养价值较高,可鲜食,也非常适应用于制作成保健果酒[1-5]。蓝莓酒按其酿制方法大致可分为发酵型和配制型。发酵型蓝莓酒是指完全由蓝莓原果经破碎、压榨取汁,经酵母菌酒精发酵而成。配制型蓝莓酒以发酵酒或蒸馏酒为酒基,将蓝莓果实或果皮等浸泡其中,或者按一定比例将果汁、香精、色素、甜味辅料等调配而成,特点是色泽鲜艳,果香好,制做方法简单,成本低[6-7]。
原花青素(proanthocyanidins,PAs)是一种以黄烷-3-醇作为结构单元,通过C-C键聚合而成的多酚类化合物,广泛存在于自然界多种植物中,尤其蓝莓、葡萄、松树皮等植物含量较多[8]。据资料显示原花青素中的抗氧化性核心成分为低聚原花青素(oligomeric proanthocyanidins,OPC),拥有极强的抗氧化能力,研究发现其在体内抗氧化、清除自由基能力相当于维生素C的20倍、维生素E的50倍[9]。还具有调节人体新陈代谢、抗肿瘤、抑菌抗炎、预防血液扩张、动脉硬化、抑制α-淀粉酶活性,降低摄入体内的葡萄糖吸收率,减轻体质量等功效[10-13]。以其稳定、无毒、天然等优点被广泛用于食品、医药、保健、日化等方面[14-15]。近年来,原花青素对人体健康潜在生物活性受到广泛关注,目前对提取原花青素的研究以葡萄籽、葡萄皮渣、黑枸杞、花生红衣为原料较多,提取方法有多种,如酶法、溶剂法、超声辅助法、微波辅助法、超声波微波联用法、超临界流体萃取法等[16-20]。刘振华等[21]以乙醇为提取剂优化黑枸杞中花青素提取工艺时最大提取率为0.424%;张晓静等[22]利用微波辅助乙醇溶剂提取酿酒葡萄籽中的花青素时最大提取率为5.09%;陈丽媛等[23]在用超声波提取紫玉米芯中花青素时,最大提取率为4.623 mg/g,研究发现提取体积分数70%丙酮水溶液为最好溶剂。但在食品工业中则要求所用溶剂必须无毒且终产物纯度高[24]。乙醇提取法设备要求低,工艺简单,无毒,故适合于食品工业。
该研究采用乙醇提取法提取配制型蓝莓酒(以下简称蓝莓酒)中原花青素,通过单因素及响应面试验优化提取工艺,旨在通过优化蓝莓酒中原花青素提取工艺条件,为下一步提高蓝莓酒稳定性研究奠定基础,为推动蓝莓酒的研究及产业发展提供参考价值。
1 材料与方法
1.1 材料与试剂
蓝莓酒(12%vol):市售;盐酸、甲醇、正丁醇、体积分数为99.5%乙醇(均为分析纯):上海国药集团化学试剂有限公司;石油醚(分析纯):天津科密欧化学试剂有限公司;原花青素(色谱级):上海源叶生物科技有限公司。
1.2 仪器与设备
ME204TE分析天平:Mettler toledo国际贸易有限公司;KW-1000DC电子恒温水浴锅:江苏中大生物科技集团有限公司;RE5220旋转蒸发器:上海垒固仪器有限公司;TDL-5-A GENESYS 10S紫外分光光度计:美国Thermo公司;CH-250超声波清洗机:北京创新德超声电子研究所;TDL-5-A离心机:上海安亭科学仪器厂;LC-10N-50A真空冷冻干燥机:力辰科技公司;JJ-CJ-IFD超净工作台:苏州市金净净化设备科技有限公司。
1.3 方法
1.3.1 原花青素提取工艺优化单因素试验[25]
取一定量蓝莓酒,将石油醚按照蓝莓酒4倍体积加入,室温浸泡1 d,过滤、抽真空、浓缩,干燥后备用。按照不同的乙醇体积分数(40%、50%、60%、70%、80%)、提取温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃)、料液比(1∶5、1∶6、1∶7、1∶8、1∶9(g∶mL))、时间(20 min、30 min、40 min、50 min、60 min),对干燥得到的产物进行提取,然后再在真空条件下浓缩、洗脱、干燥即得原花青素提取物。初始提取条件:提取温度50 ℃,时间60 min,料液比1∶8(g∶mL),样品质量1 g。
1.3.2 原花青素含量测定
称取待测样品1 mg加入甲醇溶液在棕色容量瓶中定容至10 mL后摇匀,移取稀释液1 mL,以空白调零,参照文献[26]测量吸光度值并计算样品中原花青素含量。原花青素得率计算公式如下:
其中:w为原花青素得率,mg/g;c为提取液中原花青素质量浓度,mg/mL;v为提取液体积,mL;m为蓝莓酒样品质量,g。
1.3.3 原花青素提取工艺优化响应面试验
在单因素试验基础上,以蓝莓酒中原花青素得率为评价指标,以乙醇体积分数(A)、料液比(B)、提取温度(C)、提取时间(D)为4个评价因素,采用Box-Behnken中心组合原理,以4因素3水平设计优化试验,试验因素与水平见表1。
表1 蓝莓酒中原花青素提取工艺优化响应面试验因素与水平
Table 1 Factors and levels of response surface methodology for extraction porcess optimization of proanthocyanidins from blueberry wine

1.3.4 数据分析
通过Design-Expert 8.0.6软件对试验数据进行多元回归拟合分析、方差分析,最终确定蓝莓酒中提取原花青素的最佳工艺条件。
2 结果与分析
2.1 单因素试验
2.1.1 乙醇体积分数对原花青素得率的影响
由图1可知,在乙醇体积分数为40%~70%时,原花青素得率与乙醇体积分数呈正比,在乙醇体积分数为70%时,原花青素得率达到最大值,继续增加乙醇体积分数,原花青素得率下降。蓝莓酒中的色素、亲脂成分、醇溶杂质等溶出量会增加,原花青素与这些物质会共同竞争乙醇-水分子,从而降低得率[27]。故原花青素提取最佳乙醇体积分数为70%。
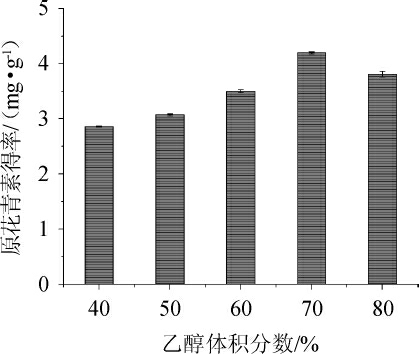
图1 不同乙醇体积分数对原花青素得率的影响
Fig.1 Effect of different ethanol volume fraction on oligomeric proanthocyanidins yield
2.1.2 料液比对原花青素得率的影响
由图2可知,料液比在1∶5~1∶7(g∶mL)时,原花青素得率与料液比呈正比,继续增加料液比,得率未出现明显变化。可能是因为蓝莓酒中原花青素含量相对有限,当料液比达到一定值后,溶液中的原花青素已完全溶解,故得率不再上升。故原花青素提取最佳料液比为1∶7(g∶mL)。
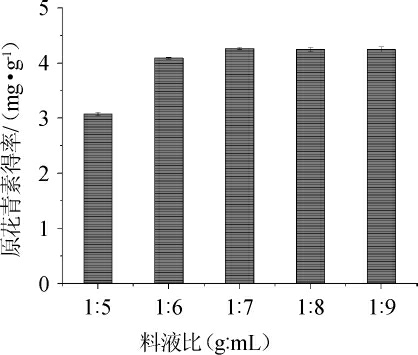
图2 不同料液比对原花青素得率的影响
Fig.2 Effect of different different material-liquid ratio on oligomeric proanthocyanidins yield
2.1.3 提取时间对原花青素得率的影响
由图3可知,在提取时间为20~50 min时,原花青素得率与提取时间呈正比,在50 min左右达到最大值。但继续延长提取时间,得率下降,这可能是由于提取时间的延长,原花青素中富含的酚羟基基团易与其他物质发生氧化反应,从而降低了得率[28]。故原花青素最佳提取时间为50 min。
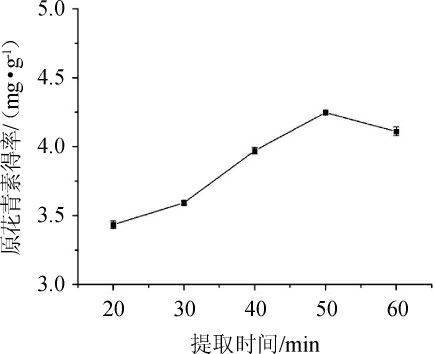
图3 不同提取时间对原花青素得率的影响
Fig.3 Effect of different extraction time on oligomeric proanthocyanidins yield
2.1.4 提取温度对原花青素得率的影响
由图4可知,在提取温度为30~50 ℃时,蓝莓酒中原花青素得率随着提取温度升高而上升,50 ℃时,得率达到最大值,继续升高温度,得率反而下降,一方面可能是由于高温很容易破坏原花青素结构;另一方面可能是由于蓝莓酒中的其他化学物质在高温条件下,增大了溶出率。故原花青素最佳提取温度为50 ℃。

图4 不同提取温度对原花青素得率的影响
Fig.4 Effect of different extraction temperautre on oligomeric proanthocyanidins yield
2.2 响应面试验分析
以乙醇体积分数(A)、料液比(B)、提取温度(C)、提取时间(D)为4个评价因素设计响应面试验,蓝莓酒中原花青素提取的响应面试验设计与结果分析见表2,二次多项式模型方差分析见表3。
表2 蓝莓酒中原花青素提取工艺优化响应面试验设计及结果
Table 2 Design and results of response surface methodology for extraction process optimization of proanthocyanidins from blueberry wine

表3 二次多项式模型方差分析
Table 3 Variance analysis of quadratic polynomial model

续表
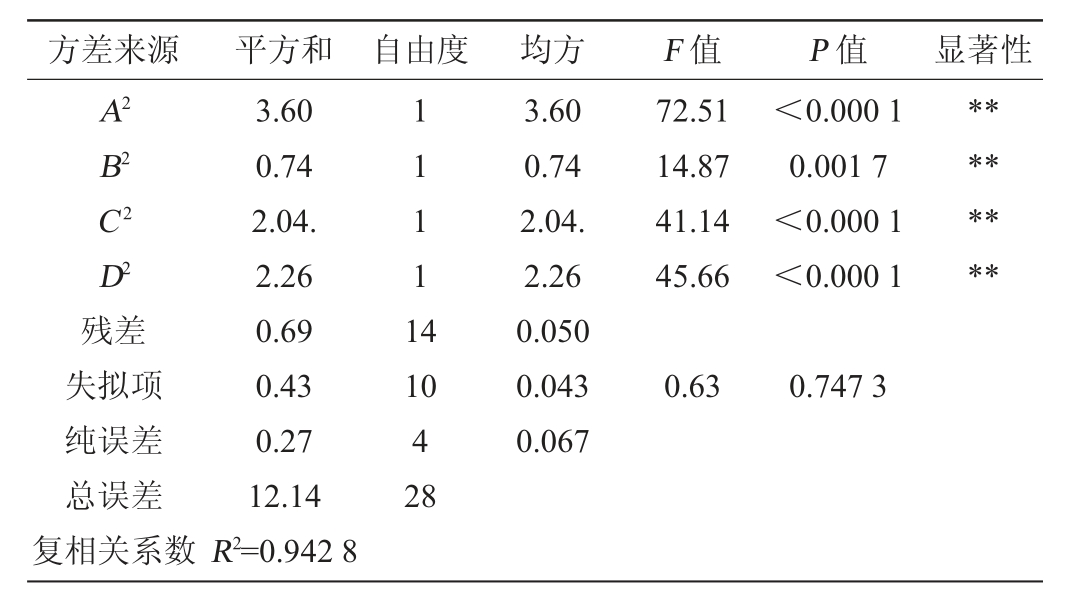
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
从表2可知,通过Design-Expert 8.0.6软件对响应面试验结果分析,建立了多元回归拟合模型,得到原花青素得率回归方程:
由表3可知,在本次试验所涉及的范围内,二次多项回归模型P<0.000 1,模型有极显著差异,说明自变量和响应值存在的相关关系极显著。失拟项P=0.747 3>0.05,说明模型差异显著,其他因素对该模型影响较小,误差小,故得出该模型可以很好地反应出蓝莓酒中原花青素得率与各因素之间的关系。从F值可得,四个因素对原花青素得率产生影响的主次排序依次为:提取时间>提取温度>乙醇体积分数>料液比。从方差分析可得知提取时间、提取温度、乙醇体积分数对原花青素得率影响极显著(P<0.01),料液比对其影响不显著(P>0.05),提取时间与温度之间的交互作用极显著(P<0.01),乙醇体积分数与提取时间之间的交互作用显著(P<0.05),乙醇体积分数与料液比、乙醇体积分数与提取温度、料液比与提取时间以及料液比与提取温度之间的交互作用均不显著(P>0.05)。
2.3 响应面最优结果与试验验证
2.3.1 响应面试验
采用Design-Expert 8.0.6软件绘制响应面及等高线图,探索各因素之间的交互作用对原花青素得率的影响,结果见图5。

图5 乙醇体积分数、液料比、提取温度、提取时间交互作用对蓝莓酒中原花青素得率影响的响应面及等高线图
Fig.5 Response surface plots and contour lines of effects of interaction between each factor on ethanol concentration,liquid to material ratio,extraction temperature and time on proanthocyanidins yield in blueberry wine
由图5可知,乙醇体积分数与提取时间之间交互作用显著(P<0.05),提取时间与温度之间交互作用极显著(P<0.01);乙醇体积分数与料液比、乙醇体积分数与提取温度、料液比与提取时间、料液比与提取温度之间交互作用均不显著(P>0.05)。利用响应面分析预测了蓝莓酒中原花青素的最优提取工艺条件:提取时间为56.71 min,料液比为1∶7.18(g∶mL),乙醇体积分数为66.96%,提取温度为55.08 ℃,原花青素得率理论值为4.97 mg/g。
2.3.2 验证试验
为了验证模型预测最优工艺条件的稳定性和准确性,且便于实际操作,将提取条件修订为提取时间57 min,料液比为1∶7(g∶mL),乙醇体积分数67.0%,提取温度55 ℃的条件下进行3次重复平行性试验,试验结果分别为4.83 mg/g、4.74 mg/g、5.01 mg/g,平均原花青素得率实际值为4.86 mg/g。验证结果与模型理论值相接近,从而表明该模型可以较好的预测蓝莓酒中原花青素得率的提取工艺条件。
3 结论
该研究优化蓝莓酒中原花青素的提取工艺,以蓝莓酒中原花青素为目标成分,采用乙醇提取法,从单因素试验得出提取时间、提取温度、料液比、乙醇体积分数四个因素对蓝莓酒中原花青素得率存在一定影响,以四因素三水平设计优化试验,通过响应面分析优化及验证试验确定最优提取工艺条件为:提取时间57 min,料液比1∶7(g∶mL),乙醇体积分数67.0%,提取温度55 ℃,在此最佳条件下,原花青素平均得率为4.86 mg/g。
[1]刘笑宏,李公存,沙玉芬,等.不同品种蓝莓花色苷及其抗氧化活性分析[J].中国酿造,2020,39(2):120-124.
[2]蒋本庆,高铭坤.果酒的保健功效及蓝莓果酒发展分析研究[J].酿酒,2015,42(2):115-118.
[3]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 17204—2008 饮料酒分类[S].北京:中国标准出版社,2008.
[4]程思颖.蓝莓深加工技术研究进展探讨[J].食品安全导刊,2018(12):134-135.
[5]袁晓晶.蓝莓新品种对比试验报告[J].河南农业,2017(28):18.
[6]刘瑜彬,黄剑钊,陈汉勇,等.蓝莓发酵酒生产工艺研究进展[J].中国酿造,2020,39(4):23-27.
[7]李森,莫依灿.蓝莓饮料研究概况[J].中国酿造,2016,35(7):11-14.
[8]王俊儒.天然产物提取分离与鉴定技术[M].杨凌:西北农林科技大学出版社,2006:121.
[9]BAKOWSKA A,KUCHARSKA A Z,OSZMIANSKI J.The effects of heating,UV irradiation,and storage on stability of the anthocyanin-polyphenol copigment complex[J].Food Chem,2003,81(3):349-355
[10]徐歆,姚其凤,祝琳,等.紫娟茶原花青素的组分及活性评价[J].食品工业科技,2018,39(21):235-240.
[11]WEI M,CHAI W,YANG Q,et al.Novel insights into the inhibitory effectand mechanism of proanthocyanidins from Pyracantha fortuneana fruit on α-glucosidase[J].J Food Sci,2017(5):302-305.
[12]CHOI J S,BHAKTA H K,FUJII H,et al.Inhibitory evaluation of oligonol on α-glucosidase,protein tyrosine phosphatase 1B,cholinesterase,and β-secretase 1 related to diabetes and Alzheimer's disease[J].Arch Pharm Res,2016,39(3):409-420.
[13]CHEN I J,LIU C Y,CHIU J P,et al.Therapeutic effect of high-dose green tea extract on weight reduction:A randomized,double-blind,placebo-controlled clinical trial[J].Clin Nutr,2015,35(3):592.
[14]韩何丹,王海,高丽萍.葡萄籽中原花青素抗肺癌作用机制研究进展[J].北京联合大学学报,2018,32(1):50-54.
[15]赵超英,姚小曼.葡萄籽提取物原花青素的营养保健功能[J].中国食品卫生杂志,2000,12(6):38-41.
[16]万本屹,李宏,董海洲.葡萄籽原花青素提取及其应用研究进展[J].粮食与油脂,2002(2):43-45.
[17]王竹清,王军.“赤霞珠”葡萄皮渣中原花青素的提取工艺研究[J].食品科学,2009,30(12):101-106.
[18]吕筱,郑天元,韦新月,等.花生红衣中原花青素的提取工艺与活性研究[J].农产品加工,2021(9):27-31.
[19]赵春艳,张泽生,刘海俊.微波提取山楂果中原花青素工艺的研究[J].食品研究与开发,2005,26(6):37-40.
[20]阎海青,陈相艳,程安玮,等.超声微波联用技术提取蓝莓多酚的工艺优化[J].中国食品添加剂,2014(1):88-94.
[21]刘振华,邓广海,龚又明.黑枸杞中花青素的提取工艺优化[J].广东化工,2017,44(5):68-69.
[22]张晓静,扶庆权,潘春梅.酿酒葡萄籽中原花青素微波辅助提取的响应面优化[J].现代牧业,2017,1(3):7-12.
[23]陈丽媛,杨敏,孔青,等.紫玉米芯花青素的超声波辅助提取及喷雾干燥的工艺优化[J].食品工业科技,2017(16):199-204.
[24]李超,王卫东.原花青素提取方法的研究进展[J].粮油加工,2009(9):145-148.
[25]王士超.蓝莓利口酒中原花青素稳定性的技术研究[D].贵阳:贵州大学,2018.
[26]陈安平,黄勇军,汪胜峰.市售蓝莓类产品的原花青素含量测定[J].食品研究与开发,2016,37(1):170-173.
[27]高德艳.葡萄籽原花青素分离及其对胰脂酶活性抑制功能的研究[D].济南:齐鲁工业大学,2014.
[28]兰佳佳,杨希娟,党斌,等.蚕豆皮中原花青素的提取工艺优化及品种间含量差异与抗氧化活性评价[J].核农学报,2017,31(11):2164-2174.