冰酒是典型的甜类葡萄酒,1794年起源于德国,距今已有200多年的历史,因其优越的感官品质被誉为“葡萄酒皇后”[1]。优质冰酒的生产需要以经过-8 ℃自然冷冻的冰葡萄为原料[2],经低温度采摘与压榨后接种酵母,并在15~17 ℃下进行低温发酵[3]。近年来,我国冰酒产业迅速发展,辽宁桓仁地区因其适宜的温度与独特的环境,成为我国最大的冰酒产区,而威代尔是该地区生产冰酒的主要冰葡萄品种[4]。
酵母在冰酒发酵过程中的作用至关重要,但冰葡萄汁中高浓度的糖、酸以及SO2易为酵母营造不利的生长环境,因此筛选具备良好耐受性能的优良冰酒酵母菌株是必要的[5]。酵母分为酿酒酵母(Saccharomyces cerevisiae)和非酿酒酵母(non-Saccharomyces cerevisiae)。酿酒酵母在葡萄酒自然发酵过程中可以将葡萄汁中的糖转化为乙醇、二氧化碳与其他代谢产物。然而,接种一些独特的非酿酒酵母菌株作为发酵剂,可以提高葡萄酒的质量与稳定性,有效增加葡萄酒的香气复杂度[6]。相关研究表明,与酿酒酵母相比,非酿酒酵母具有高产β-葡萄糖苷酶的能力,该酶可以促进葡萄果实中C13-降异戊二烯类、单萜烯、倍半萜醇和脂肪醇等糖苷结合态香气物质的释放[7-8]。戴尔有孢圆酵母(Torulaspora delbrueckii)是酿酒中常见的非酿酒酵母之一,其在具有产酶能力的同时,还可在含高浓度糖的葡萄酒中产生低含量的乙酸、乙醛和高含量的果味酯和萜烯类香气化合物[9-10],并减少异味副产物的产生[11]。
因此,本研究以威代尔冰酒自然发酵过程中分离出的10株戴尔有孢圆酵母菌株为研究对象,对其葡萄糖、酒精、酸、SO2耐受性能及产β-葡萄糖苷酶性能进行测定分析,筛选发酵性能优良的酵母,并将筛选菌株与酿酒酵母(Saccharomyces cerevisiae)ST混合发酵冰葡萄汁,并对冰葡萄酒的基本理化指标进行测定,以期为获得可应用于冰葡萄酒酿造的优良本土戴尔有孢圆酵母提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
威代尔冰葡萄汁:于2017年12月采集自辽宁省五女山米兰酒业有限公司(北纬41°17′53.53″、东经125°22′27.26″)。理化指标:pH值为4.03,总糖含量为432.97 g/L,可滴定酸(以酒石酸计)含量为4.98 g/L。
1.1.2 菌株
本土戴尔有孢圆酵母(Torulaspora delbrueckii)菌株(编号为TD1、TD2、TD3、TD4、TD5、TD6、TD7、TD8、TD9、TD10):分离自威代尔冰酒的自然发酵前期[12],保存于锦州医科大学食品科学与工程学院实验室;商业酿酒酵母(Saccharomyces cerevisiae)ST:法国Laffort公司。
1.1.3 试剂
葡萄糖、蛋白胨、酵母提取物(均为生化试剂):北京奥博星生物技术有限责任公司;柑橘果胶、对硝基苯酚、氯霉素(均为分析纯):北京索莱宝生物科技有限公司;熊果苷、木聚糖、柠檬酸铁铵(均为分析纯):上海阿拉丁生化科技有限公司;生理盐水、酒石酸、亚硫酸、酒精(均为分析纯):天津科密欧化学试剂有限公司。
1.1.4 培养基
无氨基酵母氮源(yeastnitrogenbase withoutaminoacids,YNB)培养基:青岛海博生物有限公司。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基[5]:葡萄糖20 g/L、蛋白胨20 g/L、酵母提取物10 g/L,121 ℃高压蒸汽灭菌20 min。YPD固体培养基:YPD液体培养基中添加琼脂20 g/L。
β-葡萄糖苷酶活性筛选培养基[13]:YNB培养基6.7 g/L、熊果苷5 g/L、琼脂20 g/L,121 ℃高压蒸汽灭菌20 min。灭菌后添加2%质量分数为1%的柠檬酸铁铵溶液。
诱导培养基[13]:YNB培养基10 g/L、木聚糖2%,121 ℃高压蒸汽灭菌20 min。
WL营养琼脂培养基[14]:酵母浸粉5 g/L、酸水解酪蛋白5 g/L、葡萄糖50 g/L、磷酸二氢钾0.55 g/L、氯化钾0.425 g/L、氯化钙0.125 g/L、硫酸镁0.125 g/L、氯化铁0.002 5 g/L、硫酸锰0.002 5 g/L、溴甲酚绿0.022 g/L、琼脂17 g/L、pH值5.5,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
pHS-3C型精密酸度计:上海虹益仪器仪表有限公司;SW-CJ-2FD净化工作台:苏州净化设备有限公司;YSQ-LS立式压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;DHP-9082电热恒温培养箱:金坛市鑫鑫实验仪器厂;TG16KII台式高速离心机:济南福的机械有限公司;M4-AL204型电子分析天平:兰州中西仪器有限公司;ND-1000微量紫外可见分光光度计:上海元析仪器有限公司;LC-15C型高效液相色谱(high performance liquid chromatography,HPLC)仪:岛津企业管理(中国)有限公司;GC-9790Plus气相色谱(gas chromatography,GC)仪:浙江福立分析仪器股份有限公司。
1.3 方法
1.3.1 菌株的活化
将受试酵母菌株接种于YPD液体培养基,于28 ℃条件下恒温培养48 h,使各菌液的细胞浓度达到107 CFU/mL(OD600nm=1.0),之后稀释10倍,获得细胞浓度为106 CFU/mL的酵母菌稀释液作为种子液,备用。
1.3.2 菌株耐受性的测定
为考察菌株对葡萄糖、乙醇、酸及SO2的耐受性,将酵母种子液按5%(V/V)的接种量分别接种于含不同质量浓度葡萄糖(300 g/L、350 g/L、400 g/L、450 g/L、500 g/L)[15]、不同体积分数乙醇(4%、8%、10%、12%、14%)[16]、不同质量浓度酒石酸(4 g/L、8 g/L、12 g/L、16 g/L、20 g/L)[17]和不同质量浓度SO2(100 mg/L、150 mg/L、200 mg/L、250 mg/L、300 mg/L、350 mg/L)[18]的YPD液体培养基中,于28 ℃条件下静置培养48 h后,使用紫外可见分光光度计在波长600 nm处测定吸光度值,试验重复3次。
1.3.3 菌株产β-葡萄糖苷酶性能的测定
定性分析:将酵母菌种子液稀释10倍后涂布于β-葡萄糖苷酶活性筛选培养基上,于28 ℃条件下恒温培养5 d,具有β-葡萄糖苷酶活性的菌株周围会产生深棕色的水解圈[19]。
定量分析:按5%的接种量将酵母种子液接种于YPD培养基中,28 ℃条件下静置培养24 h后,11 000×g离心10 min,收集酵母细胞。以106 CFU/mL的接种量接种于诱导培养基,28 ℃条件下静置培养48 h,11 000×g离心10 min后,分别收集酵母菌细胞和上清液。采用0.2 mol/L柠檬酸-0.1 mol/L磷酸盐缓冲溶液(pH 5.0)洗涤两次酵母菌细胞后重悬,用于细胞壁上β-葡萄糖苷酶活性的测定;而上清液则用于细胞外β-葡萄糖苷酶活性的测定[20]。
1.3.4 冰葡萄汁发酵试验
在250 mL无菌三角瓶中,装入180 mL冰葡萄汁后加入50 mg/L SO2,70 ℃加热20 min,于18 ℃条件下静置发酵30 d,每隔24 h称质量,连续3 d质量恒定代表发酵结束。共进行3组发酵试验,分别设置2个混菌发酵处理组,1个纯种发酵处理组,每组试验重复3次。其中,在混菌发酵组中,分别于葡萄汁中接种筛选出的戴尔有孢圆酵母菌TD6与TD9,48 h后顺序接种酿酒酵母ST,且初始接种量均为106 CFU/mL。在纯种发酵组中只接种酿酒酵母ST。
1.3.5 冰葡萄汁发酵过程中酵母菌发酵速率变化
在冰酒的发酵过程中,每隔24 h称质量以监测CO2的质量损失[21]。
1.3.6 冰葡萄汁发酵过程中酵母菌的生长情况
分别在每组冰葡萄汁发酵过程中的第0天、2天、4天、7天、14天、21天和30天取样,经生理盐水适当稀释后涂布于WL营养琼脂培养基,于28 ℃条件下静置培养5 d[12]。根据不同菌落颜色和形态[16]的区别,分别对戴尔有孢圆酵母与酿酒酵母进行菌落计数。
1.3.7 冰葡萄酒基本理化指标的测定
冰葡萄汁发酵结束后取样,测定冰葡萄酒的基本理化指标。
总糖含量的测定:参考国标GB/T 15038—2006《葡萄酒果酒分析方法》;酒石酸、乙酸含量的测定:采用HPLC法[21];乙醇含量的测定:采用GC法[22]。
1.3.8 数据处理
对试验所得数据采用Microsoft Office Excel 2007进行基本处理和作图,试验均重复3次,结果以“平均值±标准偏差”表示;使用SPSS17.0进行Duncan检验和单因素方差分析。
2 结果与分析
2.1 菌株的耐受性
10株本土戴尔有孢圆酵母菌对葡萄糖、乙醇、酒石酸及SO2的耐受性见图1。
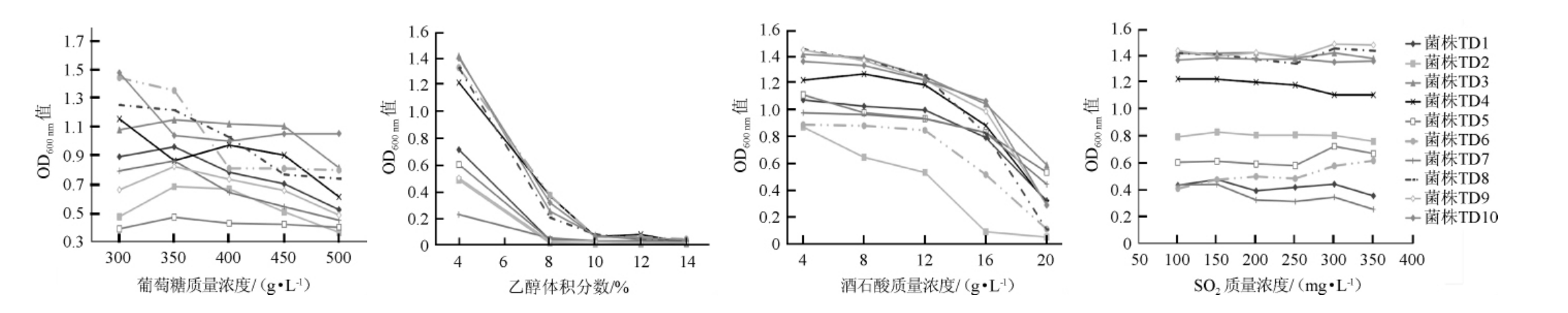
图1 10株本土戴尔有孢圆酵母菌对葡萄糖、乙醇、酒石酸及SO2的耐受性测定结果
Fig.1 Determination results of tolerance to glucose,ethanol,acid and SO2 of 10 strains of Torulaspora delbrueckii
由图1可知,随着葡萄糖、乙醇、酒石酸以及SO2含量的升高,大部分戴尔有孢圆酵母菌株的OD600nm值呈下降趋势。根据国标GB/T 25504—2010《冰葡萄酒》的规定,冰酒的酒精度在9.0%vol~14.0%vol、乙酸质量浓度≤2.1 g/L、葡萄糖质量浓度≥125 g/L。除了菌株TD2外,所有戴尔有孢圆酵母菌株均可以耐受质量浓度为500 g/L的葡萄糖,体积分数为4%的乙醇,质量浓度为20 g/L的酒石酸以及质量浓度为350 mg/L的SO2;尤其是戴尔有孢圆酵母菌株TD3、TD4、TD6、TD7、TD8及TD10可以耐受体积分数为8%的乙醇。综上可知,除菌株TD2外,其他所有的受试戴尔有孢圆酵母菌株均能够耐受冰酒发酵过程中高糖、高酸环境以及一定体积分数的乙醇,具有应用于冰酒发酵的潜力。
2.2 菌株的β-葡萄糖苷酶活性分析
2.2.1 定性分析
10株戴尔有孢圆酵母菌株的β-葡萄糖苷酶活性的定性分析结果见表1。
表1 10株戴尔有孢圆酵母菌株产β-葡萄糖苷酶的定性分析结果
Table 1 Qualitative analysis results of β-glucosidase produced by 10 strains of Torulaspora delbrueckii
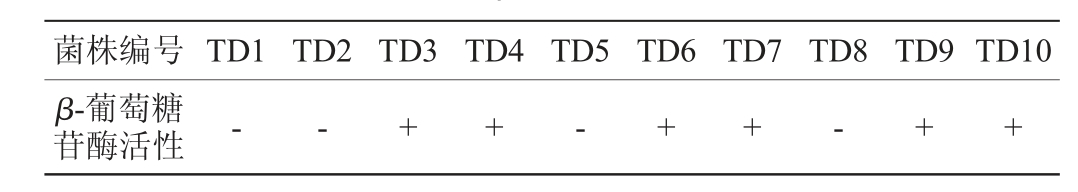
注:“+”表示菌株具有β-葡萄糖苷酶活性;“-”表示菌株无β-葡萄糖苷酶活性。
由表1可知,10株菌株中只有戴尔有孢圆酵母菌株TD3、TD4、TD6、TD7、TD9、TD10具有β-葡萄糖苷酶活性。因此,对初步筛选出具有β-葡萄糖苷酶活性的6株戴尔有孢圆酵母菌株进行酶活性定量分析。
2.2.2 定量分析
β-葡萄糖苷酶可分布于细胞外、细胞内和细胞壁上。发酵过程中,在酵母不发生自溶的情况下,通常仅有细胞外的酶有能力作用于香气前体物质并产生香气。在发酵前期,大部分酵母细胞易悬浮于发酵液中,因此细胞壁结合酶对葡萄酒香气物质的释放也会产生一定的积极作用[13]。
由图2可知,6株戴尔有孢圆酵母菌株均具有细胞外及细胞壁上的β-葡萄糖苷酶活力。其中,戴尔有孢圆酵母菌株TD3、TD6、TD9及TD10细胞壁上的β-葡萄糖苷酶活力明显优于菌株TD4与TD7,尤其是菌株TD6与TD9,其细胞壁上的酶活力分别高达23.21 U/mL与31.13 U/mL。此外,相对于菌株TD3、TD4、TD10,菌株TD6与TD9还具备相对较高的细胞外β-葡萄糖苷酶活性,分别为2.835 U/mL和4.635 U/mL。综上可知,菌株TD6和TD9具备良好的产细胞外以及细胞壁上β-葡萄糖苷酶的能力,因此,将菌株TD6和TD9应用于冰葡萄酒酿造。
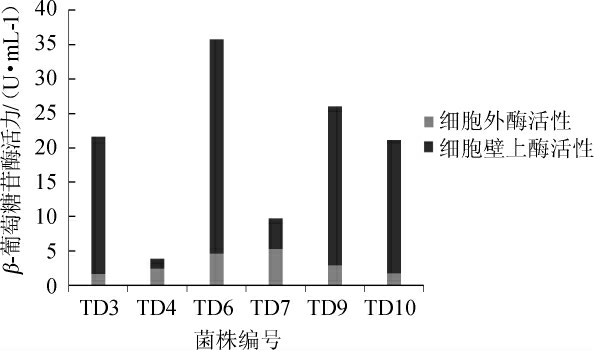
图2 6株戴尔有孢圆酵母菌株产β-葡萄糖苷酶的定量分析结果
Fig.2 Quantitative analysis results of β-glucosidase produced by 6 strains of Torulaspora delbrueckii
2.3 冰葡萄汁混菌发酵
2.3.1 冰葡萄汁混菌发酵过程中酵母菌株发酵速率的变化
由图3可知,3个发酵组均能够在30 d内完成酒精发酵,随着发酵时间的延长,发酵液中的CO2质量损失变化趋势一致。混菌发酵组TD6/ST与TD9/ST在发酵过程中CO2的质量损失显著低于纯种发酵组ST(P<0.05),这说明戴尔有孢圆酵母的接种会对酒精发酵速率产生一定的负面影响。然而,HRANILOVIC A等[23]研究发现,非酿酒酵母参与的混合发酵可以在保证发酵及时完成的前提下,通过提高葡萄酒的品质来弥补其发酵速率相对缓慢的问题,此外,控制相对平缓的发酵速率不仅可以提高香气代谢物的保留率,还可以有效节约能源,以防止发酵剧烈损坏容器[24]。

图3 冰葡萄汁混菌发酵过程中酵母菌发酵速率的变化
Fig.3 Change of yeast fermentation rate during mixed fermentation of ice-grape juice
TD6/ST表示接种菌株TD6 48 h后接种菌株ST发酵葡萄汁;
TD9/ST表示接种菌株TD9 48 h后接种菌株ST发酵葡萄汁;
ST表示接种菌株ST发酵葡萄汁。下同。
2.3.2 冰葡萄汁混菌发酵过程中酵母菌的生长情况
由图4可知,在混菌发酵过程中,随着发酵时间的延长,酿酒酵母ST的菌体浓度均呈先上升趋势,直到第14天菌体浓度分别达到最大值,菌体浓度对数值分别为7.48与7.20,随后,菌体浓度开始下降直至发酵结束。混菌发酵过程中酿酒酵母ST的菌体浓度均低于纯种发酵,说明戴尔有孢圆酵母菌株的加入对酿酒酵母ST的生长有一定的抑制作用。在混菌发酵过程中,菌株TD6与TD9的菌体浓度也先呈增长趋势,且均于第4天达到最大值,菌体浓度对数值分别为7.5与7.6。然而,在酿酒酵母ST接种48 h后,它们的菌体浓度迅速下降,甚至在发酵结束时不能被检测到。此外,两个混菌发酵组中酿酒酵母ST的细胞浓度均在第14天超过了戴尔有孢圆酵母TD6与TD9,同时,酿酒酵母ST开始逐渐占据各自发酵过程中的主导地位。针对戴尔有孢圆酵母细胞浓度早期下降的现象,可能与发酵过程中酿酒酵母与非酿酒酵母之间营养物质的竞争或细胞间的接触机制有关[21,25]。
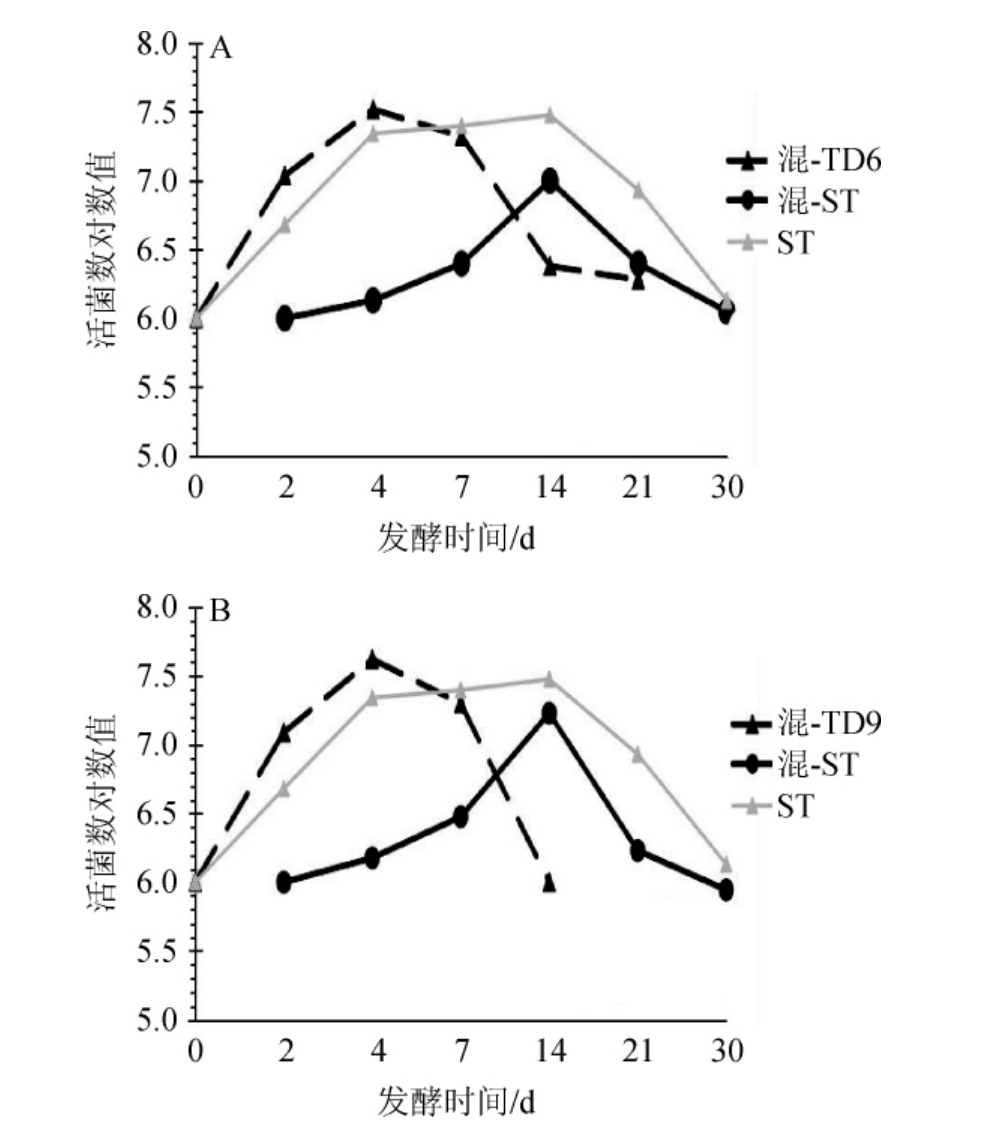
图4 冰葡萄汁发酵过程中酵母菌TD6(A)及TD9(B)的生长情况
Fig.4 Growth of yeast TD6 (A) and TD9 (B) during fermentation process of ice-grape juice
混-TD6表示混合发酵过程中菌株TD6的生长情况;混-TD9表示混合发酵过程中菌株TD9的生长情况;混-ST表示“混合发酵过程中菌株ST的生长情况;ST表示纯种发酵过程中菌株ST的生长情况。
2.3.3 冰葡萄酒基本理化指标的测定结果
过高的乙酸含量不仅不利于冰酒香气产生,还会降低冰酒的品质。由表2可知,与酿酒酵母ST的纯种发酵相比,接种两株戴尔有孢圆酵母可以明显降低乙酸的含量(P<0.05),这与ALBERGARIA H等[26-27]的研究结果一致。与菌株TD9相比,菌株TD6降低乙酸含量的效果更好。此外,混菌发酵组冰酒中总糖含量更高,而酒精度较低,这与CO2质量损失的动态变化一致。3组冰酒中乙酸含量均<2.10 g/L,均符合国标GB/T 25504—2010《冰葡萄酒》的规定,这表明将筛选出的两株优良戴尔有孢圆酵母菌株TD6、TD9应用于冰葡萄酒酿造,具有高度可行性。
表2 冰酒的基本理化指标测定结果
Table 2 Determination results of basic physical and chemical indexes of icewine
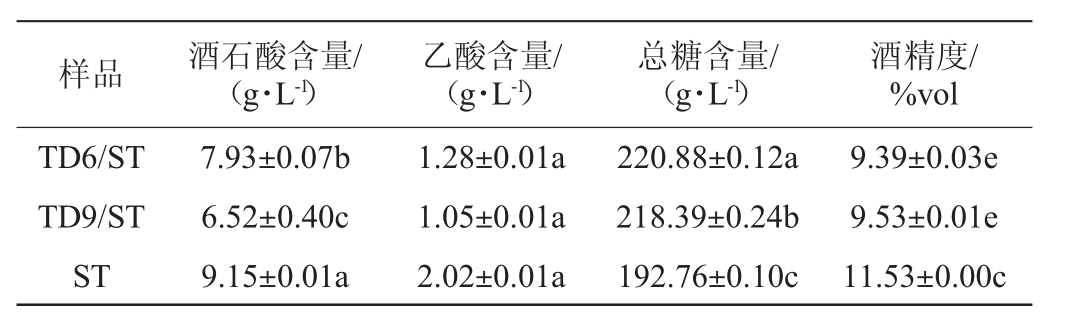
注:不同小写字母表示差异显著(P<0.05)。
3 结论
10株戴尔有孢圆酵母菌中除菌株TD2外,其他菌株均能够耐受葡萄糖500 g/L、乙醇体积分数4%、酒石酸16 g/L及SO2 350 mg/L,其中菌株TD6与TD9产β-葡萄糖苷酶活力较高,为优良本土戴尔有孢圆酵母。将菌株TD6、TD9分别与酿酒酵母ST混合发酵冰葡萄汁时均能在30 d完成酒精发酵,且冰葡萄酒的基本理化指标均符合国标GB/T 25504—2010《冰葡萄酒》规定。此外,戴尔有孢圆酵母的接种对整个发酵过程的发酵速率与酿酒酵母的生长起到了一定的抑制作用,并且可以降低冰葡萄酒中乙酸和乙醇含量,提高总糖含量。
[1]邵威.冰酒生产工艺及其品质影响因素[I].酿酒,2004,31(2):73.
[2]MA Y,KE T,XU Y,et al.Characterization of the key aroma compounds in Chinese Vidal icewine bygas chromatography-olfactometry,quantitative measurements,aroma recombination and omission tests[J].J Agr Food Chem,2016,65(2):394.
[3]张烨.不同酵母菌种及工艺条件对冰葡萄酒发酵的影响[D].大连:大连工业大学,2017.
[4]郭在力.菌种及理化条件对冰葡萄酒发酵的影响[D].大连:大连工业大学,2016.
[5]陈誉文,洪梦楠,李婧.冰酒中的毕赤属和汉逊属酵母菌的筛选及其在葡萄酒酿造中的应用[J].食品科技,2021,46(1):8-14.
[6] BEDRIÑANA R P,QUEIPO A L,VALLES B S.Screening of enzymatic activities in non-Saccharomyces cider yeasts[J].J Food Biochem,2012,36(6):683-689.
[7] LÓPRZ M C,MATEO J J,MAICAS S.Screening of β-glucosidase and β-xylosidase activities in four non-Saccharomyces yeast isolates[J].J Food Sci,2015,80(8):696-704.
[8]夏俊芳,古丽娜孜,李璟瑜.“赤霞珠”葡萄自然发酵过程中高产β-葡萄糖苷酶酵母菌株筛选分析[J].食品工业科技,2020,41(13):1-9.
[9]ZHANG B Q,YU L,DUAN C Q,et al.Use of Torulaspora delbrueckii cofermentation with two Saccharomyces cerevisiae strains with different aromatic characteristic to improve the diversity of red wine aroma profile[J].Front Microbiol,2018,9:606.
[10]BELDA I,RUIZ J,BEISERT B,et al.Influence of Torulaspora delbrueckii in varietal thiol(3-SH and 4-MSP)release in wine sequential fermentations[J].Int J Food Microbiol,2017,257:183-191.
[11] CONTRERAS A,HIDALGO C,HENSCHKE P A,et al.Evaluation ofnon-Saccharomyces yeasts for the reduction of alcohol content in wine[J].Appl Environ Microbiol,2013,80(5):1670-1678.
[12] LI J,HU W,HUANG X,et al.Investigation of yeast population diversity and dynamics in spontaneous fermentation of Vidal Blanc icewine by traditional culture-dependent and high-throughput sequencing methods[J].Food Res Int,2018,112:66-77.
[13]洪梦楠.Starmerella bacillaris 酵母的筛选及其在威代尔冰酒酿造中的应用[D].锦州:锦州医科大学,2020.
[14] LI J,HU W Z,XU Y P.Diversity and dynamics of yeasts during Vidal Blanc icewine fermentation:A strategy of the combination of culture-dependent and high-throughput sequencing approaches[J].Front Microbiol,2019,10:1588.
[15] TOFALO R,CHAVES-LÓPEZ C,DI F F,et al.Molecular identification and osmotolerant profile of wine yeasts that ferment a high sugar grape must[J].Int J Food Microbiol,2009,130:179-187.
[16] PINA C,COUTO J A,ANTÓNIO J,et al.Inferring ethanol tolerance of Saccharomyces and non-Saccharomyces yeasts by progressive inactivation[J].Biotechnol Lett,2004,26:1521-1527.
[17]付肖蒙,王鹏飞,郝爱丽,等.高耐性酿酒酵母的筛选及其耐受性研究[J].中国酿造,2017,36(10):23-26.
[18]PORTER T J,DIVOL B,SETATI M E.Investigating the biochemical and fermentation attributes of Lachancea species and strains:Deciphering the potential contribution to wine chemical composition[J].Int J Food Microbiol,2019,290:273-287.
[19]ROSI I,VINELLA M,DOMIZIO P.Characterization of β-glucosidase activity in yeast of oenological origin[J].J Appl Microbiol,1994,77(5):519-527.
[20] LÓPEZ M C,MATEO J J,MAICAS S.Screening of β-glucosidase and β-xylosidase activities in four non-Saccharomyces yeast isolates[J].J Food Sci,2015,80(8):696-704.
[21]HONG M,LI J,CHEN Y,et al.Impact of mixed non-Saccharomyces yeast during fermentation on volatile aroma compounds of Vidal Blanc icewine[J].LWT-Food Sci Technol,2021,145(11):111342.
[22]叶青,许云贺,张莉力,等.豆腐酸浆中干酪乳杆菌的分离、鉴定及作为豆腐凝固剂的应用[J].食品工业科技,2017,38(18):94-98.
[23]HRANILOVIC A,LI S,BOSS P K,et al.Chemical and sensory profiling of Shiraz wines co-fermented with commercial non-Saccharomyces inocula[J].Aust J Grape Wine Res,2018,24(2):166-180.
[24]BINATI R L,JUNIOR W,LUZZINI G,et al.Contribution of non-Saccharomyces yeasts to wine volatile and sensory diversity:A study on Lachancea thermotolerans, Metschnikowia spp.and Starmerella bacillaris strains isolated in Italy[J].Int J Food Microbiol,2020,318:108470.
[25]MEDINA K,BOIDO E,FARINA L.Increased flavour diversity of Chardonnay wines by spontaneous fermentation and co-fermentation with Hanseniaspora vineae[J].Food Chem,2013,141(3):2513-2521.
[26] ALBERGARIA H,ARNEBORG N.Dominance of Saccharomyces cerevisiae in alcoholic fermentation processes:Role of physiological fitness and microbial interactions[J].Appl Microbiol Biot,2016,100(5):2035-2046.
[27]NISSEN P,ARNEBORG N.Characterization of early deaths of non-Saccharomyces yeasts in mixed cultures with Saccharomyces cerevisiae[J].Arch Microbiol,2003,180(4):257-263.