葡萄酒发酵是由酿酒酵母(Saccharomyces cerevisiae)主导的生物转化过程[1]。氮是发酵过程中极其重要的营养物质,参与蛋白质、细胞壁和核酸合成,不仅影响酵母生长和发酵速率,还会产生最终决定葡萄酒感官质量的化合物[2-3]。氨基酸与铵盐是葡萄中的主要含氮化合物,因葡萄品种、砧木、葡萄园管理、环境条件和生长季节不同,在葡萄汁中含氮化合物的质量浓度范围为300~5 000 mg/L(40~700 mg N/L)[4-5]。研究发现,至少葡萄汁中含氮化合物的质量浓度300 mg N/L才能完成葡萄酒发酵[6]。酿酒葡萄中的氮不足会导致葡萄酒酿造过程酵母细胞数量过低,从而引起发酵缓慢甚至停滞以及微生物污染等问题[7]。工业上,有两种方式解决氮不足的问题:一是外源添加足量氮源;二是引入足量酵母菌,从其他发酵罐中添加足够的生物量或接种更高的酵母量[8]。在实际生产中,发酵罐转移生物量存在技术难度大、污染风险高和细胞适应差等问题[9]。增大接种量则使购买商业酵母的成本增加以及传代次数减少,后者会影响次生代谢物的合成,进而影响葡萄酒的香气和口感[8-9]。目前,应对氮不足的常用方法是补充氮源,如硫酸铵或磷酸铵形式的铵盐[10]。然而,过量添加铵盐会生成致癌物氨基甲酸乙酯(ethylcarbamate,EC),对发酵产生负面影响[11]。在葡萄酒发酵过程中,补充氮源的时机有两个:在发酵起始时,在发酵进入稳定期时,在发酵起始时补加氮存在增加对系统瞬时最大瞬时能量的需求的缺点[12]。目前在葡萄酒工业化生产过程中氮源的补加是根据酿酒师的经验来操作的,因此在基础发酵液的氮源也可以基本满足发酵的基础上,考察过量的氮源补加造成的影响是本研究想要探究的内容[13]。
为了探究氨基酸(amino acid,AA)是否适合作为葡萄酒发酵的补加氮源,本研究以模拟葡萄汁为原料,分别将组氨酸(histidine,His)、苯丙氨酸(phenylalanine,Phe)、色氨酸(tryptophan,Trp)、丝氨酸(serine,Ser)、半胱氨酸(cysteine,Cys)、甘氨酸(glycine,Gly)、丙氨酸(alanine,Ala)、缬氨酸(valine,Val)、亮氨酸(leucine,Leu)、谷氨酸(glutamate,Glu)、谷氨酰胺(glutamine,Gln)、脯氨酸(proline,Pro)、精氨酸(arginine,Arg)、天冬氨酸(aspartate,Asp)、天冬酰胺(asparagine,Asn)、蛋氨酸(methionine,Met)、苏氨酸(threonine,Thr)和赖氨酸(lysine,Lys)等18种氨基酸分别在酿酒酵母(Saccharomyces cerevisiae)F15进入发酵稳定期时添加到发酵基质中,从发酵过程酿酒酵母的生长、发酵速率以及发酵结束乙醇、有机酸和高级醇含量对比18种氨基酸作为补加氮源对葡萄酒发酵过程和品质的影响,以探究氨基酸作为葡萄酒发酵氮不足时补加氮源的可能性,为葡萄酒酿造过程补加氮源提供参考和指导。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株
酿酒酵母(Saccharomyces cerevisiae)F15:法国Laffort公司。
1.1.2 化学试剂
葡萄糖:西王药业有限公司;果糖:山东西王糖业有限公司;苹果酸:天津科密欧化学试剂有限公司;酒石酸、琥珀酸、乙酸,组氨酸(His)、苯丙氨酸(Phe)、色氨酸(Trp)、丝氨酸(Ser)、胱氨酸(Cys)、丙氨酸(Ala)、缬氨酸(Val)、亮氨酸(Leu)、谷氨酸(Glu)、谷氨酰胺(Gln)、脯氨酸(Pro)、精氨酸(Arg)、天冬氨酸(Asp)、天冬酰胺(Asn)、苏氨酸(Thr)、赖氨酸(Lys):上海麦克林生化科技有限公司;乳酸:上海阿拉丁生化科技股份有限公司;甘氨酸(Gly):科昊生物工程有限责任公司;蛋氨酸(Met):生工生物工程(上海)股份有限公司;乙醇:天津市致远化学试剂有限公司;3,5-二硝基水杨酸(dinitrosalicylic acid,DNS):上海科丰实业有限公司;2-辛醇:北京百灵威科技有限公司。所有试剂均为分析纯。
1.1.3 模拟葡萄汁的制备
实验在模拟葡萄汁中进行,以保证实验条件的标准性,避免葡萄汁成分发生改变引起的变化。
模拟葡萄汁培养基:参考BELY M等的[12]配方。氮300 mg N/L,100 g/L葡萄糖,100 g/L果糖,5 g/L苹果酸,3 g/L酒石酸和0.5 g/L柠檬酸,无厌氧因子[13]。
1.2 仪器与设备
BSA224S电子天平:赛多利斯科学仪器北京有限公司;ZQZY-85CS振荡培养箱:上海知楚仪器有限公司;EVOLU TION 220紫外可见分光光度计:赛默飞世尔科技有限公司;SBA-40D生物传感分析仪:山东省科学院生物研究所;LC-2030 PLUS高效液相色谱(high performance liquid chromatography,HPLC)仪:日本岛津公司;HPX-87H色谱柱(300 mm×7.8 mm):美国Bio-Rad公司;57348-U 50/30 μm DVB/CAR/PDMS萃取头、PAL RSI 120 SPME进样器、HP-INNOWax毛细管柱(60 m×250 μm×0.25 μm)、Agilent 7890B 气相色谱仪、Agilent 5977B 质谱仪:美国安捷伦科技有限公司。
1.3 方法
1.3.1 酵母活化
将酵母干粉缓慢加入其10倍质量的37 ℃温水中活化,静置20 min后缓慢加入模拟葡萄汁培养基中,接种量为200 mg/L。
1.3.2 葡萄酒发酵
2 L三角瓶装1.8 L模拟葡萄汁培养基,接种活化的酿酒酵母F15于28 ℃、180 r/min条件下摇床培养,每隔6 h测定生物量(OD600nm值),12 h测定各实验组残糖。当发酵进入稳定期时,以每份150 mL分装到250 mL三角瓶中,分别添加40 mg N/L、80 mg N/L和200 mg N/L单一氮源,根据补加氨基酸(amino acid,AA)种类及相应质量浓度,分别简写为AA 40、AA 80和AA 200,AA代表相应氨基酸氮源,以不添加氮源为对照(CK)。每隔8 h测定各实验组生物量、CO2释放量和残糖,残糖<2 g/L,则认为发酵结束。将三角瓶转移到4 ℃冰箱中,待其自然澄清,取10 mL上清液,储存于4 ℃冰箱下,用于发酵产物分析。
1.3.3 分析检测
还原糖含量的测定:DNS法[14]。
CO2释放量测定:充分晃动三角瓶,使二氧化碳完全逸出,用电子天平称质量。
乙醇含量测定:将发酵液用去离子水稀释到合适浓度,用SBA-40D生物传感分析仪测定。
酒石酸、苹果酸、琥珀酸、乳酸和乙酸采用HPLC法测定[15]。其色谱条件为:HPX-87H 色谱柱(300 mm×7.8 mm),检测器为紫外检测器(波长210 nm),流动相为5 mmol/L H2SO4溶液,流速0.6 mL/min,进样量20 μL,柱温55 ℃;除Met 200实验组分析时间40 min外,其余实验组均为25 min。采用标准品保留时间对比进行有机酸定性,峰面积外标法定量。
利用顶空固相微萃取-气质联用(headspace solid-phase microextraction-gas chromatography-mass spectrometry,HSSPME-GC-MS)技术测定挥发性化合物[16]。样品前处理:20 mL顶空瓶中加入1 mL样品,1 g氯化钠,3 mL去离子水,10 μL内标(2-辛醇,16 mg/L),40 ℃孵育30 min,萃取30 min,250 ℃解吸8 min。
GC条件:使用HP-INNOWax毛细管柱(60 m×250 μm×0.25 μm),载气为高纯氦气(He),流速1 mL/min;升温程序:40 ℃保持3 min,以4 ℃/min升温到160 ℃,再以7 ℃/min升温到220 ℃,保持8 min。
MS条件:电子离子(electronic ionization,EI)源,电子能量70 eV,传输线和离子源温度分别为280 ℃和230 ℃。扫描范围29~350 amu。
定性定量方法:运用美国国家标准技术研究所(national institute of standards and technology,NIST)17.L对图谱进行初步检索及分析,结合相关文献比对解析,确认各个挥发性物质的化学成分。采用内标法进行半定量分析(假定校正因子为1),内标为2-辛醇(质量浓度16 mg/L);待测挥发性物质成分定量分析计算公式如下:
式中:Ci为待测挥发性物质含量,μg/L;Ai为待测挥发性物质峰面积;As为内标物质2-辛醇的峰面积;Cs为样品中2-辛醇的含量,μg;4为样品稀释倍数。
1.3.4 数据处理
每组实验3个重复,实验结果为3个重复的平均值。采用Minitab 18软件进行数据分析处理,采用Tukey检验法进行方差分析。采用Origin 2019软件进行绘图。
2 结果与分析
2.1 不同氨基酸对酿酒酵母生长的影响
不同氨基酸条件下(氨基酸是在酿酒酵母发酵进入稳定期即OD600nm值不再增加时,分别添加40 mg N/L、80 mg N/L和200 mg N/L三种质量浓度的单种氨基酸,在发酵过程中通过测定OD600nm值监测酿酒酵母的生物量变化,用酿酒酵母补加氨基酸后的OD600nm值最大值得到图1。由图1可知,Cys 200的生物量显著低于对照、Cys 40和Cys 80(P<0.05)。因为Cys会对酿酒酵母产生毒性并且毒性具有浓度依赖性,在酿酒酵母以Cys为硫源生长的条件下,没有或者只有轻微的毒性,而当含硫氨基酸作为氮源被降解时,会产生毒性很强的亚硫酸抑制酿酒酵母生长[17]。His、Phe、Trp、Ser、Gly、Val、Leu、Arg、Asp、Asn、Met、Thr和Lys三个质量浓度之间无显著性差异(P>0.05)。Ala、Glu、Gln、Pro和Asn的酿酒酵母最大生物量随氮源质量浓度增加而增加,Ala 40与Ala 200,Pro 40与Pro 200之间存在显著性差异(P<0.05)。最大生物量显著性大于对照组的只有Ala和Val组(P<0.05)。这与BELTRAN G等[18]得到的生长期补加氮才增加生物量的结论并不相同。可见氨基酸作为补加氮源时,酿酒酵母的生长会增加或降低。根据酿酒酵母以单一氨基酸为氮源的生长速率,氨基酸被划分为“偏好”和“非偏好”两类氮源[19]。比如,一般认为Gln和Asn是偏好氮源,Met是非偏好氮源,具体分类因酵母而异[20]。因此,在稳定期氨基酸作为补加氮源酿酒酵母的生长变化的现象可能与酿酒酵母氮源利用偏好性有关[21]。个别氨基酸(如Cys)的分解产物是否存在抑制作用也会影响酿酒酵母的而生长。从氨基酸对酿酒酵母发酵生长的影响来看,补加200 mg N/L的Ala和Val两种氨基酸的效果最佳。
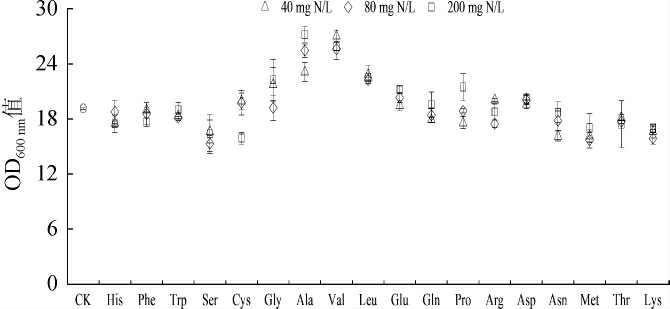
图1 不同氨基酸对酿酒酵母生长的影响
Fig.1 Effects of different amino acids on the growth of Saccharomyces cerevisiae
2.2 不同氨基酸对酿酒酵母发酵速率的影响
酿酒酵母的发酵速率可由CO2释放速率间接表示,补加氮源后平均CO2释放速率见图2。
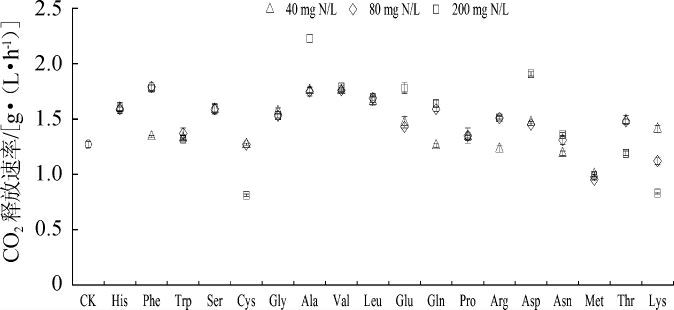
图2 不同氨基酸对酿酒酵母CO2释放速率的影响
Fig.2 Effects of different amino acids on CO2 release rate of Saccharomyces cerevisiae
由图2可知,18种氨基酸按照其对发酵速率的影响可以分为三类:①随质量浓度增加发酵速率加快,Phe、Ala、Glu、Gln、Arg、Asp和Asn;②对发酵速率的影响与质量浓度无关,His、Trp、Ser、Gly、Val、Leu、Pro和Met;③随质量浓度增加发酵速率下降,Cys、Thr和Lys。与对照相比,Cys 200、Met 40、Met 80、Met 200、Lys 80和Lys 200的平均CO2释放速率显著下降(P<0.05)。Cys 200平均CO2释放速率下降的原因可能与其生长受到抑制有关。Lys抑制葡萄酒发酵这一现象与DUC C等[22]的研究结果一致,虽机理未明,但从本研究中可以看出这与发酵液中Lys的质量浓度有关,推测Lys对酿酒酵母的抑制影响具有浓度依赖性。Phe 40、Trp 40、Trp 80、Trp 200、Cys 40、Cys 80、Gln 40、Pro 40、Pro 80、Pro 200、Arg 40和Asn 40、Asn 80、Asn 200的平均CO2释放速率与对照无显著性差异(P>0.05)。其余组的平均CO2释放速率都显著大于对照组(P<0.05),这与SEGUINOT P等[23]得出的稳定期补加氮能增加发酵速率提高糖利用率的结论一致。从氮源对酿酒酵母发酵速率的影响来看,第二类中的Met和第三类中的Cys和Lys并不适合作为补加氮源。其余氨基酸比较适合作为补加氮源,并且大部分氨基酸在80 mg N/L和200 mg N/L时无显著性差异(P>0.05),从经济角度考虑,80 mg N/L的添加量最为适宜。
2.3 不同氨基酸对乙醇含量的影响
乙醇是葡萄酒的主要成分,决定了葡萄酒的粘度(酒体),并起到固定香气的作用[24]。不同氨基酸对乙醇含量的影响见图3。由图3可知,Ser 40、Ser 80、Ser 200、Cys 40、Cys 80、Cys 200、Gly 40、Gly 80、Ala 40、Ala 200、Val 40、Val 80、Val 200、Leu 40、Leu 80、Leu 200、Glu 40、Glu 80、Glu 200、Asp 40、Asp 80、Asp 200、Thr 40和Lys 40的乙醇含量显著增加(P<0.05),氮对乙醇含量的影响取决于氮的种类,这与VILANOVA M等[25-26]的研究一致。这些促进乙醇含量增加的氮源基本也是促进酿酒酵母发酵速率的氨源。造成这种现象的原因可能有两个:一是发酵速率增加缩短了发酵周期,使发酵过程中的乙醇挥发损失减少;二是充足的氮源刺激了蛋白质的合成,尤其是糖转运系统,增加了乙醇含量[27]。从氨基酸对乙醇的影响来看,对乙醇含量无显著性影响的氨基酸(His、Phe、Trp、Gln、Pro、Arg、Asn和Met)显然更适合作为补加氮源。
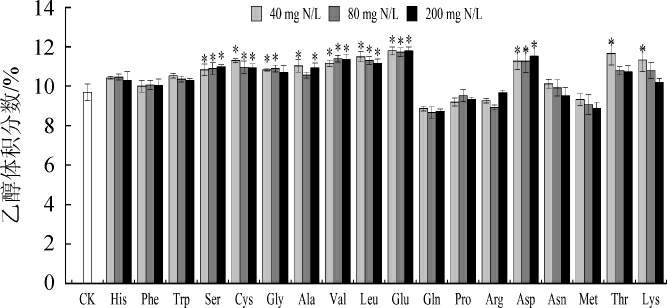
图3 不同氨基酸对乙醇含量的影响
Fig.3 Effects of different amino acids on ethanol contents
“*”表示该组与对照差异显著(P<0.05)。下同。
2.4 不同氨基酸对有机酸含量的影响
不同氨基酸可通过多种机制影响有机酸的代谢,但关于其机制的阐述寥寥无几[28]。在本研究中,不同氨基酸对有机酸含量的影响见图4。
由图4A可知,在补加氮源40 mg N/L时,只有His、Phe、Trp、Arg、Asp和Lys的苹果酸含量显著高于对照(P<0.05);在补加氮源80 mg N/L时,Ser、Cys、Gln、Asn和Thr的苹果酸含量也显著高于对照(P<0.05);在补加氮源200 mg N/L时,Gly、Ala、Val和Leu的苹果酸含量也显著高于对照(P<0.05)。苹果酸含量随补加的氮源质量浓度增加而增加。特别地是,Lys组苹果酸含量虽然都显著高于对照(P<0.05),但苹果酸含量随补加氮源质量浓度增加而下降。

图4 不同氨基酸对有机酸含量的影响
Fig.4 Effects of different amino acids on organic acids contents
琥珀酸是酿酒酵母酒精发酵过程形成的主要非挥发酸,在葡萄酒中最高为3 g/L[29]。由图4B可知,只有Cys组中琥珀酸显著增加(P<0.05),在3.5~4.4 g/L之间。
由图4C可知,酿酒酵母丙酮酸脱羧酶活性缺陷,不存在有效的乳酸合成途径,只能产生微量的乳酸。除Cys 200外,其余组乳酸在0~0.3 g/L之间。
在苹果酸、琥珀酸和乳酸中存在一个共同的现象,Cys 80和Cys 200显著增加了其含量(P<0.05)。可能是Cys具有较强的还原性,导致代谢通路的氧化还原状态发生了改变,从而促进了有机酸的产生[16]。
乙酸是葡萄酒中主要的挥发酸。由图4D可知,除Lys 200外,其余组的乙酸含量在0.2~0.7 g/L之间,在乙酸积累的最佳质量浓度范围内[30]。Lys 200的乙酸的质量浓度达到了0.9 g/L,是对照的2.6倍。虽然并没有超出国标GB 15037—2006《葡萄酒》规定的上限1.2 g/L,但可能正是因为乙酸含量超出最佳质量浓度范围对酿酒酵母发酵产生了抑制作用,导致Lys 200的发酵速率受到抑制[31]。在葡萄酒酿造过程中,乙酸主要是由乙醛脱氢酶催化乙醛生成,造成Lys 200乙酸过多积累的原因可能是乙醛脱氢酶活性增加[32]。葡萄酒的品质与糖酸比直接相关,酸含量过高会使葡萄酒过于酸和尖锐。由此可见,Cys和Lys并不适合作为补加氮源。就苹果酸而言,补加较高质量浓度的氮源也是不可取的。因此,从氨基酸对有机酸的含量的影响来看,除了Cys和Lys以外的氨基酸比较适合作为补加氮源,40 mg N/L的添加量最为适宜。
2.5 不同氨基酸对高级醇含量的影响
高级醇也被成为杂醇,是发酵过程中产生的碳原子数>2的挥发性醇[33]。对葡萄酒香气有重要影响,总量低于300 mg/L时,可增加葡萄酒香气的复杂性,超过400 mg/L会使葡萄酒的香气变得粗糙[34]。不同氨基酸对高级醇含量的影响见表1。由表1可知,本研究共检出5种高级醇,结果表明补加发酵香气物质合成的前体氨基酸Phe、Gly、Ala、Val、Leu和Met时,能显著提高酒中高级醇的含量(P<0.05),而且含量与补加量呈正相关,这与王亚钦等[35]研究结果一致。Met组产生的较多3-甲硫基丙醇可继续氧化或者与其他化合物形成含硫挥发物,对葡萄酒的感官品质造成不良影响。其余的四种高级醇都对葡萄酒的香气复杂性有积极影响。从氨基酸对高级醇含量的影响来看,Phe、Gly、Ala、Val和Leu比较适合作为补加氮源,并且80 mg N/L的添加量最为适宜。
表1 不同氨基酸对高级醇含量的影响
Table 1 Effects of different amino acids on higher alcohol contents

续表

注:“-”表示未检出;“*”表示该组与对照差异显著(P<0.05)。
3 结论
本研究在酿酒酵母葡萄酒发酵进入稳定期时分别补加18种氨基酸,对不同氨基酸作为补加氮源对酿酒酵母的生长和发酵速率以及最终的乙醇、有机酸和高级醇含量的影响进行了探究。结果表明,丙氨酸族氨基酸(Ala、Val和Leu)作为补加氮源时,酿酒酵母发酵速率增加,乙醇含量增加了1%,有机酸含量变化较小。此外,Ala和Val显著增加了酿酒酵母的生物量以及异丁醇的含量(P<0.05),Leu显著增加了异戊醇的含量(P<0.05),增加了葡萄酒的香气复杂性。含硫氨基酸(Cys和Met)会抑制酿酒酵母的发酵速率。Cys 200不仅显著抑制酿酒酵母的生长(P<0.05),对有机酸的代谢也产生较大干扰,其有机酸总量是对照的2倍,破坏了葡萄酒的糖酸平衡。而Met产生了较多的3-甲硫基丙醇,对葡萄酒感官品质存在潜在负面影响。Lys 200抑制酿酒酵母生长和发酵速率,产生了过高的乙酸。因此,丙氨酸族的Ala和Val比较适合作为葡萄酒酿造过程的补加氮源,含硫氨基酸和Lys不适合作补加氮源。
[1]PANDEY A,NEGI S,SOCCOL C R.Current developments in biotechnology and bioengineering[M].Netherland:Elsevier,2017:263-279.
[2]VARELA C,PIZARRO F,AGOSIN E.Biomass content governs fermentation rate in nitrogen-deficient wine musts[J].Appl Environ Microbiol,2004,70(6):3392-3400.
[3] GOBERT A,TOURDOT-MARÉCHAL R,SPARROW C,et al.Influence of nitrogen status in wine alcoholic fermentation[J].Food Microbiol,2019,83:71-85.
[4] WATERHOUSE A L,SACKS G L,JEFFERY D W.Understanding wine chemistry[M].The United States:Wiley,2016:172-178.
[5]LEE J M,STEENWERTH K L.Rootstock and vineyard floor management influence on 'Cabernet Sauvignon' grape yeast assimilable nitrogen (YAN)[J].Food Chem,2011,127(3):926-933.
[6]MENDES-FERREIRA A,MENDES-FAIA A,LEÃO C.Growth and fermentation patterns of Saccharomyces cerevisiae under different ammonium concentrations and its implications in winemaking industry[J].J Appl Microbiol,2004,97(3):540-545.
[7]JIMÉNEZ-MARTÍ E,ARANDA A,MENDES-FERREIRA A,et al.The nature of the nitrogen source added to nitrogen depleted vinifications conducted by a Saccharomyces cerevisiae strain in synthetic must affects gene expression and the levels of several volatile compounds[J].Anton Leeuw,2007,92(1):61-75.
[8]GUTIÉRREZ A,CHIVA R,SANCHO M,et al.Nitrogen requirements of commercial wine yeast strains during fermentation of a synthetic grape must[J].Food Microbiol,2012,31(1):25-32.
[9]孙悦.不同氮素水平对酿酒酵母混合发酵特征的影响及其代谢物研究[D].杨凌:西北农林科技大学,2016.
[10]DUC C,PRADAL M,SANCHEZ I,et al.A set of nutrient limitations trigger yeast cell death in a nitrogen-dependent manner during wine alcoholic fermentationt[J].PLoS One,2017,12(9):e0184838.
[11]郭在力,栾静,孙玉梅.可同化氮对葡萄酒发酵影响的研究进展[J].中国酿造,2016,35(4):19-23.
[12] BELY M,SABLAYROLLES J M,BARRE P.Automatic detection of assimilable nitrogen deficiencies during alcoholic fermentation in oenological conditions[J].J Ferment Bioeng,1990,70(4):246-252.
[13] GUTIÉRREZ A,CHIVA R,GUILLAMÓN J M.Arginine addition in the stationary phase influences the fermentation rate and synthesis of aroma compounds in a synthetic must fermented by three commercial wine strains[J].LWT-Food Sci Technol,2015,60(2):1009-1016.
[14]史荣超,刘洒洒,侯阳阳,等.梅奇酵母转化L-苯丙氨酸合成2-苯乙醇发酵条件优化[J].食品与发酵工业,2021,47(5):22-28.
[15]DUAN L L,SHI Y,JIANG R H,et al.Effects of adding unsaturated fatty acids on fatty acid composition of Saccharomyces cerevisiae and major volatile compounds in wine[J].South African J Enol Vitic,2015,36(2):285-295.
[16]HU K,JIN G J,XU Y H,et al.Enhancing wine ester biosynthesis in mixed Hanseniaspora uvarum/Saccharomyces cerevisiae fermentation by nitrogen nutrient addition[J].Food Res Int,2019,123:559-566.
[17] SANTIAGO M,GARDNER R C.The IRC7 gene encodes cysteine desulphydrase activity and confers on yeast the ability to grow on cysteine as a nitrogen source[J].Yeast,2015,32(7):519-532.
[18] BELTRAN G,ESTEVE-ZARZOSO B,ROZÈS N,et al.Influence of the timing of nitrogen additions during synthetic grape must fermentations on fermentation kinetics and nitrogen consumption[J].J Agric Food Chem,2005,53(4):996-1002.
[19] CRÉPIN L,NIDELET T,SANCHEZ I,et al.Sequential use of nitrogen compounds by Saccharomyces cerevisiae during wine fermentation:a model based on kinetic and regulation characteristics of nitrogen permeases[J].Appl Environ Microbiol,2012,78(22):8102-8111.
[20]BOER V M,TAI S L,VURALHAN Z,et al.Transcriptional responses ofSaccharomyces cerevisiae to preferred and nonpreferred nitrogen sources in glucose-limited chemostat cultures[J].FEMS Yeast Res,2007,7(4):604-620.
[21] LJUNGDAHL P O,DAIGNAN-FORNIER B.Regulation of amino acid,nucleotide,and phosphate metabolism in Saccharomyces cerevisiae[J].Genetics,2012,190(3):885-929.
[22] DUC C,NOBLE J,TESNIÈRE C,et al.Occurrence of yeast cell death associated with micronutrient starvation during wine fermentation varies with nitrogen sources[J].OENO One,2019,53(3):445-456.
[23]SEGUINOT P,ROLLERO S,SANCHEZ I,et al.Impact of the timing and the nature of nitrogen additions on the production kinetics of fermentative aromas by Saccharomyces cerevisiae during winemaking fermentation in synthetic media[J].Food Microbiol,2018,76:29-39.
[24] ROMANO P,CIANI M,FLEET G H.Yeasts in the production of wine[M].Berlin:Springer,2019:43-80.
[25]VILANOVA M,UGLIANO M,VARELA C,et al.Assimilable nitrogen utilisation and production of volatile and non-volatile compounds in chemically defined medium by Saccharomyces cerevisiae wine yeasts[J].Appl Microbiol Biotechnol,2007,77(1):145-157.
[26]谢诗怡,韩月,张烨,等.不同有机氮源对葡萄酒发酵的影响[J].中国酿造,2018,34(4):43-48.
[27] BELY M,SALMON J M,BARRE P.Assimilable nitrogen addition and hexose transport system activity during enological fermentations[J].J I Brewing,1994,100(4):279-282.
[28]CHIDI B S,BAUER F F,ROSSOUW D.Organic acid metabolism and the impactoffermentation practiceson wine acidity:Areview[J].South African J Enol Vitic,2018,39(2):315-329.
[29]KLERK J L D.Succinic acid production by wine yeasts[D].Stellenbosch:Stellenbosch University,2010.
[30]ROMANO P,CIANI M,FLEET G H.Yeasts in the production of wine[M].Berlin:Springer,2019:283-313.
[31]赵伟,赵兵涛,次仁潘多,等.酿酒酵母代谢有机酸对乙醇发酵的影响[J].可再生能源,2017,35(7):971-977.
[32] REMIZE F,ANDRIEU E,DE QUIN S.Engineering of the pyruvate dehydrogenase bypass in Saccharomyces cerevisiae:role of the cytosolic Mg(2+)and mitochondrial K(+)acetaldehyde dehydrogenases Ald6p and Ald4p in acetate formation during alcoholic fermentation[J].Appl Environ Microbiol,2000,66(8):3151-3159.
[33] CORDENTE A G,SCHMIDT S,BELTRAN G,et al.Harnessing yeast metabolism of aromatic amino acids for fermented beverage bioflavouring and bioproduction[J].Appl Microbiol Biotechnol,2019,103(11):4325-4336.
[34] RODRÍGUEZ M C,CORRAL M F,OTERO P,et al.Secondary aroma:influence of wine microorganisms in their aroma profile[J].Foods,2020,10(51):1.
[35]王亚钦,刘沛通,吴广枫,等.可同化氮对葡萄酒发酵香气物质积累及代谢调控的影响[J].中国食品学报,2017,17(12):170-177.