东北豆酱作为我国传统调味食品,因其独特的滋味与气味而受到大众普遍欢迎[1]。在酶的作用下,大豆中的铁、磷、钙等矿物质能更容易的被释放,从而使大豆中的营养成分更易于人体消化吸收[2-3]。在豆酱自然发酵过程中,乳酸菌可以利用大豆中的蛋白质、碳水化合物、脂肪等,分解成小分子醛、酸、酯等风味物质,使得豆酱的养分发生变化,进而影响豆酱的风味[4-5]。
嗜盐四联球菌(Tetragenococcus halophilus)是一类广泛存在于豆酱、酱油、泡菜等含盐发酵食品中的乳酸菌。已有研究表明,把从中国传统发酵食品豆瓣酱中筛选出的一株嗜盐四联球菌菌株作为发酵剂添加至豆瓣酱的发酵过程中,豆瓣酱中的挥发性物质如氨基酸态氮、酸类、酯类等含量均有提高,其有助于豆瓣酱整体滋味与品质的提升,对发酵产品有明显的增益作用[6]。此外,将嗜盐四联球菌用于强化豆瓣酱的风味,豆瓣酱中的挥发性成分如氨基酸态氮、酸类、醇类等均有所提高,而亚硝酸盐含量减少39.4%
[7]。有大量研究表明,乳酸菌作为重要的微生物在传统食品发酵过程中对风味物质的形成有着至关重要的作用,虽然国内外对传统发酵食品的生产工艺、感官品质、理化指标等做了大量的研究,但对其中嗜盐乳酸菌分离筛选的研究相对较少。
该试验从传统自然发酵豆酱中分离嗜盐四联球菌菌株[8-10],采用分子生物学技术对其进行鉴定[11-13],并对菌株益生特性进行研究,筛选益生性优良的嗜盐四联球菌菌株。进一步探讨优良菌株的最佳生长条件,并以活菌数为响应值,采用单因素及响应面优化试验对其增殖培养基组分进行优化,为嗜盐四联球菌进一步地开发与应用提供重要的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
高盐自然发酵豆酱样品:采集自辽宁省,共计14份。
大肠杆菌(Escherichia coli)、单核细胞增生李斯特菌(Listeria monocytogenes)、金黄色葡萄球菌(Staphylococcus aureus):中国普通微生物菌种保藏管理中心。
1.1.2 试剂
脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国OMEGA公司;AxyPrepDNA凝胶回收试剂盒:美国AXYGEN公司;FastpfuDNAPolymerase:北京TransGen公司;琼脂糖(生化试剂):西班牙沃比森公司;聚合酶链式反应(polymerase chain reaction,PCR)引物、扩增体系:北京鼎国昌盛有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
分离培养基[14]:蛋白胨10 g,牛肉膏8 g,酵母提取物4 g,葡萄糖20 g,乙酸钠·3H2O 5 g,吐温80 1 g,K2HPO4 2 g,柠檬酸钠2 g,MgSO4·7H2O 0.58 g,MnSO4·4H2O 0.25 g,氯化钠150 g,那他霉素2 g,碳酸钙10 g,琼脂20 g,蒸馏水1 000 mL。121 ℃高压蒸汽灭菌20 min。
MRS液体培养基[15]:蛋白胨10 g,无水乙酸钠3 g;K2HPO4 2 g;MgSO4·7H2O 0.575 g;MnSO4·H2O 0.25 g,葡萄糖20 g,柠檬酸三钠2.42 g,酵母粉4 g,牛肉浸膏8 g,吐温80 1 g,琼脂(半固体)1.75 g,蒸馏水1 000 mL。121 ℃高压蒸汽灭菌20 min。MRS固体培养基:MRS液体培养基中添加琼脂20 g。
LB液体培养基[16]:酵母粉5 g,蛋白胨10 g,NaCl 10 g,蒸馏水1 000 mL。121 ℃高压蒸汽灭菌15 min。
种子培养基[17]:MRS液体培养基中添加氯化钠100.0g/L,pH 7.0。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
SHP-250型生化培养箱:上海精宏实验设备有限公司;ZHJH-C1112C超净工作台:苏州安泰空气技术有限公司;ABI-2720 PCR仪:美国AppliedBiosytems公司;DYY-12电泳仪:北京六一生物仪器有限公司;UVPGDS-8000凝胶成像仪:上海精密科学有限公司;Centrifuge 5804R高速台式冷冻离心机:德国Eppendorf公司;NanoDrop 2000c超微量分光光度计:美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 自然发酵豆酱中耐盐乳酸菌的初步分离及纯化
将自然发酵豆酱样品通过10倍稀释法用生理盐水进行梯度稀释,然后选取2~3个合适梯度的稀释液涂布于分离培养基中,于30 ℃条件下兼性厌氧培养6 d。挑取单菌落接种到MRS固体培养基纯化2~3次。将分离得到的菌株接种于MRS固体培养基,30 ℃条件下培养60 h,挑取单菌落进行革兰氏染色,采用显微镜观察细胞形态,记录菌落特征,从而获得嗜盐四联球菌疑似菌株。
1.3.2 生理生化试验
参照《常见细菌系统鉴定手册》[18]对菌株进行生理生化试验。
1.3.3 分子生物学鉴定
采用试剂盒法提取分离菌株的基因组DNA,采用微量紫外分光光度计对基因组DNA进行浓度和纯度的测定,以其为模板,利用16S rRNA基因通用引物[19-20]27f(5'-AGAGTTTGATCCTGGCTCAG-3')、1492r(5'-CTACGGCTACCTTGTTACGA-3')PCR扩增16S rDNA基因序列。PCR扩增体系:基因组DNA模板1 μL(50 ng/μL),引物27f、1492r各0.5 μL(25 pmol/μL),10×PCR buffer 2.5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)MIX 2 μL,ExTaq酶0.2 μL,双蒸水(ddH2O)18.3 μL;PCR扩增条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,27个循环;最后72 ℃延伸10 min。PCR扩增产物经0.5%琼脂糖凝胶电泳检测合格后委托上海桑尼生物技术有限公司进行测序[21-23]。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性对比搜索,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA软件中的邻接(neighbor-joining,NJ)法构建系统发育树[24-25]。
1.3.4 嗜盐四联球菌耐受性试验
将分离并鉴定到的嗜盐四联球菌菌株分别接种于种子培养基,30 ℃静置培养24 h,作为种子液,备用。
按2%(V/V)的接种量将嗜盐四联球菌种子液接种于5 mL MRS液体培养基中,30 ℃、100 r/min摇床培养24 h后,取培养液2 mL,12 000 r/min离心2 min,收集菌体,在超净工作台中倒掉上清液并加2 mL灭菌生理盐水进行重悬;吸取菌悬液0.5 mL分别加入到4.5 mL pH 3.0盐酸溶液、0.3%胆盐溶液和灭菌生理盐水中,30 ℃、100 r/min条件下培养4 h,取500 μL上述处理液到5 mL的MRS液体培养基中,30 ℃、100 r/min条件下培养8 h后,采用超微量分光光度计在波长600 nm处测定吸光度值(OD600nm值),并计算菌株存活率,其计算公式如下:
式中:A表示生理盐水培养液的吸光度值;B表示各处理培养液的吸光度值。
1.3.5 嗜盐四联球菌抑菌性试验
按2%的接种量将嗜盐四联球菌种子液接种到MRS液体培养基中,在30 ℃的条件下培养24 h。将发酵液在4 ℃、10 000 r/min条件下离心10 min,取上清液过滤除菌,保存备用。将大肠杆菌(Escherichia coli)、单核细胞增生李斯特菌(Listeria monocytogenes)及金黄色葡萄球菌(Staphylococcus aureus)作为指示菌接种于LB液体培养基中,30 ℃条件下培养24 h。参照麦氏比浊管,用无菌生理盐水将指示菌悬液菌体浓度稀释成105 CFU/mL,取100 μL均匀涂布在LB固体培养基上,用无菌镊子在每个培养皿中等距离的放置3个牛津杯,在每个牛津杯中加100 μL嗜盐四联球菌发酵液,在4 ℃静置1 h。用游标卡尺量取抑菌圈的直径,每组做三个平行试验取其平均值。抑菌圈直径>8 mm时有抑菌作用[26]。
1.3.6 嗜盐四联球菌最适培养条件的测定及菌体生长曲线
将嗜盐四联球菌种子液按3%(V/V)的接种量接种于初始pH值为7、NaCl含量为5%的MRS液体培养基中,33 ℃条件下静置培养32 h,每隔2 h测定其活菌数值,三次重复取均值。在此基础上考察接种量(1%、2%、3%、4%、5%)(V/V)、培养温度(27 ℃、30 ℃、33 ℃、35 ℃、37 ℃)、NaCl含量(0、2%、5%、8%、10%)、初始pH值(5、6、7、8、9)对嗜盐四联球菌活菌数的影响。
将嗜盐四联球菌种子液按最适接种量接种于含最适NaCl含量的MRS液体培养基中,在最适培养条件下静置培养,每2 h取样测定活菌数,以培养时间(x)为横坐标,活菌数(y)为纵坐标为绘制菌株生长曲线。
1.3.7 嗜盐四联球菌增殖培养基成分优化
单因素试验:在最适培养条件下,以MRS液体培养基为基础,分别采用葡萄糖、蔗糖、可溶性淀粉、玉米糊精作为培养基的唯一碳源,添加量为2%,考察碳源种类对嗜盐四联球菌活菌数的影响;确定最适碳源后,考察碳源添加量(1.0%、1.5%、2.0%、2.5%、3.0%)对嗜盐四联球菌活菌数的影响。然后,分别采用蛋白胨、胰蛋白胨、大豆蛋白胨、硫酸铵作为培养基的唯一氮源,添加量2.5%,考察氮源种类对嗜盐四联球菌活菌数的影响;确定最适氮源后,考察氮源添加量(1.5%、2.0%、2.5%、3.0%、3.5%)对嗜盐四联球菌活菌数的影响。最后,以未添加果蔬汁的培养基为对照,分别加入胡萝卜汁、玉米汁、番茄汁、黄豆浆,添加量为4%,考察生长因子种类对嗜盐四联球菌活菌数的影响;确定最适生长因子后,考察其添加量(2%、4%、6%、8%)对嗜盐四联球菌活菌数的影响。以上试验均在最适培养条件下静置培养18 h后测定其活菌数,比较不同碳源、氮源、生长因子条件下菌体的生长情况。
响应面优化试验:在单因素试验的基础上,以活菌数(Y)为响应值,选择葡萄糖(A)、蛋白胨(B)和黄豆浆(C)为考察因素,选用Box-Benhnken设计法设计响应面试验,对嗜盐四联球菌增殖培养基成分进行优化。
2 结果与分析
2.1 嗜盐四联球菌疑似菌株的分离及纯化
根据乳酸菌的菌落形态特征从自然发酵豆酱中初步分离出68株耐盐乳酸菌。进一步应用革兰染色进行形态学观察,并通过生长试验、脱脂乳试验以及过氧化氢酶试验等生理生化试验,初步筛选出15株嗜盐四联球菌疑似菌株。
2.2 嗜盐四联球菌疑似菌株的分子生物学鉴定
15株嗜盐四联球菌疑似菌株的系统发育树见图1。由图1 可知,10 株菌株为嗜盐四联球菌(Tetragenococcus halophilus),4株为戊糖片球菌(Pediococcus pentosaceus)及1株为肉葡萄球菌(Staphylococcus carnosus)。

图1 基于16S rDNA基因序列15株菌株的系统发育树
Fig.1 Phylogenetic tree of 15 strains based on 16S rDNA gene sequences
2.3 嗜盐四联球菌的耐受性
10株嗜盐四联球菌的耐酸、耐胆盐性能见图2。由图2可知,10株嗜盐四联球菌在酸溶液中的存活率均>30%,其中菌株YSJ-3、YSJ-4、YSJ-5及YSJ-10耐酸性较好;除菌株YSJ-6外,9株嗜盐四联球菌在胆盐溶液的存活率均>40%,其中菌株YSJ-1、YSJ-5、YSJ-10、YSJ-15的胆盐耐受性较好。

图2 嗜盐四链球菌耐受性试验结果
Fig.2 Result of tolerant test of Tetragenococcus halophilus
2.4 嗜盐四联球菌的抑菌性
10株嗜盐四联球菌对3种致病菌的抑制效果见表1。由表1可知,10株嗜盐四联球菌对金黄色葡萄球菌、大肠杆菌及单核细胞增生李斯特菌均具有抑菌作用,其中菌株YSJ-5、YSJ-11对致病菌的抑菌性较好。综上,菌株YSJ-5具有较好的耐受性和抑菌性,为优良的嗜盐四联球菌。
表1 嗜盐四联球菌对致病菌的抑制效果
Table 1 Inhibitory effect of Tetragenococcus halophilus on pathogenic bacteria

注:“-”表示抑菌圈直径<8 mm;“+”表示抑菌圈直径为8~11 mm;“++”表示抑菌圈直径为11~14 mm;“+++”表示抑菌圈直径>14 mm。
2.5 优良嗜盐四联球菌YSJ-5最适培养条件的确定
2.5.1 最适接种量的确定
不同接种量对优良菌株YSJ-5生长的影响见图3。由图3可知,随着接种量的升高,活菌数呈先升高后降低的趋势。当接种量为3%时,培养18 h后活菌数最高达到0.28×109 CFU/mL,确定最优接种量为3%。
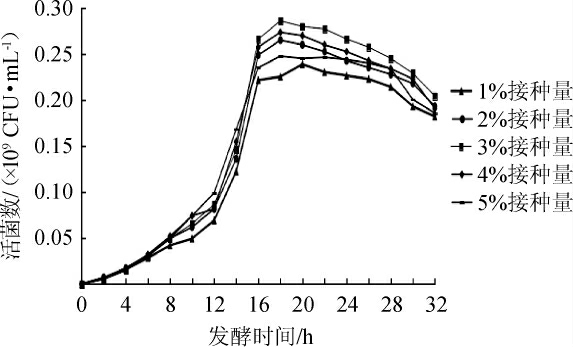
图3 接种量对嗜盐四联球菌YSJ-5生长的影响
Fig.3 Effect of inoculum on the growth of Tetragenococcus halophilus YSJ-5
2.5.2 最适培养温度的确定
不同培养温度对优良菌株YSJ-5生长的影响见图4。由图4可知,随着培养温度的升高,活菌数呈先升高后降低的趋势。当培养温度为33 ℃时,培养18 h后活菌数最高达到0.29×109 CFU/mL,确定最优培养温度为33 ℃。

图4 培养温度对嗜盐四联球菌YSJ-5生长的影响
Fig.4 Effect of culture temperature on the growth of Tetragenococcus halophilus YSJ-5
2.5.3 最适NaCl含量的确定
不同NaCl含量对优良菌株YSJ-5生长的影响见图5。有研究发现[27],嗜盐四联球菌最高可耐受NaCl含量26%,最适生长NaCl含量为5%~10%,大多数菌株在无NaCl的情况下也能生长。由图5可知,随着NaCl含量的升高,活菌数整体呈先升高后降低的趋势。当NaCl含量为5%时,培养16 h后活菌数最高达到0.30×109 CFU/mL,确定最优NaCl含量为5%。
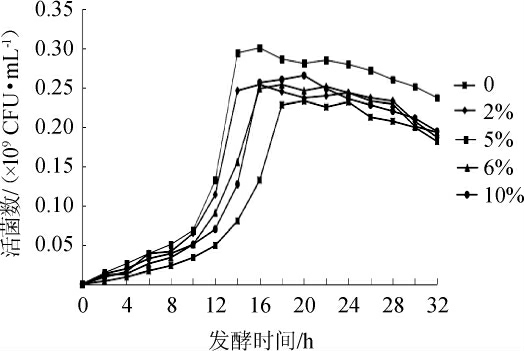
图5 NaCl含量对嗜盐四联球菌YSJ-5生长的影响
Fig.5 Effect of salt concentration on the growth of Tetragenococcus halophilus YSJ-5
2.5.4 初始pH值的确定
不同初始pH值对优良菌株YSJ-5生长的影响见图6。由图6可知,随着pH值的升高,活菌数整体呈先升高后降低的趋势。当pH值为8时,培养16 h后活菌数最高达到0.35×109 CFU/mL,确定最优pH值为8.0。
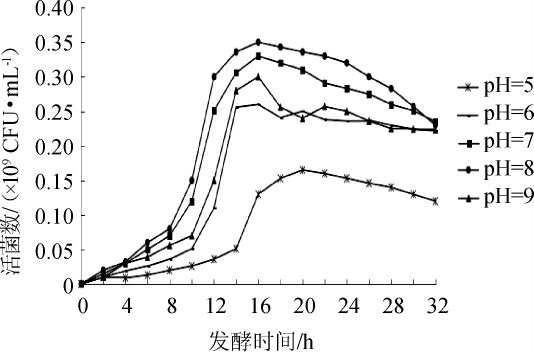
图6 初始pH值对嗜盐四联球菌YSJ-5生长的影响
Fig.6 Effect of initial pH value on the growth of Tetragenococcus halophilus YSJ-5
2.5.5 嗜盐四联球菌YSJ-5的生长曲线
嗜盐四联球菌YSJ-5的最适培养条件为:接种量3%,培养温度33 ℃,NaCl含量5%,pH值8.0。在最适生长条件下,菌株YSJ-5的生长曲线见图7。
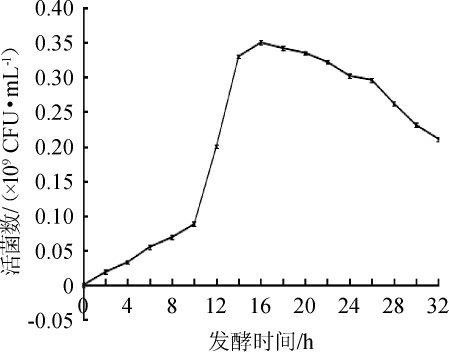
图7 在最适生长条件下嗜盐四联球菌YSJ-5的生长曲线
Fig.7 Growth curve of Tetragenococcus halophilus YSJ-5 under optimum growth conditions
由图7可知,培养0~8 h为迟滞期,8~16 h为对数增长期,16~24 h为稳定期,24 h后为衰亡期。培养16 h时,活菌数达到最高,为0.35×109 CFU/mL。
2.6 嗜盐四联球菌YSJ-5增殖培养基组成优化试验
2.6.1 碳源种类及添加量对菌株YSJ-5生长的影响
不同碳源及葡萄糖添加量对优良嗜盐四联球菌菌株YSJ-5生长的影响见图8。
由图8a可知,蔗糖和葡萄糖的增殖效果要明显优于淀粉和麦芽糊精,当碳源为葡萄糖时,菌株YSJ-5的活菌数最高,达到0.59×109 CFU/mL。因此,确定最优碳源为葡萄糖。由图8b可知,随着葡萄糖添加量的增大,菌株YSJ-5的活菌数呈先升高后降低的趋势,当葡萄糖添加量为2.5%时,活菌数达到最高,为0.74×109 CFU/mL。因此,确定葡萄糖最适添加量为2.5%。
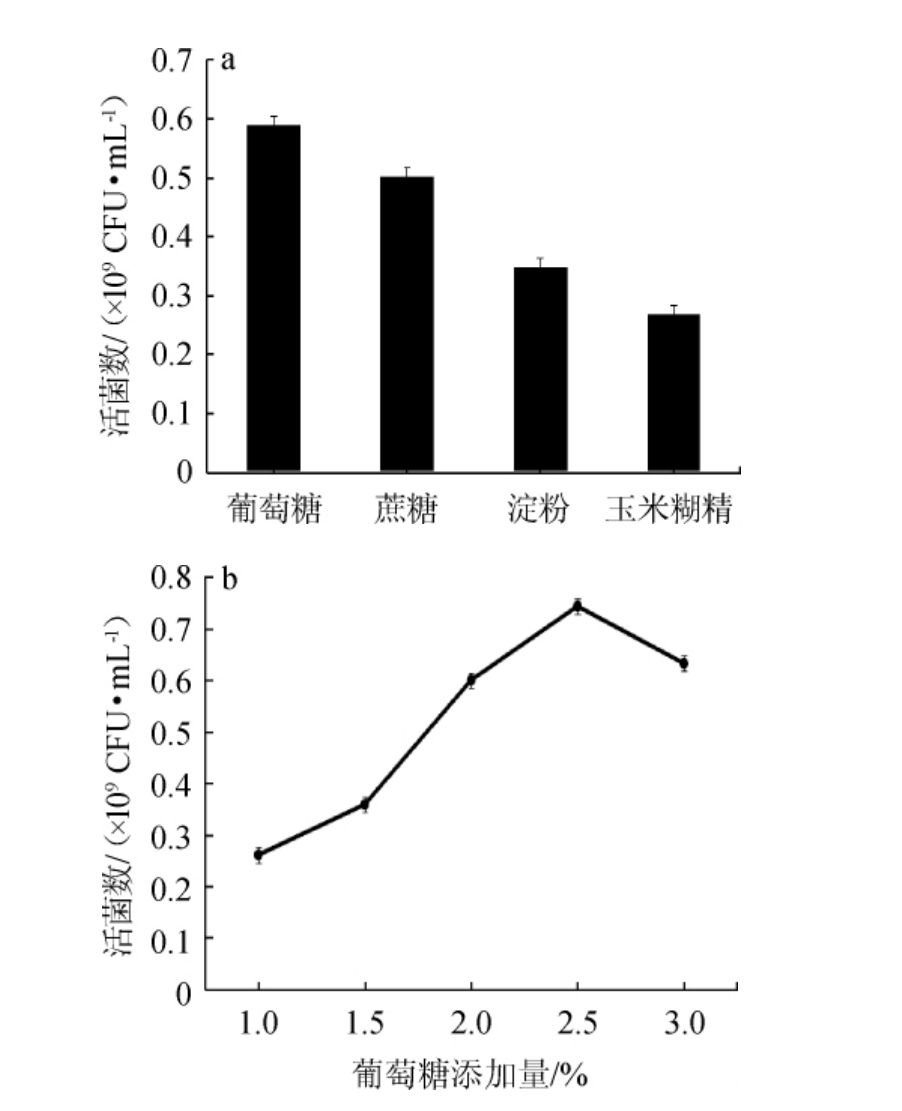
图8 碳源种类(a)及葡萄糖添加量(b)对嗜盐四联球菌YSJ-5生长的影响
Fig.8 Effects of carbon source type (a) and glucose addition (b) on the growth of Tetragenococcus halophilus YSJ-5
2.6.2 氮源种类及添加量对菌株YSJ-5生长的影响
不同氮源及蛋白胨添加量对优良嗜盐四联球菌菌株YSJ-5生长的影响见图9。

图9 氮源种类(a)及蛋白胨添加量(b)对嗜盐四联球菌YSJ-5生长的影响
Fig.9 Effects of nitrogen source type(a)and peptone addition(b)on the growth of Tetragenococcus halophilus YSJ-5
由图9a可知,当氮源为蛋白胨时,菌株YSJ-5的活菌数最高,达到0.90×109 CFU/mL。因此,确定最优氮源为蛋白胨。由图9b可知,随着蛋白胨添加量的增大,菌株YSJ-5的活菌数呈先升高后降低的趋势,当蛋白胨添加量为2.5%时,活菌数达到最高,为0.90×109 CFU/mL。因此,确定蛋白胨最适添加量为2.5%。
2.6.3 生长因子种类及添加量对菌株YSJ-5生长的影响
生长因子种类及添加量对嗜盐四联球菌YSJ-5生长的影响见图10。由图10a可知,各生长因子对嗜盐四联球菌YSJ-5均有增菌效果,黄豆浆的增菌效果最为明显,培养18 h后,活菌数达到1.61×109 CFU/mL。因此确定最优生长因子为黄豆浆。由图10b可知,随着黄豆浆添加量的增加,嗜盐四联球菌YSJ-5的活菌数呈先升高后降低的趋势,当黄豆浆添加量增至4%时,活菌数达到最高,为1.62×109 CFU/mL。因此,确定黄豆浆的最优添加量为4%。

图10 生长因子种类(a)及黄豆浆添加量(b)对嗜盐四联球菌YSJ-5生长的影响
Fig.10 Effects of growth factor type (a) and soybean milk addition (b)on the growth of Tetraphylococcus halophilus YSJ-5
2.6.4 响应面优化试验
依据Box-Benhnken中心组合试验设计原理,以前期培养条件优化及培养基优化单因素试验结果为基础,选取葡萄糖(A)、蛋白胨(B)和黄豆浆(C)添加量为考察因素,嗜盐四联球菌YSJ-5活菌数(Y)为响应值,利用响应面分析法优化嗜盐四联球菌YSJ-5的增殖培养基组分,试验设计及结果见表2,方差分析见表3。
采用Design Expert 8.0.6软件对表2试验结果进行二次多项回归拟合,得到自变量的回归模型方程为Y=219.20+44.75A-27.38B+11.13C+4.75AB+33.25AC+7.50BC-67.85A2-46.10B2-65.60C2。由表3可知,模型极显著(P<0.01),失拟项不显著(P>0.05),表明方程与实际数据能够良好拟合,此试验设计结果较为可靠,可用于优化嗜盐四联球菌YSJ-5的增殖培养基组分。由表3亦可知,一次项A、B、交互项AC及二次项A2、B2、C2对结果影响极显著(P<0.01),一次项C对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。其中交互项AC对结果影响的响应面及等高线见图11。
表2 响应面试验设计与结果
Table 2 Design and results of the response surface tests
表3 响应面试验结果的方差分析
Table 3 Variance analysis of response surface tests

注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
由图11可知,响应面呈曲凸面,等高线呈椭圆形,说明葡萄糖添加量与黄豆浆添加量间的交互作用对嗜盐四联球菌YSJ-5活菌数的影响显著(P<0.05),与方差分析结果一致。
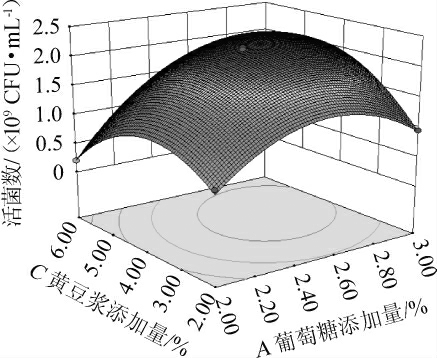
图11 葡萄糖与黄豆浆添加量交互作用对嗜盐四联球菌YSJ-5活菌数影响的响应面及等高线
Fig.11 Response surface plots and contour lines of effects of glucose and soybean milk addition on viable count of Tetraphylococcus halophilus YSJ-5
应用Design Expert 8.0.6软件对回归模型方程进行分析,得出最优增殖培养基组成为:葡萄糖添加量2.70%,蛋白胨添加量2.36%,黄豆浆添加量4.41%,嗜盐四联球菌YSJ-5活菌数的预测值为2.31×109 CFU/mL。在最优条件下进行验证试验,嗜盐四联球菌YSJ-5培养18 h后的活菌数实际值为2.20×109 CFU/mL,与理论预测值相近,是优化前活菌数(3.50×108CFU/mL)的6.31倍。因此,应用响应面法优化所得到的增殖培养基组成参数准确可靠,同时也具有一定实用价值。
3 结论
本研究采用传统培养分离方法,从辽宁地区14份传统自然发酵豆酱样品中初步分离出68株耐盐乳酸菌株,通过形态学观察、生理生化试验,初步筛选出15株嗜盐四联球菌疑似菌株。采用分子生物学技术鉴定,其中10株为嗜盐四联球菌。由耐受性试验可知,菌株YSJ-3、YSJ-4、YSJ-5、YSJ-10对酸溶液耐受性较好,菌株YSJ-1、YSJ-3、YSJ-4、YSJ-5、YSJ-10、YSJ-15对胆盐的耐受性较好,说明菌株YSJ-3、YSJ-4、YSJ-5、YSJ-10的益生性较好。由抑菌性试验可知,菌株YSJ-5、YSJ-11对致病菌的抑菌性较好,其中YSJ-5的抑菌性较YSJ-11更好。因此,确定菌株YSJ-5菌株为优良菌株。该菌株的最适培养条件为接种量3%(V/V)、培养温度33 ℃、NaCl含量5%、初始pH值8.0,在此条件下,其培养16 h时达到稳定期,OD600nm值达到最高为1.822。在最适培养条件下,通过单因素及响应面试验确定菌株YSJ-5的最优增殖培养基组成为葡萄糖2.70%、蛋白胨2.36%、黄豆浆4.41%,其他成分及添加量与基础MRS液体培养基一致,在此最优培养基组成下,菌株YSJ-5的活菌数达到2.20×109 CFU/mL。
[1]张平,武俊瑞,乌日娜.大豆发酵食品-豆酱的研究进展[J].中国酿造,2018,37(2):6-10.
[2]姜洪华.大豆的营养价值及保健功能[J].农业技术与装备,2010(9):75.
[3]吴聚兰,李秀珍,张海生,等.大豆及大豆制品的营养成分[J].农产品加工(创新版),2012(8):53-56,77.
[4]武俊瑞,王晓蕊,唐筱扬,等.辽宁传统发酵豆酱中乳酸菌及酵母菌分离鉴定[J].食品科学,2015,36(9):78-83.
[5]辛星,宋刚,周晓杭,等.传统发酵豆酱中乳酸菌的分离、筛选及鉴定[J].中国食品学报,2014,14(9):202-207.
[6]HE G Q,WU C D,HUANG J,et al.Effect of exogenous proline on metabolic response of Tetragenococcus halophilus under salt stress[J].J Microbiol Biotechnol,2017,27(9):1681-1691.
[7]WU C D,LIU C L,HE G Q,et al.Characterization of a multiple-stress tolerance Tetragenococcushalophilusand application asstarter culture in Chinese Horsebean-chili-paste manufacture for quality improvement[J].Food Sci Technol Res,2013,19(5):855-864.
[8]张汉波,段昌群.土壤微生态环境的非培养方法研究[J].生态学杂志,2003,22(5):131-136.
[9]凌代文,东秀珠.乳酸细菌分类鉴定及试验方法[M].北京:中国轻工业出版社,1999:1-25.
[10]谭才邓,瘳延智,朱美娟.一株饲料乳酸菌的选育及特性研究[J].饲料与畜牧,2019,7(12):66-71.
[11]乌日娜.内蒙古传统酸马奶中乳杆菌的分离鉴定及16S rDNA 序列同源性分析[D].呼和浩特:内蒙古农业大学,2005.
[12]安美玲,张艳,刘忆冬,等.新疆喀什地区母乳中乳酸菌的多样性分析[J].微生物学通报,2017,44(9):2104-2111.
[13]黄道梅,陈曦,李国林,等.四川传统泡菜中抗氧化活性食窦魏斯氏菌的筛选、鉴定及其特性分析[J].食品工业科技,2015,36(17):3-5
[14]张平,张鹏飞,刘斯琪,等.自然发酵豆酱中明串珠菌的分离鉴定[J].食品科学,2018,39(22):110-115
[15]刘境.自然发酵锦州小菜中魏斯氏菌的分离筛选及其特性研究[D].沈阳:沈阳农业大学,2018.
[16]李晓玉,夏媛媛,沈微,等.肠膜明串珠菌蔗糖磷酸化酶的酶学表征及在催化合成α-熊果苷中的应用[J].生物工程学报,2020,36(8):1546-1555.
[17]张平.肠膜明串珠菌FX6 的全基因组序列分析及其对豆酱风味品质的影响[D].沈阳:沈阳农业大学,2019.
[18]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:370-398.
[19]GOMEZ-BALDERAS C D C,COCHET N,BERT V.16S rDNA analysis of bacterial communities associated with the hyper accumulator Arabidopsis halleri grown on a Zn and Cd polluted soil[J].Eur J Soil Biol,2014,60:16-23.
[20]李欣,武俊瑞,田甜,等.大庆自然发酵酸菜中乳酸菌的分离鉴定及耐酸菌株初步筛选[J].食品科学,2014,35(1):150-154.
[21]王磊,张洁,赵国忠.东北酸菜优良乳酸菌筛选及抑菌特性研究[J].中国酿造,2017,36(7):48-52.
[22]ADESULU-DAHUNSI A T,SANNI A I,JEYARAM K.Rapid differentiation among Lactobacillus, Pediococcus and Weissella species from some Nigerian indigenous fermented foods[J].LWT-Food Sci Technol,2017,77:39-44.
[23]乌日娜,张和平,孟和毕力格.酸马奶中乳杆菌Lb.casei Zhang 和ZL12-1的16S rDNA 基因序列及聚类分析[J].中国乳品工业,2005,33(6):4-9.
[24]LIU A P,LIU G R,HUANG C P,et al.The bacterial diversity of ripened Guang'yuan Suancai and in vitro evaluation of potential probiotic lactic acid bacteria isolated from Suancai[J].LWT-Food Sci Technol,2017,85:175-180.
[25]唐玲,刘平,黄瑛,等.酵母的分子生物学鉴定[J].生物技术通报,2008(5):84-87.
[26]毛晋春.传统发酵酸面团微生物群落动态变化及其主要发酵菌株分离筛选[D].沈阳:沈阳农业大学,2020.
[27] COLLINS M D,WILLIAMS A M,WALLBANKS S.The phylogeny of Aerococcus and Pediococcus as determined by 16s rRNA sequence analysis:Description of Tetragenococcus gen.nov.[J].FEMS Microbiol Lett,1990,70(3):255-262.