虾青素是目前经济价值和应用价值较高的类胡萝卜素物质,由于其多方面的生理功能而引起人们极大重视。虾青素具有比维生素E、β-胡萝卜素更强的抗氧化活性[1],可以有效抑制细胞的氧化损伤和癌变[2],同时还具有抗高血压、预防心血管疾病、增强免疫、防紫外线辐射等诸多功效。此外,由于其具有抗氧化特性以及其他生理生化活性,虾青素还可以作为食品添加剂[3]。因此,虾青素在医药、食品、饲料、保健品和化妆品等领域的应用与日俱增。
本文介绍了虾青素的结构性质、虾青素来源和生产方法,着重讲述红法夫酵母(Phaffia rhodozyma)生产虾青素的生物合成途径、发酵培养条件以及虾青素的破壁提取和纯化方法,为虾青素工业化生产提供一定理论基础。
1 虾青素的性质与结构
虾青素是萜烯类不饱和化合物,化学名为3,3'-二羟基-β,β'-胡萝卜素-4,4'-二酮,分子式为![]() 。在100 kPa条件下,熔点为216 ℃,沸点为774 ℃[5]。虾青素具有疏水性,在室温条件下易溶于苯、氯仿、丙酮和二甲亚砜等有机溶剂中[6],微溶于甲醇、乙醇和石油醚等极性较大的有机溶剂中。虾青素对光、氧、温度等因素敏感,容易发生降解反应从而失去生物活性。
。在100 kPa条件下,熔点为216 ℃,沸点为774 ℃[5]。虾青素具有疏水性,在室温条件下易溶于苯、氯仿、丙酮和二甲亚砜等有机溶剂中[6],微溶于甲醇、乙醇和石油醚等极性较大的有机溶剂中。虾青素对光、氧、温度等因素敏感,容易发生降解反应从而失去生物活性。
天然虾青素由4个异戊二烯结构组成的长的共轭双键碳链和两端α-羟基酮的六元环构成,分子结构与β-胡萝卜素类似。2个六元环上的羟基,构成手性中心,形成了虾青素3种不同的构型:左旋(3S-3'S),右旋(3R-3'R)和内消旋(3R-3'S)。

雨生红球藻(Haematococcus pluvialis)中按干质量计算含有1.5%~3.0%的(3S-3'S)虾青素,主要以虾青素双酯和虾青素单酯的形式[7]。1972年,PHAFF H J[8]研究发现,红法夫酵母可以合成虾青素,产生右旋构型(3R-3'R)的虾青素。目前,已知只有红法夫酵母产生(3R-3'R)构型的天然虾青素,此种天然构型的虾青素在人体的生物利用率更高[9]。
2 虾青素的天然来源和生产方法
2.1 天然来源
虾青素广泛存在于动物(如水生动物、鸟类)、植物、真菌、藻类和细菌中。野生鲑鱼从食物链中获得虾青素,但养殖鲑鱼从含虾青素的饲料中获得鲑鱼肉的特征颜色[10]。火烈鸟羽毛的艳丽颜色也是因为虾青素的存在。虾青素的含量和存在状态在动物体内有所不相同,如三文鱼的肌肉、内脏器官和血浆的虾青素以游离态为主,而皮、鱼鳞和鱼籽中所含虾青素主要以酯化形式存在。动物体均不能自行从头开始合成虾青素,需要摄入的藻类、酵母、植物来获得虾青素[11]。目前,虾青素应用广泛,消费需求不断增加,仅依赖于食物链中存在的虾青素含量不足以满足各大行业需求。现有虾青素的生产方法主要包括化学合成法、天然提取法和生物合成法。
2.2 生产方法
2.2.1 化学合成方法
利用多步化学和生物催化反应来生产虾青素的方法称为化学合成法。根据合成方法的差异,化学合成法又分为半合成法和全合成法。半合成法是以虾青素代谢途径中的前体物质(如叶黄素、角黄质)为原料来制备虾青素的方法;全合成法即完全利用化学合成的方法来获得虾青素的方法[12]。化学合成虾青素具有生产成本较低、产量高、虾青素纯度可达96%以上等优点[13]。但化学合成的虾青素是多种构型的混合物,并含有副产物,在生物体内的吸收利用率较低[14],稳定性、安全性以及抗氧化活性低于天然提取的虾青素[15]。
2.2.2 天然提取法
海洋生物中多存在天然虾青素,采用粉碎虾、蟹等富含虾青素的加工副产品、去除石灰质、利用有机溶剂等方式提取虾青素的方法称为天然提取法。这种制备方式能促进养殖业的发展,同时减少废弃水产品副产物对环境的污染。但由于废弃的虾、蟹中甲壳中灰分、几丁质含量高,而虾青素的含量低会造成提取过程复杂,存在提取费用高的问题[16]。
2.2.3 微生物发酵法
利用酵母、藻类和细菌生产虾青素的方法称为微生物发酵法。主要菌种包括:单细胞绿藻雨生红球藻、铜绿小球藻(Chlorella aeruginosa)[11]、红法夫酵母[17]、粘红酵母(Rhodotorula rubra)、胶红酵母(Rhodotorula glutinosa)[18]和副球菌属(Paracoccus)[19-20]。发酵法生产的虾青素结构明确、副产物少、对环境友好。但受到产量低、培养条件要求严格、培养成本高等因素的制约。使用廉价培养原料、选育优质的高产菌种使其可以应用于工业生产是微生物发酵法生产虾青素的关键因素。
3 产虾青素的微生物
3.1 藻类生产虾青素
许多藻类都可以产生虾青素,如雨生红球藻、衣藻(Chlamydomonas)、伞藻(Acetabularia)、裸藻(Euglena)等。雨生红球藻是一种淡水单细胞绿藻,属于绿藻门,团藻目,红球藻科,红球藻属,是虾青素生产的主要藻类。雨生红球藻胞内虾青素主要以双酯化虾青素和单酯化虾青素存在,少量以游离态形式存在。但雨生红球藻的生长时间长,培养条件要求严苛,需要光照,生产场所受限,并且虾青素存在于厚壁孢子中,提取率低、连续性较差[21-23]。卫生部在2010年批准雨生红球藻为新资源食品;自此,多种富含雨生红球藻虾青素的保健食品陆续得到国家食品药品监督管理局的批准,这些举措对推动虾青素产品的研究开发及产业快速发展具有积极意义[24]。
铜绿小球藻是另一种产生天然虾青素的绿藻。铜绿小球藻的虾青素含量低于雨生红球菌,但这种藻类具有特殊的培养优势。铜绿小球藻是一种好氧的异养生物,可以使用葡萄糖作为唯一的碳源,生长快,可达到超高细胞密度,对不利的环境条件敏感性低以及易于在室内和室外进行培养。
3.2 细菌生产虾青素
虾青素存在于短杆菌(Brevibacterium)、副球菌属、乳酸分支杆菌(Mycobacterium lacticola)等多种细菌中。尽管大多数细菌的虾青素含量远低于藻类和红法夫酵母[25-27],但通过在细菌中导入虾青素合成相关基因,可改善细菌产虾青素低的问题。尤其是革兰氏阴性菌[28]的细胞壁薄易破碎,色素易提取,适合进行大规模高密度发酵培养[11]。通过细菌发酵生产虾青素,可大幅度降低天然虾青素的生产成本,对未来虾青素的工业生产具有重要意义。
3.3 酵母生产虾青素
酵母发酵生产虾青素,主要用到的菌种包括红法夫酵母、粘红酵母[29]、海洋红酵母(Rhodotorula benthica)[30-31]以及深红酵母(Rhodotrula glutinis)。
红法夫酵母是真菌界、真菌门、半知菌亚门、隐球酵母科、红法夫酵母属的唯一种,繁殖方式为无性繁殖中的芽殖,代谢方式为有氧呼吸和无氧呼吸两种,是目前国内外微生物发酵生产虾青素普遍采用的真菌[32-34]。红法夫酵母野生株系中虾青素达细胞干质量的0.05%,一些突变株系中达1.0%,约占总类胡萝卜素含量的80%。红法夫酵母生产虾青素具有如下优势:可利用多种碳源和氮源生产虾青素,细胞生长繁殖速度快,可实现高密度培养;生产周期短,成本低;细胞壁容易破碎,生产的虾青素为右旋构型(3R-3'R),且是游离态,易于人体吸收,提取后酵母菌体可直接作为饲料添加剂[4,35]。
4 酵母虾青素的生物合成
许多研究表明,甲羟戊酸(mevalonate,MVA)、异戊烯焦磷酸(isopentenyl pyrophosphate,IPP)、法呢基焦磷酸(farnesyl pyrophosphate,FPP)、二甲基烯丙基焦磷酸(dimethylallylpyrophosphate,DMAPP)、牻牛儿基牻牛儿基焦磷酸(geranylgeranyl pyrophosphate,GGPP)、八氢番茄红素、四氢番茄红素、β-胡萝卜素等是虾青素的生物合成代谢途径中的重要中间产物。酵母生物合成虾青素的途径分为两个阶段:第一阶段为β-胡萝卜素的合成;第二阶段为β-胡萝卜素通过氧化及羟基化生成虾青素[36]。酵母中类胡萝卜素来源于甲羟戊酸途径,由葡萄糖出发,经糖酵解途径(embden-meyerhof pathway,EMP)生成丙酮酸,再氧化脱羧得到乙酰辅酶A(Acetyl-CoA),三分子Acetyl-CoA缩合形成MVA,MVA再经磷酸化脱羧转化成异戊二烯焦磷酸(C5),IPP是所有异戊二烯类化合物(如虾青素、胡萝卜素和麦角固醇)的合成前体。IPP经缩合形成GGPP(C20),两分子GGPP经过二聚作用生成无色的八氢番茄红素被认为是类胡萝卜素合成的第一个特异步骤。后续经多步脱氢和一步环化合成β-胡萝卜素[37]。最终经过两步酶促反应,利用酮化酶催化β-胡萝卜素分子上引入2个4位的酮基,羟化酶催化引入2个3位的羟基,将β-胡萝卜素催化生成虾青素,酵母虾青素的合成途径[4]如下:

5 酵母发酵过程的控制与优化
产虾青素的酵母具有很强的代谢能力,可以利用单糖[38]、二糖和多糖、有机酸和醇类物质。它还可以迅速利用简单氮源(如铵、硝酸盐、尿素或氨基酸)以及复杂混合物(如酵母膏、牛肉膏、麦芽提取物或蛋白胨)。还可以利用工业废料,可有效降低生产成本,如制糖工艺、玉米湿磨工艺的废料[39]或木材的酶水解溶液[40]。STOKLOSA R J等[41]利用甜高粱蔗渣(sweet sorghumbagasse,SSB)在2 L发酵罐中培养法夫酵母发酵产生虾青素65.4 mg/L,占总干细胞虾青素含量为2.49 mg/g。但是,低成本的培养基可能含有未知的胡萝卜素生成抑制剂,使其不适用于生产过程[42]。在上述实验基础上添加SSB水解液发酵虾青素含量反而降低至53.3mg/L,这可能是SSB中的酚类化合物起了抑制作用[27,41]。在大多数情况下,培养基必须补充必要的营养成分,还可能包括胡萝卜素生成的诱导剂或前体[43]。添加一些成分会提高的虾青素产量,如添加新鲜番茄汁[44]、胡萝卜汁[45]。
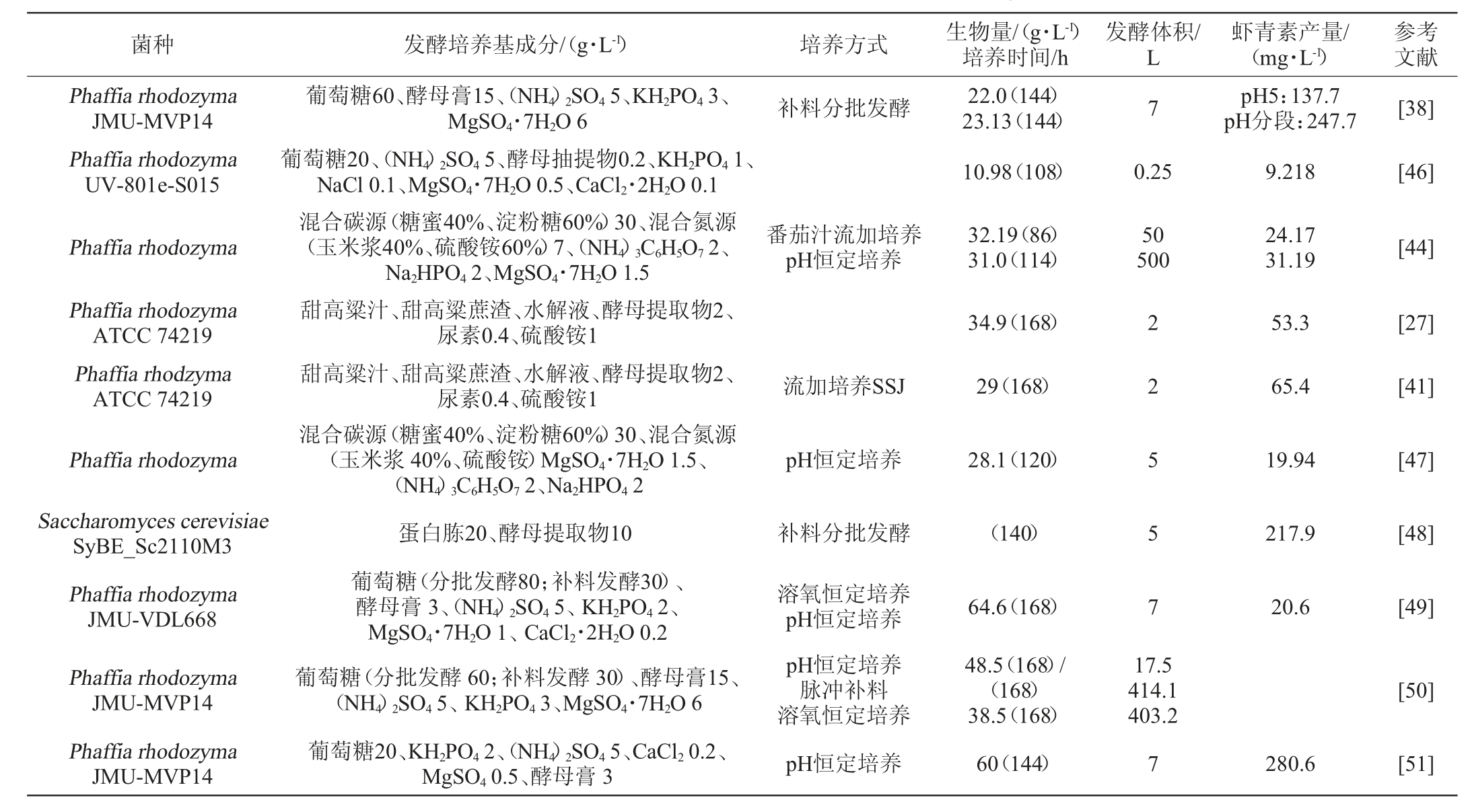
营养物质(碳源、氮源、金属离子、维生素等)和物理因素(温度、pH、供氧等)都会影响细胞生长和虾青素生成。文献中采用的菌种或虾青素高产突变菌株的不同,造成培养基组成和发酵工艺条件不尽相同(见表1)。同时,其中的突变菌株含有随机插入的基因片段,数量或位置以及插入基因的确切功能性质在大多数情况下仍不清楚,从而可能影响文献之间的可比性。对于营养物质和培养方式对细胞生长和虾青素产量的影响可以做以下总结。
红法夫酵母是一种中等嗜冷性酵母、其生长温度范围为0~27 ℃。根据所使用的(突变)菌株、虾青素生产和酵母细胞生长的最佳温度通常位于18~22 ℃。虾青素合成和酵母细胞生长的最佳pH值通常介于5~6之间。酵母细胞生长最佳温度或pH值等培养条件一般情况下与虾青素合成以及积累的最佳温度或pH值不同。因此,在发酵过程中改变pH值或温度均可在发酵培养过程中提高虾青素产量。无论是突变株还是野生株,培养温度和培养基pH值对细胞内虾青素含量、类胡萝卜素组成都有很强的影响[52-53]。
氧在虾青素生物合成中起着关键作用、虾青素的积累量与氧的转移速率有关。氧气供应不足导致β-胡萝卜素积累、降低β-胡萝卜素向虾青素氧化的效率。因此,充分的氧气有助于虾青素的积累[54]。在10%~20%的空气饱和度下有一个临界溶解氧浓度,低于此值的溶解氧浓度会抑制细胞生长和类胡萝卜素的形成。然而,氧气含量过多会抑制酵母细胞生长。因此,为红法夫酵母细胞提供适量的氧气有助于提高虾青素的合成。所以,在培养不同菌株时需要对菌体耗氧量进行确定从而调节发酵设备的转速。除了调节转速、改变空气流速提高通氧量、向培养基中添加具有高氧溶解度的生物相容性有机溶剂作为氧载体,比如油酸、正十二烷、豆油、Tween-80、乙酸乙酯等、也可以改善细胞的氧转移速率。
在细胞生长指数期,高糖将会抑制番茄红素合成β-胡萝卜素及β-胡萝卜素合成虾青素的两个过程。因此,不宜采用高碳源浓度[54]。但在细胞生长的后期,高碳源浓度可促进胡萝卜素的积累[55]。因此,可以通过采用分批补料工艺来消除高糖浓度的拮抗作用,同时实现高生物量和高细胞内虾青素浓度。工业上,红法夫酵母发酵过程分为两个阶段:细胞生长阶段和成熟阶段。通过提供一个低的C/N比率(碳源与氮源浓度的比率),细胞最初表现为快速的生长,当接近高的细胞浓度时生长速率逐渐变慢。在这一阶段,细胞的生长速度高于虾青素的形成速度。当细胞接近生长稳定期时,转换到高碳氮比,虾青素的合成速率高于细胞的生长速度。在相同发酵时间内,通过对不同菌体发酵阶段的碳源浓度和碳氮比进行调控,可同时实现高细胞产量和高虾青素产量。
所使用的(突变)菌株和培养基决定了实现最大加工生产率的进料控制,并且可以通过几种方法建立。如基于Monod指数进料、pH-stat控制[40]、DO-stat培养控制或测定碳源的浓度后的脉冲进料(参见表1)。作为补料分批工艺的一种替代方法,可以考虑半连续和连续两种工艺。评估表1中的数据,脉冲进料和指数进料似乎是较好的进料方法。另一种通过在最初代谢的碳源耗尽后添加缓慢代谢的碳源,如甘油或乙酸来增加成熟阶段虾青素。
表1 产虾青素酵母的培养基及虾青素产量
Table 1 Medium and astaxanthin yield of astaxanthin-producing yeast
6 不同来源虾青素的提纯方法
6.1 虾青素的破壁处理方法
虾青素为胞内产物,一般需经过破壁、提取和纯化等步骤才可从酵母菌体中提取。常用的破壁方法有机械法、化学法[56]、酶解法和热处理等[57]。
机械法是利用机械设备将细胞壁撕裂、通过细胞内渗透压释放内含物。主要方式有超声波破碎法、珠式研磨法、喷雾撞击破碎法以及高压均浆法。机械法操作简便而被广泛使用、但易引起部分位置溶液温度过高造成虾青素损失。
化学法主要有二甲基亚砜法、酸碱加热法和有机溶剂渗透等。碱提法和酸解法破壁需要消耗大量碱和有机酸、使污水排放量增加、造成环境污染、并且较强的酸碱会对虾青素造成伤害。采用5.55 mol/L乳酸浓度、30 ℃破碎温度进行破壁提取可减小对虾青素的损害,最终提取出的虾青素和总类胡萝卜素含量分别为1 294.7 μg/g 和1 516.0 μg/g、虾青素占总提取物的85.4%[56]。
β-葡聚糖酶、蜗牛酶等能水解细胞壁骨架成分β-葡聚糖、与其它方法相比可更加有效地破壁、且避免虾青素溢出菌体减少损失。酶法处理条件温和、对设备的要求低、处理过程对环境造成的污染也较小、提取的虾青素比其他方法获得的虾青素更加稳定。
目前,已经开发出用于提取活性组分的多种现代提取方法、例如脉冲电场(pulsed electric field,PEF)[58]、高压微流化(high-pressure microfluidisation,HPMF)、离子液体(ionic liquids,ILs)[59]等新兴技术。PEF的应用可能通过细胞膜的瞬时透化和细胞区室之间带电物质的电泳运动而对细胞造成致命性损伤或诱导亚致死应激。已有一些学者研究利用PEF从微藻中提取不同有价值化合物。HPMF是一种新兴技术,用于乳状液的高速冲击、强剪切、瞬时压降、高频振动、气蚀和超高压(高达200 MPa)、大分子的改性和生物活性成分的提取。与传统的高压均质相比、HPMF具有不同的阀、腔室设计和更高的工作压力。ILs由松散保持的阳离子和阴离子组成,其特征在于可忽略的蒸气压、低熔融温度、优异的热稳定性和化学稳定性。此外,其溶解纤维素的容量高、离子液体混合物对小球藻脂质提取的影响小。因此,ILs是一种可用于回收小球藻中脂质和蛋白质的新型细胞破碎技术。比较从雨生红球藻中提取虾青素的细胞壁破坏效率的各种技术如PEF、超声(ultrasound、US)、HPMF、HCl和ILs。结果表明,ILs、HCl和HPMF处理对细胞破坏最有效、虾青素提取率超过80%、PEF和US对细胞壁的破坏效率较低[60]。与传统破壁技术相比、PEF、HPMF和ILs等新兴破壁技术对虾青素影响较小,实验过程中所用溶剂较少、耗时短、节能环保。
6.2 虾青素的提取方法
虾青素是脂溶性物质,溶于有机溶剂不溶于水,可利用丙酮、乙醇、甲醇、石油醚等极性有机溶剂进行提取。不同溶剂对南极磷虾中总类胡萝卜素提取率影响的结果表明,无水乙醇的提取效果最好,总类胡萝卜素的提取率达到了73.3%[61]。然而,虾青素虽溶于有机溶剂但溶解度较低,因此,单一溶剂提取效果有限。黄开森等[62]利用乙酸乙酯和乙醇2∶1混合溶液作为浸提液的酸热法提取的虾青素含量显著高于单一溶液的提取效果。
6.3 虾青素的纯化及检测方法
在虾青素的纯化方面,主要用到薄层层析法(thin layer chromatography,TLC)和柱层析法,薄层层析法可用于粗提物成分的简单确定,该方法分离度不高、结果重现性差、易受外界因素干扰、对操作人员的操作过程要求极高、不便于纯化后期实验操作。与其他纯化方法相比,柱层析设备低廉、更换固定相和流动相方便,是最常用的纯化方法。利用不同固定相和流动相的组合能够实现一些相对简单样品的分离与纯化、应用范围很广。薄层层析法和柱层析适用于前期的纯化过程,后期纯化利用制备型高效液相色谱(high performance liquid chromatography,HPLC)法可使纯化效果达98%以上、但制备成本较高。HPLC法不仅可以得到高纯度虾青素,还可以选择合适的流动相利用C18、C30高效液相色谱柱准确测定虾青素的含量。在实验中为了快速测定虾青素的产生量,通常采用紫外可见分光光度法。
7 结语与展望
虾青素具有广阔的开发潜力,在医药、化妆品、保健品、饲料添加剂等方面均具有很大的利用价值和发展空间。天然虾青素和化学合成虾青素的制备过程都各具有一定缺点。今后,虾青素微生物法合成研究仍将以开发遗传性状稳定的高产菌株、使用低成本的培养原料、探索操作简便的生产工艺、利用先进、快速、精准的提取纯化技术来降低生产成本、提高虾青素产量及纯度为主要内容。
[1] SHAH M M,LIANG Y,CHENG J J,et al,et al.Astaxanthin-producing green microalga Haematococcus pluvialis:From single cell to high value commercial products[J].Front Plant Sci,2016,7:531.
[2]FARAONE I,SINISGALLI C,OSTUNI A,et al.Astaxanthin anticancer effects are mediated through multiple molecular mechanisms:A systematic review[J].Pharmacol Res,2020,155:104689.
[3]FAKHRI S,ABBASZADEH F,DARGAHI L,et al.Astaxanthin:A mechanistic review on its biological activities and health benefits[J].Pharmacol Res,2018,136:1-20.
[4]蔡俊,游智能.发酵法生产虾青素的研究进展[J].食品科学,2015,36(23):358-366.
[5]张晓娜,惠伯棣,裴凌鹏,等.功能因子虾青素研究概况[J].中国食品添加剂,2017(8):208-214.
[6]周萍萍.酿酒酵母中虾青素生物合成及其代谢调控的研究[D].杭州:浙江大学,2018.
[7]LI X,WANG X Q,DUAN C L,et al.Biotechnological production of astaxanthin from the microalga Haematococcus pluvialis[J].Biotechnol Adv,2020,43:107602.
[8]PHAFF H J.A comparative study of the yeast florae associated with trees of the Japanese Islands and on the West Coast of North America[J].Ferment Technol Today,1972:759-774.
[9]RAMÍREZ J,NUÑEZ M L,VALDIVIA R.Increased astaxanthin production by a Phaffia rhodozyma mutant grown on date juice from Yucca fillifera[J].J Ind Microbiol Biot,2000,24(3):187-190.
[10]EDWARDS J A,BELLION P,BEILSTEIN P,et al.Review of genotoxicity and rat carcinogenicity investigations with astaxanthin[J].Regul Toxicol Pharm,2016,75:5-19.
[11]FANG N,WANG C,LIU X,et al.De novo synthesis of astaxanthin:From organisms to genes[J].Trends Food Sci Tech,2019,92:162-171.
[12]冼啟志,林劲冬,周应芳,等.天然叶黄素转化的虾青素的热异构化研究[J].中国食品添加剂,2019,30(3):87-93.
[13]汪多仁.虾青素的开发与应用进展[J].江西食品工业,2011(3):38-41.
[14]ERNST H.Recent advances in industrial carotenoid synthesis[J].Pure Appl Chem,2013,74(11):1369-1382.
[15]崔海辉.虾青素的生物学功能及在动物生产中的应用[J].饲料研究,2019,42(9):112-115.
[16] BON J A,LEATHERS T D,JAYASWAL R K.Isolation of astaxanthinoverproducing mutants of Phaffia rhodozyma[J].Biotechnol Lett,1997,19(2):109-112.
[17]ZHUANG Y,JIANG G L,ZHU M J.Atmospheric and room temperature plasma mutagenesis and astaxanthin production from sugarcane bagasse hydrolysate by Phaffia rhodozyma mutant Y1[J].Process Biochem,2020,91:330-338.
[18] LEYTON A,FLORES L,MAKI-ARVELA P,et al. Macrocystis pyrifera source of nutrients for the production of carotenoids by a marine yeast Rhodotorula mucilaginosa[J].J Appl Microbiol,2019,127(4):1069-1079.
[19]ASKER D,AWAD T S,BEPPU T,et al.Purification and identification of astaxanthin and its novel derivative produced by radio-tolerant Sphingomonas astaxanthinifaciens[J].Method Mol Biol,2018,1852:171-192.
[20]HENKE N A,HEIDER S A E,PETERS W P,et al.Production of the marine carotenoid astaxanthin by metabolically engineered Corynebacterium glutamicum[J].Mar Drug,2016,14(7):124.
[21]IP P F,WONG K H,FENG C.Enhanced production of astaxanthin by the green microalga Chlorella zofingiensis in mixotrophic culture[J].Process Biochem,2003,39(11):1761-1766.
[22] KATSUDA T,SHIRAISHI H,ISHIZU N,et al.Effect of light intensity and frequency of flashing light from blue light emitting diodes on astaxanthin production by Haematococcus pluvialis[J].J Biosci Bioeng,2008,105(3):216-220.
[23]KIM Z H,KIM S H,LEE H S,et al.Enhanced production of astaxanthin by flashing light using Haematococcus pluvialis[J].Enzyme Microb Tech,2006,39(3):414-419.
[24]彭宇,任晓丽,陈林,等.虾青素制剂技术及其对虾青素稳定性影响的研究进展[J].中国油脂,2019,44(4):115-121.
[25] JEEVANANTHAM G,VINOTH M,HUSSAIN J M,et al.Biochemical characterization of five marine cyanobacteria species for their biotechnological applications[J].J Pharmacognosy Phytochem,2019,8(2):635-640.
[26]KHOO K S,LEE S Y,OOI C W,et al.Recent advances in biorefinery of astaxanthin from Haematococcus pluvialis[J].Bioresource Technol,2019,288:121606.
[27] STOKLOSA R J,JOHNSTON D B,NGHIEM N P. Phaffia rhodozyma cultivation on structural and non-structural sugars from sweet sorghum for astaxanthin generation[J].Process Biochem,2019,83:9-17.
[28]朱薿.红法夫酵母发酵合成虾青素工艺研究[D].武汉:华中科技大学,2007.
[29]罗秀针,林燕燕,陈雅静,等.粘红酵母RG-31 产虾青素发酵条件优化[J].福建农业科技,2019(9):16-21.
[30]王福强,张艾青,刘希凤,等.海洋红酵母菌活化培养虾青素工艺及其研究进展[J].现代食品,2018(20):149-150,162.
[31]赵笛.海洋红酵母培养条件优化及提高虾青素得率研究[D].大连:大连工业大学,2015.
[32]ANARJAN N,TAN C P.Developing a three component stabilizer system for producing astaxanthin nanodispersions[J].Food Hydrocolloid,2013,30(1):437-447.
[33] WANG J,HAN D,SOMMERFELD M R,et al.Effect of initial biomass density on growth and astaxanthin production of Haematococcus pluvialis in an outdoor photobioreactor[J].J Appl Phycol,2013,25(1):253-260.
[34]YUAN C,JIN Z Y,XU X M,et al.Inclusion complex of astaxanthin with hydroxypropyl-β-cyclodextrin:UV,FTIR,1H NMR and molecular modeling studies[J].Carbohyd Polym,2012,89(2):492-496.
[35]彭小兰.虾青素的生理功能及其生产与应用研究[J].当代畜牧,2005(11):50-52.
[36]徐彩荣.高产虾青素措施的研究[D].泰安:山东农业大学,2013.
[37]迟爽.提高法夫酵母合成虾青素水平的策略及代谢调控特征分析[D].北京:中国农业大学,2016.
[38]肖安风,于广仁,蔡慧农,等.法夫酵母发酵过程的pH 值控制策略及对虾青素合成的影响[J].中国食品学报,2015,15(1):66-72.
[39]朱晓立,梁世中,邓毛程,等.pH 恒定培养控制流加培养红发夫酵母产虾青素[J].食品研究与开发,2011,32(4):160-164.
[40]VÁZQUEZ M,MARTIN A M.Optimization of Phaffia rhodozyma continuous culture through response surface methodology[J].Biotechnol Bioeng,2015,57(3):314-320.
[41] STOKLOSA R J,JOHNSTON D B,NGHIEM N P.Utilization of sweet sorghum juice for the production of astaxanthin as a biorefinery co-product by Phaffia rhodozyma[J].ACS Sust Chem Eng,2018,6(3):3124-3134.
[42] OKAGBUE R N,LEWIS M J.Use of alfalfa residual juice as a substrate for propagation of the red yeast Phaffia rhodozyma[J].Appl Microbiol Biot,1984,20(1):33-39.
[43]CALO P,MIGUEL T,VELÁZQUEZ J B,et al.Mevalonic acid increases trans-astaxanthin and carotenoid biosynthesis in Phaffia rhodozyma[J].Biotech Lett,1995,17(6):575-578.
[44]朱晓立,梁世中.50 L 和500 L 反应器培养红发夫酵母产虾青素的研究[J].现代食品,2016(13):106-110.
[45]胡向东,潘玲燕,叶茂,等.高产虾青素红法夫酵母菌株的选育和发酵参数优化[J].食品工业科技,2016,37(5):142-147.
[46]宋超.代谢网络在虾青素生物合成中的应用[D].大连:大连工业大学,2010.
[47]朱晓立,等.pH-stat 控制流加培养红发夫酵母产虾青素[J].食品研究与开发,2011,32(4):160-164.
[48]靳瑾.产虾青素酿酒酵母的单碱基突变进化和基因组重排[D].天津:天津大学,2018.
[49]蒋兴龙,洪清林,蔡慧农,等.补料工艺对两株法夫酵母菌株产虾青素的影响[J].微生物学通报,2013,40(11):1996-2004.
[50]付爽,沈宁燕,倪辉,等.乙醇补料对法夫酵母发酵产虾青素的促进效果[J].集美大学学报(自然科学版),2017,22(4):20-27.
[51] LIU Z Q,ZHANG J F,ZHENG Y G,et al.Improvement of astaxanthin production by a newly isolated Phaffia rhodozyma mutant with low-energy ion beam implantation[J].J Appl Microbiol,2008,104(3):861-872.
[52]RAMIÍREZJ,GUTIERREZH,GSCHAEDLER A.Optimization of astaxanthin production by Phaffia rhodozyma through factorial design and response surface methodology[J].J Biotechnol,2001,88(3):259-268.
[53] FRENGOVA G I,BESHKOVA D M.Carotenoids from Rhodotorula and Phaffia:yeasts of biotechnological importance[J].J Ind Microbiol Biot,2009,36(2):163-180.
[54] MIAO L,CHI S,WU M,et al.Deregulation of phytoene-β-carotene synthase results in derepression of astaxanthin synthesis at high glucose concentration in Phaffia rhodozyma astaxanthin-overproducing strain MK19[J].BMC Microbiol,2019,19(1):133.
[55]MEYER P S,PREEZ J C.Astaxanthin production by a Phaffia rhodozymamutant on grape juice[J].World J Microb Biot,1994,10(2):178-183.
[56]NI H,CHEN Q H,HE G Q,et al.Optimization of acidic extraction of astaxanthin from Phaffia rhodozyma[J].J Zhejiang U Sci B,2008,9(1):51-59.
[57]滕长英,张立,秦松.虾青素的生理功能、生物安全性及应用潜力[J].湖北农业科学,2006(6):827-829.
[58]MARTÍNEZ J M,SCHOTTROFF F,HAAS K,et al.Evaluation of pulsed electric fields technology for the improvement of subsequent carotenoid extraction from dried Rhodotorula glutinis yeast[J].Food Chem,2020,323:126824.
[59]GAO J,FANG C L,LIN Y Z,et al.Enhanced extraction of astaxanthin using aqueous biphasic systems composed of ionic liquids and potassium phosphate[J].Food Chem,2020,309:125672.
[60]LIU Z W,ZENG X A,CHENG J H,et al.The efficiency and comparison of novel techniques for cell wall disruption in astaxanthin extraction from Haematococcus pluvialis[J].Int J Food Sci Technol,2018,53(9):2212-2219.
[61]宋素梅.南极磷虾壳中虾青素的提取与分离纯化[D].无锡:江南大学,2013.
[62]黄开森,廖志赢,徐春厚,等.胶红酵母虾青素纯品提取及分离纯化方法优化[J].天然产物研究与开发,2018,30(11):1858-1862,1877.