灵菌红素是一种具有三吡咯环的线性环状化合物,其三个吡咯环分别命名为A、B、C环,其中A环源于L-脯氨酸,B环源于L-丝氨酸,C环源于甘氨酸[1]。灵菌红素是灵菌素大家族的一员,灵菌素中各种色素结构如下[1-5]:
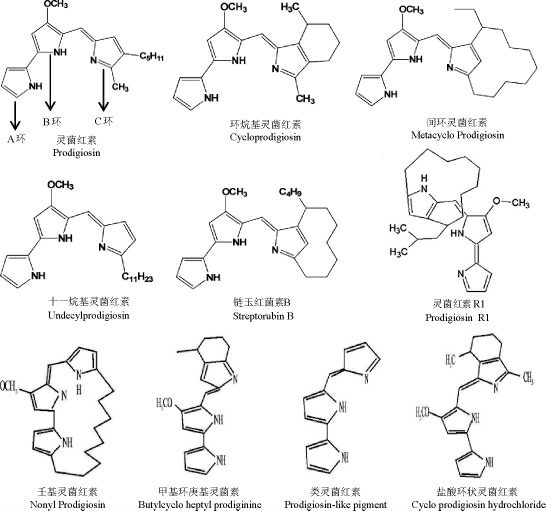
灵菌素还包括十一烷基灵菌红素、环烷基灵菌红素、间环灵菌红素、链玉红菌素B、灵菌红素R1、壬基灵菌红素、甲基环庚基灵菌红素、类灵菌红素以及盐酸环状灵菌红素等,其中灵菌红素、十一烷基灵菌红素以及类灵菌红素属于线性三吡咯结构,其他灵菌素属于环状三吡咯结构[2-5]。灵菌红素是由微生物的次级代谢产生的红色色素,存在于微生物细胞的细胞壁内,易溶于乙醇、甲醇、乙醚、丙酮、氯仿等有机溶剂,不易溶于水,对光敏感,并随着溶液体系的氢离子浓度(hydrogen ion concentration,HIC)指数pH变化而变化,在酸性环境下呈红色,在碱性环境下呈黄色,在酸性环境下更稳定[6]。还有研究表明,灵菌红素在溶液中以顺式(β)和反式(α)旋转体的混合物存在,其比例取决于溶液的pH值[7]。对灵菌红素的鉴定通常采用紫外-可见光谱、红外光谱、高效液相色谱、薄层色谱、核磁共振波谱等方法,此类方法都可以进行定性分析,而紫外-可见光谱和高效液相色谱还可以进行定量分析[8]。自然界中可以产生灵菌红素的微生物种类众多,包括沙雷氏菌属(Serratia),河氏菌属(Hahella)、弧菌属(Vibrio)、链霉菌属(Streptomyces)等,沙雷氏菌属中的普城沙雷氏菌(Serratia plymuthica)、深红沙雷氏菌(Serratia rubidaea)及粘质沙雷氏菌(Serratia marcescens)均可以产生灵菌红素[9],其中研究最多的是粘质沙雷氏菌,该菌也是最早发现产灵菌红素的微生物[10]。粘质沙雷氏菌属于革兰氏阴性杆菌,在自然界中生存性极强,在植物根部、水以及昆虫和哺乳动物等均可以生存[11],还有大量研究表明,粘质沙雷氏菌的最佳生长温度为37 ℃。有关灵菌红素对其生产菌株的生理作用研究目前还没有定论,有研究提出,微生物产生灵菌红素是为了抵御外界的环境竞争,从而保证自身的生存[12]。据报道,灵菌红素生产菌株的遗传物质中超过20个基因用于合成灵菌红素,占其自身全部遗传物质的很大一部分[2],足以证明灵菌红素对其生产菌株的重要性。
灵菌红素最初由于其抗癌、抗细菌、抗真菌、抗疟疾、免疫抑制等生物活性而备受关注,近年来,灵菌红素越来越多的潜在应用被发现,如灵菌红素的光敏感性,使其成为染料敏化太阳能电池的化学光敏剂的潜在替代品[13],以及作为防晒物质应用于化妆品中。灵菌红素独特的红色色泽以及易上色和上色稳定等特点有望推动食品及纺织行业的发展进步[14]。灵菌红素还可以抑制藻类生长、杀虫、抗重金属等,因此,具有减缓水环境污染、保护绿植的作用[2,15,16]。灵菌红素的生产目前以微生物发酵法为主,对该方法的研究主要是针对发酵培养基的优化、发酵参数的优化以及对菌种和基因的改造等。目前,灵菌红素在沙雷氏菌体内的合成途径已经明确,是由一条二分叉途径合成的。本文对灵菌红素的应用、发酵工艺、生物合成以及生产菌株的改造进行综合阐述,以期为灵菌红素的开发应用提供参考。
1 灵菌红素的理化性质
灵菌红素是一种含有三吡咯环的红色线性化合物,分子式为C20H25N3O,分子质量为323.42 Da,全称为4-甲氧基-2,2'-二吡咯-5-甲戊基吡咯,由含单吡咯的2-甲基-3-戊基吡咯(2-methyl-3-amyl pyrrole,MAP)和含双吡咯的4-甲氧基-2,2'-二吡咯-5-甲醛(4-methoxy-2-2'-bipyrrole-5-carbaldehyde,MBC)组成[8]。灵菌红素为非水溶性物质,易溶于乙醇、甲醇、丙酮等有机物质,不溶于水[3]。灵菌红素的稳定性受温度、光照及金属离子等的影响,高温强光照射下灵菌红素易分解,不同金属离子对灵菌红素的稳定性具有不同作用,Ca2+使灵菌红素稳定性增强,Cu2+使灵菌红素稳定性减弱[6,14]。介质溶液中氢离子浓度对灵菌红素有显著影响,在pH 2~5的酸性介质中该色素呈现红色,且在波长535 nm处有稳定的吸收峰;而在碱性介质中该色素呈现橙黄色,在波长470 nm呈现最大吸收峰,色素损失较大[6]。因此,利用酸性介质中灵菌红素在波长535 nm处稳定的吸收峰对灵菌红素进行定性及定量测定。质谱检测323 m/z(质核比)处的吸收峰表明灵菌红素的存在,而薄层色谱分析比移值及高效液相色谱分析保留值根据实验条件的不同存在差异[8]。
2 灵菌红素的应用
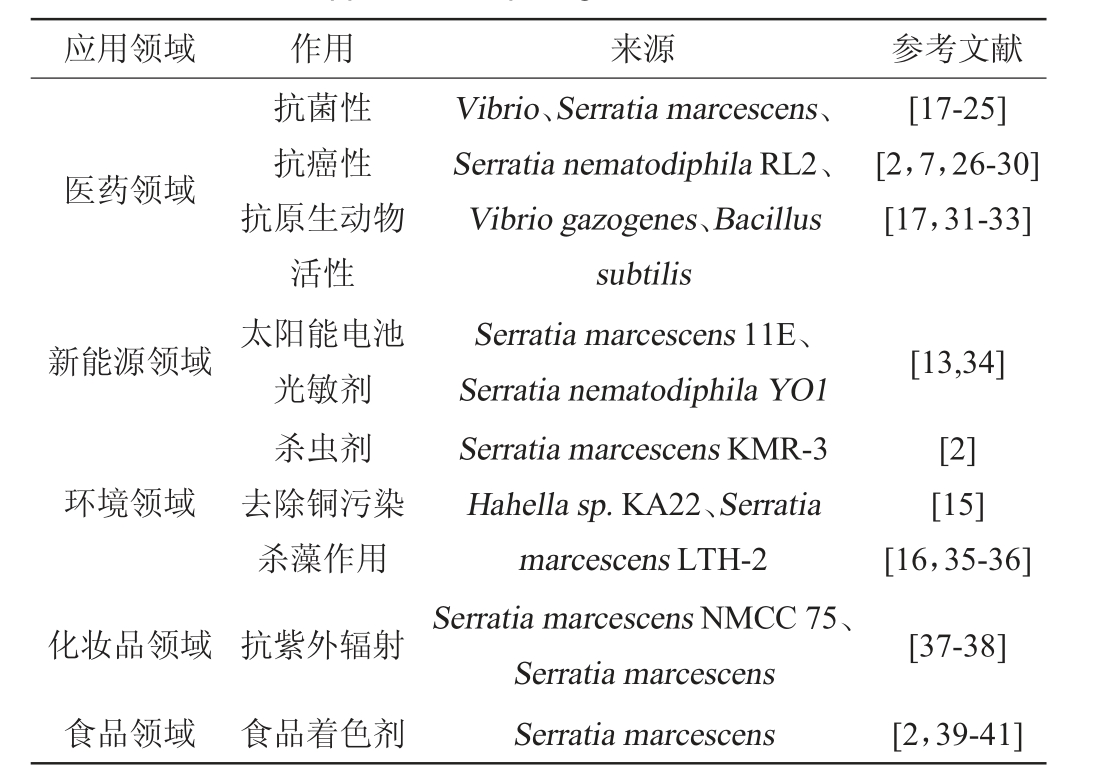
如表1所示,灵菌红素在很多方面具有潜在的应用潜力,其中在医学方面的作用最为突出,包括抗癌性、抗菌性、抗感染性等,灵菌红素具有对癌细胞诱导凋亡作用而对正常人体细胞无毒副作用的特殊作用机制,此机制使其成为有潜力的抗癌药物[4]。灵菌红素在其他方面的作用也早有报道,如在纺织业可用做染料,在食品工业可用做食品着色剂,还可以治理海藻泛滥引起的赤潮现象以及在农田中起到杀虫剂的作用[2]。下面对灵菌红素各方面的应用进行详细阐述。
表1 灵菌红素在各领域的应用
Table 1 Application of prodigiosin in various fields
2.1 医药领域的应用
尽管目前灵菌红素在产生菌的生长过程中的生理生化作用还没有明确,但其具有的一系列的生物学活性,抗菌性、抗癌性、抗原生动物活性等已经被大家熟知并且进行了大量研究,灵菌红素具有靶细胞特异性,即只对特定细胞如癌细胞具有作用,而对正常细胞没有作用,将该性质应用于医疗行业对治疗癌症具有重大意义,然而,由于其主要产生菌粘质沙雷氏菌的安全性问题,灵菌红素还未进行大规模的商业生产应用[2]。下面分别对其各种生物学活性进行综述。
2.1.1 抗菌性
据报道,灵菌红素对大多数细菌具有抑制作用,灵菌红素的抗菌作用机制目前还没有明确的结论。对于由原生病原体引发的传染病,一般采用抗生素等抗性药物进行治疗,如最早发现的抗生素青霉素[17]。然而,虽然含有抗生素的药物可以降低发病率,但如果长期大量服用含有抗生素的药物会让体内有害微生物的耐药性变得更强,从而危害人体健康。所以,微生物产生的某些具有抗菌活性的次级代谢产物便成为有潜力的抗性药物,其中灵菌红素这种微生物次级代谢产物就被大量实验证明具有抗菌性,包括抗原生动物、抗幼虫等[18],已有研究结果表明,灵菌红素比现有抗生素对某些细菌具有更强的抑制作用[19]。GONDIL V S等[20]报道了由嗜线虫沙雷氏菌(Serratia entomophila)RL2产生的灵菌红素对单核细胞增多性李斯特菌属(Listeria monocytogenes)、假单胞菌属(Pseudoalteromonas)、耶尔森菌属(Yersinia)和志贺氏菌属(Shigella)等细菌均具有抗菌活性,而灵菌红素生产菌可以在产生灵菌红素的同时正常生存是由于其具有对灵菌红素的抵抗性[21]。关于灵菌红素的抑菌机理,有研究认为是通过影响细菌的生理生长过程从而对生长产生抑制作用[21]。YOU Z Y等[17]对灵菌红素的抗菌机制进行了研究,推测灵菌红素的抗菌机制包括细胞膜损伤、蛋白质和核糖核酸(ribonucleic acid,RNA)合成抑制、线粒体功能障碍、生物膜抑制、和酶活性抑制,其线粒体功能障碍表现为抑制细菌的正常呼吸进而影响细胞正常代谢。DANEVCˇICˇT等[22]也证实了灵菌红素抑制蛋白质及脱氧核糖核酸(deoxyribonucleic acid,DNA)的合成,在其实验中对照组蛋白质及DNA在增长,而经灵菌红素处理的大肠杆菌的蛋白质以及DNA没有变化,表明灵菌红素可以抑制蛋白质及DNA的合成。有研究发现,灵菌红素对不同细菌有不同的抗菌作用方式。RAMINA M等[23]认为,灵菌红素抗菌活性的作用机理是由于它能够穿过细胞膜,并直接抑制靶酶,如控制细胞生长所必需的DNA旋转酶和拓扑异构酶IV,再进一步抑制细菌的生长。DANEVCˇICˇT等[21]在研究灵菌红素对大肠杆菌(Escherichia coli)的作用机理时还发现,灵菌红素对大肠杆菌的作用强度与浓度有关,当灵菌红素浓度高于最低抑制浓度(minimum inhibitory concentration,MIC)值,用其处理大肠杆菌,大肠杆菌细胞中细胞外膜发生破损,DNA几乎没有损伤,细胞质膜也没有解体,但细胞正常代谢受到严重影响,当稀释灵菌红素而降低其浓度时细菌细胞则会恢复生长。灵菌红素的抗菌活性还可能与灵菌红素和细菌细胞膜的相互作用有关,二者的相互作用会产生活性氧化物,从而导致细菌细胞死亡[24]。有报道认为,灵菌红素对枯草芽孢杆菌(Bacillus subtilis)的抗菌作用机制主要是自溶素的诱导,这种方式是一种有效的抗菌机制[22]。还有研究表明,沙雷氏菌(Serratia)产生的灵菌红素是通过诱导细胞程序性死亡而对细菌起到抑制作用,包括使细菌内的DNA片段化以及抑制细菌细胞中半胱氨酸蛋白酶的表达等[25]。
2.1.2 抗癌性
关于灵菌红素的抗癌活性已经进行了大量的实验研究,有研究对60多个癌细胞株进行了灵菌红素的抗癌活性实验,并且已经证实灵菌红素对几种人类癌细胞都具有细胞毒性,这种细胞毒性是特异性靶向作用,只诱导癌细胞凋亡[7,26]。MONTANER B等[27]之前的研究也证实了灵菌红素只对癌细胞具有诱导凋亡作用,而对正常细胞无影响。灵菌红素的抗癌特性表现为诱导肿瘤坏死和癌细胞凋亡[28],如灵菌红素可以有效抑制T淋巴细胞的增殖[2]。关于灵菌红素的抗癌机制,主要是对癌细胞生长的重要途径起干扰作用,并且这种作用与灵菌红素的浓度有关。灵菌红素的浓度对癌细胞的作用强度有很大的影响,在非细胞毒性浓度时,灵菌红素可扰乱癌细胞内的pH,从而抑制癌细胞的增长。在细胞毒性浓度时,灵菌红素通过干扰其生长的重要途径如原激活蛋白激酶信号通路以及线粒体细胞死亡通路等起到对癌细胞的诱导凋亡作用[2]。DAVIS J T[29]认为,灵菌红素的抗癌机制是由于灵菌红素作为阴离子载体可以与细胞膜上的阴离子结合,形成灵菌红素阴离子复合物,该复合物可以抑制液泡三磷酸腺苷酶(vacuolar adenosine triphosphate,V-ATP),使癌细胞的细胞器pH升高,细胞质基质pH降低,癌细胞内的环境变酸无法正常代谢而凋亡。KAVITHA R等[30]研究发现,灵菌红素对HeLa细胞的半数抑制浓度(half inhibitory concentration,IC50)值为700 nmol/L,因此灵菌红素对癌细胞的作用强度与浓度直接相关,灵菌红素的浓度决定了是否对癌细胞起作用[30]。还有研究发现,灵菌素可以与癌细胞DNA结合,从而促进编码细胞毒性的DNA氧化裂解,也就是灵菌红素可以插入癌细胞的DNA促进DNA的氧化并且片段化,进而导致癌细胞的凋亡[7]。
2.1.3 抗原生动物活性
疟疾是一种由原生动物疟原虫引发的传染病,目前,已有可用于治疗疟疾的药物有青蒿素、奎宁、氯喹、甲氟喹以及蒿甲醚等。据报道,灵菌红素具有抗疟疾的作用,众多研究对其抗疟疾作用进行了阐述。早期的一项研究表明,在40 mg/kg体质量的灵菌红素剂量下延长了感染疟疾小鼠的平均寿命[31]。灵菌素的其他色素也对不同的疟原虫具有抗性作用,如十一烷基灵菌红素、间环丙菌素等,在体内研究中分别就灵菌红素、十一烷基灵菌红素、间环丙菌素以及链玉红菌素B等对恶性疟原虫进行了抗感染性实验,结果分别得到8 nmol/L、7.7 nmol/L、1.7 nmol/L、7.8 nmol/L的IC50值,从实验结果得知,间环丙菌素的抗感染活性最强[32]。在该研究中还对被感染小鼠进行了口服给药以评估其作用,在每种灵菌红素类似物25 mg/(kg·d)的口服剂量下抑制了超过90%的寄生虫血症[32]。CLEMENTS T等[33]研究表明,灵菌红素具有广泛的抗原生动物活性,在其试验中对痢疾内变形虫进行了研究,发现茴香霉素、灵菌红素、甲磺酸盐和醋酸硝唑四种化合物都对痢疾内变形虫有抗性,并且茴香霉素、灵菌红素以及甲磺酸盐三种抗性物质具有广泛的抗寄生虫活性,包括对血吸虫、毛滴虫等寄生虫也具有抗性。其他研究表明,灵菌红素对其他多种原生动物也具有抗性,如裂殖吸虫、克氏锥虫和布氏锥虫等,证明灵菌红素具有多种抗原生动物活性[17]。
2.2 新能源领域的应用
最近,灵菌红素的光敏性受到越来越多的关注,其光敏性可应用于太阳能电池中,代替其中的化学敏化剂来开发染料敏化太阳能电池(dye sensitized solar cell,DSSC)。研究表明,粘质沙雷氏菌E11产生的灵菌红素具有很强的光稳定性,并且对其进行了光电性测试,灵菌红素作为光敏剂的太阳能电池的开路电压为560mV,电流密度为0.096mA/cm2,转化效率为0.032%,是一种潜在的染料敏化太阳能电池敏化剂[34]。另一项研究也证实了灵菌红素作为太阳能电池的光敏剂的潜能,其开路电压为336.1 mV,最大短路电流为0.098 mV/cm2,灵菌红素表现出与DSSC化学敏化剂相当的光电性能[13]。
2.3 环境领域的应用
大自然是人类赖以生存的环境,各种生物长时间的共生给大自然造成了各种污染以及破坏,环境污染是目前的一个全球性问题,因此,减缓环境污染及加强对环境的保护具有重要意义。杀虫剂、重金属及藻类造成的赤潮及水华等都对环境造成严重污染。有研究表明,由粘质沙雷氏菌产生的灵菌红素可以作为杀虫剂使用[2],病虫害不仅导致农作物的生长不良,还会破坏环境,用普通的杀虫剂处理会带给环境新的污染,用灵菌红素这种生物制剂消除病虫害不会给环境带来残留问题。还有报道称,粘质沙雷菌KMR-3 产的灵菌红素具有抗重金属作用,可以用来去除对环境造成重大污染的铜[15]。藻类造成的水华污染及赤潮现象对环境的影响不容乐观,不仅直接影响生态系统的稳定,还间接危害公众健康,人类通过饮用水、游泳等活动也会受到藻类的危害[35]。据报道,由某些微生物产生的灵菌红素可以用来除掉藻类[16,35-36],FENG J R等[16]对Hahella sp.KA22的全基因组进行了测序,研究其产生的灵菌红素对赤潮藻的灭藻活性,发现该菌产生的灵菌红素具有很强的灭藻性。ZHANG S等[36]的研究也证明了灵菌红素的抗藻类作用,其结果表明,当灵菌红素的质量浓度为3 μg/mL时表现出最好的杀藻效果。在WEI J等[35]的实验中首次提出灵菌红素不仅具有灭藻功能,还对微囊藻产生的毒素有抑制作用,并同时提出灵菌红素的杀藻机理可能是引起氧化应激反应,提高藻类细胞内的丙二醛含量,改变超氧化物歧化酶的活性,抑制微囊藻毒素合酶的表达,进一步抑制微囊藻毒素的合成。ZHANG S等[36]还提出灵菌红素可能是通过破坏藻类的细胞结构,抑制基因及蛋白质的表达,抑制藻类的光合作用及呼吸促使活性氧的积累,进而对藻类细胞造成氧化损伤甚至死亡。因此,微生物产生的灵菌红素是很有潜力的除藻治理环境物质。
2.4 化妆品领域的应用
人体皮肤长期暴露于太阳紫外线下会导致许多皮肤疾病,市场上也出现了各种各样的防晒产品,然而,由于目前的防晒霜成分大部分还是合成的,有些会造成粉刺、灼烧等不良反应,因此,人们的需求转向天然防晒物质[37]。据报道,某些生存在高紫外线场所的细菌为防止自身免受外界环境的恶劣影响而产生的色素具有抗紫外线辐射作用,先前有研究从土壤中分离出来的产色素细菌,有些色素的防晒系数高达7~8[37]。由众多细菌产生的灵菌红素也具有很好的抗紫外作用,SURYAWANSHI R K等[38]向芦荟叶和黄瓜的提取物以及防晒霜中添加灵菌红素,与未添加灵菌红素的三种原始物质进行对比,研究灵菌红素是否具有增加防晒效果的作用,结果表明,灵菌红素的添加极大地提高了这3种物质的防晒作用,其中灵菌红素对防晒霜的防晒系数提高了10%以上。极强的抗菌活性增加了灵菌红素作为化妆品中添加物质的合理性[38]。因此,天然产物灵菌红素可作为市面上的防晒霜的添加物质来增强其防晒系数。
2.5 食品领域的应用
目前,食品着色剂所使用的色素绝大多数为合成色素,而合成色素由于其不安全性等隐患问题越来越不受到人们的欢迎。众所周知,天然色素是环境友好型色素,某些色素不仅具有视觉吸引力,还有增强体内益生菌活性,对人体起到保健作用,因此,将天然色素开发为食品级的安全色素具有重大意义[39]。灵菌红素这种微生物天然色素颜色鲜艳、着色能力强、方便易得,将其开发成为食品级的着色剂将极大地推进食品行业的发展。作为着色剂,色素的稳定性是关键,有研究就温度、pH、光照等对灵菌红素色素稳定性的影响进行了测定,结果表明,随着温度、pH、光照强度的增强灵菌红素的稳定性降低,原因是各种影响因素的变化破坏了灵菌红素的化学结构,并且提出在0~20 ℃和pH 2~7范围内,灵菌红素更适合作为食品着色剂,还阐明了灵菌红素在食品中作为着色剂的应用可行性[40]。还有研究提出,可以通过包埋法将灵菌红素包埋作为着色剂应用于食品中,以提高灵菌红素的溶解性及稳定性。在其研究中用卡拉胶和麦芽糊精作为包埋剂,用喷雾干燥法将灵菌红素包埋,制成可溶于水的灵菌红素微胶囊,该灵菌红素微胶囊可以应用于酸奶、牛奶和碳酸饮料等[2,41]。
3 灵菌红素的发酵生产
3.1 传统的灵菌红素发酵工艺
发酵法生产灵菌红素的工艺优化有培养基优化及培养条件优化,影响灵菌红素产量的因素很多,所采用的方法以及所使用的营养物质均会影响灵菌红素的产量。到目前为止,文献报道的灵菌红素最大生产率为49.50 g/L,该实验采用了甘露醇培养基、玉米浆培养基、玉米浆甘露醇培养基、木薯废液培养基、木薯废液甘露醇培养基以及LB葡萄糖培养基进行对比试验,最终粘质沙雷氏菌UCP 1549用60 g/L的木薯废液和20 g/L的甘露醇(在pH 7和28 ℃条件下)培养48 h,发酵液中灵菌红素产量最高为49.50 g/L,并推断细菌生长增强和色素生成降低的最可能原因与碳源和培养基的最终pH值有关[9]。GIRI A V等[42]使用花生粉培养基作为粘质沙雷氏菌的营养物质来生产灵菌红素,得到了高达38.75 g/L的灵菌红素产率。花生粉培养基中灵菌红素含量较高是因为培养基中脂肪酸含量高,脂肪酸对细胞生长有促进作用,从而提高灵菌红素产量。培养基中脂肪酸的存在会促进2-辛烯醛的产生[43],而2-辛烯醛是MAP生物合成途径的前体物质[44]。倪亮[45]用中药废弃物生产灵菌红素的实验研究中发现,中药废弃物中的饱和脂肪酸含量与灵菌红素的产量呈正相关关系,而不饱和脂肪酸含量与灵菌红素产量呈负相关关系,饱和脂肪酸含量越高的中药废弃物粘质沙雷氏菌L9对其利用率越高。该培养基在42 ℃时还可以产生灵菌红素(一般灵菌红素的生产温度为28 ℃),可能是由于温度对不同培养基中灵菌红素的产生影响不同[43]。还有研究发现,向花生粉培养基中添加葡萄糖或麦芽糖时反而会使灵菌红素较少,可能原因是分解代谢抑制作用[42],所以用脂肪酸作为碳源有利于灵菌红素的产生。CHEN Q L等[46]分别以大豆蛋白胨、牛肉膏和花生粉为粘质沙雷氏菌FZSF02发酵生产灵菌红素的唯一氮源时,花生粉作为氮源时灵菌红素产量最高约3.76 g/L,表明花生粉为最佳氮源,并且,当牛肉膏和花生粉共同作为氮源时灵菌红素产量比二者分别作为单一氮源时高了很多。在该实验中也发现,添加橄榄油作为促进产生灵菌红素的油脂,获得了较好的灵菌红素含量,约为11.40 g/L,比不加橄榄油时提高很多[46]。GONDIL V S等[20]用10 g/L酵母提取物、蛋白胨、色氨酸、牛肉提取物、甘氨酸和硫酸铵等分别作为嗜线虫沙雷氏菌RL2产灵菌红素的氮源,当氮源为酵母提取物时灵菌红素的产量相对最高,为0.46 g/L,并发现金属离子可以促进灵菌红素的产生。CHEN W C等[47]使用淀粉和蛋白胨作为粘质沙雷氏菌C3的能源物质,并将淀粉与蛋白胨比率定为6∶4,灵菌红素的产量从2.30 g/L增加至6.70 g/L。在Fe2+和Mn2+的促进作用以及30 g/L海藻酸钙球体的固定作用下,灵菌红素产量分别提高到7.07 g/L和15.60 g/L。TAO J L等[48]利用分批给料的方法来增加粘质沙雷氏菌突变菌株B6的灵菌红素产量,葡萄糖有利于菌体的生长,所以先供给葡萄糖促进菌体的生长,当细胞浓度达到最大,停止葡萄糖的添加,当葡萄糖耗尽后再供给甘油以利于灵菌红素的产生。30 h内其产量为0.58 g/L,很大程度提高了灵菌红素的产量。SURYAWANSHI R K等[19]以马铃薯粉以及酪蛋白水解液为营养物质使粘质沙雷氏菌产生灵菌红素,其最大产量为4.80 g/L。还有研究发现,环糊精可以促进粘质沙雷氏菌产生灵菌红素[49]。
3.2 利用工业副产物生产灵菌红素
最近基于环保的利用工业副产物来生产灵菌红素掀起了风潮,如鱿鱼骨粉、螃蟹废弃物、工业废蛋白、中药废弃物以及造纸污泥等含有营养物质的副产物等。利用工业副产物生产具有优良性质的灵菌红素的同时还可以减轻工业副产物带来的环境及资源问题,不仅对灵菌红素的生产具有促进作用,还提高了资源的有效利用率。BHAGWAT A等[50]利用提取油脂剩余的残渣—花生油籽饼、芝麻油籽饼等作为脂肪酸底物供粘质沙雷氏菌生产灵菌红素,筛选获得高产量灵菌红素的含油底物,结果以花生油籽饼作为底物得到更高的灵菌红素产量,经优化后得到的培养条件为40 g/L花生油籽饼、20 g/L蔗糖、pH 7.5,28 ℃培养72 h后灵菌红素产量达到0.90 g/L。在WANG S L等[51]的研究中,粘质沙雷氏菌TKU011只利用海洋废弃物——鱿鱼骨粉作为单一的碳氮源生产灵菌红素,最后得出,在仅含有1.5%的鱿鱼骨粉的培养基中,灵菌红素的产量为0.98 g/L,其培养条件为30 ℃培养1 d,25 ℃培养2 d,发现与避光条件相比,光照条件下得到的灵菌红素产量更高。在其另一项研究中,粘质沙雷氏菌TKU011利用海洋甲壳素作为底物生产灵菌红素,最终的优化条件为10g/Lα-甲壳素、6g/L酪蛋白、0.5 g/L K2HPO4和1 g/L CaSO4、初始pH值5.65~6.15,最终的灵菌红素产量为4.62 g/L[52]。他们还对之前的鱿鱼骨粉实验进行了改进,在对比螃蟹壳、虾壳以及鱿鱼骨粉三种含甲壳素和蛋白质的海洋副产物对生产灵菌红素的作用后,发现鱿鱼骨粉作为碳氮源时灵菌红素的产量最高,还发现不同的甲壳素/蛋白质比率对灵菌红素的产量有明显的影响,当甲壳素/蛋白质的比率控制在3/7~4/6的范围内时灵菌红素产量较好,因此,鱿鱼骨粉中的甲壳素/蛋白质的比率接近4/6时对灵菌红素的产生具有明显的促进作用。该实验在17.5 g/L鱿鱼骨粉、0.3 g/L K2HPO4和0.5 g/L MgSO4的培养基中25 ℃避光培养12 h,得到3.45 g/L的灵菌红素产量[53],又以脱矿蟹壳粉为底物生产灵菌红素,最终在16 g/L的C/N源(蛋白质/脱矿蟹壳粉=3/7)、0.2 g/L的(NH4)2SO4、1 g/L的K2HPO4培养基,27 ℃培养8 h,灵菌红素产量为5.10 g/L[54]。MAJUMDAR S等[55]将造纸产生的废弃物作为固态培养基供粘质沙雷氏菌利用,得到0.5 g/L的灵菌红素。工业废蛋白是工业生产中常见的副产物,用工废蛋白代替蛋白胨生产灵菌红素很大程度上提高了灵菌红素的产量(5.91 g/L),还降低了灵菌红素的生产成本(相比代替前降低44%),在此基础上可以极大的推进灵菌红素的发展进程[56]。倪亮[45]探究了苦参种子油、僵蚕药渣、杏仁儿药渣等中药废弃物对灵菌红素生产的促进作用,得出全中药废弃物培养基(僵蚕药渣22.00 g/L、杏仁药渣油14.13 g/L和硫酸镁0.35 g/L)比苦参种子油培养基(苦参种子油12.93 g/L、牛肉膏9.47 g/L和氯化钙0.30 g/L)的灵菌红素产量提高了8.7倍,前者为2.76 g/L,后者为0.32 g/L。灵菌红素的产量及生产菌株总结见表2。
表2 不同条件下灵菌红素的产量
Table 2 Yield of prodigiosin under different conditions

4 灵菌红素的提取纯化
基于灵菌红素不溶于水易溶于有机溶剂的性质,寻找安全高效的提取纯化方法至关重要。截至目前为止,文献报道的提取纯化灵菌红素的方法包括溶剂萃取法、薄层色谱法、柱层析色谱法及高效液相萃取法等,有文献报道用制备型高效液相仪制备高纯度灵菌红素[57]。通常灵菌红素的提取纯化流程如下:发酵液经离心得到的含色素沉淀用酸性乙醇或者甲醇充分溶解,色素层上清液通过旋转蒸发浓缩去除有机溶剂,得到色素粗提物。利用薄层色谱法筛选适合用于柱层析色谱的溶剂,以纯化灵菌红素粗提物(直接用薄层色谱法也可得到少量纯化的灵菌红素),得到纯化的灵菌红素[9,20,42]。CHEN Q L等[46]将50 mL发酵液中的含色素沉淀用50 mL酸化甲醇(4 mL 1 mol/L HCl/96 mL甲醇)溶解,静置1 h后旋转蒸发将上清液浓缩的色素粗提物;去除含色素沉淀的剩余发酵液与等量的乙酸乙酯充分混合,分层后的乙酸乙酯相旋转蒸发得到色素粗提物。用于纯化粗提物的硅胶柱先用石油醚充分洗脱,色素粗提物用乙醚∶乙酸乙酯(1∶1,V/V)的混合溶液溶解后注入硅胶柱上层,然后用石油醚洗脱色素层,收集洗脱出来的含色素溶剂,此部分溶剂经过旋转蒸发得到纯化的灵菌红素。有研究表明乙醇作为提取灵菌红素的有机溶剂相较于其他溶剂具有显著优势,灵菌红素的提取率明显较高,可能原因是乙醇通过非共价相互作用与色素发生反应,从而有助于色素迅速扩散到溶液中[58]。乙醇较其他有机溶剂具有毒性小、污染小、更容易回收利用等优势,因此更适合作为提取灵菌红素的有机溶剂。
5 灵菌红素的合成途径
灵菌红素的合成方法主要有化学合成和生物合成,化学合成即运用化学方法人工合成灵菌红素,生物合成方法即利用微生物进行灵菌红素的合成。目前,生物合成方法研究的较多[6]。灵菌红素的生物合成过程中受众多因素的影响,有研究表明,很多微生物的次级代谢产物的生成都会受到葡萄糖的抑制,即在富含葡萄糖的培养基中生长受到抑制,也就是所说的葡萄糖效应,灵菌红素也不例外[59]。尽管葡萄糖有利于粘质沙雷氏菌生长,却对灵菌红素的合成具有抑制作用(1949年发现D-葡萄糖可以抑制灵菌红素的合成)[60]。而且这种抑制作用只与pH有关,没有环腺苷酸(cAMP)的参与,有多个基因参与了葡萄糖对灵菌红素的抑制作用[11]。FENDER J E等[11]通过实验得出了D-葡萄糖通过影响微生物的代谢进而引起pH值降低,通过转录控制灵菌红素生物合成操纵子,共同抑制灵菌红素的产生。因此,未来可以从微生物体内分步合成途径上进一步分析各种影响因素的调控机制。下面对灵菌红素的合成路径进行阐述。
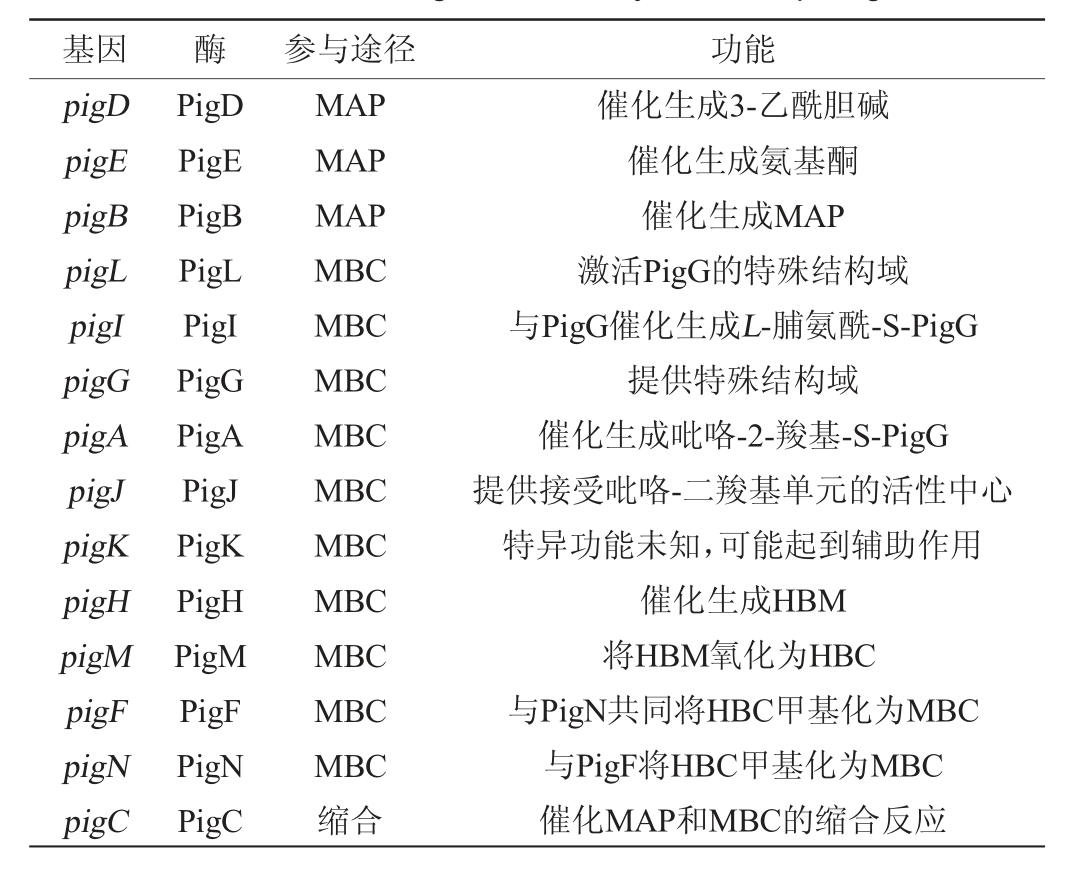
灵菌红素在粘质沙雷氏菌体内的生物合成是由两条分支途径共同完成的,MAP合成途径和MBC合成途径,最后MAP和MBC经过缩合反应形成灵菌红素。不同种类的微生物控制合成灵菌红素的基因簇不同,链霉菌、河氏菌属、囊状假单胞菌(Pseudoalteromonas tunicate)、灰绿链霉菌(Streptomyces griseoviridis)、沙雷氏菌中控制灵菌红素合成的基因簇分别为red、hap、tam、rph、pig基因簇[8]。粘质沙雷氏菌中灵菌红素的生物合成途径中的pig基因簇包括pigD、pigE、pigB、pigA、pigF、pigG、pigH、pigI、pigK、pigJ、pigL、pigM和pigN、pigC共14个基因,对应基因编码的酶分别命名为PigD、PigE、PigB、PigA、PigF、PigG、PigH、PigI、PigK、PigJ、PigL、PigM和PigN、PigC。在众多基因中最终催化MAP和MBC的缩合反应的基因pigC被称为关键基因[4]。14种基因及对应的酶在灵菌红素合成途径中的作用见表3。灵菌红素在粘质沙雷氏菌中的合成途径[4,6,8]如下:
表3 灵菌红素合成过程中各个基因的作用[4,64]
Table 3 Role of various genes in the synthesis of prodigiosin[4,64]

5.1 MAP合成途径
MAP途径中主要有pigD、pigE和pigB三个基因参与。该合成途径从有机物代谢的中间产物2-辛烯酸和丙酮酸开始,2-辛烯酸和丙酮酸在PigD和焦磷酸硫胺素(thiamine pyrophosphate,TPP)的共同催化作用下释放CO2并生成3-乙酰胆碱[10],3-乙酰胆碱上的氨基在PigE的催化作用下与乙醛反应生成氨基酮,然后通过氨基酮自动环化生成的环亚胺在PigB的作用下氧化脱氢生成MAP[61]。
5.2 MBC合成途径
MBC途径是大多数微生物中灵菌红素合成的共同途径,该途径最终产物MBC的合成经由10个基因(pigA、pigF、pigG、pigH、pigI、pigK、pigJ、pigL、pigM和pigN)的共同作用而完成[10]。其中pigK编码PigK酶,并不直接参与灵菌红素的合成,但可能在灵菌红素的合成过程中起到协助其他基因的辅助作用,是整个合成途径中不可或缺的一部分[10]。该途径又分为两条支路,一条是丙二酰辅酶A(malonyl coenzyme A,Malonyl-CoA)与PigH反应生成丙二酰基-S-PigH。另一条是从L-脯氨酸开始,据报道,PigL起到激活PigG的作用,然后,激活的PigG与L-脯氨酸在ATP供能的条件下结合,生成L-脯氨酰-S-PigG[1]。ZHANG F等[62]对PigG的晶体结构及在合成途径中的作用进行了研究,发现PigG的缺失会抑制灵菌红素的产生,证实了PigG及PigG丝氨酸残基对灵菌红素合成途径的重要性。L-脯氨酰-S-PigG在FAD供氢以及PigA的催化下发生氧化脱氢反应,生成吡咯-2-羧基-S-PigG,吡咯-2-羧基-S-PigG的吡咯-2-羧基发生转移生成吡咯-2-羧基-S-PigJ[61]。两条路径的产物丙二酰基-S-PigH与吡咯-2-羧基-S-PigJ进一步反应生成吡咯-β-酮硫酯,再依次经过PigH、PigM的作用发生脱羧及氧化得到中间产物4-羟基-2,2'-二吡咯-5-甲醇(4-hydroxy-2,2'-bipyrrole-5-methanol,HBM)以及4-羟基-2,2'-双吡咯-5-甲醛(4-hydroxy-2,2'-bipyrrole-5-carbaldehyde,HBC),最后,HBC在PigF(氧甲基转移酶)、PigN(氧化还原酶)共同作用下进行甲基化,生成终产物4-甲氧基-2,2'-二吡咯-5-甲醛(MBC)[63]。
5.3 MAP与MBC的缩合反应
两个前体物质MAP与MBC的缩合反应是灵菌红素合成途径的最后一步,也是最关键一步,因此,催化该步骤的酶PigC被称为灵菌红素合成的关键酶。前人对该反应进行了反应机理的研究,PigC的两个末端序列分别与ATP的结合域和转移域序列呈现相似性[10],MBC与催化该反应的酶PigC的催化中心结合,ATP与PigC的ATP结合域结合,PigC夺取ATP的磷酸基团进攻MBC的醛基使其活化,然后,进入ATP催化中心的MAP与MBC进行缩合,生成灵菌红素[61]。
6 利用基因重组技术生产灵菌红素的发酵工艺
微生物体内灵菌红素的合成受到多种基因及复杂蛋白的调控,导致其产量比较低,加上灵菌红素对粘质沙雷氏菌具有细胞毒性,若对其进行大规模培养生产灵菌红素存在大量问题[65]。因此,近年来基因重组技术发展起来,即利用寄宿细胞进行基因重组来大规模生产灵菌红素,不仅经济安全而且更有效地合成灵菌红素。此生物学方法是将基因从原宿主细胞通过相关途径转移到寄宿细胞中继续进行表达,从DNA分子水平进行蛋白质和代谢物的大规模生产技术[4]。生物学方法已经成功地应用于很多有利于治疗疾病的生物大分子的合成,如青蒿素和萜类等物质[4]。灵菌红素是受众多基因的控制而合成的,基因重组可以通过提高灵菌红素合成过程中关键酶的活性及量,从而进一步提高灵菌红素的产量。为提高灵菌红素产量,在宿主中提高合成灵菌红素生物合成过程中需要的关键酶的表达是很关键的。YOU ZY等[66]优化了灵菌红素合成途径中关键酶PigC在大肠杆菌中的表达,他们通过优化诱导策略和培养基组分,提高了大肠杆菌产灵菌红素合成酶PigC的产率。在他们的试验中证明,自诱导是PigC生产的最佳方式,其自诱导参数为葡萄糖0.73 g/L、酵母提取物13.17 g/L和乳糖5.86 g/L,乳糖同时作为诱导剂和碳源,甘油同时作为碳源和能量来源,很大程度提高了PigC活性,达到179.3 U/mL。将粘质沙雷氏菌的pig基因群插入到假单胞菌KT2440中,得到(14±1)mg/g细胞干质量的灵菌红素产量[67]。LIU P P等[68]诱导培养了一株高产灵菌红素的天蓝色链霉菌,其最高灵菌红素产量为96.8 mg/g细胞干质量,是野生型菌株M145灵菌红素产量的12倍。还有研究在大肠杆菌中用生物学合成方法生产了5种沙雷氏菌ATCC 39006生物合成灵菌红素所需的酶(分别为PigA、PigG、PigH、PigI、PigJ)来深入研究灵菌红素合成机制[1]。KLEIN A S等[69]利用灵菌红素合成过程中PigC对MAP和MBC及两者的类似物的特异性识别特点,改变或者代替MAP及MBC的某些结构,观察PigC是否能够继续合成灵菌红素或者其衍生物,以确定PigC的底物特异性,利用菌株Pseudomonas putida KT2440合成了13种不同的具有很强的调节自噬作用的灵菌红素衍生物,进一步提高了灵菌红素类色素的应用可能性。因此,利用基因工程技术敲除或者改变抑制灵菌红素产生的基因,优化促进灵菌红素合成的基因,对灵菌红素的深入研究具有重大意义。
7 展望
灵菌红素在医学领域、食品领域、环境领域、化妆品领域以及新能源领域等各方面的应用潜能,推动着从实际应用为目的出发对灵菌红素的深入研究。而灵菌红素在实际应用首先要确保其应用的安全性,特别是食品和医学方面安全性是重中之重。灵菌红素作为食品着色剂开发还要考虑到色素的脱臭、纯化等关键问题,以保证不影响食品本来的风味。灵菌红素在其他方面的开发应用也应该考虑到相应的关键影响因素。目前,对于灵菌红素各方面的研究大多数还处在实验室研究阶段,其合成产量较低,实际应用还不够深入透彻,因此,还有很大的挖掘空间。未来可从两方面来提高灵菌红素的产量,一是结合传统的灵菌红素培养条件的优化策略以及生物学方法来生产灵菌红素,二是着重探究灵菌红素的提取纯化方法,以便为灵菌红素在更多方面的应用研究提供足够的原料,推动各行业的发展进步。
[1]GARNEAU-TSODIKOVA S,DORRESTEIN P C,KELLEHER N L,et al.Protein assembly line components in prodigiosin biosynthesis:Characterization of pigA,G,H,I,J[J].J Am Chem Soc,2006,128(39):12600-12601.
[2]STANKOVIC N,SENEROVIC L,ILIC-TOMIC T,et al.Properties and applications of undecylprodigiosin and other bacterial prodigiosins[J].Appl Microbiol Biot,2014,98(9):3841-3858.
[3]阿布都热合曼·阿布力米提,布佐日古丽·喀迪尔,吾甫尔·米吉提.灵菌红素及其应用的研究进展[J].安徽农业科学,2015,43(9):102-105.
[4]YIP C,YARKONI O,AJIOKA J,et al.Recent advancements in high-level synthesis of the promising clinical drug,prodigiosin[J].Appl Microbiol Biot,2019,103(4):1667-1680.
[5] WANG S L,NGUYEN V B,DOAN C T,et al.Production and potential applications of bioconversion of chitin and protein-containing fishery byproducts into prodigiosin:A review[J].Molecules,2020,25(12):E2744.
[6]刘同军,杨海龙,唐华.灵菌红素的研究进展[J].食品与药品,2007,9(8):47-51.
[7] DARSHAN N,MANONMANI H K.Prodigiosin and its potential applications[J].J Food Sci Tech,2015,52(9):5393-5407.
[8]PAUL T,BANDYOPADHYAY T K,MONDAL A,et al.A comprehensive review on recent trends in production,purification,and applications of prodigiosin[J].Biomass Convers Bioref,2020,DOI:10.1007/s13399-020-00928-2.
[9]CASULLO DE ARAU′JO H W,FUKUSHIMA K,TAKAKI G M C.Prodigiosin production by Serratia marcescens UCP 1549 using renewable-resources as a low cost substrate[J].Molecules,2010,15(10):6931-6940.
[10] SAKAI-KAWADA F E,IP C G,HAGIWARA K,et al.Biosynthesis and bioactivity of prodiginine analogs in marine bacteria, Pseudoalteromonas:A mini review[J].Front Microbiol,2019,10:1715.
[11] FENDER J E,BENDER C M,STELLA N A,et al. Serratia marcescens quinoprotein glucose dehydrogenase activity mediates medium acidification and inhibition of prodigiosin production by glucose[J].Appl Environ Microbiol,2012,78(17):6225-6235.
[12]STANCU M M.Effect of high growth temperature on Serratia marcescens[J].Romanian Biotechnol Lett,2020,25(1):1275-1280.
[13]ABDUL MANAS N H,CHONG L Y,TESFAMARIAM Y M,et al.Effects of oil substrate supplementation on production of prodigiosin by Serratia nematodiphila for dye-sensitized solar cell[J].J Biotechnol,2020,317:16-26.
[14]尤忠毓,王玉洁,孙诗清,等.微生物发酵法生产灵菌红素研究进展[J].生物工程学报,2016,32(10):1332-1347.
[15]徐凤宇,么乃全,高云航,等.黏质沙雷菌应用研究进展[J].畜牧与饲料科学,2012,33(5):27-29.
[16] FENG J R,HU Z,WANG H.Complete genome sequence of Hahella sp.KA22,a prodigiosin-producing algicidal bacterium[J].Mar Genomics,2019,47:100678.
[17] YOU Z Y,ZHANG S P,LIU X X,et al.Insights into the anti-infective properties of prodiginines[J].Appl Microbiol Biot,2019,103(7):2873-2887.
[18]ALIHOSSEINI F,LANGO J,JU K S,et al.Mutation of bacterium Vibrio gazogenes for selective preparation of colorants[J].Biotechnol Progr,2010,26:352-360.
[19]SURYAWANSHI R K,PATIL C D,BORASE H P,et al.Studies on production and biological potential of prodigiosin by Serratia marcescens[J].Appl Biochem Biotech,2014,173(5):1209-1221.
[20] GONDIL V S,ASIF M,BHALLA T C.Optimization of physicochemical parameters influencing the production of prodigiosin from Serratia nematodiphila RL2 and exploring its antibacterial activity[J].3 Biotech,2017,7(5):338.
[21]DANEVCˇICˇT,BORIC VEZJAK M,ZOREC M,et al.Prodigiosin-a multifaceted Escherichia coli antimicrobial agent[J].PLOS One,2016,11(9):e162412.
[22]DANEVCˇICˇT,BORICVEZJAK M,TABOR M,et al.Prodigiosin induces autolysinsinactivelygrownBacillussubtiliscells[J].Front Microbiol,2016,7(796):27.
[23]RAMINA M,SAMIRA Y Y.The role of red pigment produced by Serratia marcescens as antibacterial and plasmid curing agent[J].J Duhok U,2009,12:268-274.
[24] ARAKHA M,SALEEM M,MALLICK B C,et al.The effects of interfacial potential on antimicrobial propensity of ZnO nanoparticle[J].Sci Rep,2015,5:9578.
[25]DARSHAN N,MANONMANI H K.Prodigiosin inhibits motility and activates bacterial cell death revealing molecular biomarkers of programmed cell death[J].AMB Express,2016,6(1):50.
[26]REGOURD J,AL-SHEIKH A A,THOMPSON A.Synthesis and anti-cancer activity of C-ring-functionalized prodigiosin analogues[J].J Med Chem,2007,50(7):1528-1536.
[27]MONTANER B,NAVARRO S,PIQUÉ M,et al.Prodigiosin from the supernatant of Serratia marcescens induces apoptosis in haematopoietic cancer cell lines[J].Brit J Pharmacol,2000,131:585-593.
[28] BENNETT J W,BENTLEY R.Seeing red:the story of prodigiosins[J].Adv Appl Microbiol,2000,47:1-32.
[29]DAVIS J T.Anion binding and transport by prodigiosin and its analog[J].Anion Recogn Supramol Chem,2010,24:145-176.
[30]KAVITHA R,AISWARIYA S,RATNAVALI C M G.Anticancer activity of red pigment from Serratia marcescens in human cervix carcinoma[J].Int J Pharm Tech Res,2010,2(1):784-787.
[31]CASTRO A J.Antimalarial activity of prodigiosin[J].Nature,1967,213(5079):903-904.
[32]KANCHARLA P,SMILKSTEIN M,KELLY J X,et al.Antimalarial activity of natural and synthetic prodiginines[J].J Med Chem,2011,54(15):5296-5306.
[33] CLEMENTS T,NDLOVU T,KHAN W.Broad-spectrum antimicrobial activity of secondary metabolites produced by Serratia marcescens strains[J].Microbiol Res,2019,229:126329.
[34] HERNÁNDEZ-VELASCO P,MORALES-ATILANO I,RODRÍGUEZDELGADO M,et al.Photoelectric evaluation of dye-sensitized solar cells based on prodigiosin pigment derived from Serratia marcescens 11E[J].Dyes Pigments,2020,177:108278.
[35]WEI J,XIE X,HUANG F Y,et al.Simultaneous Microcystis algicidal and microcystin synthesis inhibition by a red pigment prodigiosin[J].Environ Pollut,2020,256:113444.
[36] ZHANG S,ZHENG W,WANG H.Physiological response and morphological changes of Heterosigma akashiwo to an algicidal compound prodigiosin[J].J Hazard Mater,2020,385:121530.
[37]CHOKSI J,VORA J,SHRIVASTAVA N.Bioactive pigments from isolated bacteria and its antibacterial,antioxidant and sun protective application useful for cosmetic products[J].Indian J Microbiol,2020,60(3):379-382.
[38]SURYAWANSHI R K,PATIL C D,BORASE H P,et al.Towards an understanding of bacterial metabolites prodigiosin and violacein and their potential for use in commercial sunscreens[J].Int J Cosmet Sci,2015,37(1):98-107.
[39] NAGPAL N,MUNJAL N,CHATTERJEE S.Microbial pigments with health benefits-a mini review[J].Trend Biosci,2011,4:157-160.
[40] GJADHAR S,MELLEM J.Isolation and characterization of a microbial pigment obtained from Serratia marcescens as a natural food colourant[J].The Annals of the University Dunarea de Jos of Galati Fascicle VIFood Technology,2019,43(1):137-154.
[41] NAMAZKAR S,AHMAD W A.Spray-dried prodigiosin from Serratia marcescens as a colorant[J].Biosci Biotech Res Asia,2013,10(1):69-76.
[42] GIRI A V,ANANDKUMAR N,MUTHUKUMARAN G,et al.A novel medium for the enhanced cell growth and production of prodigiosin from Serratia marcescens isolated from soil[J].BMC Microbiol,2004,4:11.
[43] SPITELLER P,KERN W,REINER J,et al.Aldehydic lipid peroxidation products derived from linoleic acid[J].BBA,2001,1531:188-208.
[44]WILLIAMSON N R,FINERAM P C,LEEPER F J,et al.The biosynthesis and regulation of bacterial prodiginines[J].Nat Rev Microbiol,2006,4(12):887-899.
[45]倪亮.利用中药废弃物发酵生产灵菌红素的研究[D].南京:南京中医药大学,2020.
[46] CHEN Q L,XIAN B J,YU F,et al.Enhanced production of prodigiosin by Serratia marcescens FZSF02 in the form of pigment pellets[J].Electron J Biotechn,2019,40:58-64.
[47]CHEN W C,YU W J,CHANG C C,et al.Enhancing production of prodigiosin from Serratia marcescens C3 by statistical experimental design and porous carrier addition strategy[J].Biochem Eng J,2013,78:93-100.
[48]TAO J L,WANG X D,SHEN Y L,et al.Strategy for the improvement of prodigiosin production by a Serratia marcescens mutant through fed-batch fermentation[J].World J Microbiol Biotechn,2005,21(6-7):969-972.
[49]BAR R,ROKEM J S.Cyclodextrin-stimulated fermentation of prodigiosin by Serratia marcescens[J].Biotechnol Lett,1990,12(6):447-448.
[50]BHAGWAT A,PADALIA U.Optimization of prodigiosin biosynthesis by Serratia marcescens using unconventional bioresources[J].J Genet Eng Biotechn,2020,18(1):1-9.
[51]WANG S L,WANG C Y,YEN Y H,et al.Enhanced production of insecticidal prodigiosin from Serratia marcescens TKU011 in media containing squid pen[J].Process Biochem,2012,47(11):1684-1690.
[52]NGUYEN V B,CHEN S P,NGUYEN T H,et al.Novel efficient bioprocessing of marine chitins into active anticancer prodigiosin[J].Mar Drug,2020,18(1):15.
[53]WANG S L,NGUYEN V B,DOAN T,et al.Production and potential applications of bioconversion of chitin and protein-containing fishery byproducts into prodigiosin:A review[J].Molecules,2020,25(12):2744.
[54]NGUYEN V B,NGUYEN D N,NGUYEN A D,et al.Utilization of crab waste for cost-effective bioproduction of prodigiosin[J].Mar Drug,2020,18(11):523.
[55] MAJUMDAR S,PAUL I,DEY S,et al.Biotransformation of paper mill sludge by Serratia marcescens NITDPER1 for prodigiosin and cellulose nanocrystals:A strategic valorization approach[J].Biochem Eng J,2020,164:107766.
[56]张茜莹,薛常鲁,杨进,等.工业废蛋白用于灵菌红素的发酵工艺优化[J].嘉兴学院学报,2020,32(6):136-140.
[57]胡凯.硅胶柱层析纯化灵菌红素的工艺优化及动力学研究[D].武汉:武汉工程大学,2016.
[58]KHANAM B,CHANDRA R.Comparative analysis of prodigiosin isolated from endophyte Serratia marcescens[J].Lett Appl Microbiol,2018,66(3):194-201.
[59]李子武.产灵菌红素粘质沙雷氏菌的选育及其合成机理的初步研究[D].无锡:江南大学,2012.
[60]BUNTING M I,ROBINOW C F,BUNTING H.Factors affecting the elaboration of pigment and polysaccharide by Serratia marcescens[J].J Bacteriol,1949,58(1):114-115.
[61]白腾飞,刘月芹.沙雷氏菌抗生性次级代谢产物合成机制[J].微生学杂志,2017,37(4):115-119.
[62]ZHANG F,WEI Q,TONG H,et al.Crystal structure of MBP-PigG fusionprotein and the essential function of PigG in the prodigiosin biosynthetic pathway in Serratia marcescens FS14[J].Int J Biol Macromol,2017,99:394-400.
[63] HARRIS A K P,WILLIAMSON N R,SLATER H,et al.The Serratia gene cluster encodingbiosynthesisofthe red antibiotic,prodigiosin,shows speciesand strain-dependent genome context variation[J].Microbiology,2004,150:3547-3560.
[64]WILLIAMSON N R,SIMONSEN H T,AHMED R A A,et al.Biosynthesis of the red antibiotic,prodigiosin,in Serratia:Identification of a novel 2-methyl-3-n-amyl-pyrrole(MAP)assembly pathway,definition of the terminal condensing enzyme,and implications for undecylprodigiosin biosynthesis in Streptomyces[J].Mol Microb,2005,56(4):971-989.
[65]ELKENAWY N M,YASSIN A S,ELHIFNAWY H N,et al.Optimization of prodigiosin production by Serratia marcescens using crude glycerol and enhancing production using gamma radiation[J].Biotech Rep,2017,14:47-53.
[66]YOU Z Y,ZHANG S P,LIU X X,et al.Enhancement of prodigiosin synthetase(PigC)production from recombinant Escherichia coli through optimization of induction strategy and media[J].Prep Biochem Biotech,2018,48(3):226-233.
[67]DOMROSE A,KLEIN A S,HAGE-HUISMANN J,et al.Efficient recombinant production of prodigiosin in Pseudomonas putida[J].Front Microbiol,2015,6:972.
[68] LIU P P,ZHU H,ZHENG G S,et al.Metabolic engineering of Streptomyces coelicolor for enhanced prodigiosins(RED)production[J].Sci China Life Sci,2017,60(9):948-957.
[69]KLEIN A S,DOMRÖSE A,BONGEN P,et al.New prodigiosin derivatives obtained by mutasynthesis in Pseudomonas putida[J].ACS Syn Biol,2017,6(9):1757-1765.