米曲霉(Aspergillus oryzae)属于曲霉属[1-2],主要存在于发酵食品、粮食、土壤以及腐败的有机物中,是美国食品与药品管理局和美国饲料公司协会发布的安全菌种之一[3-4]。米曲霉是一类可以产复合酶的菌种[5-7],菌丝一般由多细胞组成,能够产生丰富的蛋白酶系,包括碱性蛋白酶,中性蛋白酶和酸性蛋白酶,中性蛋白酶能耐受较高的温度[8]。由于液态深层发酵具有生长周期短、成本低、传质传热性良好、各种生化反应更为均匀的特点[9-10],而且霉菌在液态培养基中一般长势良好,产酶的效率较高[11-13],明显高于固态发酵[14-16]。因此,霉菌生产蛋白酶主要采用液态深层发酵的方法[17-18]。
香菇(Lentinula edodes)既富含蛋白质、碳水化合物、脂肪酸、维生素、膳食纤维以及矿物质等营养成分又含有多糖等多种活性成分,属于食药两用菌[19-21]。目前,我国由香菇资源开发的产品还不是很多,其中大部分被作为食材,在欧洲地区及日本等发达国家,香菇除作食材外,主要用于肽类药物以及功能食品和食品添加剂[22]。香菇残次品和加工中的下脚料作为发酵原料制作酒精[23]、葡萄酒[24]、饮料[25-26]和调味品[27]等,但是,其利用率还不高,产品的种类偏少且附加值高的产品不多[28]。对香菇残次品进行液态发酵,提高蛋白酶酶活以提高其利用率[29-30],但蛋白酶活受菌种以及发酵条件的影响[30-32]。
本研究以香菇残次品及其加工中的下脚料为主要原料,以米曲霉(Aspergillus oryzae)为菌种,采用液态发酵,以蛋白酶活为响应值,通过单因素试验及响应面试验优化米曲霉产蛋白酶的发酵条件,以期利用香菇残次品生产蛋白酶提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
香菇残次品及其加工中的下脚料:荆州市欣恺生物科技有限公司;米曲霉(Aspergillus oryzae):长江大学生命科学学院保藏。
1.1.2 试剂
葡萄糖、蔗糖、硝酸钾、硫酸铵、氯化钠、硫酸镁、磷酸氢二钾、磷酸氢二钠、磷酸二氢钠、盐酸、干酪素、氢氧化钠、茚三酮、醋酸、醋酸钠、三氯乙酸(均为分析纯):国药集团化学试剂有限公司;L-酪氨酸、L-丙氨酸(纯度均为99%):上海麦克林生化科技有限公司。
1.1.3 培养基
酪蛋白培养基[33]:干酪素4 g/L,MgSO4·7H2O 0.5 g/L,KH2PO4 0.3 g/L,FeSO4·7H2O 0.001 g/L,NaCl 1 g,ZnCl2 0.015 g/L,CaCl2·2H2O 0.005 g/L,琼脂20 g,蒸馏水溶解定容1 000 mL,pH 6.5~7.0。121 ℃灭菌25 min。
马铃薯葡萄糖琼脂(potatodextroseagar,PDA)培养基[34]:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,蒸馏水1 000 mL。121 ℃灭菌25 min。
香菇液体培养基:将香菇残次品加入6~12倍的蒸馏水,用高速匀浆机打成浆。121 ℃灭菌25 min。
1.2 仪器与设备
DL-5-C高速冷冻离心机:上海予皓科学仪器有限公司;ET-2010KA立式双门回旋摇床:金坛市亿通电子有限公司;UV-1800紫外分光光度计:日本岛津(SHIMADIU)公司;HH-4恒温水浴锅:上海蓝凯仪器仪表有限公司;BS-IE电热恒温振荡培养箱:上海精宏实验设备有限公司;HVE-50立体式高压灭菌锅:上海三申医疗器械有限公司;SPX-250B-Z生化恒温培养箱:上海博迅实业有限公司医疗设备厂;FSH-2高速匀浆机:常州亿通分析仪器制造有限公司。
1.3 方法
1.3.1 菌种活化
将米曲霉接种到酪蛋白培养基中,30 ℃恒温静置培养72 h,观察透明圈直径大小,挑出直径较大的菌落,接种到PDA斜面上,30 ℃恒温静置培养72 h。转接3次,得到蛋白酶活力较高的菌株,4 ℃条件保藏,备用。
1.3.2 孢子悬液的制备
吸取20 mL无菌水加入到米曲霉斜面试管上,用接种环将试管斜面上的孢子轻轻刮下,倒入带有4层擦镜纸的灭菌漏斗中过滤,然后将过滤的米曲霉菌液倒入盛有小玻璃珠50 mL的灭菌三角瓶中,重复3次,于30 ℃,150 r/min条件下振荡15 min,将孢子充分打散,得到米曲霉单孢子悬液。
1.3.3 米曲霉产蛋白酶发酵条件优化
单因素试验:将单孢子悬液按1%(V/V)接种于发酵培养基,30 ℃恒温发酵,考察发酵时间(1 d、2 d、3 d、4 d、5 d)、料液比(1∶6、1∶8、1∶10、1∶12(g∶mL))、初始pH值(5.5、6.5、7.5、8.5、9.5)、转速(135 r/min、155 r/min、175 r/min、195 r/min、215 r/min)对蛋白酶活力的影响。
响应面试验:在单因素试验的基础上,固定发酵时间3 d,以米曲霉蛋白酶活力(Y)为响应值,选取对结果影响较大的初始pH值(A)、料液比(B)和转速(C)作为影响因素,进行3因素3水平的响应面试验,因素与水平见表1。
表1 发酵条件优化Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken experiments for fermentation conditions optimization

1.3.4 分析检测
蛋白酶活力的测定采用商业行业标准SB/T 10317—1999《蛋白酶活力测定法》中的福林法[36];氨基酸含量测定采用茚三酮比色法[37]。蛋白酶活力定义:即每1 mL液体酶在40 ℃下,1 min水解酪蛋白产生1 μg酪氨酸所需酶量,定义为1个蛋白酶活力单位(U/mL)。
1.3.5 统计分析
采用Design-Expert 8.0.6.1软件进行Plackett-Burman试验和Box-Behnken响应面优化试验设计,运用该软件的数据分析功能进行数据分析,建立回归模型,并对建立的模型进行验证,利用Origin 8.5和SPSS 20.0软件对数据进行分析。
2 结果与分析
2.1 米曲霉产蛋白酶发酵条件优化单因素试验
2.1.1 发酵时间对米曲霉产蛋白酶活力的影响
发酵时间对蛋白酶活力的影响见图1。
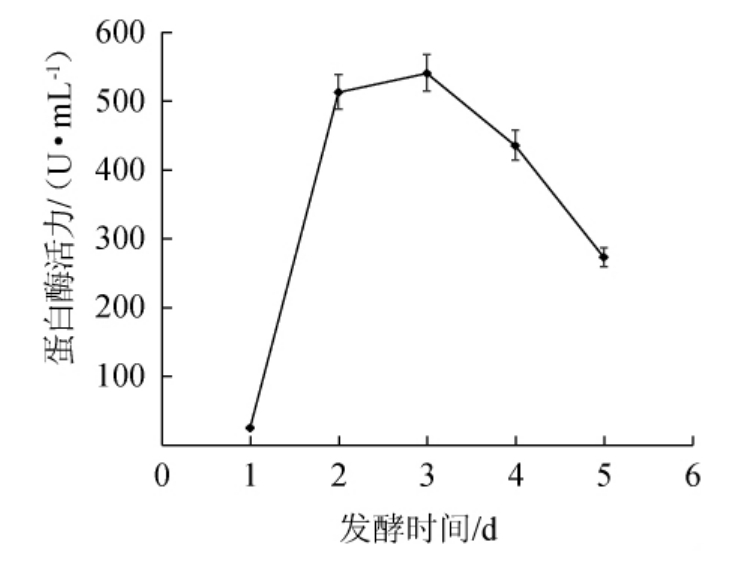
图1 发酵时间对蛋白酶活力的影响
Fig.1 Effect of fermentation time on protease activity
由图1可知,随着发酵时间在1~3 d范围内的延长,蛋白酶活力曲线呈上升趋势;当发酵时间为3 d时,米曲霉蛋白酶活力最高,为541.9 U/mL;当发酵时间>3 d之后,蛋白酶活力有所下降。分析原因可能是,在发酵前期(发酵时间3 d前),随发酵时间的延长,米曲霉处于生长旺盛期,产蛋白酶能力增强,因此米曲霉产蛋白酶活力提高。但发酵后期(发酵时间3 d后),米曲霉产生的蛋白酶用于降解香菇中蛋白质而消耗蛋白酶,因此发酵后期蛋白酶活力降低。因此,选择最佳发酵时间为3 d。
2.1.2 料液比对蛋白酶活力的影响
料液比对蛋白酶活力的影响见图2。
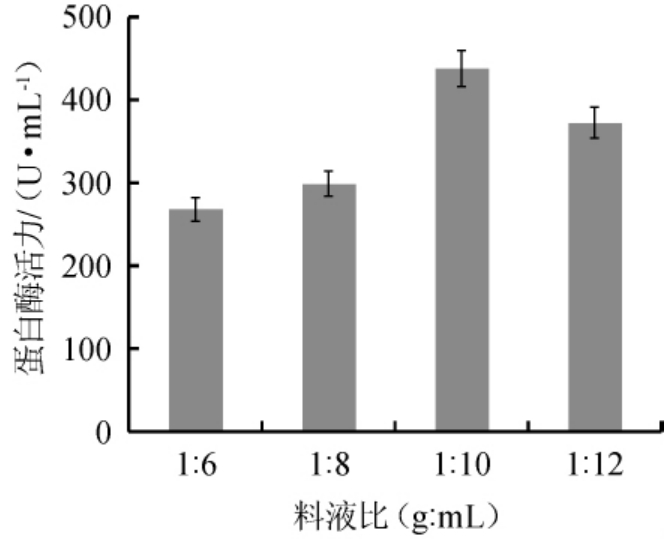
图2 料液比对蛋白酶活力的影响
Fig.2 Effect of solid and liquid ratio on protease activity
由图2可知,料液比为1∶6、1∶8、1∶10(g∶mL)时,随着液体占比的增加,发酵液中蛋白酶活力呈现增加的趋势;料液比为1∶10(g∶mL)时,培养基质中蛋白酶活力值最高;当液体占比继续增加,蛋白酶活力下降。水分是微生物生长和代谢很重要的影响因素,水分过低时,不能把香菇中的营养成分充分溶解,不利于米曲霉的生长和代谢产酶。水分过高时,溶液形成水层,不利于氧的传递,影响米曲霉的生长代谢,导致蛋白酶产量较少[38]。因此,选择最佳料液比为1∶10(g∶mL)。
2.1.3 初始pH值对蛋白酶活力的影响
初始pH值对蛋白酶活力的影响见图3。
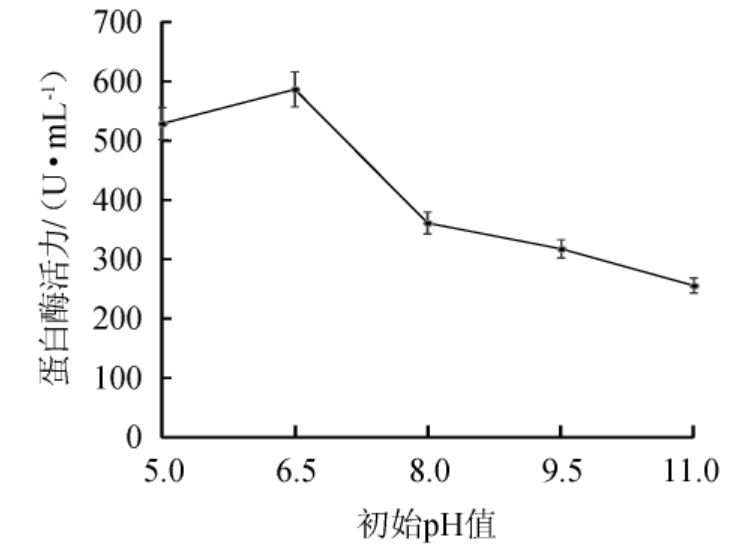
图3 初始pH值对蛋白酶活力的影响
Fig.3 Effect of initial pH value on protease activity
由图3可知,在不同的初始pH值下,米曲霉产蛋白酶的活力不同。随着培养基初始pH值在5.0~6.5范围内的增加,蛋白酶活力增加;初始pH值为6.5时蛋白酶活力最高,初始pH值为6.5~11.0时,随着初始pH值增加,蛋白酶活力逐渐降低。这说明米曲霉在偏碱性环境中对米曲霉产蛋白酶有一定的抑制作用[39]。因此,选择最佳初始pH值为6.5。
2.1.4 转速对蛋白酶活力的影响
转速对蛋白酶活力的影响见图4。
由图4可知,随着转速在135~175 r/min范围内的增加,蛋白酶活力呈快速增加的趋势;当转速为175 r/min时,蛋白酶活力值达到最大,为405.16 U/mL;当转速为175~215 r/min时,蛋白酶活力下降。可能是因为转速在135~175 r/min,发酵液溶氧量增加,有利于米曲霉的生长[40],导致米曲霉产蛋白酶酶活增加;而培养转速过高,发酵液流动剪切力不断增强,导致菌丝体结构结实紧密,不利于米曲霉的生长和代谢[41],导致米曲霉产蛋白酶酶活力降低。因此,选择最佳转速175 r/min。
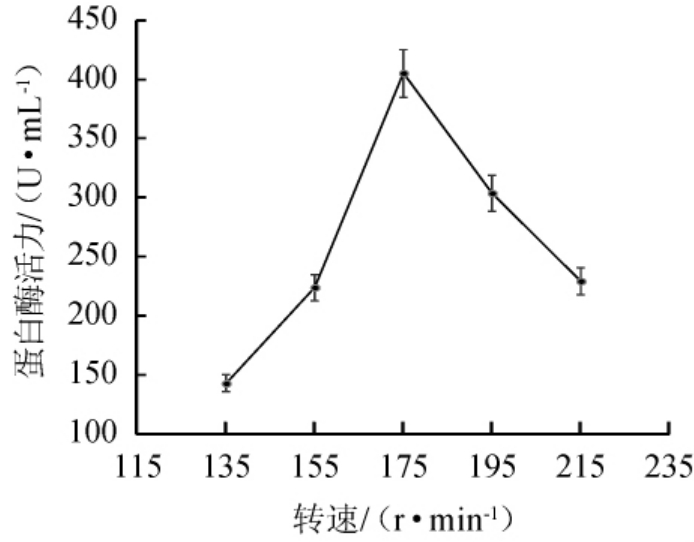
图4 转速对蛋白酶活力的影响
Fig.4 Effect of rotating speed on protease activity
2.2 米曲霉产蛋白酶发酵条件优化响应面试验
在单因素试验基础上,以初始pH值(A)、料液比(B)、转速(C)为响应因子,以蛋白酶活(Y)为响应值进行评价,采用3因素3水平响应面试验优化米曲霉产蛋白酶发酵条件,Box-Behnken试验设计及结果见表2,二次回归模型方差分析见表3。
表2 发酵条件优化Box-Behnken试验设计与结果
Table 2 Design and results of Box-Behnken experiments for fermentation conditions optimization
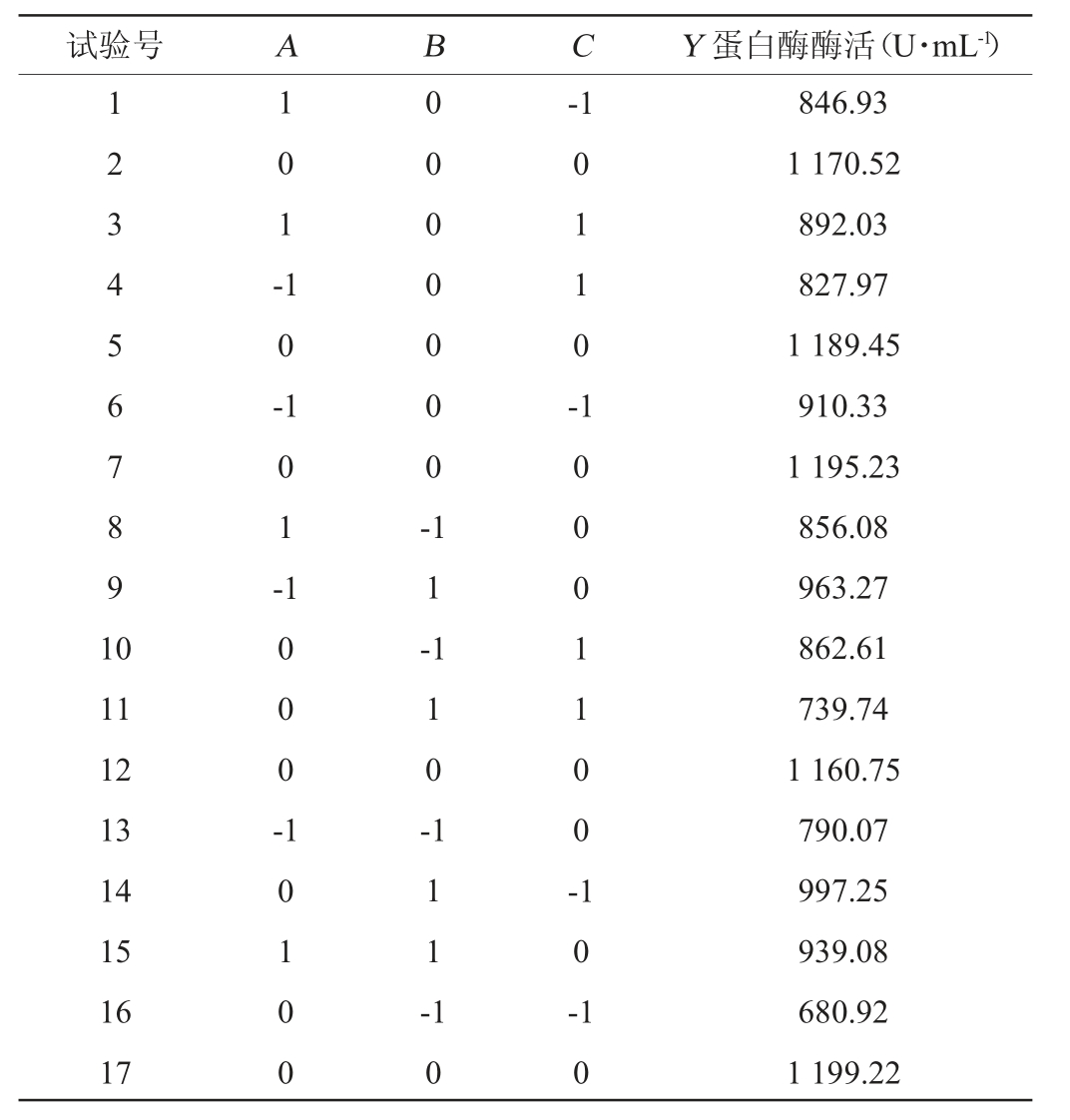
表3 回归模型方差分析
Table 3 Variance analysis of regression model
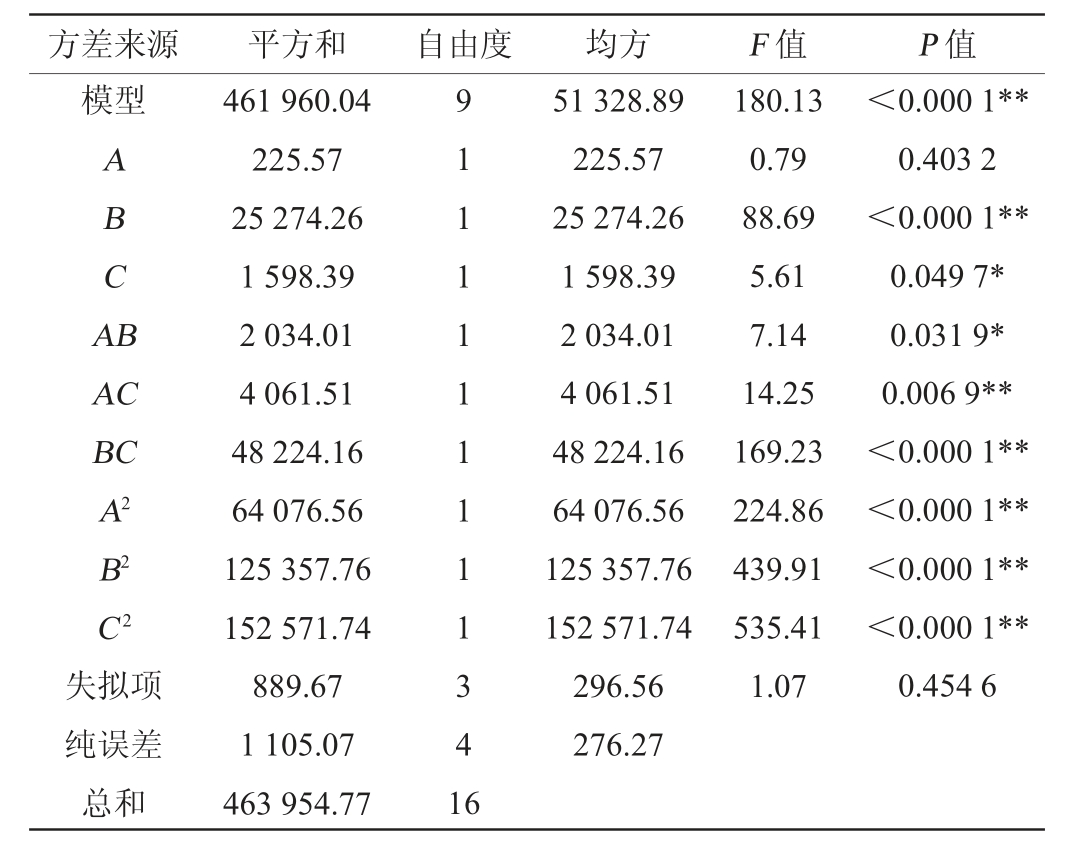
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著
(P<0.01)。
通过Design Expert 8.0.6软件对表2中的数据进行二次多项回归拟合,获得蛋白酶酶活力与初始pH值、料液比和转速的二次多项式回归方程:
Y=1 183.03+5.31A+56.21B-14.14C-22.55AB+31.87AC-109.80BC-123.36A2-172.55B2-190.36C2
由表3可知,模型P<0.000 1,表明该模型高度显著;失拟项P=0.454 6>0.05,表明失拟项不显著,该模型的拟合度良好。除一次项A对米曲霉产蛋白酶活力的影响不显著(P>0.05)外,一次项C和交互项AB对米曲霉产蛋白酶活力的影响显著(P<0.05),一次项B、交互项AC、BC以及二次项A2、B2、C2对米曲霉产蛋白酶活力影响极显著(P<0.01)。回归方程决定系数R2=0.965 6,调整决定系数![]() =0.990 2,表明此回归模型能够解释96.56%的响应变化。说明该模型拟合程度良好,试验误差小,可信度较高,可用此模型对米曲霉产蛋白酶活发酵条件进行预测。同时,确定影响米曲霉产蛋白酶活3因素顺序为B>C>A,即料液比>转速>初始pH值。
=0.990 2,表明此回归模型能够解释96.56%的响应变化。说明该模型拟合程度良好,试验误差小,可信度较高,可用此模型对米曲霉产蛋白酶活发酵条件进行预测。同时,确定影响米曲霉产蛋白酶活3因素顺序为B>C>A,即料液比>转速>初始pH值。
2.3 响应面各因素交互作用分析
各因素交互作用对米曲霉产蛋白酶活影响的响应面及等高线见图5。
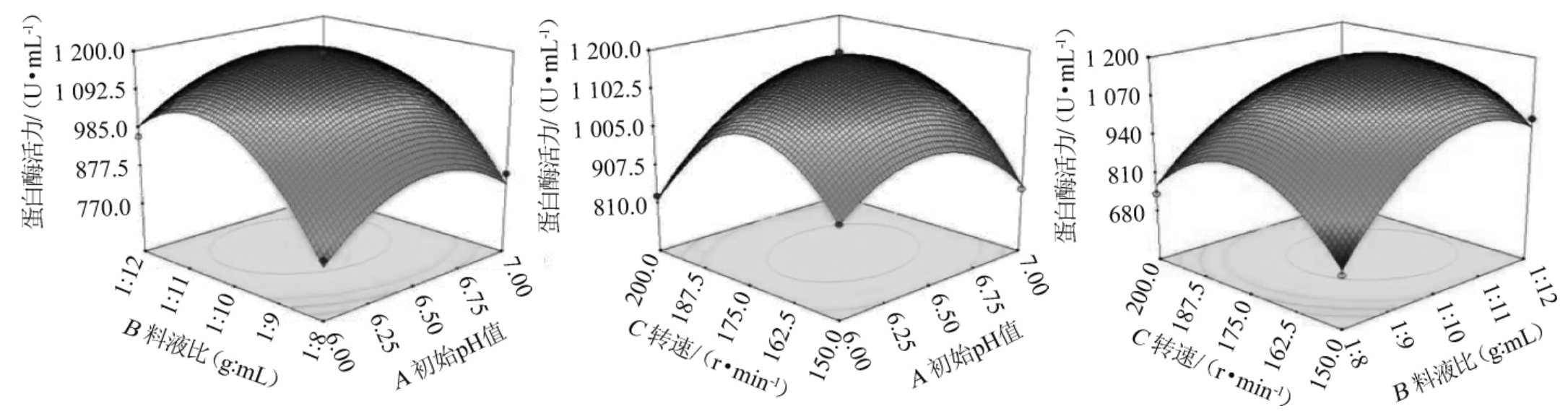
图5 各因素交互作用对米曲霉产蛋白酶酶活影响的响应面及等高线
Fig.5 Response surface plots and contour lines of effects of interaction between each factor on activity of protease produced by Aspergillus oryzae
若响应面较陡峭,说明该因素对蛋白酶酶活的影响较大;若响应面相对平缓,说明该因素对蛋白酶酶活的影响较小。由图5可知,料液比与初始pH值之间交互作用的响应面陡峭,对响应值影响显著;转速与初始pH值之间交互作用的响应面陡峭,对响应值影响极显著;料液比与转速之间交互作用的响应面最陡峭,对响应值影响极显著。这与回归模型方差分析结果一致。
2.4 验证试验
采用Design Expert 8.0.6.1软件对回归方程进行求解,最终确定米曲霉产蛋白酶活的最优发酵条件为初始pH值6.5,料液比1∶10(g∶mL),转速175 r/min,该条件下蛋白酶酶活力预测值为1 183.04 U/mL。为了验证模拟模型的准确性,采用优化后的最佳发酵条件进行3次验证试验,检测的蛋白酶活力的实际平均值为1 182.48 U/mL,与预测值相近,说明该工艺可行。
3 结论
本研究以米曲霉(Aspergillus oryzae)为菌种,对香菇残次品进行液态发酵,在单因素试验基础上,采用Box-Behnken试验方法优化米曲霉产蛋白酶活发酵条件。结果表明,米曲霉液态发酵香菇残次品产蛋白酶活最优条件为发酵时间3 d,发酵初始pH值6.5,料液比1∶10(g∶mL),转速175 r/min。在此优化条件下,蛋白酶活力实际值为1 182.48 U/mL。采用该方法优化米曲霉产蛋白酶活的发酵条件,能够提高其产蛋白酶的酶活力,为香菇残次品的综合利用提供了一定的理论依据。
[1]TANAKA M,ITO K,MATSUURA T,et al.Identification and distinct regulation of three ditripeptide transporters in Aspergillus oryzae[J].Biosci Biotechnol Biochem,2021,85(2):452-463.
[2] YOON J,KIMURA S,MARUYAMA J I,et al.Construction of quintuple protease gene disruptant for helerologous production Aspergillus oryzae[J].Appl Microbiol Biotechnol,2009,82(4):691-701.
[3]BOLUMAR T,SANZ Y,ARISTOY M.C,et al.Purification and characterisation of proteases A and D from Debaryomyces hansenii[J].Int J Food Microbiol,2008,124(2):135-141.
[4] WANG D,ZHENG Z Y,FENG J,et al.Influence of sodium chloride on thermal denaturation of a high-salt-tolerant neutral protease from Aspergillus oryzae[J].Food Sci Biotechnol,2013,22:1-7.
[5]李晶,马贵明.米曲霉菌种选育的研究进展[J].食品工程,2011(4):51-53.
[6]孙春华.米曲霉菌株诱变选育及其制剂的应用研究[D].济南:山东农业大学,2008.
[7]李诗雯.米曲霉蛋白酶系协同水解大豆蛋白的研究[D].武汉:湖北工业大学,2015.
[8]刘志伟,谭兴和,周红丽,等.米曲霉产中性蛋白酶条件的优化[J].中国酿造,2011,30(11):26-28.
[9]陈欢.秀珍菇液体菌种发酵工艺优化及应用研究[D].长沙:湖南农业大学,2019.
[10]王星凯.米酒液态发酵原料预处理及发酵条件优化[D].广州:华南理工大学,2018.
[11]艾雨晴,陈松骏,秦娟,等.微生物产蛋白酶的研究进展[J].食品工业科技,2021,42(19):454-461.
[12]胡亚兰.米曲霉发酵制备大豆粕抗菌液及其抗菌机理初探[D].广州:华南理工大学,2020.
[13]朱文优,周守叙.米曲霉产生淀粉酶菌株的诱变选育[J].中国酿造,2010,29(6):19-23.
[14]蒋爱凤,胡喜巧,李兰.米曲霉产中性蛋白酶提取与粗酶性质研究[J].河南科技学院学报(自然科学版),2011,39(2):43-48.
[15]吴琛,陈旭,李馨宁,等.米曲霉奶酪发酵剂培养条件优化[J].沈阳农业大学学报,2020,51(6):696-704.
[16]刘丹,葛予宁,徐晗,等.混菌制曲和酱渣添加对黄豆酱理化指标动态变化的影响[J].中国酿造,2020,39(7):125-130.
[17]马俊阳,诸葛斌,方慧英,等.米曲霉蛋白酶的分离纯化及酶学性质研究[J].微生物学通报,2014,41(1):83-89.
[18]宗红,冯颖杰,陆信曜,等.一种米曲霉蛋白酶的分离纯化及酶解特性研究[J].食品工业科技,2015,36(20):210-213,219.
[19]GAITÁN-HERNÁNDEZ R,LÓPEZ-PEÑA D,ESQUEDA M,et al.Review of bioactive molecules production,biomass,and basidiomata of shiitake culinary-medicinal mushrooms, Lentinus edodes (Agaricomycetes)[J]. Int J Med Mushrooms,2019,21(9):841-850.
[20]HU D H,CHEN W,LI X S,et al.Ultraviolet irradiation increased the concentration of vitamin D2 and decreased the concentration of ergosterol in shiitake mushroom(Lentinus edodes)and oyster mushroom (Pleurotus ostreatus)powder in ethanol suspension[J].ACS Omega,2020,5(13):7361-7368.
[21] HUANG Q H,QIAN X C,JIANG T J,et al.Effect of chitosan and guargum based composite edible coating on quality of mushroom(Lentinus edodes)during postharvest storage[J].Sci Hortic-Amsterd,2019,253:382-389.
[22]WANG L,HU T T,JIANG Z Q,et al.Efficient production of a novel alkaline cold-active phospholipase C from Aspergillus oryzae by molecular chaperon co-expression for crude oil degumming[J]. Food Chem,2021,350:129212.
[23]李雪玲,颜喆,胡文锋.酱油酿造优良米曲霉菌株的高效选育[J].中国调味品,2021,46(8):20-23,28.
[24]孙永林,王海燕.发酵型香菇葡萄酒酿造工艺研究[J].中国酿造,2015,34(11):167-170.
[25]陈振青,熊丹萍,王宏勋,等.香菇菌柄饮品酶法制备工艺研究[J].中国酿造,2012,31(8):13-15.
[26]骆嘉原,常晨,孙瑶,等.香菇可溶性膳食纤维饮品的研制[J].中国酿造,2017,36(3):182-187.
[27]曹世宁,陈相艳,崔文甲,等.食用菌中呈味物质的研究进展[J].食品工业,2016,37(3):231-232.
[28]杨卓.香菇柄多糖提取和体外抑癌活性的研究[D].保定:河北农业大学,2018.
[29]王振猛,江晓,孙建安,等.米曲霉固态发酵产蛋白酶酶解虾头工艺探究[J].中国渔业质量与标准,2020,10(3):19-30.
[30]樊嘉训,刘松,陆信曜,等.高产蛋白酶米曲霉菌株的选育及对酱油风味生成的影响[J/OL].食品与发酵工业:1-11[2021-08-01].https://doi.org/10.13995/j.cnki.11-1802/ts.027031.
[31]刘云鹏,尤升波,马德源,等.高产蛋白酶菌的筛选及其对螺旋藻发酵物活性的影响研究[J].食品与发酵工业,2021,47(13):140-145.
[32]洪玲.辣椒酱发酵过程中蛋白酶活性变化的研究[J].中国调味品,2019,44(9):111-115.
[33]李雪玲,颜喆,胡文锋.酱油酿造优良米曲霉菌株的高效选育[J].中国调味品,2021,46(8):20-23,28.
[34]XIONG X Q,ZHEN Z X,LIU Y B,et al.Low-frequency magnetic field of appropriate strengths changed secondary metabolite production and Na+concentration of intracellular and extracellular Monascus purpureus[J].Bioelectromagnetics,2020,41(4):289-297.
[35]殷休,袁博,刘应保,等.黑曲霉液体发酵香菇残次品产纤维素酶的培养基优化[J].中国酿造,2019,38(12):97-101.
[36]国家国内贸易局.SB/T 10317—1999 蛋白酶活力测定法[S].北京:中国标准出版社,1999.
[37]国家食品药品监督管理总局,国家卫生和计划生育委员会.GB 5009.124—2016 食品中氨基酸的测定[S].北京:中国标准出版社,2016.
[38]肖连冬,于海彦,李慧星,等.米曲霉制备麦糟蛋白肽固态发酵培养基优化[J/OL].食品工业科技:1-12[2021-08-06].https://doi.org/10.13386/j.issn1002-0306.2021040006.
[39]吴琛,陈旭,李馨宁,等.米曲霉奶酪发酵剂培养条件优化[J].沈阳农业大学学报,2020,51(6):696-704.
[40]游见明,吕开斌,曹新志.米曲霉菌株NJ132 液态发酵产孢子条件初步筛选[J].食品研究与开发,2017,38(21):177-180.
[41]刘容,孙卫东,李军委.米曲霉生产曲酸的发酵条件研究[J].广西农学报,2016,31(6):25-29.