硒是第六主族元素,以有机硒[1]和无机硒[2]两种形式存在于自然界中。无机硒主要有单质硒、硒化物、硒酸盐等,具有较强的毒性[3];有机硒主要包括硒代半胱氨酸、硒蛋氨酸、硒蛋白等,低毒或无毒[4]。硒是人体必需的微量元素,具有提高机体免疫力、抗衰老、防癌抗癌、调节维生素的吸收与消耗等功能[5]。硒缺乏严重时会导致心脏病、肌肉萎缩和人体机能的紊乱,克山病及大骨节病就是硒元素摄入不足时引起的疾病[6]。然而,摄入过多硒元素也会危害人体健康,世界卫生组织(world health organization,WHO)推荐健康成年人硒日摄入量为50 μg[7]。最传统的补硒方式是将无机硒物质—亚硒酸钠作为硒源[8]。然而,亚硒酸钠具有毒性作用和腐蚀性作用,添加的剂量过多时会危害人体健康发生中毒现象。有机硒具有很强的生物活性,对人体的毒性作用较低,人体吸收利用率高[9]。用有机硒强化硒元素是功能性食品的研究热点之一,具有广泛的市场前景,如富硒茶叶[10]、富硒大蒜[11]、富硒水稻[12]、富硒食用菌[13]和富硒酵母[14]等。
富硒酵母是将酵母放入含有无机硒(亚硒酸钠)的培养基中培养,其中一定数量的无机硒能被酵母同化为有机硒而变成富硒酵母[15]。富硒酵母具有富硒能力高、发酵条件简单、周期短、产量高等优点,补硒价值极高[16]。酿酒酵母和产朊假丝酵母因具有较高富硒能力,常被用作有机硒载体[17]。在富硒酵母的细胞膜上会存在许多有机硒,大部分物质的存在形式为硒代半胱氨酸,少部分物质为硒代蛋氨酸和非氨基形式的有机硒化合物[18]。富硒酵母自身富含丰富的蛋白质、糖类和B族维生素等营养物质,在作为补硒的有机硒源之外,还可以提供其他的营养物质。富硒酵母可以作为安全的食品添加剂进行食用[19],它对人体的毒性作用与无机硒相比危害小,副作用低[20]。尤其是在生物转化率方面,富硒酵母细胞可以将硒通过生物代谢作用进行转化,且高于无机硒的转化效率,可以作为一种天然的生物制剂品进行开发[21],食用富硒酵母产品与服用含有亚硒酸钠的无机硒产品相比,前者更具有安全有效的优点,提高人体身体健康。综合来看,把含有富硒酵母的产品作为一种良好的硒源来取代亚硒酸钠等无机硒产品,可以提高人体补硒的安全性,并且将危害风险降到最低水平。
有机硒是由富硒酵母细胞把无机硒通过生物作用转化到细胞内部的蛋白质以及多糖上面[22]。由于有机硒具有毒性小,人体吸收率高的优势,在食品应用方面可开发为功能性食品添加剂。富硒酵母硒蛋白作为一种安全、有效的高富硒来源,在未来的市场上有着广阔的应用前景[23]。本研究以实验室前期分离的高富硒酵母XJ1-3为原料,通过单因素和响应面试验优化酵母富硒蛋白提取条件,以期为酵母富硒蛋白在食品发酵工业应用提供基础的理论依据。
1 材料与方法
1.1 材料与试剂
富硒酵母菌株:库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)XJ1-3,由本实验室筛选和保藏在-80 ℃的超低温冰箱中。
发酵液培养基:葡萄糖25 g,蛋白胨25 g,酵母浸粉8 g,亚硒酸钠30 mg,水1 000 mL,pH6.0,121 ℃灭菌20 min。
体积分数90%乙醇、硫酸钠、氢氧化钠、氯化钠、碳酸氢钠(均为分析纯):北京奥博星生物技术公司。
1.2 仪器与设备
LDZX-30KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;BS 2000S 型电子天平:上海西唐生物科技有限公司;DW-86L158-80 ℃超低温冰箱:山东艾普仪器设备有限公司;B250电热恒温水浴锅:上海予卓仪器有限公司;SW-CJ-2D无菌操作台:苏洁净化设备有限公司;SPX-250B生化培养箱:常州诺基仪器有限公司。
1.3 方法
1.3.1 酵母富硒蛋白的提取工艺
富硒酵母扩培:用灭菌环从斜面培养基中挑取富硒酵母接入15 mL试管(装有9 mL发酵液培养基),30 ℃、180 r/min振荡培养23 h,按10%接种量接种富硒酵母扩培液于250 mL发酵瓶中,根据测得的生长曲线确定富硒蛋白的提取时间。
发酵:将保存的富硒酵母菌株活化后接种于发酵液培养基中,30 ℃、180 r/min摇床培养24 h。
酵母富硒蛋白提取:培养24 h的发酵液培养基在4 ℃条件下,8 000 r/min离心15 min,用去离子水反复洗涤沉淀3次,倾去上清液,冷冻干燥获得备用的富硒酵母干粉[24]。称取上述富硒酵母干粉样品1 g置于容器中,用0.10 mol/L NaOH溶液,按8∶1(mL∶g)的液料比于37 ℃条件下水浴振荡提取120 min,然后放入180 r/min摇床中37 ℃保温2 h,浸提液在4 ℃条件下8 000 r/min离心15 min,分离除去沉淀,保留上清液。
纯化:在上清液中加入饱和度为50%的硫酸铵,于磁力搅拌器上匀速搅拌3 h,4 ℃沉淀过夜。将得到的上清液在4 ℃条件下,8 000 r/min离心15 min[25]。向得到的富硒蛋白沉淀中加入适量超纯水在磷酸盐缓冲液(phosphate buffered saline,PBS)中透析除盐,经Sephadex G-75层析柱分离纯化得到酵母富硒蛋白,以酵母富硒蛋白的提取率为最终指标。
1.3.2 酵母富硒蛋白提取条件优化单因素试验
保持其他条件不变,只改变其中一个因素,分别考察NaOH浓度(0.05 mol/L、0.10 mol/L、0.15 mol/L、0.20 mol/L、0.25 mol/L),液料比(5∶1、6∶1、7∶1、8∶1、9∶1(mL∶g))、提取时间(30 min、60 min、90 min、120 min、150 min)对酵母富硒蛋白提取的影响,以酵母富硒蛋白的提取率为最终指标。
1.3.3 酵母富硒蛋白提取条件优化响应面分析试验
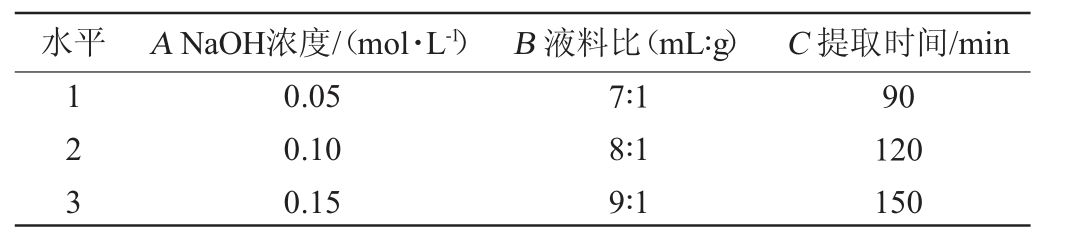
在单因素试验的基础上,以NaOH浓度(A)、液料比(B)和提取时间(C)为3个评价因素,以酵母富硒蛋白提取率(Y)为响应值,采用Box-Behnken中心组合设计原理设计响应面试验对酵母富硒蛋白提取条件进行优化[26]。响应面试验因素与水平见表1。
表1 酵母富硒蛋白提取条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for extraction conditions optimization of yeast selenium-enriched protein
1.3.4 测定方法
富硒蛋白含量的测定:采用考马斯亮蓝G-250法测定富硒蛋白,以牛血清蛋白(bovine serum albumin,BSA)标准溶液的浓度为横坐标,吸光度值为纵坐标,绘制牛血清蛋白质溶液浓度的标准曲线[27]。得到牛血清蛋白溶液浓度标准曲线:Y=5.231 43X+0.008 43,利用该回归方程计算富硒蛋白含量。
富硒蛋白提取率的计算方法:
式中:m1为浸取液中蛋白质的质量,g;m2为富硒酵母干粉的质量,g。
硒含量的测定:酵母富硒蛋白中硒含量的测定采用催化分光光度法,以硒含量作为横坐标,吸光度值作为纵坐标,绘制硒的标准曲线[28]。
1.3.5 数据处理
采用Design-Expert 8.0.6.1软件进行响应面优化试验设计,运用该软件的数据分析功能进行数据分析,建立回归模型,并对建立的模型进行验证,利用Origin 8.5和SPSS 22.0软件对数据进行分析。
2 结果与分析
2.1 酵母富硒蛋白提取条件优化单因素试验
2.1.1 NaOH浓度对酵母富硒蛋白提取的影响
NaOH浓度对酵母富硒蛋白提取的影响见图1。
由图1可知,酵母富硒蛋白提取率随NaOH浓度的增大呈先增大后减小的趋势。当NaOH浓度由0.05 mol/L增加至0.10 mol/L时,酵母富硒蛋白提取率呈上升趋势。NaOH浓度达到0.10 mol/L时,酵母富硒蛋白的提取率最大,为12.5%。NaOH浓度超过0.10 mol/L后,酵母富硒蛋白的提取率呈下降趋势。推测可能是过高浓度的NaOH溶液会使部分蛋白质发生变性。因此选择NaOH浓度为0.05 mol/L、0.10 mol/L、0.15 mol/L进行后续试验。
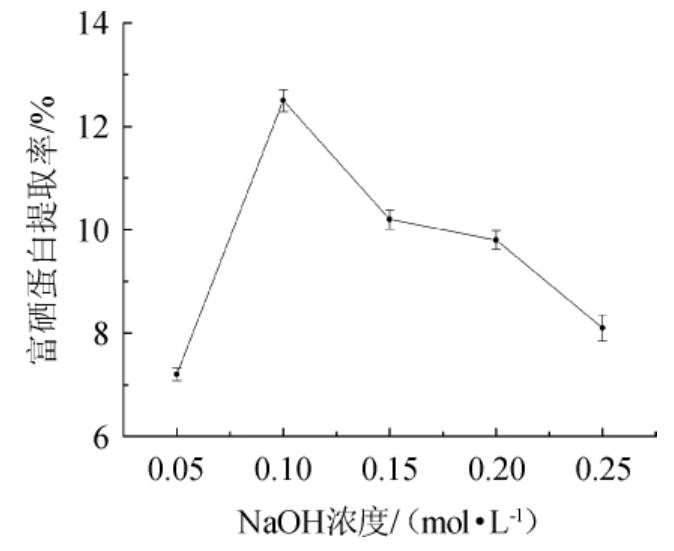
图1 NaOH浓度对酵母富硒蛋白提取率的影响
Fig.1 Effect of NaOH concentration on extraction rate of yeast selenium-enriched protein
2.1.2 液料比对酵母富硒蛋白提取的影响
液料比对酵母富硒蛋白提取的影响见图2。
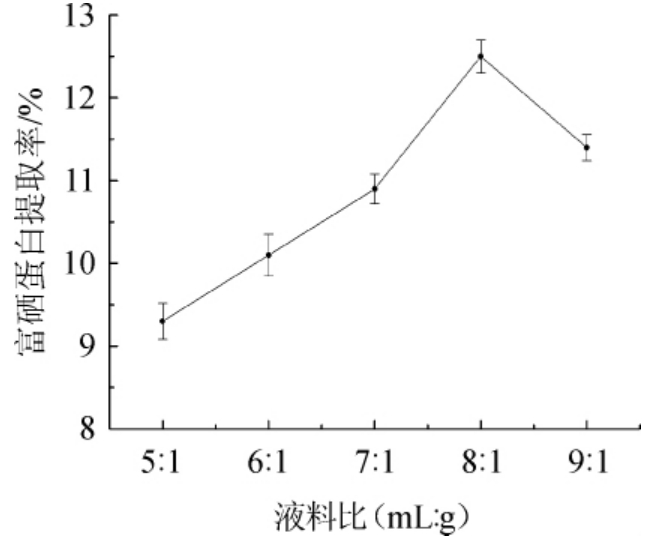
图2 液料比对酵母富硒蛋白提取率的影响
Fig.2 Effect of liquid and material ratio on extraction rate of yeast selenium-enriched protein
由图2可知,酵母富硒蛋白提取率随液料比的增大呈先增后减的趋势。当液料比由5∶1增加至8∶1时,酵母富硒蛋白提取率呈上升趋势。液料比为8∶1时,酵母富硒蛋白的提取率最大,为12.5%。液料比超过8∶1时,酵母富硒蛋白的提取率呈下降趋势。推测发生这种现象的主要原因是,氢氧化钠溶液与冷冻干燥后的富硒酵母粉末接触不完全,细胞里面的富硒蛋白还无法全部溶解出来。因此选择料液比值7∶1、8∶1、9∶1进行后续试验。
2.1.3 提取时间对酵母富硒蛋白提取的影响
提取时间对酵母富硒蛋白提取的影响见图3。
由图3可知,酵母富硒蛋白提取率随提取时间的增加呈先增大后减小的趋势。当提取时间由30 min增加至120 min时,酵母富硒蛋白提取率呈上升趋势。提取时间为120 min时,酵母富硒蛋白的提取率最大,为12.21%。提取时间超过120 min时,酵母富硒蛋白的提取率呈下降趋势。推测发生这种现象的主要原因是,由于提取的时间过短氢氧化钠溶液的浓度与富硒蛋白结合不完全,导致富硒蛋白不能够全部溶解出来,产生富硒蛋白提取率低的情况。因此选择提取时间为90 min、120 min、150 min 进行后续试验。
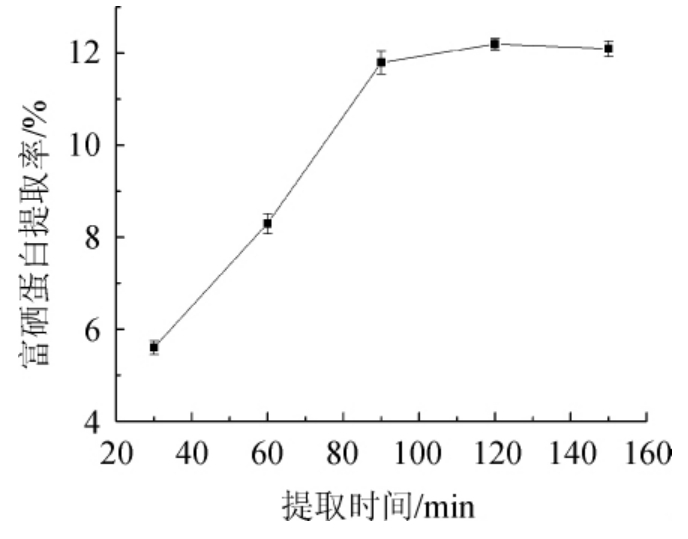
图3 提取时间对酵母富硒蛋白提取率的影响
Fig.3 Effect of extraction time on extraction rate of yeast selenium-enriched protein
2.2 酵母富硒蛋白提取条件优化响应面试验结果分析
酵母富硒蛋白提取条件优化响应面分析试验结果与分析见表2,回归模型的方差分析见表3。
表2 响应面试验设计及结果
Table 2 Design and results of response surface methodology
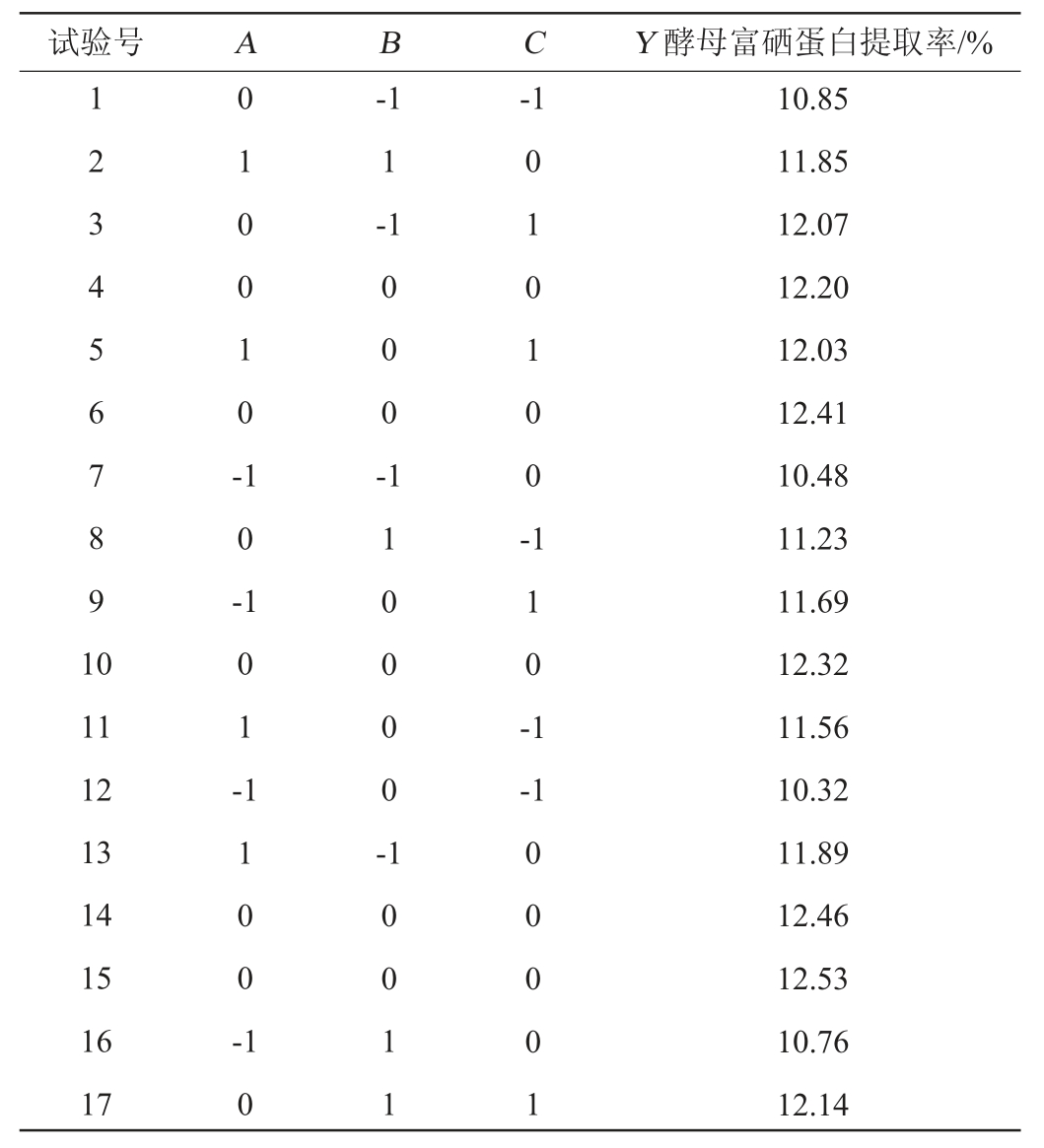
表3 回归模型的回归系数的显著性检验与方差分析
Table 3 Significant tests and variance analysis of regression coefficient of regression model
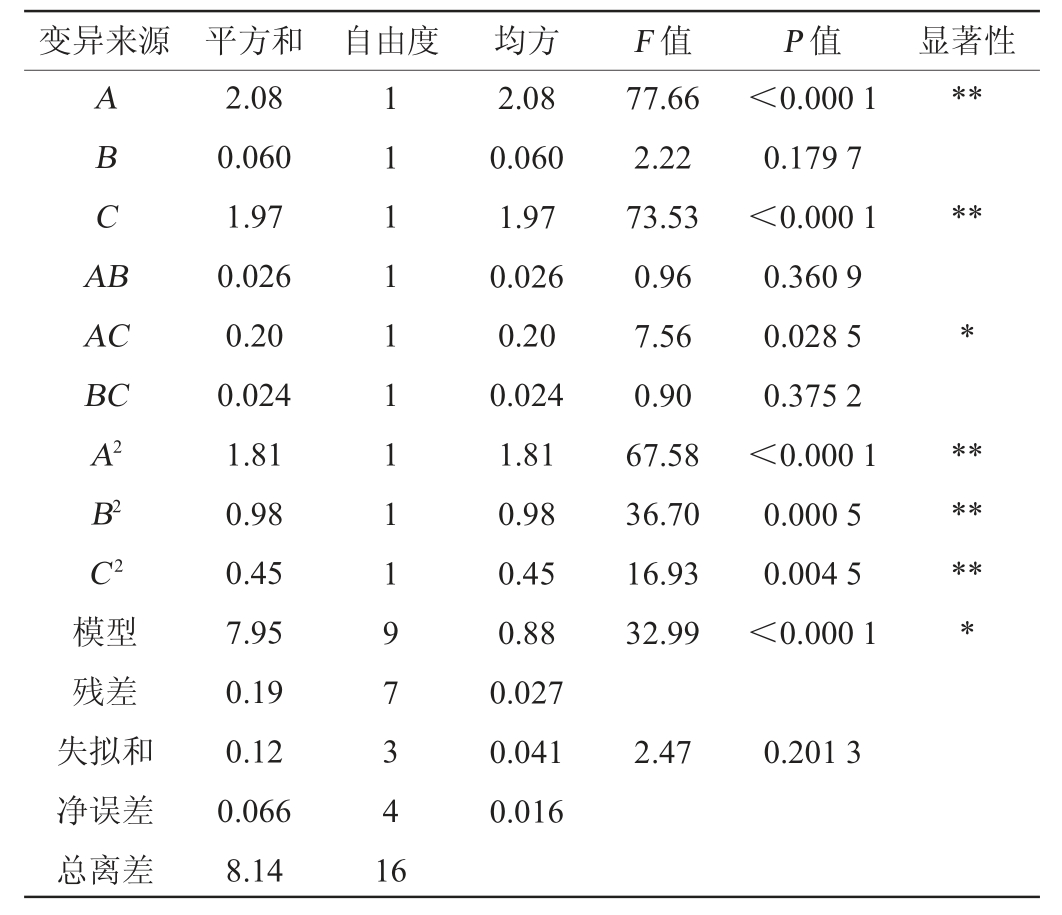
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著
(P<0.01)。
对表3的数据用Design Expert软件进行分析,进行三元二次回归方程拟合,获得的响应值为酵母富硒蛋白的提取率对编码自变量的二次项回归方程:
由回归模型方差分析结果(表3)可以看出,模型P<0.000 1说明试验所选用的二次多项模型极显著。一次项A、C,二次项A2、B2、C2对酵母富硒蛋白提取率的影响极显著(P<0.01),交互项AC对酵母富硒蛋白提取率的影响显著(P<0.05)。影响酵母富硒蛋白提取率的主次因素依次为A>C>B,即NaOH浓度>提取时间>液料比。失拟项P=0.201 3>0.05不显著,表明所建立的回归二次模型成立,调整决定系数R2Adj=0.947 3,表明可用此模型这说明该模型解释酵母富硒蛋白提取提取率有94.73%,具有可靠性,富硒蛋白的提取率变化可由虚拟模型解释。决定系数R2为0.977 0,这个数据表明响应值的实测值与预测值之间具有非常高的相关性。通过这个方差显著性分析数据能够说明Design-Expert 8.0.6软件建立的这个模型能够通过拟合值来代表真实值,响应面法的最终预测出的酵母富硒蛋白提取工艺与真实的提取工艺相近,这种预测方法具有代表性。
由图4可知,在液料比为8∶1(mL∶g)时,NaOH浓度不变,随着提取时间的延长,富硒蛋白提取率逐渐增加达到最大值。提取时间一定时,持续增加NaOH浓度,富硒蛋白提取率逐渐增加达到最大值。NaOH浓度与提取时间的交互作用影响显著,与方差分析显著性结果相一致。
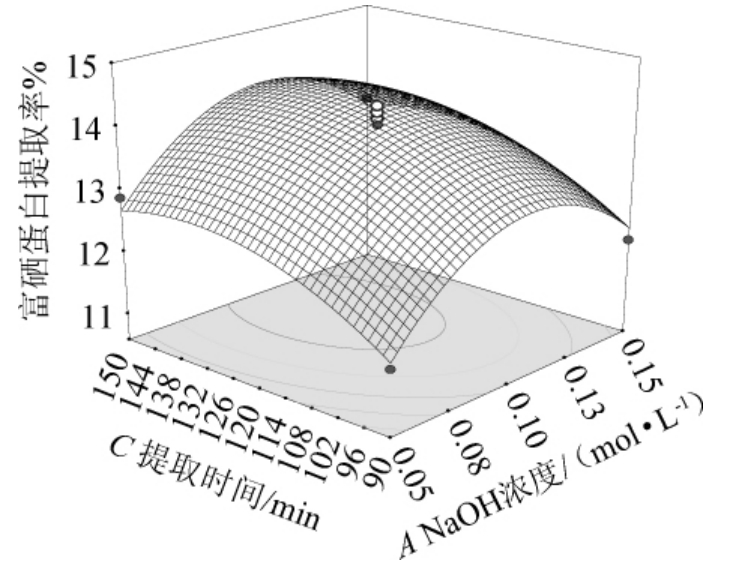
图4 NaOH浓度与提取时间交互作用对酵母富硒蛋白提取率影响的响应曲面及等高线
Fig.4 Response surface plots and contour lines of effect of interaction between NaOH concentration and extraction time on the extraction rate of yeast selenium-enriched protein
酵母富硒蛋白最佳提取工艺参数为NaOH浓度0.11mol/L、液料比为7.51∶1(mL∶g)、提取时间139.81 min。在此条件下,酵母富硒蛋白提取率理论值为12.62%。为方便实际操作,将提取工艺参数修正为NaOH浓度0.1 mol/L、液料比为7.5∶1(mL∶g)、提取时间140 min。在此条件下,实际测得的酵母富硒蛋白平均提取率实际值为12.58%,酵母富硒蛋白中硒含量为358.9 μg/g。与预测出来的理论值相接近,进一步验证了模拟出来的数学回归模型的准确性,得到的工艺参数与试验所得的数值相差不大。
3 结论
采用Box-Behnken试验设计原理,建立酵母富硒蛋白提取工艺参数的二次多项式数学模型,经检验该模型是合理可靠的,可以合理的预测提取酵母富硒蛋白的产率。提取富硒蛋白工艺参数对富硒蛋白的提取率有显著影响,影响因子的主要顺序为NaOH浓度>提取时间>液料比。酵母富硒蛋白提取优化工艺的参数为NaOH 0.1 mol/L、液料比为7.5∶1(mL∶g)、提取时间140 min,酵母富硒蛋白的提取率可达12.58%,酵母富硒蛋白中硒含量为358.9 μg/g。通过这种工艺技术,为以后富硒产品在食品添加剂,食品发酵等产业中提供一定的理论基础。
[1]ZHAO Z P,BARCUS M,KIM J.High Dietary selenium intake alters lipid metabolism and protein synthesis in liver and muscle of pigs[J].J Nutr,2016,146(9):1625-1633.
[2]朱慧,邵雷,陈代杰,等.富硒酵母中硒赋态的研究[J].工业微生物,2016,46(6):59-64.
[3]姜能座,陈剑侠.国内农产品中总有机硒的几种常用测定方法[J].福建分析测试,2017,26(5):17-22.
[4]蒲云霞.富硒酵母中硒的种态分析[D].呼和浩特:内蒙古科技大学,2008.
[5]杨善岩,李海龙,狄志鸿.硒元素生理功能及微生物富硒发酵研究现状[J].食品工业,2013,34(6):167-170.
[6]ALHASAN R,KHARMA A,LEROY P.Selenium donors at the junction of inflammatory diseases[J].Curr Pharm Design,2019,25(15):1707-1716.
[7] CARLISLE A E,LEE N,MATTHEW-ONABANJO A N,et al.Selenium detoxification is required for cancer-cell survival[J].Nat Metab,2020,2(7):603-611.
[8]陈里.强富硒酵母选育及其硒肽制备研究[D].长沙:湖南农业大学,2009.
[9] TAGHIZADEH M,HAMEDIFARD Z,JAFARNEJAD S.Effect of garlic supplementation on serum C-reactive protein level:A systematic review and meta-analysis of randomized controlled trials[J].Phytother Res,2019,33(2):243-252.
[10]黄业伟,向泽敏.安康富硒绿茶和红茶的硒含量分析[J].现代食品,2020(4):153-155.
[11]冯丽荣,许小燕,刘兵,等.青海东部富硒区大蒜硒含量及其膳食风险评估[J].青海农技推广,2016(1):22-25.
[12]张宝杰,谢春生,周丽.富硒水稻品种富硒能力研究[J].肇庆学院学报,2020,41(5):17-20.
[13]柴新义,倪瓒鹏,于士军,等.黑木耳菌丝体液体发酵富硒条件优化及其多糖抗氧化活性[J].浙江农业学报,2017,29(11):1903-1911.
[14]王菲,李梦一,叶淑红,等.富硒酵母中硒蛋白的抗氧化性质[J].大连工业大学学报,2014,33(5):325-327.
[15]刘曼西,于秀芝,孙宪洁,等.硒酵母成分的研究[J].华中工学院学报,1985(3):115-119.
[16] ZHU S,DU C D,YU T,et al.Antioxidant activity of selenium-enriched peptides from the protein hydrolysate of Cardamine violifolia [J].J Food Sci,2019,84(12):3504-3511.
[17]ZENG R,FAROOQ M U,ZHANG G,et al.Dissecting the potential of se-lenoproteins extracted from selenium-enriched rice on physiological,biochemical and anti-ageing effects in vivo [J].Biol Trace Elem Res,2020,196(1):119-130.
[18]郑娅,胡生海,何元翔.响应面法优化提纯牛肉肌红蛋白[J].甘肃农业科技,2019(11):40-45.
[19]单雪凤,张水妹,蔡智辉,等.富硒螺旋藻光谱特性及其含硒蛋白质组分析[J].分析化学,2016,44(12):1814-1819.
[20]铁梅,张崴,李晶,等.石墨炉原子吸收法测定食用菌中硒[J].光谱学与光谱分析,2006(1):151-153.
[21]岳红卫,韩富亮.酿酒酵母蛋白提取工艺优化[J].食品工业科技,2015,36(16):304-307.
[22]王爽,姜兰香,张宇,等.真菌胞内蛋白质提取方法的建立[J].吉林大学学报(医学版),2012,38(3):590-594.
[23]赵小莉,付洋,赵强,等.硫酸铵沉淀分离富硒大豆蛋白的初步研究[J].食品工业科技,2016,37(13):92-95.
[24]徐莉莎,朱家桢,冯黎黎,等.富硒长双歧杆菌水溶性蛋白保护脂多糖诱导的大鼠肠上皮细胞IEC6 损伤[J].中国药理学通报,2019,35(9):1274-1278.
[25]黄业伟,向泽敏.安康富硒食用菌和魔芋产品的硒含量分析[J].食品安全导刊,2020(9):128.
[26]高二东,董文宾.紫阳富硒茶中硒蛋白的提取[J].食品工业,2012,33(4):37-40.
[27]张卓,赵萍,郭健,等.富硒花生中含硒蛋白的提取及其抗氧化性的研究[J].食品工业科技,2012,33(4):323-326.
[28]司武阳,张临颍,杨希,等.富硒酿酒酵母筛选及其富硒蛋白研究[J].食品安全导刊,2015(9):104.