霉菌在侵染粮食谷物的过程中可产生各种真菌毒素,其种类很多,可达几百种,同时化学性质比较稳定,是目前全球范围普遍关注的一种食品有害物[1-3]。农作物中的霉菌污染无处不在,真菌毒素是霉菌的次生代谢产物,是霉菌生长所导致的一个重要结果[4-5],真菌毒素可能产生于粮食生长、加工、贮藏等各个环节[6],真菌毒素不仅有肝细胞毒性、生殖絮乱、中毒性肾损伤及免疫抑制等作用,还会致癌、致畸、致突变[7-8]。世界上多数国家都制定了严格的真菌毒素限量标准以保证食品及其相关制品的安全。
白酒是一种快速消费品,广受国人的喜爱,其制作方式为将主要原料高粱,糖化发酵剂酒曲、酒母,经过粉碎、蒸煮、糖化、发酵蒸馏最后获得。在白酒的生产制作过程中,来自于原料、酒曲及其生产环境的各种霉菌不仅产生酶、香气和糖化淀粉,部分有害霉菌还会产生对人体有害的初级代谢产物或次级代谢产物,即真菌毒素[9]。
真菌毒素含量的检测方法可分为两大类,分别是快速检测和确证检测[10]。快速检测方法有酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)[11]、荧光定量试纸卡法[12]、适配体传感器法[13]和胶体金试纸条法[14]等,这些方法检测过程简单、快速,但是有时会出现假阳性和假阴性,并且无法准确定量。确证检测方法有液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry,LCMS/MS)和高效液相色谱法(high performance liquid chromatography,HPLC)等,其中LC-MS/MS具有准确性好、分辨率高、灵敏度高、检出限低等优点。李觅等[15]采用酶联免疫吸附法对浓香型白酒生产过程中的各种样品(大曲、酒醅、丢糟、黄水、基酒、成品酒)中的黄曲霉毒素B1、赭曲霉毒素A和桔霉素进行了定量分析。结果表明,黄曲霉毒素B1和赭曲霉毒素A在大曲、酒醅、丢糟和黄水中都有检出,在基酒和成品酒中的含量未达到检出水平;桔霉素在6种样品中均未检出。叶光斌等[16]采用ELISA试剂盒法对泸州老窖生产酿造过程中的大曲、酒醅、丢糟、黄水、基酒及成品酒中的赭曲霉毒素A的含量进行检测,结果表明,大曲、酒醅、丢糟、黄水中均有检出,但是含量远低于国内外食品行业的限量标准,而基酒、成品酒中并未检出。庞晓娜等[17]结合白酒产品工艺,分别采用酶联免疫法和高效液相色谱-串联质谱(high performance liquid chromatography-tandemmass spectrography,HPLC-MS/MS)法对大曲及白酒生产中的酒醅、酒糟、基酒中进行了黄曲霉毒素B1的检测,结果显示,大曲、酒醅和酒糟中有黄曲霉毒素B1检出,但是基酒中未检出。韩现文[9]采用高效液相色谱(HPLC)法研究了蒸馏对酒醅中三种真菌毒素(黄曲霉毒素B1、赭曲霉毒素A、脱氧雪腐镰刀菌烯醇)的影响,结果显示,在蒸馏后的酒醅中检出了这些真菌毒素,但在蒸馏酒中未检出这三种真菌毒素。李晓颀等[18]建立了超高效液相色谱-串联质谱测定白酒中黄曲霉毒素总量(G2、G1、B2、B1)的检测方法,但是此研究只涉及到4种常见的真菌毒素。任璐等[19]在GB 5009.22—2016《食品安全国家标准食品中黄曲霉毒素B族和G族的测定》方法1的基础上进行了方法优化、改进,建立了酿酒原料及白酒中黄曲霉毒素B1的同位素稀释液相色谱-串联质谱法。宫小明等[20]建立了葡萄酒中赭曲霉毒素A的实时直接分析-串联质谱方法。汪琼等[21]研究了液相色谱-质谱法测定啤酒中3种伏马毒素的可行性。
上述研究涉及到的酒及酒的生产原料中的真菌毒素检测种类较少,而实际生产中,以粮食作为原料的酿酒过程受到的真菌毒素污染种类众多,本研究采用超高效液相色谱-串联质谱建立白酒生产原料酒醅中31种真菌毒素的检测方法,以期为白酒生产过程中真菌毒素的监测提供前处理简单、检测过程用时较短、结果准确的检测方法。
1 材料与方法
1.1 材料与试剂
酒醅样品:某白酒企业,取10个批次。
31种真菌毒素标准品:坛墨质检科技股份有限公司;乙腈、甲醇、乙酸铵和甲酸(色谱纯):美国Fisher公司;0.22 μm尼龙滤膜:天津博纳艾杰尔公司。
1.2 仪器与设备
Acquity-Xevo TQ超高效液相色谱-串联三重四级杆质谱仪、Acquity UPLC BEH RPC18色谱柱(100 mm×2.1 mm,1.7 μm)、Masslynx色谱质谱工作站:美国Waters公司;NEVAP-12氮吹浓缩仪:美国Organomation Associates有限公司;TGL-16M高速冷冻离心机:长沙湘智离心机仪器有限公司;UMV-2多管涡旋混合器:北京优晟联合科技有限公司;明澈-D24UV实验室超纯水系统:默克化工技术(上海)有限公司。
1.3 方法
1.3.1 标准品溶液的制备
分别取31种适量真菌毒素标准品,用乙腈配制成质量浓度为100 mg/L的标准储备液;分别取适量标准储备液,用乙腈配制成质量浓度为1 mg/L的31种真菌毒素混合标准溶液;用乙腈稀释,配制一系列混合标准工作液,质量浓度分别为1 μg/L、5 μg/L、50 μg/L、100 μg/L、250 μg/L。
1.3.2 样品前处理
样品前处理使用QuEChERS(quick,easy,cheap,effective,rugged,safe)法[22-24]。本研究参考赵英莲等[25]的方法,除使用N-丙基乙二胺(primary secondary amine,PSA)粉外,还加入了石墨炭黑粉(graphitized carbon black,GCB)、十八烷基硅烷键合硅胶粉(C18)和硫酸镁(MgSO4),通过改变4种试剂的用量配比,极大地改善了样品净化效果。
称取粉碎并过50目分样筛后的酒醅样品约2 g,置于50 mL离心管中,将乙腈与1%的甲酸水以85∶15(V/V)混合,用于提取样品中的真菌毒素。将样品在20 mL提取溶剂中匀浆2 min,振摇20 min,于6 000 r/min离心10min,吸取上清液10 mL至离心管中,加入2 g QuEChERS法混合填料(45 mg GCB+225 mg PSA+450 mg C18+1 350 mg MgSO4),涡旋混匀5 min,于8 000 r/min离心10 min,取上清液2 mL于40 ℃氮气(N2)吹至约近干,加入体积分数20%的甲醇水溶液稀释至1 mL,设置超声波清洗机水温为20 ℃,超声功率为240 W,超声振荡5 min,过0.22 μm微孔滤膜,放入自动进样器样品瓶中进行后续的分析。
1.3.3 仪器条件
高效液相色谱:流动相A为0.1 mmol/L乙酸铵溶液,B为甲醇溶液,流动相中均含0.1%甲酸;色谱柱Acquity UPLC BEH RPC18(100 mm×2.1 mm,1.7 μm);柱温40 ℃;进样体积10 μL;流速0.4 mL/min;梯度洗脱程序:0~2.0 min,90%A;2.0~10.0 min,90%A~30%A;10.0~10.1min,30%A~10%A;10.1~12.0 min,10%A;12.0~12.1 min,10%A~90%A;12.1~15.0 min,90%A。
质谱:霉酚酸、交链孢酚单甲醚玉米赤霉烯酮、玉米赤霉酮、α-玉米赤霉烯醇、β-玉米赤霉烯醇、α-玉米赤霉醇和β-玉米赤霉醇采用电喷雾负离子(negative electrosprayionization,ESI-)模式,其他目标真菌毒素为电喷雾正离子(positive electrospray ionization,ESI+)模式;毛细管电压:ESI+为3000V,ESI-为1500V;脱溶剂温度450℃;离子源温度150℃;脱溶剂气N2,流速为900 L/h;锥孔气(N2)流速为50 L/h;采用多反应监测(multiple reaction monitoring,MRM)模式检测。
定性、定量:根据保留时间定性,采用外标法定量。
2 结果与分析
2.1 质谱条件优化
流动相为50∶50(V/V)的甲醇和水(甲酸0.1%),流速为0.3 mL/min,将超高效液相色谱与质谱的连接模式调至为combine,将真菌毒素的标准物质溶液注入质谱。
2.1.1 优化母离子
关闭碰撞气,进入MS-SCAN模式寻找母离子,正电离模式下加合方式为[M+H]+或[M+NH4]+,负电离模式下加合方式为[M-H]-。以5 V为步进手动优化锥孔电压,使目标物的母离子响应值达到最高。
2.1.2 优化子离子
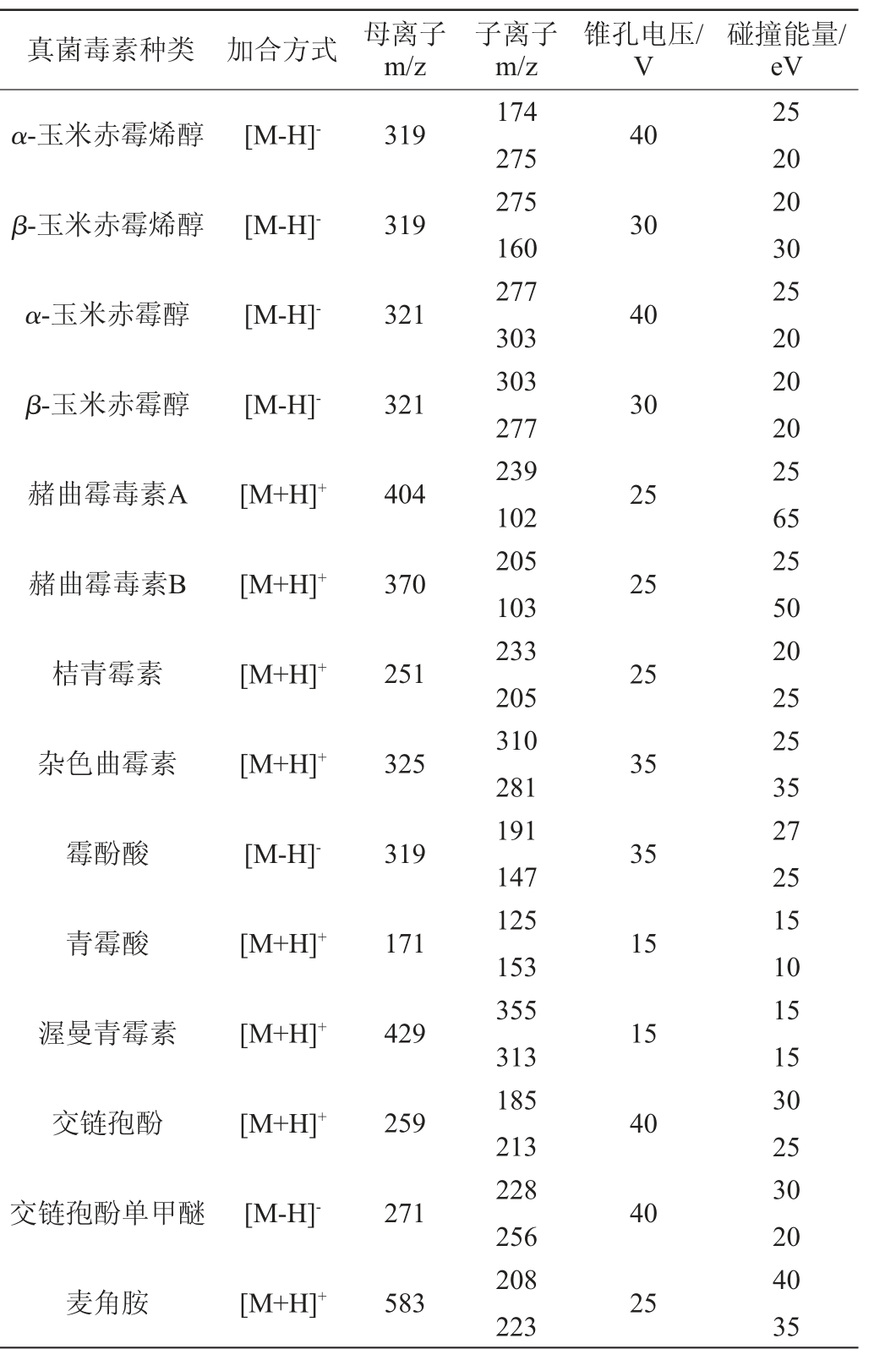
打开碰撞气,进入MS/MS模式对母离子进行MRM子离子扫描,手动优化碰撞能量获得子离子峰,选择信噪比较高的两个子离子分别作为定量和定性离子。31种真菌毒素的母离子、子离子、锥孔电压、碰撞能量等参数见表1。
表1 31种真菌毒素的质谱条件参数
Table 1 Mass spectrometry condition parameters of 31 mycotoxins
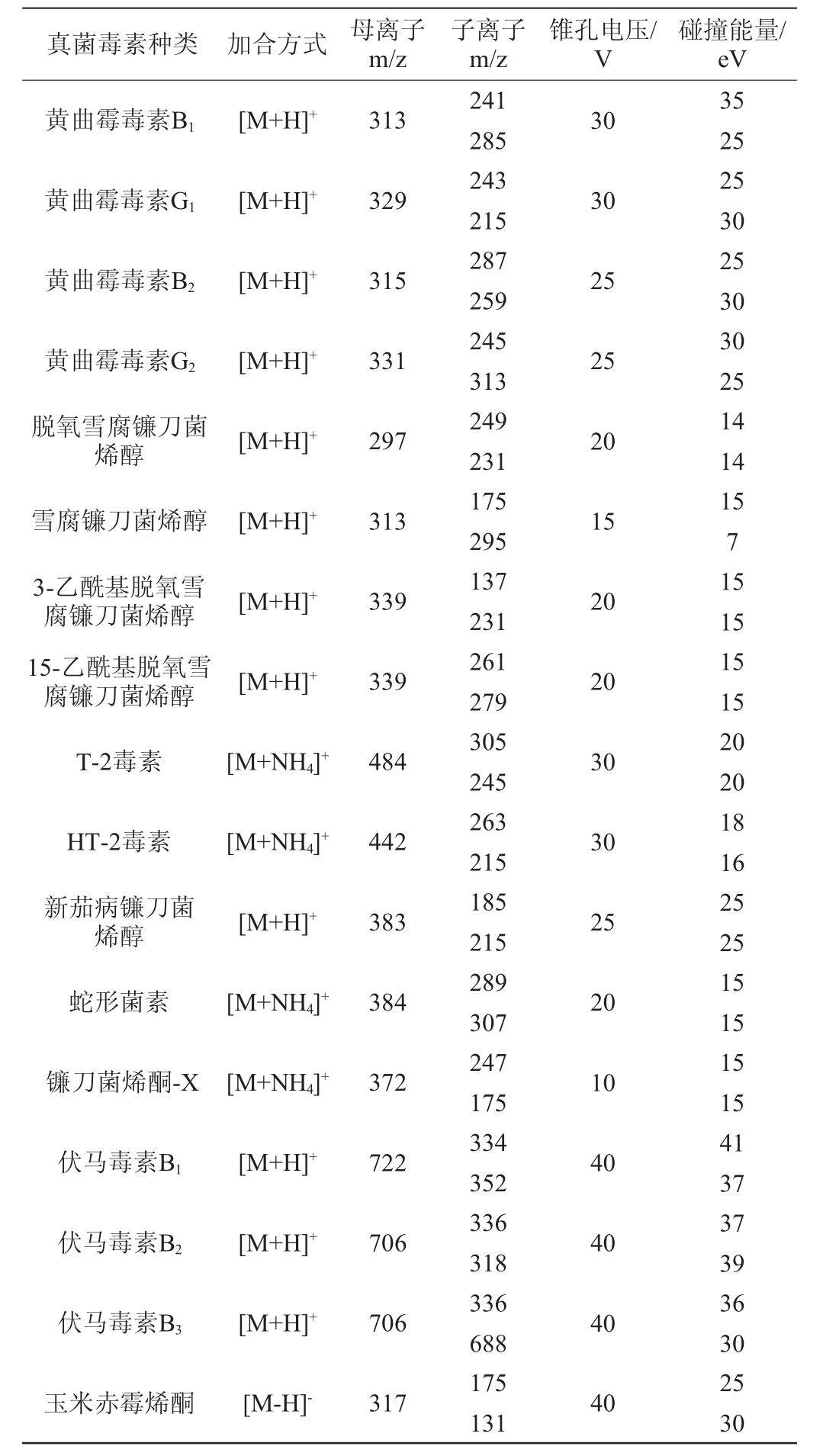
续表
2.2 标准工作曲线和检出限、定量限
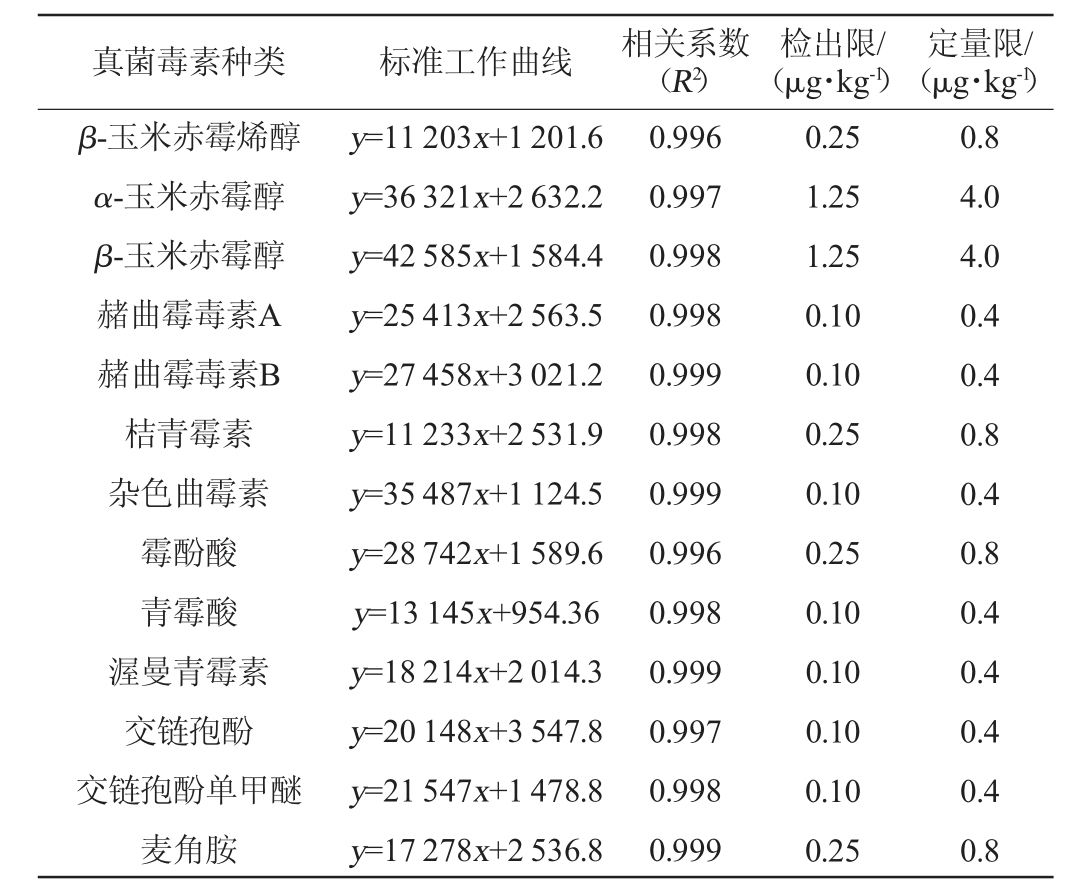
以目标化合物定量离子的峰面积为纵坐标,质量浓度为横坐标,建立了31种真菌毒素的标准工作曲线,以定性通道的3倍信噪比(S/N)确定化合物的检出限(limit of detection,LOD),以定量通道的10倍信噪比(S/N)确定化合物的定量限(limit of quantitation,LOQ),结果见表2。由表2可知,31种真菌毒素的线性关系良好,相关系数(R2)在0.991~0.999之间。检出限和定量限分别为0.10~5.00 μg/kg和0.4~16.5 μg/kg。
表2 31种真菌毒素的标准工作曲线、相关系数、检出限和定量限
Table 2 Standard working curves,correlation coefficients,detection and quantitation limits of 31 mycotoxins
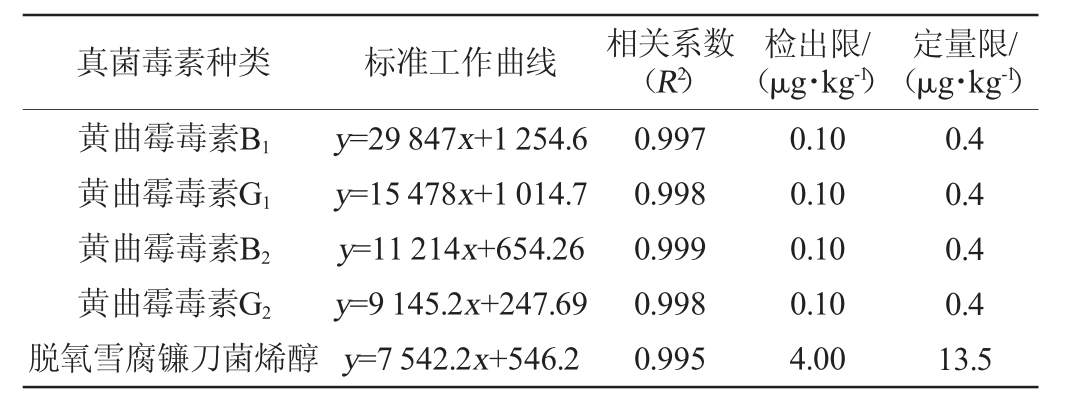
续表
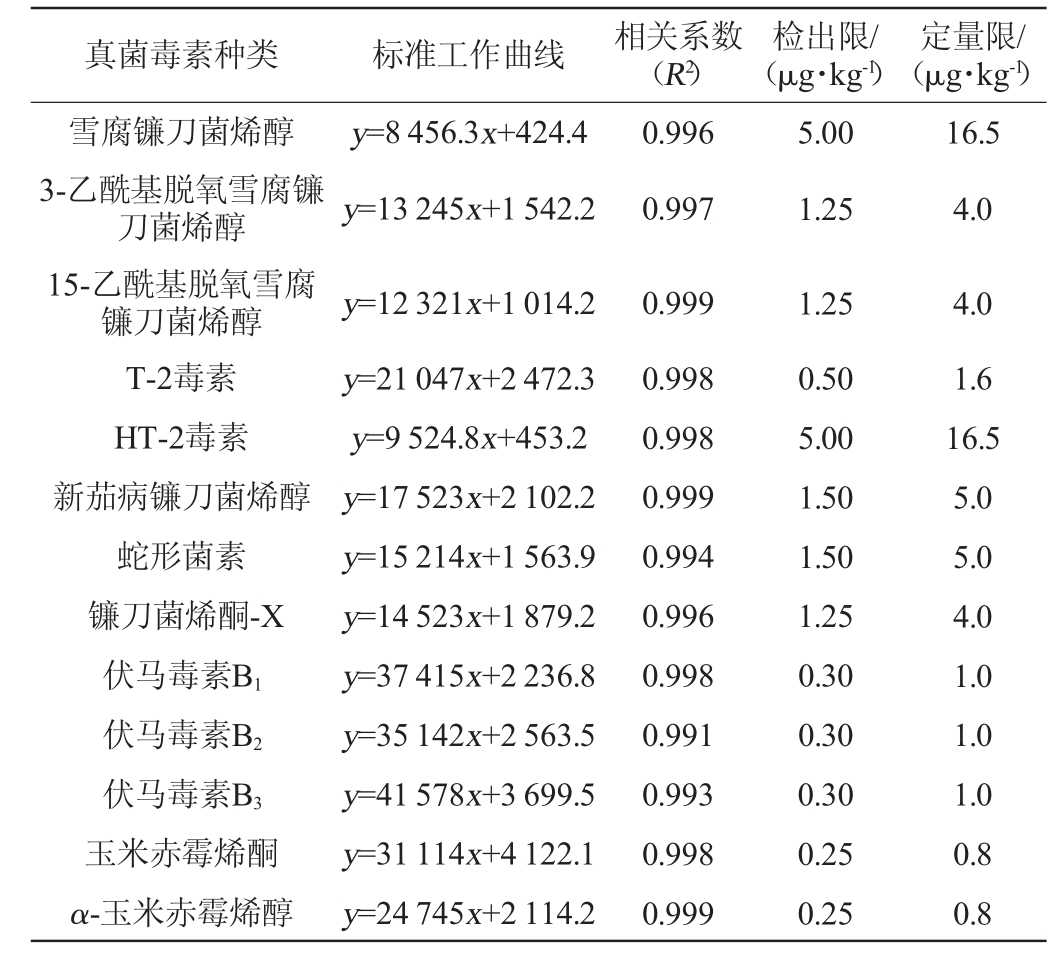
续表
2.3 回收率和精密度实验
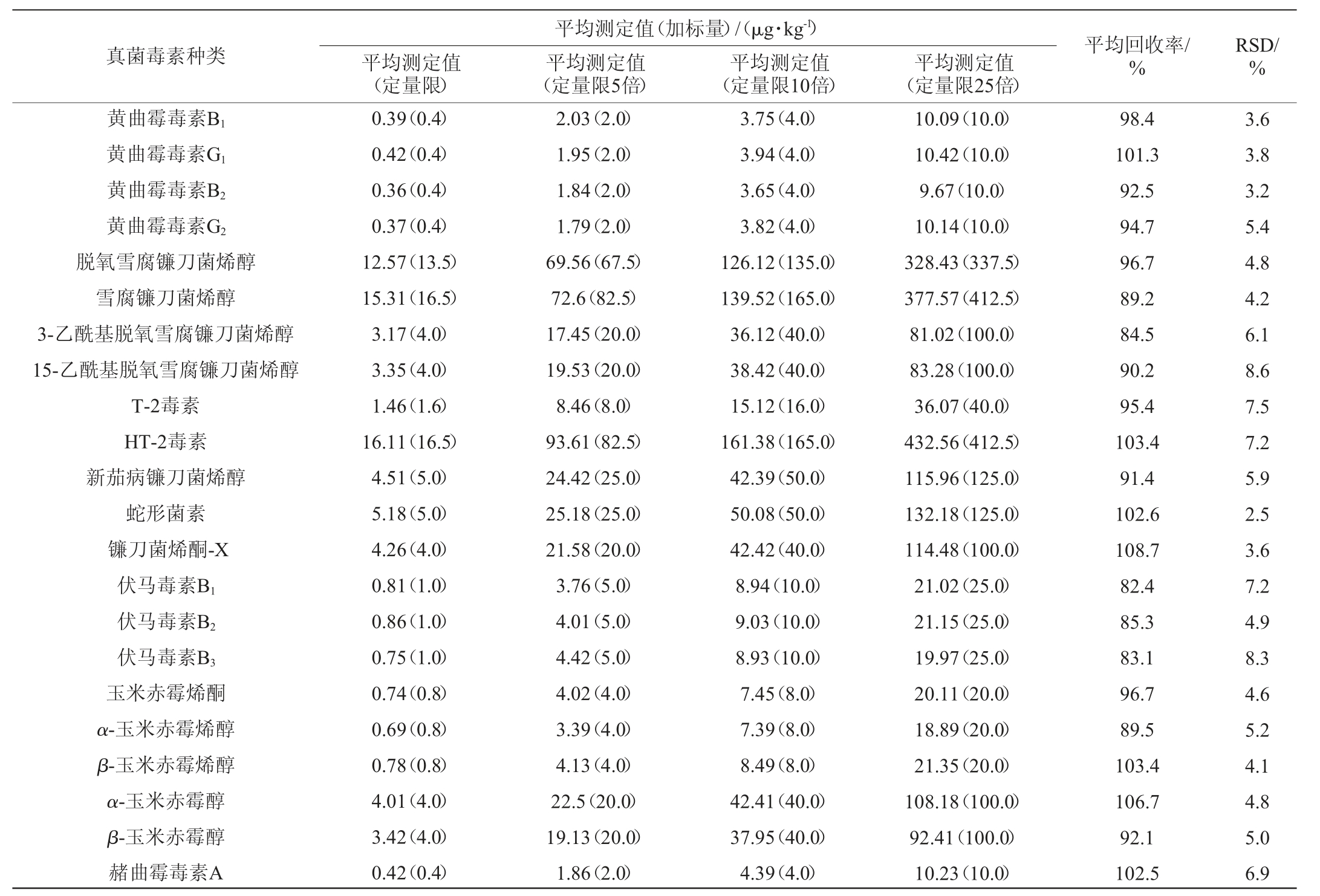
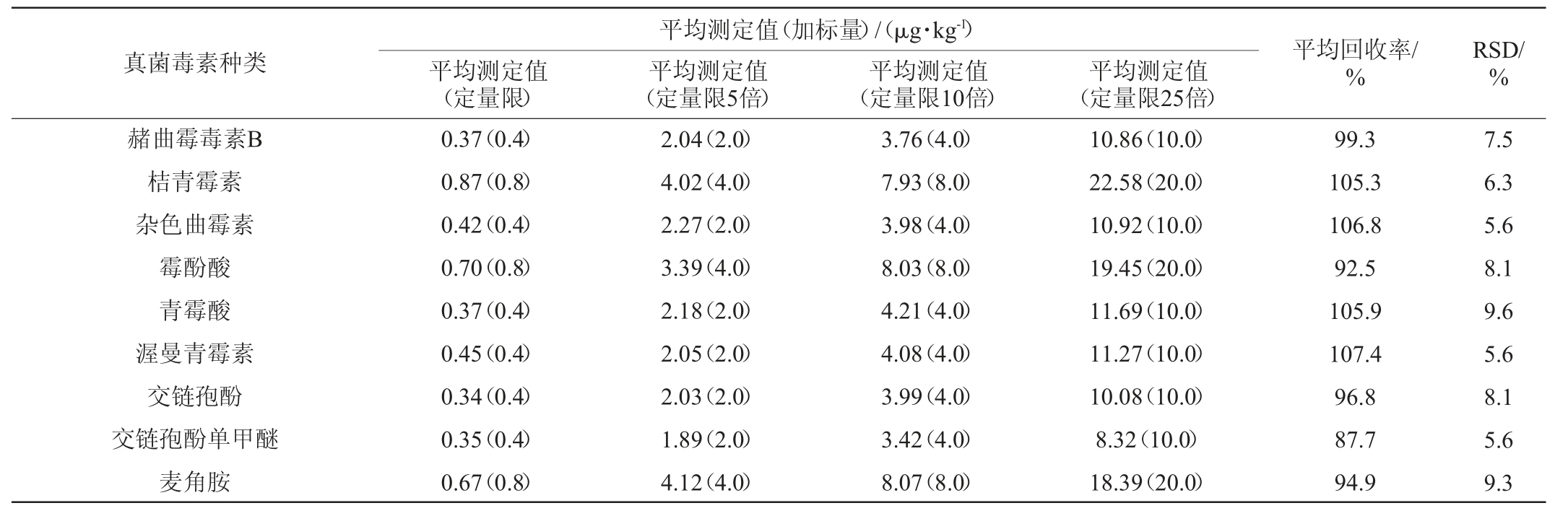
取酒醅空白样品,做4个质量浓度的加标回收试验,浓度分别为方法定量限及定量限5倍、10倍和25倍,每个浓度做5个平行,平均回收率和相对标准偏差见表3。由表3可知,真菌毒素在4个添加质量浓度下的平均回收率为83.1%~108.7%,回收率实验结果的相对标准偏差(relative standard deviation,RSD)在2.5%~9.6%之间。
表3 31种真菌毒素的回收率
Table 3 Recovery rates deviations of 31 mycotoxins
续表
2.4 样品测定
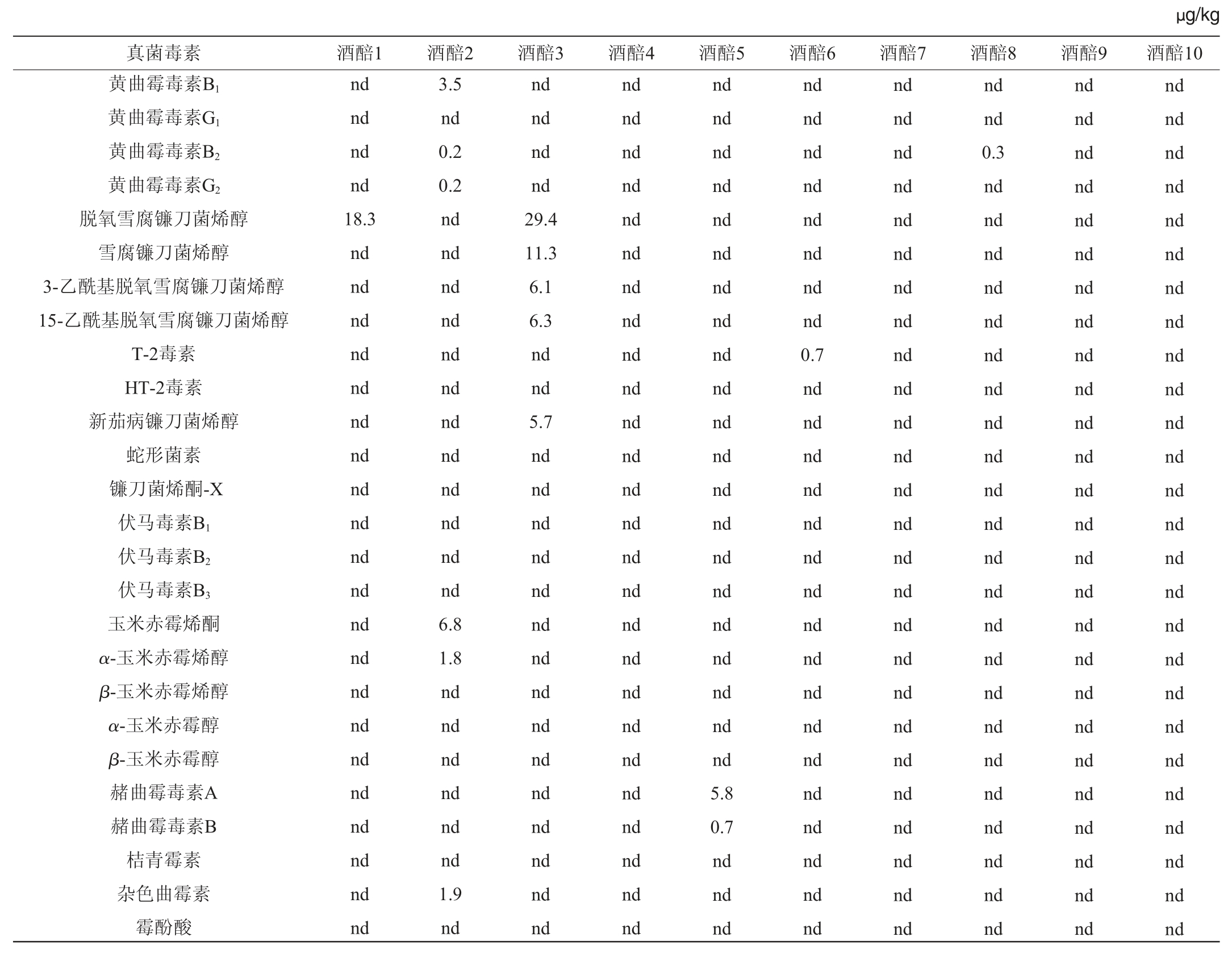
利用所建方法对10个酒醅样品进行检测,测定结果见表4。其中粮食中常见的黄曲霉毒素、脱氧雪腐镰刀菌烯醇及其衍生物、玉米赤霉毒素、赭曲霉毒素均有检出,而伏马毒素、桔青霉素、霉酚酸、青霉酸、渥曼青霉素、交链孢酚、交链孢酚单甲醚、麦角胺等在样品中未检出。编号为4、7、9、10的样品无一种真菌毒素检出,编号为1、5、6、8的样品有1~2种真菌毒素检出,而2号和3号样品中分别检出5种、6种真菌毒素。
表4 酒醅样品中真菌毒素的检测结果
Table 4 Detection results of mycotoxins in fermented grains samples
续表
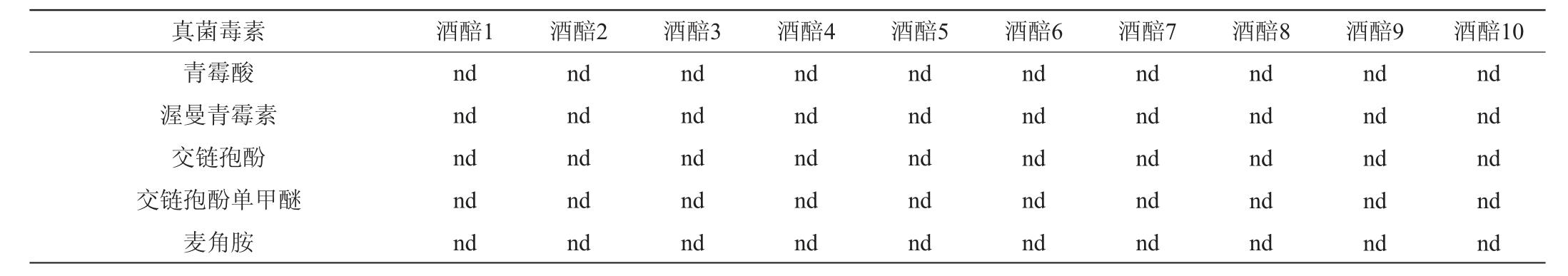
注:“nd”为未检出。
3 结论
本研究建立了白酒生产原料中31种真菌毒素含量的LC-MS/MS法,其检测范围覆盖了常见的粮食作物中的真菌毒素及其相关代谢产物。本方法采用外标法定量,相关系数R2在0.991~0.999之间,标准曲线线性关系良好;平均回收率为83.1%~108.7%,回收率实验结果的RSD为2.5%~9.6%;检出限为0.1~5.0 μg/kg;定量限为0.4~16.5 μg/kg,可满足白酒生产过程中原料的检测要求。
本研究对随机采样的10个酒醅样品进行了31种真菌毒素检测。其结果表明同一样品会受到不同种类霉菌的侵染,从而检出多种真菌毒素,同时在粮食污染中常见的真菌毒素,例如:黄曲霉毒素、玉米赤霉毒素、赭曲霉毒素在酒醅中存在。本研究检测真菌毒素的范围更广,种类更多,发现除去常见的真菌毒素,还有T-2毒素、雪腐镰刀菌烯醇、3-乙酰基脱氧雪腐镰刀菌烯醇、15-乙酰基脱氧雪腐镰刀菌烯醇、杂色曲霉素等毒素的检出,而关于31种真菌毒素是否会从酒醅中迁移至白酒中还有待进一步研究。
[1] CAO X Q,WU S C,YUE Y,et al.A high-throughput method for the simultaneous determination of multiple mycotoxins in human and laboratory animal biological fluids and tissues by PLE and HPLC-MS/MS[J].J Chromatogr B Anal Technol Biomed Life Sci,2013,942-943:113-125.
[2]TURNER N W,BRAMHMBHATT H,SZABO-VEZSE M,et al.Analytical methods for determination of mycotoxins:An update(2009-2014)[J]. Anal Chim Acta,2015,901(2):12-33.
[3]BRYDEN W L.Mycotoxin contamination of the feed supply chain:Implicationsforanimalproductivityandfeed security[J].Anim Feed Sci Tech,2012,173(1-2):134-158.
[4]张艺兵,鲍蕾,褚庆华.农产品中真菌毒素的检测分析[M].北京:化学工业出版社,2006:3-9.
[5]程传民,柏凡,李云,等.2013 年T-2 毒素在饲料原料中的污染分布规律[J].饲料与畜牧,2014(6):17-20.
[6]LEE H J,RYU D.Worldwide occurrence of mycotoxins in cereals and cereal derived food products:Public health perspectives of their co-occurrence[J].J Agr Food Chem,2017,65(33):7034-7051.
[7]李鹏,赖卫华,金晶.食品中真菌毒素的研究[J].农产品加工(学刊),2005,34(3):12-15.
[8]杨建伯.真菌毒素与人类疾病[J].中华地方病学杂志,2002,21(4):314-317.
[9]韩现文.三种真菌毒素分析方法的建立及其在白酒生产中的应用[D].天津:天津科技大学,2014.
[10]王瑞国,郭丽丽,王培龙,等.杂质吸附型净化结合超高效液相色谱-串联质谱法同时测定谷物和动物饲料中37 种霉菌毒素[J].色谱,2020,38(7):817-825.
[11]中华人民共和国国家质量监督检验总局,中国国家标准化管理总局.GB/T 17480—2008 饲料中黄曲霉毒素B1 的测定酶联免疫吸附法[S].北京:中国标准出版社,2008.
[12]王文珺,王汝琦,刘磊,等.赭曲霉毒素A 时间分辩荧光定量检测体系适用性评价[J].食品安全质量检测学报,2018,9(6):1344-1349.
[13]赵颖,刘洪美,卢静华,等.基于适配体生物传感器检测黄曲霉毒素B1 的研究进展[J].食品安全质量检测学报,2018,9(22):5806-5815.
[14]中华人民共和国农业部.NY/T 2550—2014 饲料中黄曲霉毒素B1 的测定胶体金法[S].北京:中国标准出版社,2014.
[15]李觅,邓杰,杨跃寰,等.真菌毒素在浓香型白酒生产过程中的安全性检测[J].中国酿造,2015,34(10):129-133.
[16]叶光斌,罗惠波,杨晓东,等.酶联免疫法检测赭曲霉毒素A 在浓香型白酒生产中的变化[J].现代食品科技,2013,29(5):1144-1147.
[17]庞晓娜,王硕舆,李兆杰,等.大曲中微生物及代谢产物的安全性验证[J].中国科技论文,2016,11(24):2833-2836.
[18]李晓颀,杨丽英,杨晓雯,等.超高效液相色谱-串联质谱测定白酒中的黄曲霉毒素B1B2G1G2 总量[J].食品安全质量检测学报,2020,11(7):2263-2267.
[19]任璐,罗冠龙,燕玲娟,等.酿酒原料及白酒中黄曲霉毒素B1 的测定方法改进[J].酿酒科技,2021(2):73-76.
[20]宫小明,马荣桧,王洪涛,等.实时直接分析-串联质谱法测定葡萄酒中赭曲霉毒素A[J].色谱,2017,35(2):185-185.
[21]汪琼,严付华,文刚.高效液相色谱-质谱法测定啤酒中伏马毒素含量[J].首都食品与医药,2017,24(6):10-11.
[22] LEHOTAY S J,MASTOVSKA K,YUN S J.Evaluation of two fast and easy methods for pesticide residue analysis in fatty food matrixes[J].J Aoac Int,2005,88(2):630-638.
[23]ANASTASSIADAS M,LEHOTAY S J,STAJNBAHER D,et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and"dispersive solid-phase extraction"for the determination of pesticide residues in produce[J].J Aoac Int,2003,86(2):412-413.
[24]ANASTASSIADES M,LEHOTAY S J,D STAJNBAHER D.Quick,easy,cheap,effective,rugged,and safe (QuEchERS) approach for determining pesticide residues[C]//Proceedings The Fourteenth Annual Waste Testing&Quality Assurance Symposium.US:Dept.of Agriculture,Agricultural Research Service,Eastern Regional Research Center,2002:231-241.
[25]赵英莲,张梓琪,赵鑫,等.QuEChERS 技术在食品真菌毒素检测中的研究进展[J].中国酿造,2020,39(1):1-5.