高密度培养技术可以大大提高培养液中的菌体密度,经高密度培养后菌体细胞密度会达到常规培养10倍以上,因而高密度培养后菌体的发酵特性会得到提高[1]。而乳酸菌作为常见的发酵剂,对其高密度培养具有重要意义。国内外对乳酸菌进行高密度培养的研究主要针对菌种的筛选、培养基成分的筛选及优化、培养过程中工艺参数的控制以及培养模式的选择[2]。菌种是决定高密度培养的关键因素,而培养基是促进菌体增殖的重要因素,国内外主要是通过培养基的改良或额外添加营养物质以促进菌体的进一步增殖[3-6]。培养过程工艺参数的控制主要包括对发酵温度、发酵时间、接种量、培养基pH的调控。培养模式主要有透析培养、膜过滤培养等[7]。王奎明等[8]研究得出在MRS培养基中加碱中和使pH达到6.4后再添加7.5%番茄汁、12%麦芽汁、5%海带汁、2%乳清,在37 ℃培养12 h后保加利亚乳杆菌菌体浓度可达到1.0×1012 CFU/mL。高松柏[9]研究发现在5%脱脂乳水解液和12%脱脂乳中培养乳酸菌时,通过加入缓冲盐可以分别将活菌数提高3倍和6倍。CARVALHO A S等[10]研究发现在MRS培养基中加入NaCl或甘露糖对保加利亚乳杆菌(Lactobacillus bulgaricus)Lb培养后菌体存活率更高。荣博涵等[11]研究发现通过连续流加补料高密度培养酿酒酵母30 h后达到最大生物量29.29 g/L。周杏荣等[12]研究发现干酪乳杆菌LZ183E高密度培养最佳培养条件为葡萄糖25 g/L、酵母膏20 g/L、南瓜汁24 g/L、初始pH 6.5以及接种量2%,此优化条件下,活菌数对数值达到了(9.20±0.04)lg(CFU/mL)。有关乳酸菌高密度培养优化研究的报道很多[13-16],但大部分的研究都集中于培养基碳源、氮源以及发酵过程的优化,而高密度培养过程中发酵后期随着营养物质的减少以及pH的下降,不利于菌体进一步增殖,有关缓冲盐添加时间、添加缓冲盐后的培养pH以及营养液的添加量等都对培养基质的环境条件改善以及菌体进一步的生长所需的营养物质都有重要的影响,因而本研究主要针对这些影响因素进行试验。
本研究以嗜热链球菌(Streptococcus thermophilus)和保加利亚乳杆菌混合菌种为发酵菌种[17],牛乳为培养基,以菌落总数为评价指标,研究缓冲盐(改变培养pH)添加时间、调节pH、营养物质的添加体积和后发酵时间对菌体密度的影响。通过单因素试验筛选出适宜的因素水平范围,利用响应面法研究混合菌种高密度培养的最佳工艺条件参数。
1 材料与方法
1.1 材料与试剂
混合菌种(嗜热链球菌∶保加利亚乳杆菌=1∶1):山西农业大学食品学院畜产实验室保藏;鲜牛乳:山西农业大学动物科技学院;胡萝卜、番茄:市售;乳清:山西农业大学畜产实验室制作奶酪副产物。
MRS培养基:蛋白胨10 g,牛肉膏10 g,酵母提取物5 g,磷酸氢二钾2 g,乙酸钠5 g,葡萄糖20 g,吐温80 1 mL,MgSO4 0.58 g,MnSO4 0.25 g,琼脂15 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。
营养因子组成[18]:将番茄、胡萝卜清洗干净后榨汁,三层纱布滤后煮沸,冷藏待用,按照乳清∶番茄汁∶胡萝卜汁∶牛奶=4∶6∶6∶5(V/V)配制。
1.2 仪器与设备
HPP-9272电热恒温培养箱:北京东联哈尔仪器制造有限公司;BL-50立式压力蒸汽灭菌锅:上海东亚压力容器制造有限公司;SW-CJ-2FD 型双人单面净化工作台:苏州净化设备有限公司;FE30K pH计:梅特勒-托利多仪器(上海)有限公司;JYZ-V911榨汁机:九阳股份有限公司。
1.3 试验方法
1.3.1 单因素试验优化高密度培养条件
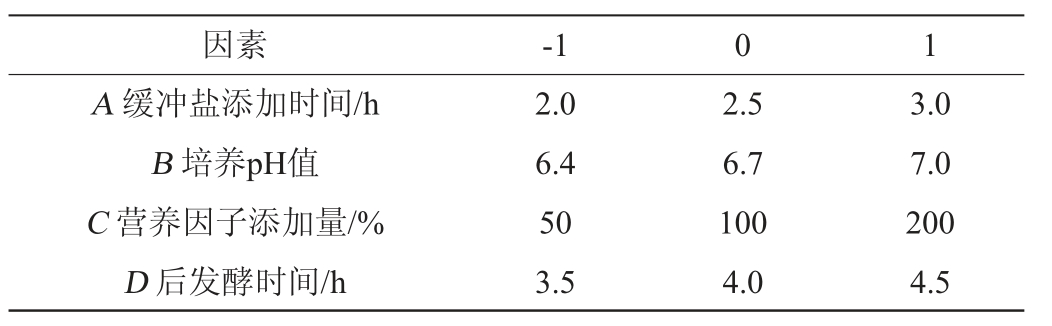
缓冲盐添加时间对活菌数的影响:分别在培养第1.5、2.0、2.5、3.0、3.5小时加入经膜过滤的15%碳酸钠缓冲溶液,调节pH为6.7,加入与原培养基等体积的营养因子(乳清∶番茄汁∶胡萝卜汁∶牛奶=4∶6∶6∶5(V/V)),搅拌均匀后继续培养4 h后进行活菌计数。
培养pH值对活菌数的影响:分别在培养第2.5小时加入经膜过滤的15%碳酸钠溶液,调节pH值为5.8、6.1、6.4、6.7、7.0,加入与原培养基等体积的营养因子,搅拌均匀后继续培养4 h后进行活菌计数。
营养因子添加量对活菌数的影响:在培养第2.5小时加入经膜过滤的15%碳酸钠溶液,调节pH为6.7,加入原培养基25%、33%、50%、100%、200%的营养因子,搅拌均匀后继续培养4 h后进行活菌计数。
后发酵时间对活菌数的影响:在培养第2.5 h时加入经膜过滤的15%碳酸钠溶液,调节pH为6.7,加入与原培养基等体积的营养因子,搅拌均匀后继续培养2.0 h、3.0 h、4.0 h、5.0 h、6.0 h后进行活菌计数。
1.3.2 响应面试验优化高密度培养条件
在单因素试验的基础上,以添加缓冲盐时间(A)、培养pH值(B)、添加营养物质体积(C)、后发酵时间(D)为4个因素,以活菌数(Y)为响应指标,对4个因素进行3水平的Box-Behnken设计,响应面试验因素与水平如表1。
表1 乳酸菌高密度培养条件优化响应面试验因素与水平
Table 1 Factors and levels of Box-Behnken experiments for lactic acid bacteria high-density culture conditions optimization
1.3.3 测定方法
菌落数:参照国标GB 4789.2—2016《食品微生物学检验菌落总数的测定》进行测定。
2 结果与分析
2.1 缓冲盐添加时间对活菌数的影响
由图1可知,活菌数随着添加缓冲盐时间的不同先升高后降低,在发酵2.5 h后添加缓冲盐溶液,活菌数最高为8.86 lg(CFU/mL)。这可能是由于培养第2.5小时乳酸大量积累,pH偏低,不利于乳酸菌的进一步增殖,而此时添加缓冲溶液可以有效调节pH[19],解除过量乳酸对乳酸菌的抑制作用[20-21],再加入营养物质后可以较好的进一步促进乳酸菌的生长。因此,选择在发酵2.5 h时添加缓冲盐溶液。
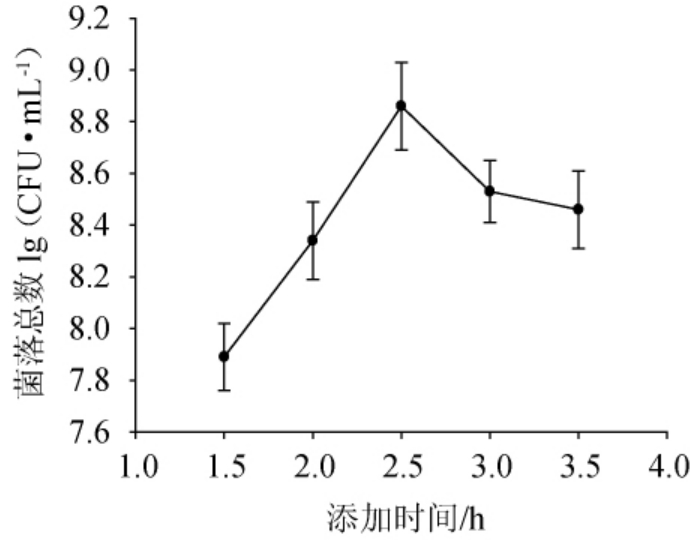
图1 缓冲盐添加时间对活菌数的影响
Fig.1 Effect of buffer salt addition time on viable count
2.2 培养pH值对活菌数的影响
由图2可知,活菌数随着pH的升高呈现先上升后下降的趋势,pH调节为6.7时菌落总数最高,达到8.87 lg(CFU/mL)。有研究表明,牛奶pH在6.6左右最适合乳酸菌的生长繁殖[22],而牛奶是乳酸菌生长繁殖的较好底物,乳酸菌已适应在接近牛奶pH的环境中生存。另外,加入缓冲盐调节pH后中和了前体乳酸菌代谢生成的乳酸,降低了较低的pH条件对乳酸菌的不利影响,保证了后续生长相对稳定的pH环境[15,21,23]。这与报道的乳酸菌R8高密度培养将pH调节为5.8的结果不同[14],可能与选用的菌株不同、营养物质添加的不同以及培养模式的差异有关。因此选择在发酵2.5 h时添加缓冲盐溶液后将pH调节为6.7。
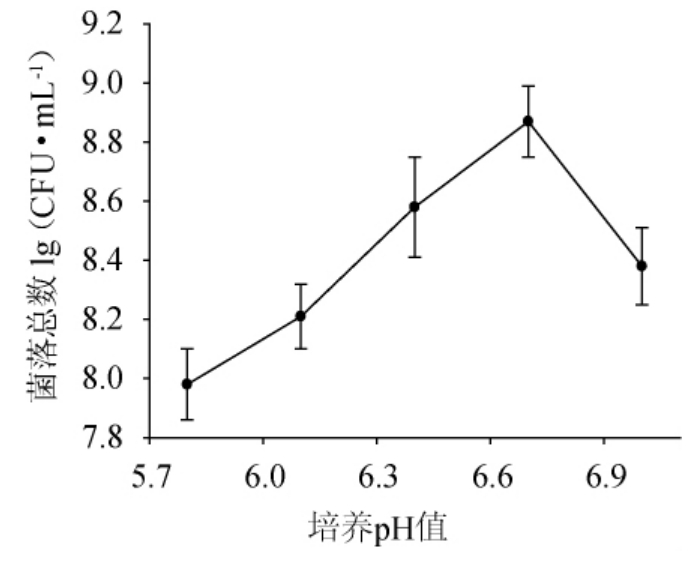
图2 培养pH值对活菌数的影响
Fig.2 Effect of culture pH value on viable count
2.3 营养因子添加量对活菌数的影响
由图3可知,随着营养因子添加量的增加,高密度培养后活菌数呈现先增加后下降的趋势,当加入原培养基等体积的营养物质时,活菌数最高为8.86 lg(CFU/mL)。而营养因子添加量的增大或减少,都不利于乳酸菌的高密度增殖。这可能是因为当加入较多的营养因子时尽管菌体密度会提高,但相对培养液的总体积也增大,最终单位菌落数会减小。而添加营养物质较少时,不能满足菌体高密度繁殖所需的营养,最终单位菌落总数也会下降[24]。因此,选择添加原培养液等体积的营养物质进行营养物质的补充。
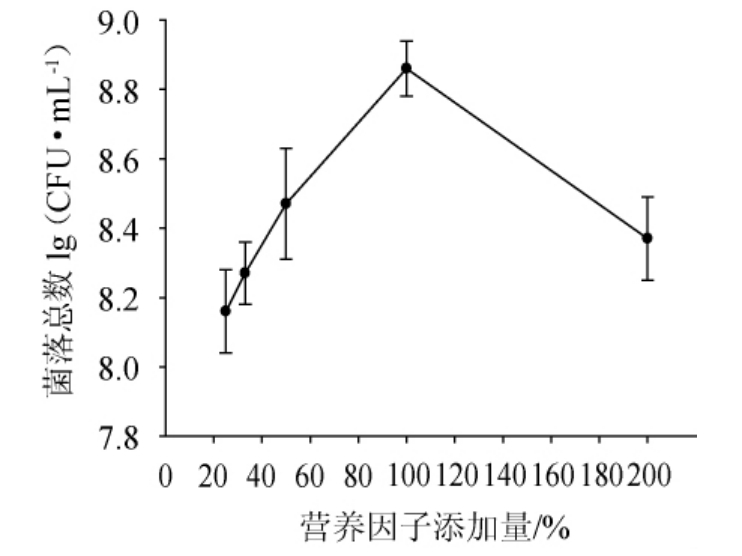
图3 营养因子添加量对活菌数的影响
Fig.3 Effect of nutrition factor addition on viable count
2.4 后发酵时间对活菌数的影响
由图4可知,当调节pH并加入营养物质后进一步培养,随着后发酵时间的延长,菌数呈先上升后下降的趋势,当发酵时间达到4 h时菌数最高为9.13 lg(CFU/mL),而4 h后菌数又降低。这可能是因为进一步延长发酵时间会使乳酸菌代谢产生的乳酸增多,一定程度抑制了乳酸菌的继续生长[25-26],也可能与发酵4 h后营养物质被彻底利用有关。因此最终确定后发酵时间为4 h。
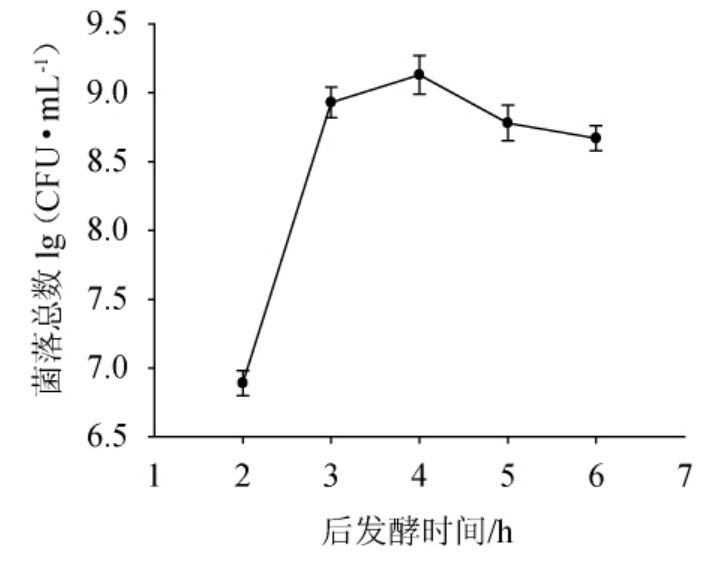
图4 后发酵时间对活菌数的影响
Fig.4 Effect of post-fermentation time on viable count
2.5 Box-Behnken试验
利用Design-Expert软件对表2数据进行回归分析。得到以下回归方程:
表2 乳酸菌高密度培养条件优化响应面试验设计与结果
Table 2 Design and results of Box-Behnken experiments for lactic acid bacteria high-density culture conditions optimization
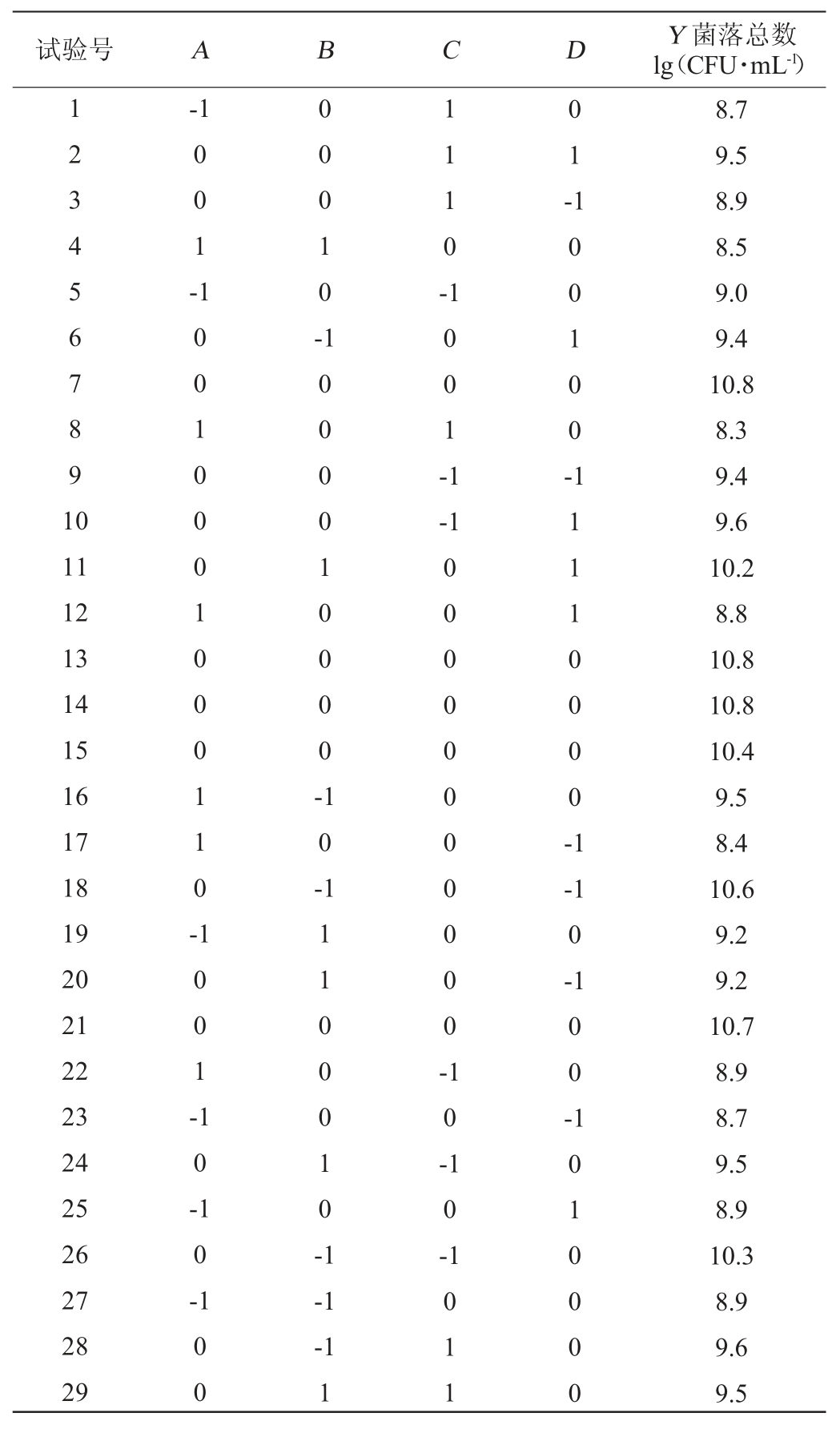
Y=10.70-0.083A-0.18B-0.18C+0.10D-0.33AB-0.075AC+0.050AD+0.18BC+0.55BD+0.10CD-1.35A2-0.28B2-0.68C2-0.63D2
不同因素对菌落总数响应值影响的方差分析如表3所示。由表3可以看出,回归模型极显著(P<0.000 1),而失拟项不显著(P>0.05),因此得到的回归方程有效,可利用该回归方程进行相关的预测和控制。同时方程的决定系数R2=0.98,调整后的决定系数R2Adj=0.96,说明利用该回归方程可以解释变异中96%的变量之间的关系,响应值和各因素之间存在二次关系,方程可信度较高。方差分析中B、C因素对结果影响极显著(P<0.01),D因素影响显著(P<0.05),A因素影响不显著(P>0.05),说明在高密度培养过程中调节pH值和添加营养物质的体积对菌数的影响极显著,而后发酵时间对菌数影响显著,缓冲盐添加时间对结果影响不显著(P>0.05),充分说明及时排除代谢生成的酸并补充营养物质对乳酸菌的高密度培养至关重要,而合适的后发酵时间也有重要影响,这些因素都是乳酸菌菌体不断增加的关键因素。而交互作用中以A和B两因素的交互作用、B和D两因素之间的交互作用影响达到极显著(P<0.01),B和C因素之间的交互作用达到显著(P<0.05),其余两因素之间的交互作用不显著(P>0.05),说明在高密度培养过程中两因素必须同时考虑,也就是调节合适的pH后要添加适合的营养物质同时保证在后续发酵过程较好的增殖。各因素的平方项对结果影响极显著(P<0.01),这表明各因素与响应值之间不是简单的线性关系。对交互作用显著的A和B、B和C、B和D因素之间进行响应面和等高线分析,结果见图5。由图5可以看出,A和B、B和C、B和D因素之间的交互作用明显,与方差分析的结果一致,通过响应面可知各因素对该响应值存在最大值。
表3 回归方程的方差分析
Table 3 Variance analysis of regression equation
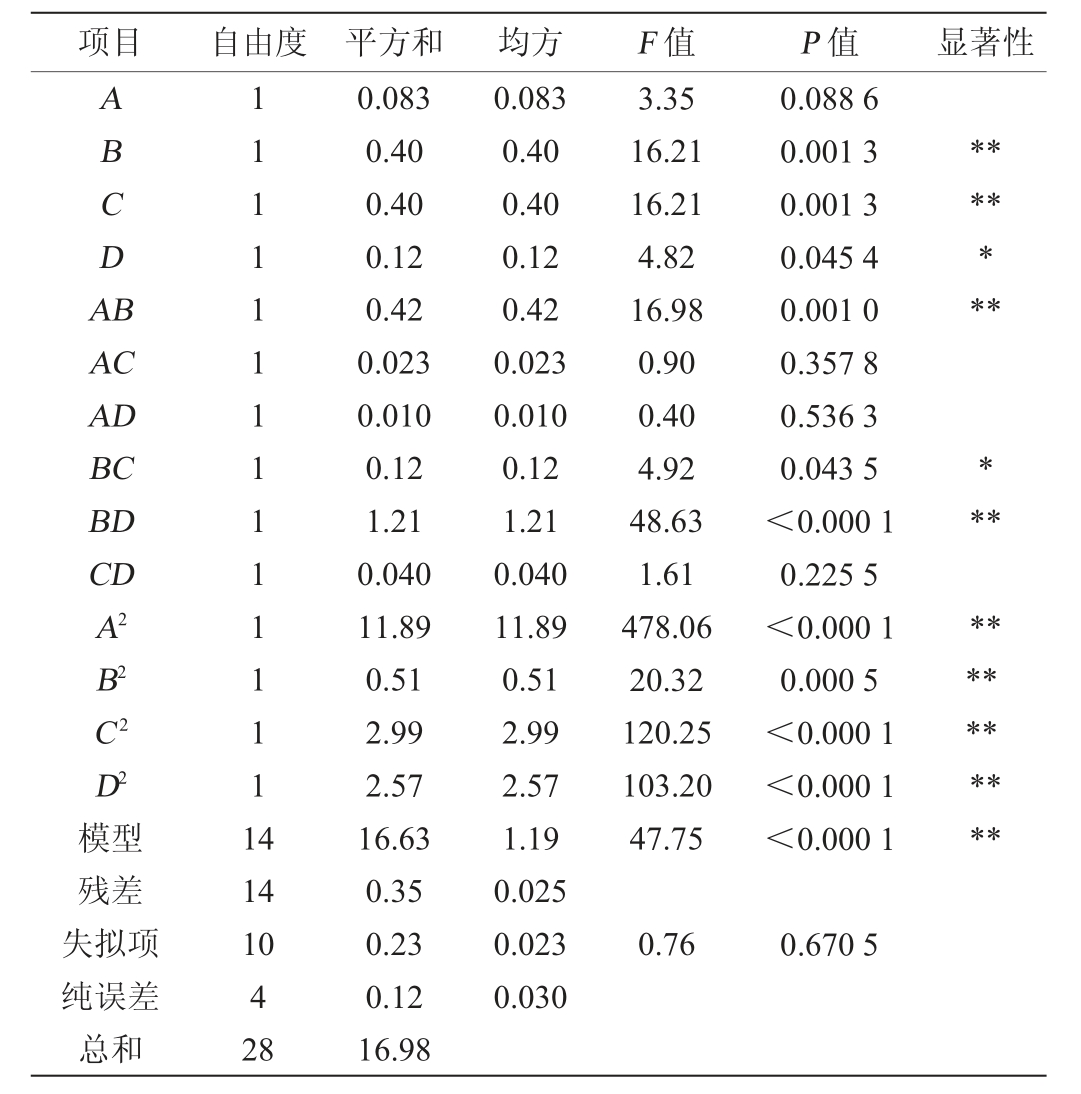
注:“**”表示对结果影响极显著(P<0.01),“*”表示对结果影响显著(P<0.05)。
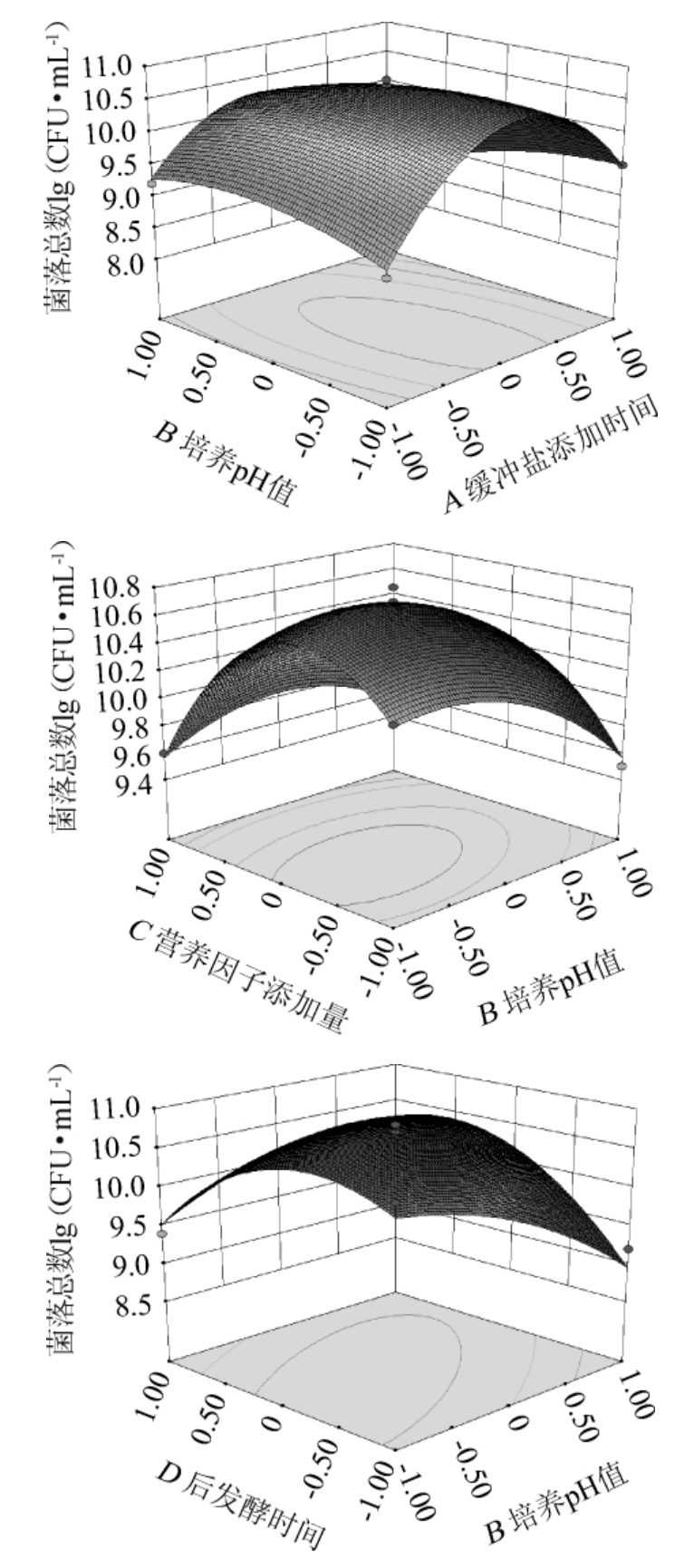
图5 各因素交互作用对乳酸菌菌落总数影响的响应曲面和等高线
Fig.5 Response surface plots and contour lines of effect of interaction between various factors on the total number of colonies of lactic acid bacteria
通过方程计算结果的最大值,由软件分析和规划求解计算得到编码值,进行换算后得到理论最佳条件:缓冲盐添加时间为2.05 h,培养pH值为6.46,添加原培养基107%的营养因子,后发酵时间3.88 h,此条件下培养液的活菌数模型预测值为5.73×1011 CFU/mL。为验证此模型下获得工艺参数的可靠性,结合实际情况对以上工艺参数进行调整,确定最终合适的工艺参数为:缓冲盐添加时间为2 h,培养pH值为6.5,添加原培养基等体积的营养因子,后发酵时间4 h,在此条件下进行验证试验,培养液的活菌数实际值为5.68×1011 CFU/mL。实际数值与模型预测值接近,因而由此模型得到的结果可靠。
3 结论
经单因素试验得出,乳酸菌高密度培养最佳条件为在发酵2.5 h 时添加缓冲液调节pH 至6.6,添加原发酵液等体积的营养因子后发酵4 h。结合响应面法得出乳酸菌高密度培养的最优条件为在培养至2 h 时添加15%碳酸钠缓冲液调节pH 值至6.5,同时添加与原培养基等体积的营养因子(乳清∶番茄汁∶胡萝卜汁∶牛奶=4∶6∶6∶5)再培养4 h,在此条件下培养液的活菌数较高,为5.68×1011 CFU/mL。
[1]李莹,周剑忠,董明盛.乳酸菌高密度培养技术研究进展[J].中国乳业,2008(10):44-46.
[2]刘振民.乳酸菌高密度培养及浓缩型发酵剂研究[D].哈尔滨:东北农业大学,2002.
[3]熊晓辉,于修鑑,熊强,等.乳酸菌发酵剂高密度培养的研究[J].中国调味品,2004,29(5):17-21.
[4]TAN J S,RAMANAN R N,LING T C,et al.Enhanced production of periplasmic interferon alpha-2b by Escherichia coli using ion-exchange resin for in situ removal of acetate in the culture[J].Biochem Eng J,2011(58-59):124-132.
[5] LIU B,HUI J,CHENG Y Q,et al.Extractive fermentation for enhanced production of thailandepsin A from Burkholderia thailandensis E264 using polyaromatic adsorbent resin Diaion HP-20[J].J Ind Microbiol Biotechnol,2012,39:767-776.
[6] ATAEI S A,VASHEGHANI-FARAHANINI E.In situ separation of lactic acid from fermentation broth using ion exchange resins[J].J Ind Microbiol Biotechnol,2008,35:1229-1233.
[7]王英,周剑忠,卢俭,等.微囊化乳酸菌高密度培养及释放特性的研究[J].江苏农业学报,2011,27(3):658-662.
[8]王奎明,王昌禄,陈铁涛,等.保加利亚乳杆菌高密度培养的初步研究[J].食品与发酵工业,2007,33(10):46-49.
[9]高松柏.酸奶的发展趋势[J].中国乳品工业,2001(5):14-17.
[10]CARVALHO A S,SILVA J,HO P,et al.Effect of various growth media upon survival during storage of freeze-dried Enterococcus faecalis and Enterococcus durans[J].J Appl Microbiol,2003,94(6):66-69.
[11]荣博涵,甄玉国,赵小丽,等.不同补料方式对酿酒酵母高密度发酵的影响[J].中国酿造,2015,34(2):72-75.
[12]周杏荣,周佳豪,雷文平,等.干酪乳杆菌LZ183E 高密度培养条件优化[J].中国酿造,2020,39(12):64-68.
[13]赵玉鉴,李盛钰,赵玉娟,等.益生性植物乳杆菌C88 的高密度培养条件优化研究[J].中国乳品工业,2014,42(1):7-10.
[14]吴军林,柏建玲,莫树平,等.乳酸菌R8 高密度培养的发酵工艺研究[J].现代食品科技,2018,34(2):164-170.
[15]曾小群,潘道东,彭涛,等.戊糖乳杆菌高密度培养技术[J].中国食品学报,2013,13(9):78-85.
[16]陈百莹,郑苗,邓泽元,等.植物乳杆菌ZJ316 培养基优化和高密度培养的研究[J].中国食品学报,2020,20(7):65-74.
[17]包维臣,陈霞,邵玉宇,等.保加利亚乳杆菌与嗜热链球菌共生机理的研究进展[J].中国乳品工业,2011,39(12):20-23.
[18]董阳.乳酸菌的高密度培养及固体活性酸奶的研制[D].晋中:山西农业大学,2018.
[19]尚天翠.温度及pH 条件对乳酸菌生长影响的研究[J].伊犁师范学院学报(自然科学版),2011(3):32-36.
[20]SCHIRALDI C,ADDUCI V,VALLI V,et al.High cell density cultivation of probiotics and lactic acid production[J]. Biotechnol Bioeng,2003,82:213-222.
[21] CA'RCAMO M,SAA P A,TORRES J,et al.Effective dissolved oxygen control strategy for high-cell-density cultures[J].IEEE Latin Am Transac,2014,12(3):389-394.
[22]徐艳伟,杜晓旭,齐云霞,等.温度对牛奶pH 值影响的研究[J].轻工科技,2013,29(3):21-51.
[23]朱承亮.乳酸菌高密度发酵技术的研究[D].杭州:浙江大学,2008.
[24]杭锋,陈卫.益生乳酸菌的生理特性研究及其在发酵果蔬饮料中的应用[J].食品科学技术学报,2017,35(4):33-41.
[25]田良玉.乳酸菌高密度规模发酵工艺优化[D].扬州:扬州大学,2018.
[26]GONC A L,RAMOS A,ALMEIDA J,et al.Elucidation of the mechanism of lactic acid growth inhibition and production in batch cultures of Lactobacillus rhamnosus[J].Appl Microbiol Biotechnol,1997,48:346-350.