类胡萝卜素是一大类类异戊二烯色素,广泛分布于各类植物和微生物[1]。这些亲脂性代谢产物不溶于水,起着生色团的作用(400~500 nm是类胡萝卜素最大吸收的电磁光谱),使生物体呈现橙色、黄色、微红色等特征[2-3]。长期以来,类胡萝卜素在食品、化妆品、制药、营养保健品、饲料等行业应用广泛,主要归功于其生物学功能,如具有很高的抗氧化活性,可以保护细胞膜免受光、氧化和自由基的破坏。类胡萝卜素作为维生素A的前体、活性氧的清除剂和体外抗体产生的促进剂,可以降低患癌症的风险和预防心血管疾病[4-5]。除此之外,类胡萝卜素对于保持某些特性和促进微生物的生长至关重要[6-7]。
与从植物和化学合成生产类胡萝卜素相比,微生物生产类胡萝卜素更具优势,如低成本,批次之间的差异较小,易于操作,且没有季节或地理变化,生产周期短。能够生产类胡萝卜素广泛的微生物包括霉菌类、酵母类、细菌类和藻类[8-9]。近年来,相关研究表明酵母菌具有单细胞特性和高生长速率,有生产大量类胡萝卜素的潜能。产类胡萝卜素的酵母被认为无处不在,因为广泛分布在陆地、淡水、海洋等环境中,能够同化各种碳源如葡萄糖、蔗糖、甘油、木糖等[10]。目前,研究发现能产生类胡萝卜素的酵母主要包括红冬孢酵母属(Rhodosporidium spp.)、掷孢酵母属(Sporobolomyces spp.)、红法夫酵母属(Phaffia spp.)及红酵母属(Rhodotorula spp.)等[11-13]。其中,利用红酵母生产类胡萝卜素营养要求简单、生长周期短、菌体营养丰富,开发前景广阔。
然而,目前用于工业化生产类胡萝卜素的微生物资源还很有限,从自然界中分离高产类胡萝卜素且安全无毒的优良菌株具有较高的研究价值和应用前景。另外,天然色素容易受到温度、氧化剂、还原剂等因素的影响而限制了其应用。因此色素的稳定性是色素应用中的一个重要问题。本实验采用传统微生物分离方法从赤霞珠酿酒葡萄表皮分离鉴定高产类胡萝卜素的酵母菌株,优化其发酵条件,并对其胞外色素稳定性进行了探究,为采用发酵法生产类胡萝卜素提供参考。
1 材料与方法
1.1 材料与试剂
酿酒葡萄赤霞珠:采于新疆五家渠市;酵母脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京索莱宝科技有限公司;酵母浸粉、琼脂粉、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;葡萄糖、过氧化氢、丙酮、柠檬酸、苹果酸、氢氧化钠、柠檬酸钠(均为分析纯):天津市盛奥化学试剂有限公司。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、PDA液体培养基:常德比克曼生物科技有限公司。
1.2 仪器与设备
SPX-250B生化培养箱:常州诺基仪器有限公司;立式高压蒸汽灭菌锅:广州柯侨实验技术有限公司;ZWYR-211D大容量恒温培养摇床:上海智城分析仪器制造有限公司;LD5-2A低速离心机:北京医用离心机厂;UV-2800紫外-可见分光光度计:尤尼柯(上海)有限公司;SW-CJ-2F洁净工作台:苏州净化设备有限公司;BPG-9240A电热风干燥箱:上海一恒科技仪器有限公司;CP114分析电子天平:美国奥豪斯科学仪器有限公司。
1.3 方法
1.3.1 产类胡萝卜素酵母菌株的分离和筛选
将无菌操作采集的葡萄样品加入到50 mL无菌生理盐水中,28 ℃、170 r/min处理30 min。对样品预处理液10倍稀释依次得到10-1、10-2、10-3、10-4、10-5菌悬液。分别吸取各梯度菌悬液200 μL于PDA培养基上,涂布均匀,每个样品涂布3个平板。28 ℃倒置培养48 h,根据菌落形态、颜色及显微镜下菌体细胞的形态观察结果,选取疑似红酵母菌落进行纯培养,直至平板上无不同菌落特征菌株。
1.3.2 高产类胡萝卜素酵母菌的筛选
将各待试菌株从保存斜面移接到活化培养基上,28 ℃培养48 h。将菌种接种于装有50 mL PDA液体培养基中28 ℃振荡(200 r/min)培养24 h,得到预培养物。将预培养物转移到50 mL PDA液体培养基中,接种量为2%,28 ℃振荡(200 r/min)发酵48 h。根据菌体干质量测定菌株的生长情况,发酵结束后经离心收集菌体并测定生物量和类胡萝卜素产量,确定类胡萝卜素高产菌株。
1.3.3 高产类胡萝卜素酵母菌株的鉴定
(1)形态及生理生化鉴定
参照文献[14]方法对高产类胡萝卜素酵母菌株的形态及生理生化特征进行初步鉴定。
(2)分子生物学鉴定
采用Fungi Genomic DNA Extraction Kit提取菌株基因组DNA,以其为模板进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。使用正向引物ITS1(5'-TCCGTAGTGAACCTGCGG-3')和反向引物ITS4(5'-TCCTCCGCTTATTGATGC-3')对内转录间隔区(internal transcribed spacers,ITS)进行扩增[15]。PCR扩增体系为预混液25 μL,正反引物(10 μm)各2 μL,DNA模板2 μL,双蒸水19 μL。PCR扩增条件为:94 ℃预变性10 min;92 ℃变性1 min,52 ℃退火1 min,72 ℃延伸1 min,循环30次;72 ℃延伸5 min。PCR扩增产物经琼脂糖凝胶电泳检测、纯化后送至北京生工基因测序公司进行测序,将获得的序列与GeneBank库(http://www.ncbi.nlm.nih.gov/BLAST/)中进行基本局部比对搜索工具(basic localalignmentsearchtool,BLAST)比对分析,鉴定种属信息。根据序列采用MEGA6.0软件中的邻接法(neighbor-joining)进行聚类分析,构建系统发育树。
1.3.4 培养基的优化
碳源的优化:分别以葡萄糖、果糖、可溶性淀粉、阿拉伯糖、乳糖、甘露糖为碳源,添加量为2%,蛋白胨2%,酵母浸粉1%,考察不同碳源对类胡萝卜素产量的影响。
氮源的优化:分别以蛋白胨、甘氨酸、赖氨酸、硝酸铵、硫酸铵作为氮源,添加量为2%,酵母浸粉1%,葡萄糖2%,考察不同氮源对类胡萝卜素产量的影响。
将菌株接种在含有50 mL发酵培养基的锥形瓶中,接种量为3%(V/V),在120 r/min、28 ℃条件下培养5 d。发酵结束后,以干细胞生物质量(dry cell mass,DCM)(g/L),类胡萝卜素产量(mg/L)和细胞类胡萝卜素(μg/g干酵母)的形式测定细胞生长,选出最合适酵母菌生长的碳源和氮源。所有摇瓶实验均平行3份进行。
1.3.5 类胡萝卜素提取与测定
(1)生物量测定
生物量的测定按照参考文献[16]进行。具体操作如下:吸取4 mL发酵液加入已烘干称质量的5 mL离心管中,5 000 r/min离心10 min,弃去上清液。菌体沉淀物用蒸馏水洗涤,同样条件下离心后弃去上清液。将含菌体的离心管在105 ℃条件下烘干至质量恒定,置于干燥器中冷却至室温后称质量,按下式计算生物量:
式中:M为带菌体管干质量,g;M0为空管干质量,g;V为发酵液体积,mL。
(2)类胡萝卜素提取
类胡萝卜素的提取按照文献[17]进行。为裂解细胞,将0.05 g干细胞浸泡在3 mL盐酸(3 μmol/L)中,25 ℃浸泡1 h,沸水中加热4 min,冰浴冷却5 min,8 000×g离心5 min,弃上清得菌体沉淀。菌体沉淀用蒸馏水洗涤后同样条件下离心得沉淀,将沉淀悬浮在8 mL的丙酮溶液中,振荡均匀,8 000×g离心10 min收集上清。上清液用紫外-可见分光光度计在475 nm波长处测定总胡萝卜素的含量。类胡萝卜素产量按下式计算:
式中:Aλmax为类胡萝卜素最大吸收波长下的吸光度值;V为提取所用溶剂量,mL;D为测定试样时的稀释倍数;W为酵母菌体干细胞质量,g;0.16为类胡萝卜素消光系数。
(3)类胡萝卜素胞外稳定性测定
在热稳定性测试中,将色素提取液分别置于20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃的水浴锅中保温,孵育1 h后冷却,用紫外-可见(UV-Vis)分光光度计(475 nm)进行分析。配制含量为0.5%、1.5%、3.0%的过氧化氢丙酮溶液,分别加入类胡萝卜素提取液中,定时测定其在475 nm处的吸光度值,以测试氧化剂对其稳定性的影响。在含有色素提取液的试管中加入抗坏血酸、亚硫酸钠,使其含量为0.1%,放置于室内暗处,定时测定其在475 nm处的吸光度值,以测试还原剂对其稳定性。为了研究pH稳定性,在类胡萝卜素提取液中分别添加柠檬酸、苹果酸、氢氧化钠和柠檬酸钠,使其浓度为0.1%,放置于室内暗处,定时测定其在475 nm处的吸光度值。其中,吸光度值下降率按下式计算:
式中:A0为起始A475nm;A为处理后的A475nm。
1.3.6 数据处理与分析
每个实验均重复3次,数据统计采用Excel 2010软件,图形绘制采用Origin 8.5软件。
2 结果与分析
2.1 产类胡萝卜素酵母菌株的筛选与鉴定
2.1.1 菌落及细胞形态观察
从酿酒葡萄表皮分离得到6株粉红色菌落,根据菌落形态/颜色不同,分别编号为Y1、Y5、Y7、Y9、Y10、Y14。将具有产类胡萝卜素能力的酵母菌在平板上培养后,进行菌落形态及个体形态观察。各菌株的菌落形态如图1所示,细胞形态见图2。

图1 分离酵母菌的菌落形态
Fig.1 Colony morphology of isolated yeasts
图2 分离酵母菌的细胞形态
Fig.2 Cell morphology of isolated yeasts
结果表明,6株酵母菌在平板培养4 d后,菌株Y1、Y5、Y10、Y14呈粉色,菌株Y7、Y9呈粉红色,且所有酵母菌落均为边缘整齐的圆形,表面光滑,质地黏稠,不透明,有光泽,凸起,且菌落直径较大;在显微镜下观察,细胞形态均为椭圆。
2.1.2 高产类胡萝卜素酵母菌种的筛选
对6株酵母菌株进行培养,4 d后分别测定生物量和类胡萝卜素含量及产量,结果见图3。从图3可知,类胡萝卜色素产量最高的酵母是菌株Y7(12.93 mg/L),其次是菌株Y5(11.71 mg/L)。菌株Y10(7.09 mg/L)和菌株Y1(5.18 mg/L)产量较低。这些结果表明,菌株Y7具有较强的类胡萝卜素产生能力,通过条件优化或遗传改良,有可能成为一株新的类胡萝卜素高产菌株。
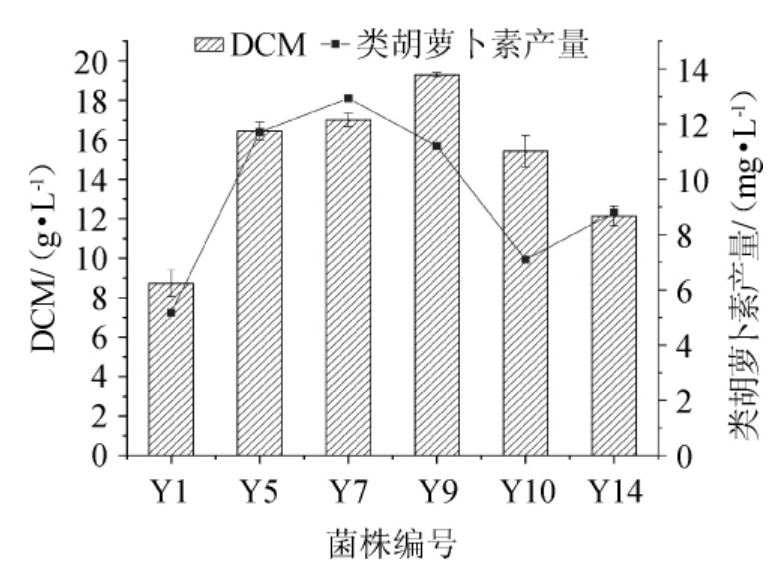
图3 6株酵母菌的生物量及类胡萝卜素产量
Fig.3 Biomass and carotenoid production of 6 strains of yeast
2.1.3 高产类胡萝卜素酵母菌株生理生化测定
菌株Y7的生理生化特性结果见表1。由表1可知,碳源同化实验结果显示,该菌株能利用葡萄糖、木糖等8种糖,不能利用海藻糖,能利用甘油、柠檬酸、苹果酸,不能利用甲醇、乙醇;氮源同化实验结果显示,该菌不能利用亚硝酸钠,能利用硫酸铵、蛋白胨、硝酸铵、甘氨酸和赖氨酸。生理生化检测结果显示,该菌不产酸,无类淀粉产物产生。
表1 分离菌株Y7的生理生化特性
Table 1 Physiological and biochemical characteristics of isolated strain Y7

注:“+”表示结果阳性;“-”表示结果阴性。
2.1.4 分子生物学鉴定
对分离得到的高产类胡萝卜素酵母菌Y7进行了ITS基因序列测定。利用GenBank数据库中的BLAST结合系统发育分析,发现菌株Y7与红酵母属(Rhodotorula spp.)有很高的相似性,特别是与Rhodotorula glutinis的亲缘性较近。用邻接法构建了菌株Y7及其近缘种的系统发育树,结果见图4。由图4可知,菌株Y7与Rhodotorula glutinis形成了一个簇,表明菌株Y7属于粘红酵母(Rhodotorula glutinis)。

图4 基于ITS基因序列分离的菌株Y7的系统发育树
Fig.4 Phylogenetic tree of the isolated strain Y7 based on ITS gene sequences
2.2 碳源和氮源种类对菌株Y7产类胡萝卜素的影响
2.2.1 碳源种类的影响
碳源通过影响类胡萝卜素合成基因的转录和提供代谢前体,在类胡萝卜素的形成过程中起着重要作用。不同碳源对菌株Y7细胞生长和胡萝卜素合成的影响见图5。由图5可知,在添加葡萄糖和果糖的培养基中,类胡萝卜素的产量相对较高,其中葡萄糖被证明是最适合类胡萝卜素生产的碳源,类胡萝卜素产量为13.67 mg/L。菌株Y7在添加乳糖的培养基中生长较好,菌体干质量为24.63 g/L。在含有可溶性淀粉、阿拉伯糖、乳糖、D-甘露糖的培养基中,类胡萝卜素合成受到不同程度的抑制。结果表明,葡萄糖和果糖是提高生物量和类胡萝卜素产量的较好碳源,而可溶性淀粉、阿拉伯糖、乳糖、D-甘露糖则不利于提高类胡萝卜素的产量。对于这一现象有几种可能的解释:①葡萄糖或果糖可能提高类胡萝卜素合成基因的转录水平;②碳源对类胡萝卜素合成的影响也与菌株有关[18-20]。结合实验结果,选择葡萄糖作为碳源。
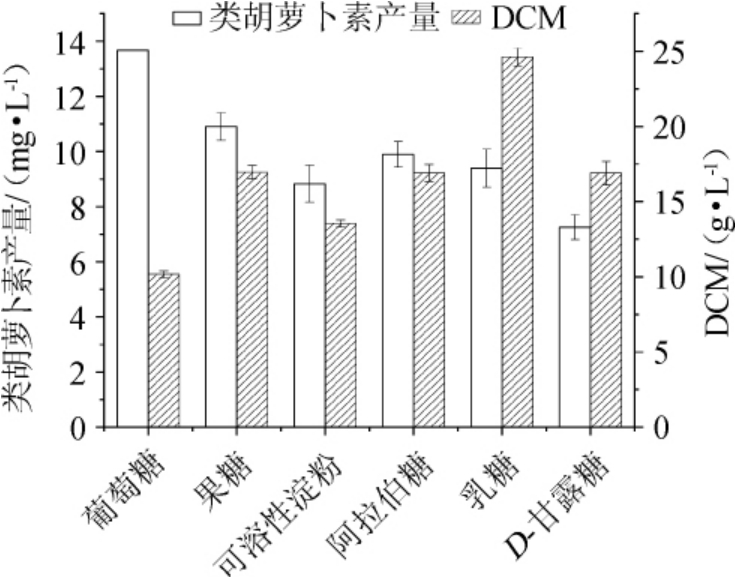
图5 不同碳源对菌株Y7生物量和类胡萝卜素产量的影响
Fig.5 Effect of different carbon sources on biomass and carotenoid production of strain Y7
2.2.2 氮源种类的影响
在微生物发酵类胡萝卜素过程中,需要对培养条件进行优化,以充分发挥所选微生物菌株的潜力。不同氮源对菌株Y7细胞生长和胡萝卜素合成的影响如图6所示。由图6可知,在不同培养条件下,生物量在8.03~14.98 g/L之间,变化较大,总类胡萝卜素含量在6.41~13.44 mg/L之间。在含有蛋白胨、甘氨酸和赖氨酸的培养基中,生物量没有明显差异。在蛋白胨培养基中,类胡萝卜素含量最高,为13.44 mg/L,菌体干质量最高为14.98 g/L,是最低产量的1.87倍。在含有硝酸铵和硫酸铵的培养基中,菌体生长和类胡萝卜素的合成受到抑制。因此,与有机氮源(蛋白胨、甘氨酸、赖氨酸)相比,无机氮源(硝酸铵和硫酸铵)对该菌的生长和类胡萝卜素含量有较强的抑制作用。一个可能的原因是有机氮源不仅提供了氮,而且还起到了碳源的作用[21]。综上选择蛋白胨作为培养基氮源。
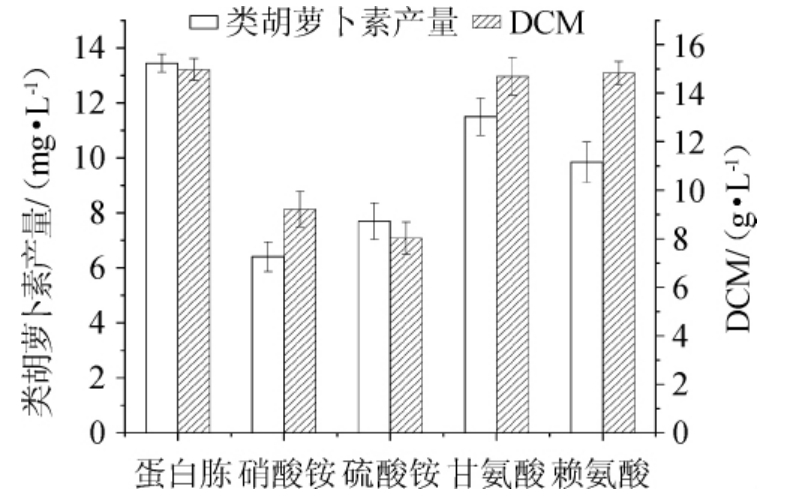
图6 不同氮源对菌株Y7生物量和类胡萝卜素产量的影响
Fig.6 Effects of different nitrogen sources on cell biomass and carotenoid production of strain Y7
2.3 菌株Y7产类胡萝卜素胞外稳定性测试
2.3.1 温度对菌株Y7产类胡萝卜素胞外稳定性的影响
温度被认为是直接影响细菌生长速率的主要物理因素,通过影响酶的表达和活性来影响类胡萝卜素的合成,在类胡萝卜素的生物合成中起着重要的作用[22]。色素提取液分别在温度20 ℃、30 ℃、40 ℃、50 ℃、60 ℃条件下孵育5 h,以测试温度的影响,结果见图7。由图7可知,20~60 ℃条件下加热类胡萝卜素,吸光度值下降率呈先稳定后逐渐升高的趋势。在40~60 ℃下,吸光度值下降率变化较大,说明类胡萝卜素高温(>40 ℃)条件下不稳定。
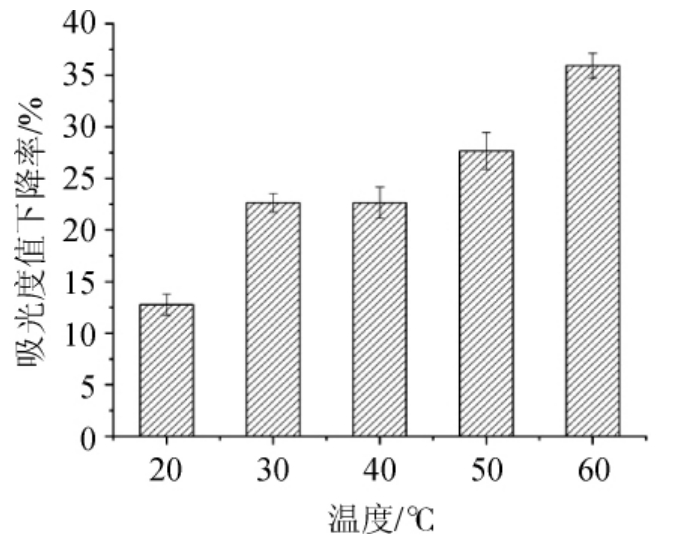
图7 不同温度对菌株Y7产类胡萝卜素胞外稳定性的影响
Fig.7 Effect of different temperature on extracellular stability of carotenoids produced by strain Y7
2.3.2 氧化剂和还原剂对菌株Y7产类胡萝卜素胞外稳定性的影响
在类胡萝卜素提取液中加入不同浓度的过氧化氢后,其吸光度值下降率曲线见图8。由图8可知,随着过氧化氢浓度的增加,类胡萝卜素溶液的吸光度值下降率也逐渐增加。但是在0.5%过氧化氢条件下,色素的吸光度值下降率上升幅度相对较小,说明其对类胡萝卜素稳定性影响相对较小。由此可见,类胡萝卜素对低浓度过氧化氢是相对稳定的,具有一定的抗氧化活性。
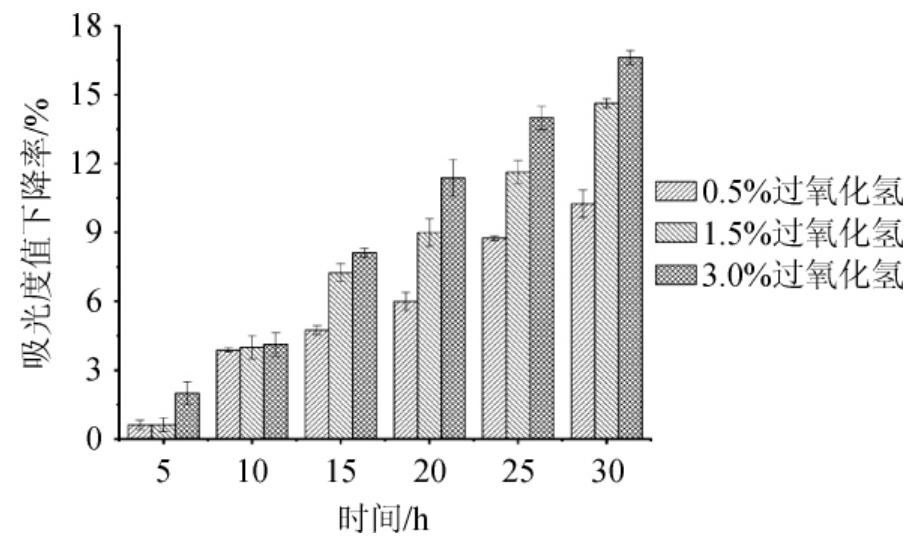
图8 不同浓度H2O2对菌株Y7类胡萝卜素胞外稳定性的影响
Fig.8 Effect of different H2O2 concentration on extracellular stability of carotenoids produced by strain Y7
不同还原剂对菌株Y7类胡萝卜素胞外稳定性的影响见图9。由图9可知,在还原剂处理过程中,随着时间的延长,类胡萝卜素溶液的吸光度值下降率逐渐上升,但上升幅度较小。在0.1%的亚硫酸钠的作用下,5~30 h范围内色素溶液吸光度值下降率从3.75%上升至10.63%,而在0.1%的抗坏血酸的作用下,色素溶液吸光度值下降率从1.88%上升至11.25%。还原剂对类胡萝卜素稳定性有一定的影响,随着放置时间增加,稳定性降低,但是类胡萝卜素吸光度值变化相对较小。
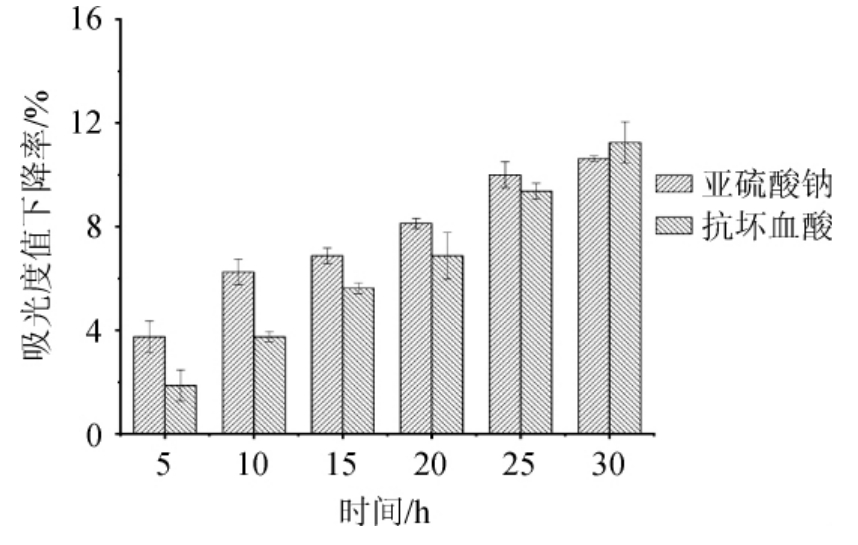
图9 不同还原剂对菌株Y7产类胡萝卜素胞外稳定性的影响
Fig.9 Effect of different reducing agents on extracellular stability of carotenoids produced by strain Y7
2.3.3 酸度调节剂对菌株Y7产类胡萝卜素胞外稳定性的影响
在类胡萝卜素提取液中加入不同酸度调节剂后,其吸光度下降率与色素溶液存放时间的关系曲线见图10。由图10可知,加入柠檬酸和柠檬酸钠,类胡萝卜素溶液的吸光度值降低,但下降的幅度较小。随着时间的延长,吸光度值下降率有所增加,但是增加幅度较低。所以柠檬酸和柠檬酸钠对类胡萝卜素稳定性影响较小。加入苹果酸和氢氧化钠,随着时间的延长,类胡萝卜素溶液的吸光度值逐渐升高使其吸光度值下降率呈现负值,说明苹果酸和氢氧化钠对类胡萝卜素有增色的效果。
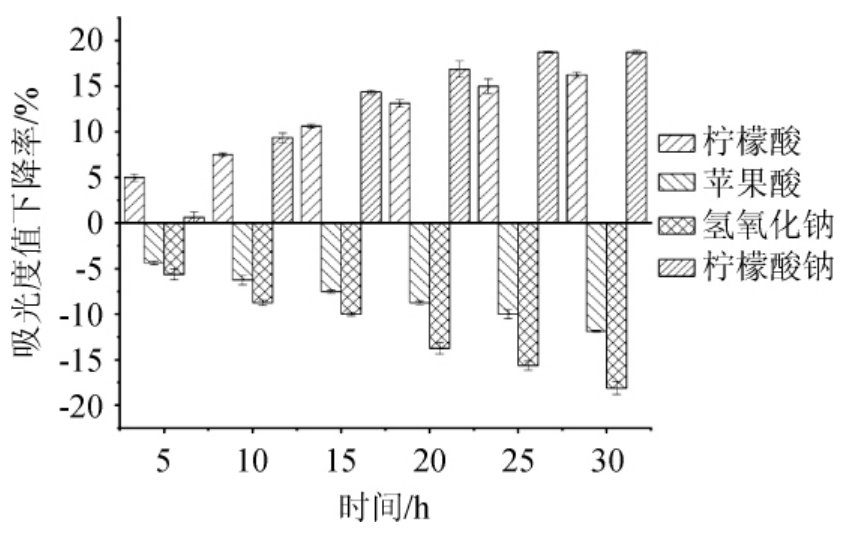
图10 不同酸度调节剂对菌株Y7产类胡萝卜素胞外稳定性的影响
Fig.10 Effect of different acidity regulator on extracellular stability of carotenoids produced by strain Y7
类胡萝卜素在酸性pH下的敏感度较高,而在中性或碱性条件下的稳定性较高,可能是强酸性pH会导致酶的变性、细胞结构的扭曲和类胡萝卜素合成的抑制,导致生长缓慢和类胡萝卜素含量低[23]。另外,苹果酸是另一个重要因素,因为它在代谢途径中顺序产生并与类胡萝卜素形成有关。添加苹果酸可支持更高类胡萝卜素含量。这可能是因为苹果酸是三羧酸(tricarboxylic acid cycle,TCA)循环的中间产物,对于类胡萝卜素和脂质生物合成过程中的代谢和碳骨架形成至关重要[24]。TCA循环还涉及自由基和单线态氧的产生,这些自由基和单线态氧增强了类胡萝卜素的生成[25]。
3 结论
本研究以新疆酿酒葡萄为材料,从中分离到6株粉红色酵母菌株,都能在测试条件下合成类胡萝卜素色素,但不同菌株产类胡萝卜素的能力不同。在初步试验中,产类胡萝卜素最高的菌株是Y7(12.93 mg/L),经分类鉴定该菌株为粘红酵母(Rhodotorula glutinis)。生理生化检测结果显示,该菌株能利用葡萄糖、木糖等8种糖,甘油、柠檬酸、苹果酸等物质可作为碳源,还能以硫酸铵、蛋白胨等作为氮源,但不能利用亚硝酸钠,在以葡萄糖为碳源、蛋白胨为氮源的液体培养基中,类胡萝卜素产量最高。将丙酮浸提液在不同温度、氧化剂、还原剂和酸度调节剂条件下处理,考察其胞外稳定性,结果显示,低温、苹果酸和氢氧化钠处理有利于维持其稳定性,不同浓度H2O2,亚硫酸钠、抗坏血酸、柠檬酸和柠檬酸钠处理对其稳定性有一定的影响,但影响较小。结果表明,菌株Y7高产类胡萝卜素具有广泛的应用潜力,这对其他类胡萝卜素和萜类产品的可持续工业生产具有重要意义。
[1]MOHAN S,RAO P R,HEMACHANDRAN H,et al.Prospects and progress in the production of valuable carotenoids:Insights from metabolic engineering,synthetic biology,and computational approaches[J].J Biotechnol,2018,266:89-101.
[2]何卿,孙国峰,林秦文,等.植物类胡萝卜素提取与分析技术研究进展[J].植物学报,2018,53(5):700-709.
[3]YUAN H,ZHANG J,NAGESWAREN D,et al.Carotenoid metabolism and regulation in horticultural crops[J].Horticult Res,2015,2:15036.
[4]JOMOVA K,VALKO M.Health protective effects of carotenoids and their interactions with other biological antioxidants[J].Eur J Med Chem,2013,70(1):102-110.
[5] MALDONADE I R,SCAMPARINI A R P,RODRIGUEZ-AMAYA D B.Selection and characterization of carotenoid-producing yeasts from campinas region,Brazil[J].Brazil J Microbiol,2007,38:65-70.
[6]FOROUZAN R,HADJ R S,AKHAVAN S A,et al.Canthaxanthin biosynthesis by Dietzia natronolimnaea HS-1:effects of inoculation and aeration rate[J].Brazil J Microbiol,2014,45(2):447-456.
[7]王倩楠,曹苏珊,韩迎亚,等.微藻类胡萝卜素生物合成代谢途径的研究进展[J].食品工业科技,2020,41(9):348-356.
[8]MUSSAGY C U,WINTERBURE J,SANTOS-EBINUMA V C,et al.Production and extraction of carotenoids produced by microorganisms[J].Appl Microbiol Biotechnol,2019,103:1095-1114.
[9]邓永平,段睿,王晓杰,等.微生物源类胡萝卜素的研究进展[J].饲料工业,2020,41(1):12-17.
[10]王蓉,曹海宁,邓小美.不同碳源对粘性红酵母WP3 生长及类胡萝卜素产量的影响[J].中国酿造,2017,36(9):132-136.
[11] ILARIA M,SARA L,TERESA L D S,et al.Red yeasts and carotenoid production:outlining a future for non-conventional yeasts of biotechnological interest[J].World J Microbiol Biotechn,2015,31:1665-1673.
[12]翟红梅,张坤生,肖冬光.黏红酵母发酵产类胡萝卜素培养基中添加维生素的优化研究[J].食品科技,2008(3):31-34.
[13]白曼利,陈艳红,黄莹,等.HSCCC 结合硅胶柱层析分离法夫酵母类胡萝卜素[J].食品工业,2019,40(3):143-147.
[14]孔维宝,杨洋,陈冬,等.1 株类胡萝卜素产生菌的鉴定及其发酵培养基的优化[J].食品科学,2018,39(24):108-115.
[15]CHEN Y,XIAO W,WANG Y,et al.Lycopene overproduction in Saccharomyces cerevisiae through combining pathway engineering with host engineering[J].Microbial Cell Fact,2016,15(1):113.
[16]张立强,梁华兵,艾桃山,等.一株产类胡萝卜素真菌的鉴定及色素稳定性分析[J].湖北农业科学,2015,54(12):2863-2865.
[17]王丽娟,刘苏萌.WD02 菌株产类胡萝卜素的稳定性研究[J].中国酿造,2013,32(3):87-90.
[18]WUW,YUX.Effectofdifferentcarbonsourceonexpressionofcarotenogenic genes and astaxanthin production in Xanthophyllomyces dendrorhous[J].Adv J Food Sci Technol,2013,5(10):1375-1379.
[19] DU W,SONG Y,LIU M,et al.Gene expression pattern analysis of a recombinant Escherichia coli strain possessing high growth and lycopene production capability when using fructose as carbon source[J]. Biotechnol Lett,2016,38(9):1-7.
[20] SAENGE C,CHEIRSILP B,SUKSAROGE T T,et al.Potential use of oleaginousred yeast Rhodotorula glutinisfor the bioconversion ofcrude glycerol from biodiesel plant to lipids and carotenoids[J]. Process Biochem,2011,46(1):210-218.
[21] SLADE D,RADMAN M.Oxidative stress resistance in Deinococcus radiodurans[J].Microbiol Mol Biol Rev,2011,75(1):133-191.
[22]MATA-GOMEZ L C,MONTAES J C,MENDEZ-ZAVALA A,et al.Biotechnological production of carotenoids by yeasts:an overview[J].Microbial Cell Fact,2014,13:12.
[23] SAEJUNG C,APAIWONG P.Enhancement of carotenoid production in the new carotenoid-producing photosynthetic bacterium Rhodopseudomonas faecalis PA2[J].Biotechnol Bioproc Eng,2015,20(4):701-707.
[24]WANG Y K,CHI Z,ZHOU H X,et al.Enhanced production of Ca2+-polymalate(PMA)with high molecular mass by Aureobasidium pullulans var.pullulans MCW[J].Microbial Cell Fact,2015,14(1):1-11.
[25] BHOSALE P,LARSON A J,BERNSTEIN P S.Factorial analysis of tricarboxylic acid cycle intermediates for optimization of zeaxanthin production from Flavobacterium multivorum[J]. J Appl Microbiol,2010,96(3):623-629.