四氢嘧啶(ectoine)是一种环状氨基酸衍生物,作为一种渗透压补偿性溶质,最早在光合细菌极端外硫红螺菌(Ectothiorhodospira halochloris)中被发现[1]。四氢嘧啶受到环境胁迫条件(如高渗、干旱和极端温度)的影响,并广泛存在于嗜盐细菌、嗜盐古菌、真菌及盐藻等细胞中[2-3]。由于其具有极强的大分子、细胞和组织保护能力,四氢嘧啶被认为具有很高的商业价值[4-5]。目前主要应用于护肤[6]和治疗疾病方面[7-8](如阿尔茨海默症)。此外,四氢嘧啶还作为相容性物质可用于加强酶和核酸等生物大分子的稳定性,从而提高生物过程加工的效率[9-10]。
四氢嘧啶中含有一个手性碳原子,通过化学法合成困难且复杂,目前主要通过微生物发酵法合成。四氢嘧啶经典的商业化生产方法是利用嗜盐细菌——伸长盐单胞菌(Halomonas elongata)进行[11],该方法优点在于细胞可以反复利用,但操作复杂,成本较高。多年来,研究者们尝试在常用的工业微生物中构建四氢嘧啶合成途径。BESTVATER T等[12]在大肠杆菌(Escherichia coli)DH5α中表达海生嗜盐球菌(Marinococcus halophilus)的操纵子ectABC,实现了0.4 mmol/g细胞干质量四氢嘧啶积累,由于使用了操纵子自身的启动子元件,仍然需要高盐的诱导条件;NING Y K等[13]利用pTrc99a质粒在大肠杆菌中表达伸长盐单胞菌(H.elongate)的操纵子ectABC,同时引入谷氨酸棒杆菌(Corynebacterium glutamicum)解除反馈抑制的天冬氨酸激酶(lysC编码)强化天冬氨酸-β-半醛的供应,敲除高丝氨酸脱氢酶(thrA编码)减弱代谢支路,失活乙醛酸循环的阻遏蛋白IclR,最终菌株在不需要高盐的条件下积累25.1 g/L四氢嘧啶。
谷氨酸棒杆菌(C.glutamicum)是革兰氏阳性安全菌株,在氨基酸发酵工业中应用了几十年,尤其是利用谷氨酸棒杆菌年产百万吨级的谷氨酸和赖氨酸。由于四氢嘧啶和赖氨酸共用前体物为天冬氨酸-β-半醛,因此改造谷氨酸棒杆菌生产四氢嘧啶可能具有较大的潜力。BECKER J等[14]在赖氨酸生产菌谷氨酸棒杆菌LYS-1的基础上表达伸长盐单胞菌(H.elongate)的操纵子ectABCD,四氢嘧啶积累量可达4.5g/L。PÉREZ-GARCÍA F等[15]以赖氨酸生产菌谷氨酸棒杆菌DM1729为出发菌,通过pVWEx1质粒表达来源于需盐色盐杆菌(Chromohalobacter salexigens)的操纵子ectABC,同时敲除全局调控基因sugR和乳酸脱氢酶基因ldhA,最终菌株产生22 g/L四氢嘧啶,但是操纵子ectABC的表达需要异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)的诱导。
本研究以野生型谷氨酸棒杆菌(C.glutamicum)ATCC 13032为研究对象,以赖氨酸积累量为评价指标,通过代谢工程手段强化天冬氨酸-β-半醛的供应;然后敲除赖氨酸输出蛋白基因lysE,组成型表达不同来源的四氢嘧啶操纵子ectABC,促进天冬氨酸-β-半醛流向四氢嘧啶的合成。本研究将为开发常规工业微生物生产四氢嘧啶、替代现行的嗜盐菌复杂工艺奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
本研究所用菌株与质粒见表1。
表1 本研究所用菌株与质粒
Table 1 Strains and plasmids used in this study

1.1.2 主要试剂
限制性内切酶XbaI、KpnI、HindIII、BamHI,PrimerSTAR HS 脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶:大连TaKaRa公司;DNA Marker:北京博迈德科技发展有限公司;2×Taq Master Mix、ClonExpressTMII(重组酶):诺唯赞生物科技有限公司;质粒提取试剂盒、DNA直接回收试剂盒、DNA凝胶回收试剂盒:美国Omega Bio-TeK公司;硫酸卡那霉素、硫酸链霉素、氯霉素:美国Sigma公司。
1.1.3 培养基
脑心浸液液体培养基(brain heart infusion,BHI):脑心浸液肉汤37.5 g/L,pH7.0,121 ℃灭菌20 min。
脑心浸液固体培养基:在BHI液体培养基配方的基础上加入2%的琼脂粉。根据实验需要添加抗生素,其中大肠杆菌硫酸卡那霉素工作质量浓度为50 μg/mL,氯霉素工作质量浓度为30 μg/mL;谷氨酸棒杆菌硫酸卡那霉素工作质量浓度为10 μg/mL,氯霉素工作质量浓度为12 μg/mL,链霉素工作质量浓度为50 μg/mL。
种子培养基:葡萄糖30 g/L,(NH4)2SO4 3 g/L,KH2PO4 1.2 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 10 mg/L,MnSO4·H2O 10 mg/L,维生素B1(vitamin B1,VB1)0.5 mg/L,VH 0.1 mg/L,酵母粉5 g/L,玉米浆30 mL/L(400 g/L,121 ℃、20 min单独灭菌),豆粕水解液15 mL/L,pH 7.0~7.2。115 ℃灭菌15 min。
发酵培养基:葡萄糖80 g/L,(NH4)2SO4 8 g/L,KH2PO4 1.6 g/L,MgSO4·7H2O 1 g/L,FeSO4·7H2O 10 mg/L,MnSO4·H2O 10 mg/L,VB1 0.5 mg/L,VH 80 μg/L,蛋氨酸0.5 g/L,谷氨酸1 g/L,玉米浆35 mL/L(400 g/L,121 ℃、20 min单独灭菌),豆粕水解液20 mL/L,pH 7.0~7.2。115 ℃灭菌15 min。
1.2 仪器与设备
GL20A高速冷冻离心机:日本日立公司;ZWYR-D2403摇床:上海智城分析仪器制造有限公司;PTC-1148聚合酶链式反应(polymerase chain reaction,PCR)仪、ScanDrop 100核酸定量分析仪:美国BIO-RAD公司;DYYIII2稳压稳流电泳仪:北京六一仪器厂;Tanon-2500数码凝胶图像处理系统:上海天能科技有限公司;Eporator电击转化仪:德国Eppendorf公司;752分光光度计:上海分析仪器厂;HH-4恒温水浴锅:金坛市科学仪器厂;SS-325全自动灭菌锅:日本TOMY仪器有限公司;LRH-250A生化培养箱:广东医疗器械厂;Agilent 1100高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦公司。
1.3 方法
1.3.1 重组质粒的构建
本研究所用的引物见表2。质粒构建以E.coli DH5α为克隆宿主。
表2 本研究所用引物
Table 2 Primers used in this study
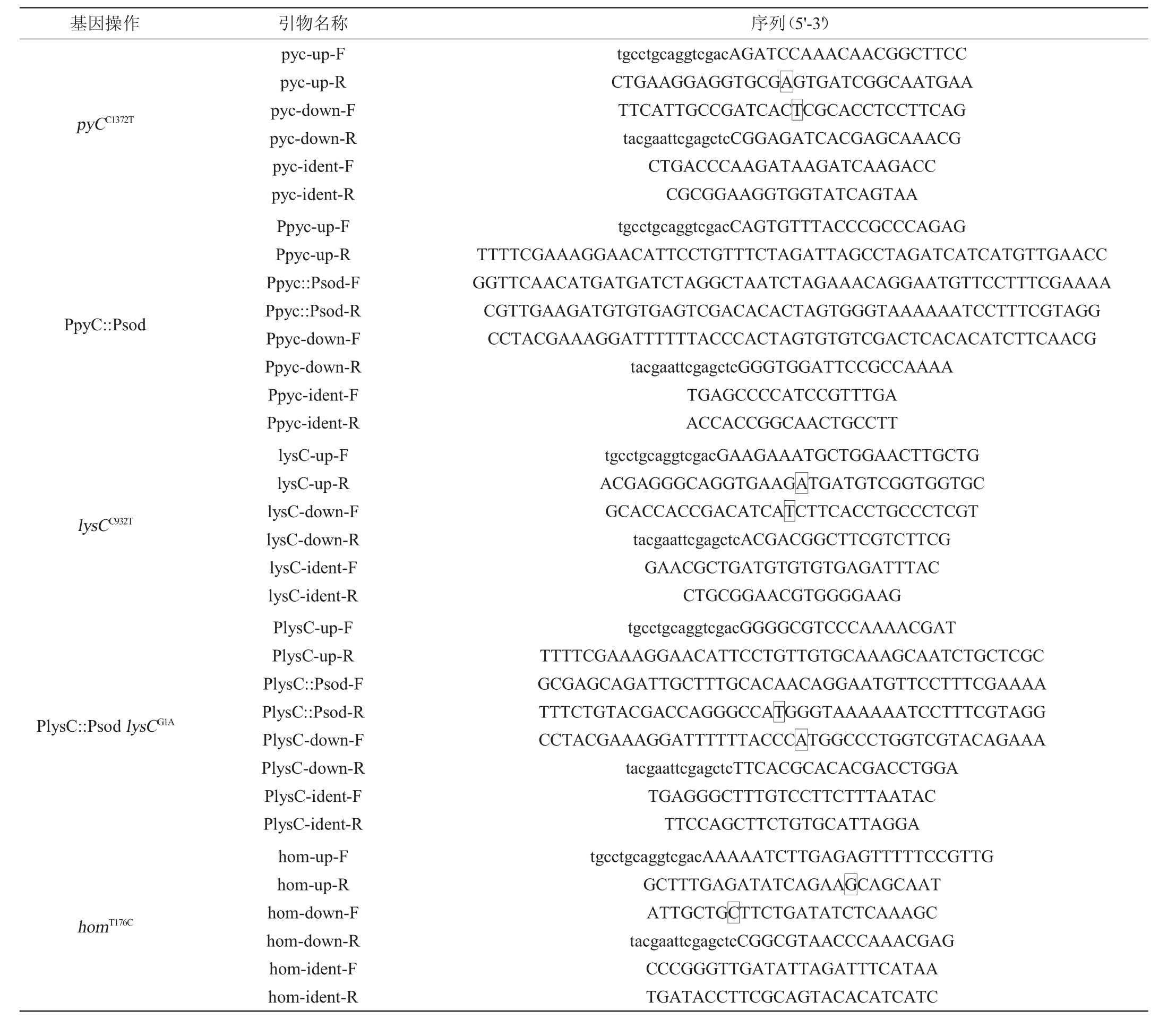
续表
过表达质粒pXtuf-ectABC的构建:分别以施氏假单胞菌(Pseudomonas stutzeri)ATCC 17588的基因组和pTrcECT质粒[13]为模板,扩增目的片段PSectABC和HEectABC。同时委托金唯智公司根据谷氨酸棒杆菌偏好性进行密码子优化和基因合成,获得PSectABCopt和HEectABCopt基因片段。扩增目的基因时在引物上添加与载体线性化后两侧同源的序列。用限制性核酸内切酶Hind III和BamH I酶切pXtuf质粒,得到线性化载体。利用同源重组的方法将目的基因和线性载体连接,获得ectABC操纵子过表达质粒pXtuf-PSectABC、pXtuf-PSectABCopt、pXtuf-HEectABC和pXtuf-HEectABCopt。菌落PCR用pXtuf质粒上Ptuf-ident引物和相应目的片段的下游引物鉴定,并送至金唯智公司进行测序验证。
基因组编辑pK18mobrpsL衍生质粒的构建:分别扩增基因组编辑位点的上下游同源臂、启动子片段和目的基因片段,各片段通过引物设计包含依次同源的序列,借助重叠PCR方法将各片段连接起来。同时用XbaI和KpnI双酶切pK18mobrpsL进行载体线性化。利用同源重组的方法将重叠片段和线性载体连接,获得pK18mobrpsL衍生质粒。菌落PCR鉴定采用通用引物M13-47和RV-M进行。
基因扩增PCR体系:5×Buffer 20 μL;脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(2.5 mmol)8 μL;引物1和引物2各4 μL;模板DNA(200~500 ng/μL)1 μL;Primer STAR HS DNA聚合酶1 μL;用双蒸水补至100 μL。
基因扩增PCR程序:95 ℃预变性5 min;98 ℃变性10 s;55 ℃退火(复性)30 s;72 ℃延伸1 min,30个循环;72 ℃再延伸10 min。
菌落PCR体系:双蒸水6.5 μL;引物1和引物2各0.5 μL;2×Taq Master Mix 7.5 μL。
菌落PCR程序:95 ℃预变性8 min;98 ℃变性30 s;55 ℃退火(复性)30 s;72 ℃延伸1 min,30个循环;72 ℃再延伸10 min。
1.3.2 菌株构建
谷氨酸棒杆菌基因组编辑采用作者团队开发的基于卡那霉素和链霉素筛选的两次同源交换技术[16]。菌株构建方法如下:将pK18mobrpsL衍生质粒电转入谷氨酸棒杆菌感受态细胞中,涂布在含有10 μg/mL卡那霉素的BHI固体平板上,32 ℃培养,待长出菌落后用相应的鉴定引物ident-F和RV-M(或M13-47和ident-R)鉴定,若有大小符合预期的条带则表示发生了一轮交换;随后将鉴定正确的单交换菌落接入含有卡那霉素的BHI摇管中,于32 ℃培养12 h后稀释涂布到含有50 μg/mL链霉素的平板上,待长出菌落后用相应的引物对ident-F和ident-R进行菌落PCR验证,若条带大小符合预期则表示第二轮交换成功。提取基因组、扩增相应片段并进行测序,最终确定获得正确的基因组编辑菌株。
过表达菌株的获得为将相应的pXtuf-ectABC质粒电转入感受态细胞中,涂布在含12 μg/mL氯霉素的BHI平板上,用构建质粒时使用的引物进行菌落PCR鉴定。
1.3.3 摇瓶发酵培养
菌种活化:用接种环从保菌管中取一环划线接种于BHI固体培养基,32 ℃条件下恒温静置培养20~24 h,即得到一代活化菌种。然后用接种环取一环菌体接种于另一支试管斜面,32 ℃条件下恒温静置培养12 h,得到二代活化菌种。
种子摇瓶培养:取活化好的二代试管斜面,用接种环刮取表层菌体,接种到装液量为30 mL/500 mL种子培养基中,置于往复旋转式摇床上,200 r/min、32 ℃条件下振荡培养12~14 h,测定OD600nm值。
发酵摇瓶培养:按10%(V/V)的接种量将种子液接入装液量为30 mL/500 mL发酵培养基中,置于往复旋转式摇床上,200 r/min、32 ℃条件下培养,定期测定OD600nm值,发酵48 h结束,取样测定赖氨酸或四氢嘧啶的质量浓度。
1.3.4 测定方法
赖氨酸质量浓度测定:取适量发酵液于1.5 mL EP管中,13 000 r/min 离心2 min后取上清,用去离子水稀释适当倍数备用,经2,4-二硝基氟苯衍生后过滤0.2 μm滤膜,进样HPLC检测,其色谱条件:色谱柱为Agilent ZORBAX Eclipse AAA氨基酸分析柱(150 mm×4.6 mm);流动相A:50%(V/V)的乙腈溶液,流动相B:50 mmol/L乙酸钠溶液,流动相A和B的比例为1∶1(V/V),流速1.0 mL/min;柱温30 ℃,检测波长360 nm;采用自动进样器进样,进样体积设置为10 μL。
四氢嘧啶质量浓度测定:采用Agilent 1100高效液相色谱仪进行检测,其色谱条件:色谱柱为Phenomenex Gemini 5u C18(250 mm×4.6 mm);流动相为2%乙腈,单泵模式,流速1.0 mL/min;柱温30 ℃,检测波长210 nm;采用自动进样器进样,进样体积设置为10 μL。
2 结果与分析
2.1 以赖氨酸积累量为评价指标强化天冬氨酸-β-半醛的合成途径
以链霉素抗性谷氨酸棒杆菌野生菌株出发构建四氢嘧啶生产菌,为了增强前体物天冬氨酸-β-半醛的代谢流,以赖氨酸积累量为评价指标进行测试。谷氨酸棒杆菌的赖氨酸代谢工程改造策略相对已经成熟[17],其中丙酮酸羧化酶(pyc编码)、天冬氨酸激酶(lysC编码)和高丝氨酸脱氢酶(hom编码)催化的途径为关键步骤[18]。为了解除草酰乙酸和天冬氨酸对丙酮酸羧化酶的反馈抑制,首先点突变pyc基因[17],引入丙酮酸羧化酶P458S突变体,然后将pyc启动子替换为强启动子Psod,获得菌株LYS-1。天冬氨酸激酶催化的反应是天冬氨酸组氨基酸合成的关键位点,受到赖氨酸、苏氨酸等产物的反馈抑制[19]。通过突变lysC基因引入C932T突变体,然后将基因lysC启动子替换为Psod启动子,同时将起始密码子GTG改为ATG,在解除天冬氨酸激酶反馈抑制的同时强化其表达,获得菌株LYS-2。高丝氨酸脱氢酶催化天冬氨酸-β-半醛生成高丝氨酸,进入苏氨酸和异亮氨酸的合成。作为竞争天冬氨酸-β-半醛的重要代谢支路,高丝氨酸脱氢酶的弱化表达非常关键。与直接失活该酶构件营养缺陷型菌株相比,引入渗漏型表达突变体为更好的策略,因为其在极大上程度控制代谢支流的同时,避免在培养基中添加苏氨酸等物质(增加生产成本和使工艺复杂化)。引入高丝氨酸脱氢酶渗漏型突变体[18],获得菌株LYS-3。
对这3株菌进行了摇瓶培养,48 h时取样测定,3株谷氨酸棒杆菌强化天冬氨酸-β-半醛供应的工程菌株的赖氨酸积累量见图1。
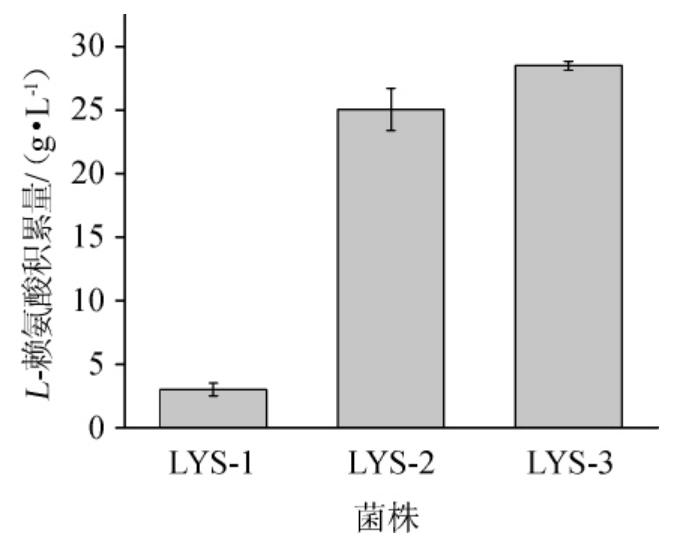
图1 3株谷氨酸棒杆菌强化天冬氨酸-β-半醛供应的工程菌株的L-赖氨酸积累量
Fig.1 L-lysine accumulation of 3 Corynebacterium glutamicum engineering strains fortified with aspartic acid-βsemialdehyde supply
由图1可知,菌株LYS-1积累了3.02 g/L赖氨酸,出发菌株C.glutamicum strpR的培养液中检测不到赖氨酸的分泌,说明强化丙酮酸羧化酶的表达,确实有助于赖氨酸的合成。与之相比,天冬氨酸激酶的改造菌株LYS-2的赖氨酸积累量大幅度提高,达到了25.05 g/L,可见突变天冬氨酸激酶发挥着重要的作用。在此基础上,弱化高丝氨酸脱氢酶的表达进一步促进了赖氨酸的生成量。由此可见,经过对野生菌株3个位点的理性改造,成功构建了一株高产赖氨酸的谷氨酸棒杆菌工程菌株LYS-3,赖氨酸积累量为28.48 g/L,其流经天冬氨酸-β-半醛的代谢流较为通畅,为后续工作奠定了基础。
2.2 引入异源基因构建四氢嘧啶合成途径
敲除菌株LYS-3的赖氨酸输出蛋白基因lysE,获得菌株LYS-4,作为表达异源四氢嘧啶合成的出发菌株。阻断赖氨酸输出通道后,赖氨酸无法排出细胞,胞内积累赖氨酸也会反馈抑制赖氨酸合成的关键酶,使得天冬氨酸-β-半醛不会过量流向赖氨酸合成方向。从天冬氨酸-β-半醛合成赖氨酸的第一个酶(二氢吡啶二羧酸合酶)为关键酶,其受到赖氨酸的强烈反馈抑制作用[19]。为了对比施氏假单胞菌(P.stutzeri)和伸长盐单胞菌(H.elongate)四氢嘧啶合成操纵子的作用效果,分别从施氏假单胞菌(P.stutzeri)基因组上扩增操纵子PSectABC,从pTrcECT质粒[13]扩增HEectABC,同时根据谷氨酸棒杆菌进行密码子优化和基因合成,获得PSectABCopt和HEectABCopt。以含有Ptuf启动子的pXMJ19衍生质粒pXtuf为框架,在谷氨酸棒杆菌LYS-4中分别表达这4个操纵子(PSectABC、PSectABCopt、HEectABC、HEectABCopt),得到菌株ECT-1、ECT-2、ECT-3、ECT-4。以携带空质粒的菌株(菌株ECT-0)为对照,进行摇瓶发酵。
菌株ECT-0、ECT-1、ECT-2、ECT-3、ECT-4的生物量积累及四氢嘧啶产量分别见图2和图3。
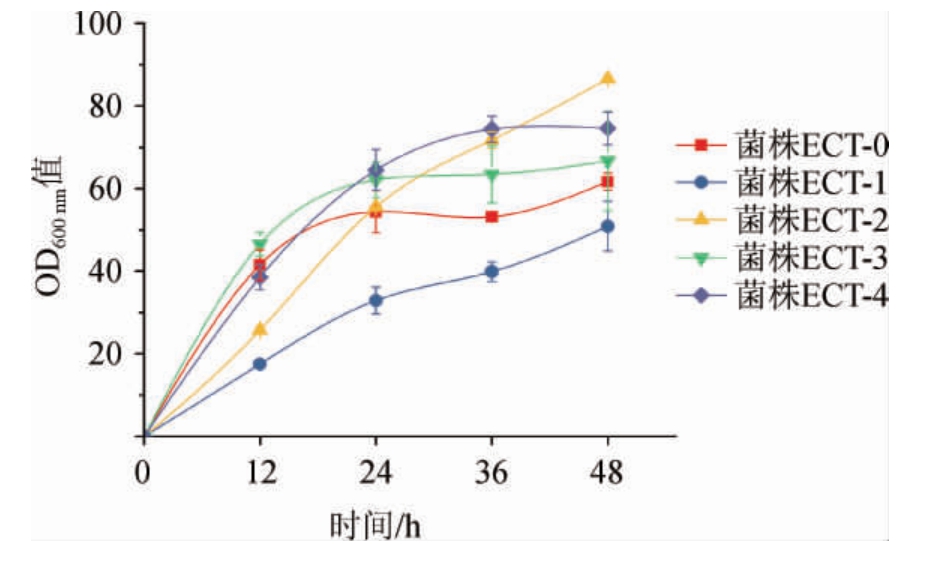
图2 表达不同ectABC谷氨酸棒杆菌摇瓶培养的生物量积累
Fig.2 Biomass accumulation of Corynebacterium glutamicum strains expressing different ectABC in shake flask culture
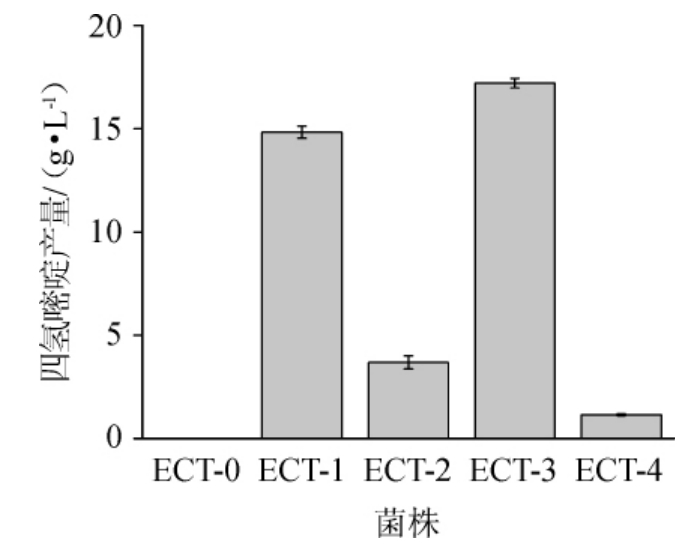
图3 表达不同ectABC谷氨酸棒杆菌摇瓶培养的四氢嘧啶产量
Fig.3 Ectoine production of Corynebacterium glutamicum strains expressing different ectABC in shake flask culture
由图2可知,与对照相比,表达PS来源操纵子的菌株ECT-1和ECT-2在24 h前生长变慢,但是24 h以后,菌株ECT-2的生物量呈现线性增长的趋势。表达HE来源基因的菌株ECT-3和ECT-4前期生长与对照菌株相当,后期生物量高于对照。
由图3可知,操纵子ectABC来源相同的菌株,四氢嘧啶产量越低菌株生长越好,可能由于基因表达效率存在差异,导致质粒的负荷不同。另外,四氢嘧啶为相容性物质,对细胞具有一定的保护性,也可能是影响菌株生长性能的一个原因。表达异源四氢嘧啶操纵子的谷氨酸棒杆菌均积累了一定浓度的四氢嘧啶。然而,密码子优化大幅降低了其产量。未进行密码子优化的菌株ECT-1和ECT-3均产生了高质量浓度的四氢嘧啶,其中菌株ECT-3(表达HEectABC)的四氢嘧啶产量最高,达到17.21 g/L。由于ectABC为操纵子结构,进行PSectABC密码子优化时并未改变后两个基因的RBS区。对于HEectABC,后两个基因区也可能各自带有启动子区(类似于海生嗜盐球菌的情况[12]),对基因间隔序列也无优化。尽管如此,两组密码子均导致四氢嘧啶产量大幅降低,优化后基因可能导致操纵子基因或转录的mRNA的二级结构发生改变,从而影响基因表达。
2.3 强化天冬氨酸转氨酶和NADPH再生途径
3株过表达基因aspC和ECpntAB谷氨酸棒杆菌摇瓶培养的四氢嘧啶产量比较结果见图4。
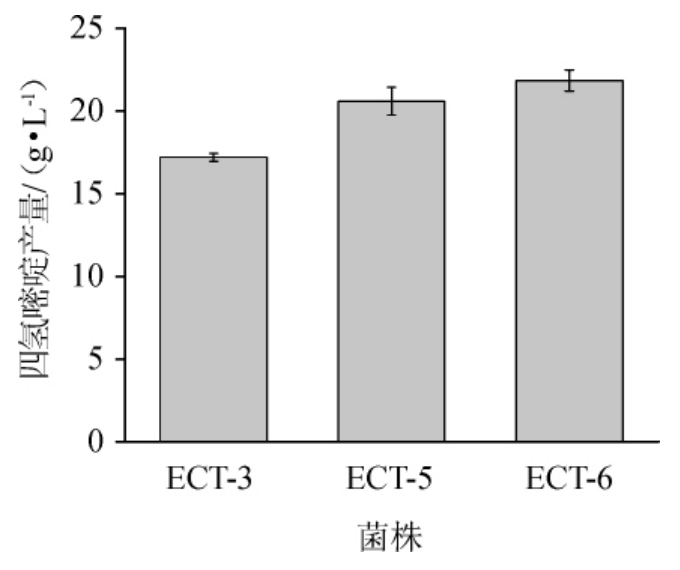
图4 过表达基因aspC和ECpntAB谷氨酸棒杆菌摇瓶培养的四氢嘧啶产量
Fig.4 Ectoine production of Corynebacterium glutamicum overexpressing gene aspC and ECpntAB in shake flask
由图4可知,将天冬氨酸转氨酶基因aspC的启动子替换为Psod,菌株ECT-5四氢嘧啶的产量提高了19.7%。由于生产1分子四氢嘧啶需要消耗3分子还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH),因此,在基因组整合表达了来自大肠杆菌的转氢酶(pntAB编码),结果表明四氢嘧啶产量进一步提高6.1%,达到21.85 g/L。表达大肠杆菌pntAB增强NADPH供应为代谢工程改造的有效策略[20-21],本研究中也促进了合成过程高需求NADPH的四氢嘧啶的生产。
天冬氨酸-β-半醛为天冬氨酸族产物合成的关键中间代谢物,强化其合成代谢流是保证四氢嘧啶高产的重要因素。从天冬氨酸-β-半醛出发,过表达2,4-二氨基丁酸转氨酶(ectB编码)也可以合成重要化合物2,4-二氨基丁酸,其在农业、医药和生物材料方面具有重要的应用价值[22]。引入DABA脱羧酶可以进一步延伸至产品1,3-丙二胺[23],二胺是合成聚氨酯、尼龙的单体物质,还包括腐胺(1,4-丁二胺)[24]和尸胺(1,5-戊二胺)[25]等。
3 结论
本研究以谷氨酸棒杆菌野生菌株ATCC 13032为出发菌株,通过理性代谢工程策略构建了四氢嘧啶高效生产菌株,摇瓶发酵产量可达21.85 g/L,接近目前报道的最高水平。结果表明,以赖氨酸积累量为评价指标,可以有效将细胞代谢流导向天冬氨酸-β-半醛,为其衍生物合成奠定基础。表达异源操纵子基因时,密码子优化可能会带来不利影响。研究结果为四氢嘧啶等天冬氨酸-β-半醛衍生物的合成提供参考。后续将进行系统代谢工程改造,提升菌株四氢嘧啶生产性能,并进行实验室水平发酵罐发酵过程优化研究。
[1] GALINSKI E A,PFEIFFER H P,TRÜPER H G.1,4,5,6-Tetrahydro-2-methyl-4-pyrimidinecarboxylicacid.Anovelcyclicaminoacidfromhalophilic phototrophic bacteria of the genus Ectothiorhodospira[J]. Eur J Biochem,1985,149(1):135-139.
[2] PASTOR J M,SALVADOR M,ARGANDOÑA M,et al.Ectoines in cell stress protection:Uses and biotechnological production[J].Biotechnol Adv,2010,28(6):782-801.
[3]SCHWIBBERT K,MARIN-SANGUINO A,BAGYAN I,et al.A blueprint of ectoine metabolism from the genome of the industrial producer Halomonas elongata DSM 2581[J].Environ Microbiol,2011,13(8):1973-1994.
[4]HANSJK,GEORGL,ERWINAG.Industrialproductionofthecellprotectant ectoine:Protection mechanisms,processes,and products[J]. Curr Biotechnol,2014,3(1):10-25.
[5] CZECH L,HERMANN L,STÖVEKEN N,et al.Role of the extremolytes ectoine and hydroxyectoine as stress protectants and nutrients:Genetics,phylogenomics,biochemistry,and structural analysis[J].Genes,2018,9(4):177.
[6]MAMALIS A,NGUYEN D H,BRODY N,et al.The active natural anti-oxidant properties of chamomile,milk thistle,and halophilic bacterial components in human skin in vitro[J].J Drugs Dermatol,2013,12(7):780-784.
[7]KANAPATHIPILLAI M,LENTZEN G,SIERKS M,et al.Ectoine and hydroxyectoine inhibit aggregation and neurotoxicity of Alzheimer's β-amyloid[J].FEBS Lett,2005,579(21):4775-4780.
[8] KANAPATHIPILLAI M,KU S H,GIRIGOSWAMI K,et al.Small stress molecules inhibit aggregation and neurotoxicity of prion peptide 106-126[J].Biochem Bioph Res Co,2008,365(4):808-813.
[9] WANG Y,ZHANG L H.Ectoine improves yield of biodiesel catalyzed by immobilized lipase[J].J Mol Catal B:Enzym,2010,62(1):90-95.
[10]ZHANG L H,LANG Y J,WANG C X,et al.Promoting effect of compatible solute ectoine on the ethanol fermentation by Zymomonas mobilis CICC10232[J].Process Biochem,2008,43(6):642-646.
[11]SAUER T,GALINSKI E A.Bacterial milking:A novel bioprocess for production of compatible solutes[J].Biotechnol Bioeng,1998,59(1):128.
[12]BESTVATER T,LOUIS P,GALINSKI E A.Heterologous ectoine productioninEscherichiacoli:By-passingthe metabolic bottle-neck[J].Saline Syst,2008,4:12.
[13] NING Y K,WU X J,ZHANG C L,et al.Pathway construction and metabolic engineering for fermentative production of ectoine in Escherichia coli[J].Meta Eng,2016,36:10-18.
[14]BECKER J,SCHÄFER R,KOHLSTEDT M,et al.Systems metabolic engineering of Corynebacterium glutamicum for production of the chemical chaperone ectoine[J].Microb Cell Fact,2013,12(1):110.
[15] PÉREZ-GARCÍA F,ZIERT C,RISSE J M,et al.Improved fermentative production of the compatible solute ectoine by Corynebacterium glutamicum from glucose and alternative carbon sources[J]. J Biotechnol,2017,258:59-68.
[16] WANG T,LI Y J,LI J,et al.An update of the suicide plasmid-mediated genome editingsystem in Corynebacterium glutamicum[J].Microb Biotechnol,2019,12(5):907-919.
[17] BECKER J,ZELDER O,HÄFNER S,et al.From zero to hero--designbased systems metabolic engineering of Corynebacterium glutamicum for L-lysine production[J]. Metab Eng,2011,13(2):159-168.
[18]IKEDA M,OHNISHI J,HAYASHI M,et al.A genome-based approach to create a minimally mutated Corynebacterium glutamicum strain for efficient L-lysine production[J].J Ind Microbiol Biotechnol,2006,33(7):610-615.
[19]LI Y J,WEI H B,WANG T,et al.Current status on metabolic engineering for the production of L-aspartate family amino acids and derivatives[J].Bioresour Technol,2017,245:1588-1602.
[20] LIANG B,SUN G N,WANG Z B,et al.Production of 3-hydroxypropionate using a novel malonyl-CoA-mediated biosynthetic pathway in genetically engineered E.coli strain[J].Green Chem,2019,21(22):6103-6115.
[21]ZHANG Y,LI Z H,CEN X C,et al.Systems metabolic engineering of Vibrio natriegens for the production of 1,3-propanediol[J].Metab Eng,2021,65:52-65.
[22]徐虹,冯小海,张扬,等.一种制备L-2,4-二氨基丁酸的方法:CN201110060255.3[P].2011-03-14.
[23]CHAE T U,KIM W J,CHOI S,et al.Metabolic engineering of Escherichia coli for the production of 1,3-diaminopropane,a three carbon diamine[J].Sci Rep,2015,5(1):13040.
[24]QIAN Z G,XIA X X,LEE S Y.Metabolic engineering of Escherichia coli for the production of putrescine:A four carbon diamine[J]. Biotechnol Bioeng,2009,104(4):651-662.
[25]KIND S,NEUBAUER S,BECKER J,et al.From zero to hero-production of bio-based nylon from renewable resources using engineered Corynebacterium glutamicum[J].Metab Eng,2014,25:113-123.