甘露聚糖是自然界中半纤维素的第二大组分[1],普遍存在于植物性食品及动物饲料中,它是一种抗营养因子,在家禽和猪等单胃动物体内会形成凝胶,使消化道内容物有很大的黏性,从而影响营养物质的消化吸收[2-3]。β-1,4-D-甘露聚糖酶(β-1,4-D-mannanase)是一类水解甘露聚糖、半乳甘露聚糖、葡萄甘露聚糖以及半乳葡萄甘露聚糖中β-1,4-D-吡喃甘露糖苷键的内切酶[4-6],广泛存在于动植物和微生物中。β-甘露聚糖酶用于饲料工业,不仅可以消除饲料中的抗营养因子甘露聚糖,其水解产物甘露低聚糖还可以改善饲料营养、提高饲料利用率、促进畜禽生长[7],同时还能促进双歧杆菌和乳酸杆菌等有益菌的增殖,抑制病原菌生长,改善肠道微生态环境,显著提高动物免疫功能,减少饲料中抗生素等化学药物的使用,从而减少养殖污染[8]。β-甘露聚糖酶在自然界中普遍存在,微生物是其最主要的生产来源。虽然目前国内外已有很多通过分子技术手段,使β-甘露聚糖酶异源表达水平大大提高的报道[9-10],但现有的微生物β-甘露聚糖酶因生物安全性问题,限制了其在饲料生产领域的应用[11],因此筛选更为安全的生产菌株,增加野生β-甘露聚糖酶生产菌的种质资源至关重要。
本试验通过刚果红平板初筛和液体发酵复筛的方法,从不同地区的魔芋生产基地土壤中,筛选分离β-甘露聚糖酶高产菌株;通过形态学察、生理生化试验及分子生物学的方法对所筛选的菌株进行鉴定,并对其所产β-甘露聚糖酶的酶学性质进行了研究,以期为β-甘露聚糖酶在饲料工业中的广泛应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
土壤样品:采自河南省南阳西峡县、河南省南阳西峡县后塘沟村、云南省昆明市盘龙区新发村、福建省南平市政和县天井洋村等地的魔芋生产基地。
1.1.2 主要试剂
胰蛋白胨、酵母膏、琼脂粉、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、魔芋粉:北京索莱宝生物科技有限公司;甘露糖:麦克林生物技术有限公司;甘露聚糖:美国Sigma公司;琼脂糖:北京鼑国生物技术有限责任公司;API 50CHB、ZYM鉴定试剂盒:物梅里埃中国有限公司;DNA Marker、2×Es Taq脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶:北京康为世纪生物科技有限公司;3,5-二硝基水杨酸(dinitrosalicylic acid,DNS):北京酷来搏科技有限公司;Ezup柱式细菌基因组DNA抽提试剂盒:美国Omega Bio-Tec公司;细菌16SrDNA通用引物27F和1492R:深圳华大基因科技有限公司。试验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
富集培养基:魔芋精粉5 g/L,蛋白胨6 g/L,酵母膏1 g/L,NaCl 0.05 g/L,蒸馏水1 000 mL,pH值7.0。121 ℃灭菌15 min。
初筛分离培养基:魔芋精粉3 g/L,蛋白胨6 g/L,酵母膏1 g/L,K2HPO4 1 g/L,MgSO4 0.25 g/L,刚果红0.5 g/L,琼脂15 g/L,蒸馏水1 000 mL,pH值7.0。121 ℃灭菌15min。
发酵培养基:魔芋精粉15g/L,蛋白胨8g/L,酵母膏4g/L,K2HPO4 1 g/L,MgSO4 0.25 g/L,蒸馏水1 000 mL,pH值7.0~7.2。121 ℃灭菌15 min。
种子培养基采用LB培养基:胰蛋白胨10 g/L,酵母膏5 g/L,NaCl 5 g/L,蒸馏水1 000 mL,pH 值7.0。121 ℃灭菌15 min。
1.2 仪器与设备
K-8D电热恒温水槽:上海精宏实验设备有限公司;QYCAxioImageM2全自动荧光显微镜:德国Zeiss公司;Thermoblock梯度电泳仪:德国Biometra公司;TCYQ全温摇瓶柜:太仓市豪成实验仪器制造有限公司;Varioskan Flash全波长扫描式多功能读数仪:美国Thermo公司;DChemiDoc XRS+化学发光成像分析系统:美国Bio-Rad公司;DYY-6C电泳仪:北京六一生物科技有限公司;Biometra TGRADIENT聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Waterman公司。
1.3 方法
1.3.1 高产β-甘露聚糖酶菌株的筛选
取10 g土壤样品于装液量为100 mL/250 mL富集培养基中,在30 ℃、180 r/min条件下摇床培养24 h,将富集培养液用无菌水梯度稀释成10-1、10-2、10-3、10-4、10-5后,取100 μL涂布于初筛分离培养基上,置于30 ℃培养箱倒置培养48 h后,记录透明圈直径(D)与菌落直径(d)之比(D/d),作为产β-甘露聚糖酶菌株能力的初筛标准。选用D/d值较大即产酶能力较强的菌株,接入种子培养基,30 ℃、180 r/min摇床培养18 h后,按3%(V/V)的接种量转接到发酵培养基中,相同条件摇床培养24 h,在4 ℃、10 000 r/min条件下离心10 min,上清液即粗酶液,测定β-甘露聚糖酶酶活,复筛菌株。
1.3.2 分析检测
β-甘露聚糖酶的酶活测定按照国标GB/T 36861—2018《饲料添加剂β-甘露聚糖酶活力的测定分光光度法》[13]。β-甘露聚糖酶酶活定义:在37 ℃、pH值为5.5条件下,每分钟从质量浓度为3 mg/mL甘露聚糖溶液中释放1 μmol还原糖所需要的酶量为1个酶活力单位(U/mL)。
1.3.3 高产β-甘露聚糖酶菌株的鉴定
形态学观察:对筛选分离纯化的菌株进行菌落和细胞形态观察,并进行革兰氏染色[12]。
生理生化鉴定:通过API 50CHB和ZYM鉴定试剂盒,对所筛选的菌株进行生理生化鉴定。
分子生物学鉴定:将菌株接种于LB液体培养基上,在30 ℃、180 r/min条件下摇床培养过夜,采用Ezup柱式细菌基因组DNA抽提试剂盒提取筛选菌株的基因组DNA,以其为模板,采用16S rDNA通用引物27F和1492R扩增目标菌株的16S rDNA序列。PCR反应体系(30 μL)为:脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)1 μL,2×Es Taq酶15 μL,引物27F和1492R(20 μmol/L)各1 μL,无菌双蒸水12 μL,混匀。PCR扩增程序:94 ℃预变性10 min;94 ℃变性30 s,52 ℃复性40 s,72 ℃延伸90 s,25个循环;72 ℃延伸5 min,4 ℃终止反应。PCR产物经1%琼脂糖凝胶电泳检测后,送至华大基因公司进行测序。将所得序列结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank基因库中进行基本局部比对工具(basic local alignment search tool,BLAST)检索,选取同源性较高的已知菌种的16S rDNA序列,采用MEGA 7.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.4 β-甘露聚糖酶酶学性质分析
参考张建新等[14]的双水相萃取法,在16%(NH4)2SO4、18%PEG2000和2%NaCl的双水相体系条件下,对粗酶液进行纯化,纯化后的酶液用于酶学性质分析。
最适反应pH值:采用不同缓冲体系配成一系列浓度0.1 mol/L的缓冲液,缓冲体系和pH值范围分别为:甘氨酸-HCl缓冲液(pH 3.0)、柠檬酸-柠檬酸钠缓冲液(pH 4.0、pH 5.0)、磷酸钠缓冲液(pH 6.0、pH 7.0、pH 8.0)、甘氨酸-NaOH缓冲液(pH 9.0、pH 10.0)。底物分别用上述不同pH值的缓冲液配制后,在pH 3.0~10.0反应体系下,37 ℃条件下保温30 min,测定β-甘露聚糖酶活力。
pH值稳定性:将酶液与不同pH值(3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0)缓冲液混合,37 ℃保温2 h后,测定β-甘露聚糖酶活力,计算相对酶活。
最适温度:在pH5.5、0.1 mol/L的乙酸-乙酸钠缓冲液体系中,在不同温度(30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃)条件下反应30 min,测定β-甘露聚糖酶活力。
温度稳定性:酶液在pH 5.5 0.1 mol/L的乙酸-乙酸钠缓冲液体系中,不同温度(40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃)条件下,保温30 min,立即冰水浴冷却,用未经温度处理的酶液作对照,测定β-甘露聚糖酶活力,计算相对酶活。
金属离子和乙二胺四乙酸(EDTA)对酶活力的影响:在酶反应体系中,分别加入金属离子(Na+、K+、Mn2+、NH4+、Mg2+、Fe2+、Cu2+、Li+、Ca2+、Co2+)和EDTA溶液(使终浓度为2.5 mmol/L),以未加金属离子和螯合剂为对照,测定β-甘露聚糖酶活力。
2 结果与分析
2.1 β-甘露聚糖酶高产菌株的筛选鉴定
2.1.1 β-甘露聚糖酶高产菌株的分离筛选
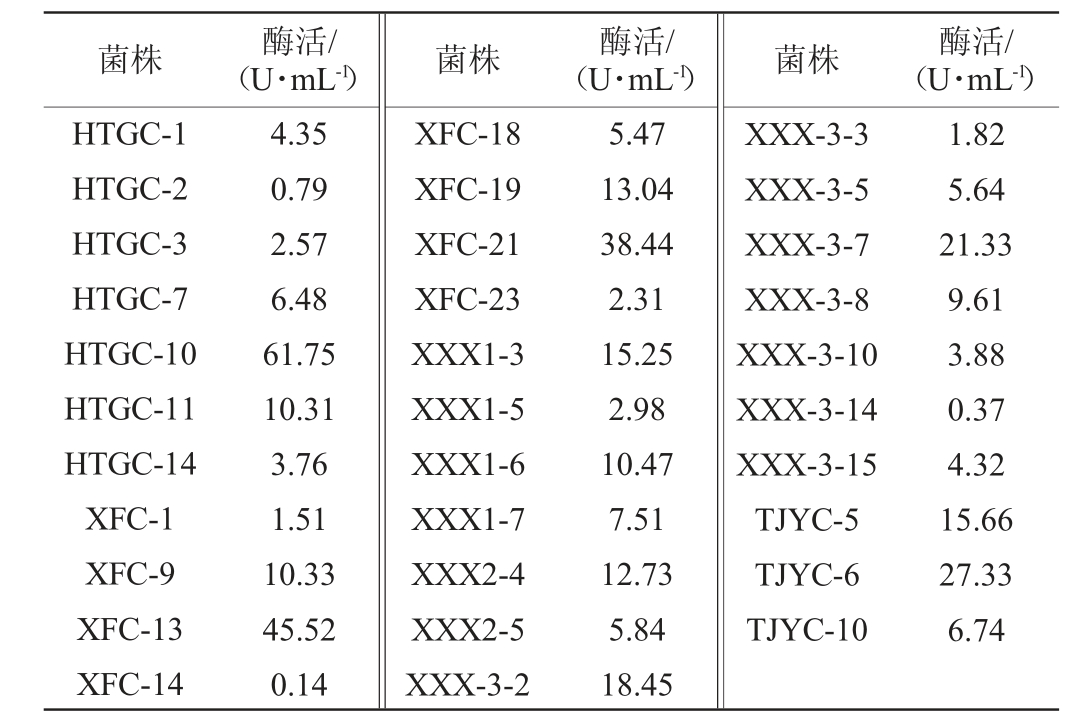
通过平板初筛的方法,从不同地区魔芋生产基地的土壤中,共分离筛选得到32株在初筛平板上D/d值较大的菌株,其中6株有代表性的菌株在初筛平板上形成的透明圈见图1。32株菌经液体发酵24 h复筛后,上清液酶活见表1。由表1可知,分自河南省南阳西峡县后塘沟村土壤样品的菌株HTGC-10经液体发酵24 h后,发酵液中β-甘露聚糖酶活力最高,可以达到61.75 U/mL,其产酶能力显著高于现有报道的多数野生菌株[15-17],且经反复发酵后产酶能力稳定。因此,进一步对菌株HTGC-10进行鉴定。
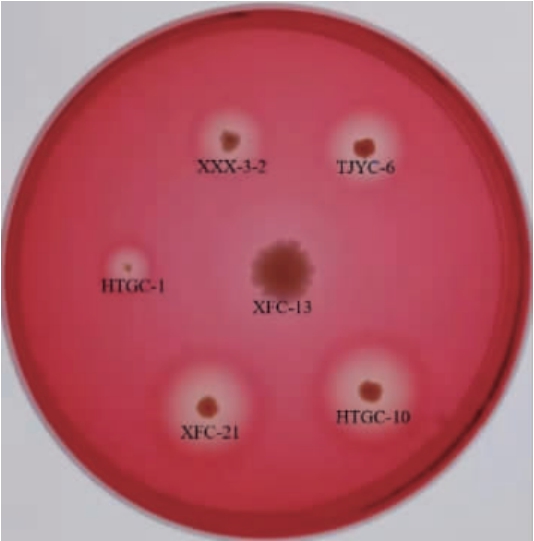
图1 6株代表性菌株在初筛平板上形成的透明圈
Fig.1 Transparent circles formed by 6 representative strains on the primary screening plate
菌株HTGC-10、XFC-21、HTGC-1、XXX3-2、TJYC-6和XFC-13的D/d值分别为4.56、4.50、5.16、3.20、3.92和1.15。
表1 32株分离菌株的β-甘露聚糖酶活力
Table 1 β-mannanase activity of 32 isolated strains
2.1.2 高产β-甘露聚糖酶菌株的鉴定
菌株HTGC-10的菌落及细胞形态见图2。由图2A可知,菌落呈圆形,无色半透明,表面光滑湿润,边缘整齐,将菌落挑起后有明显拉丝现象。由图2B可知,经革兰氏染色结果发现,菌株HTGC-10产椭圆形芽孢,芽孢呈蓝紫色,因此鉴定其为革兰氏阳性菌。
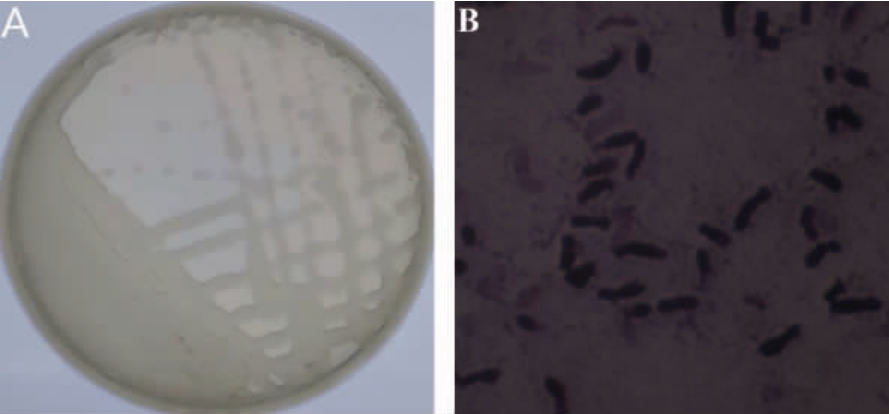
图2 菌株HTGC-10的菌落(A)及细胞(B)形态
Fig.2 Colony (A) and cell (B) morphology of strain HTGC-10
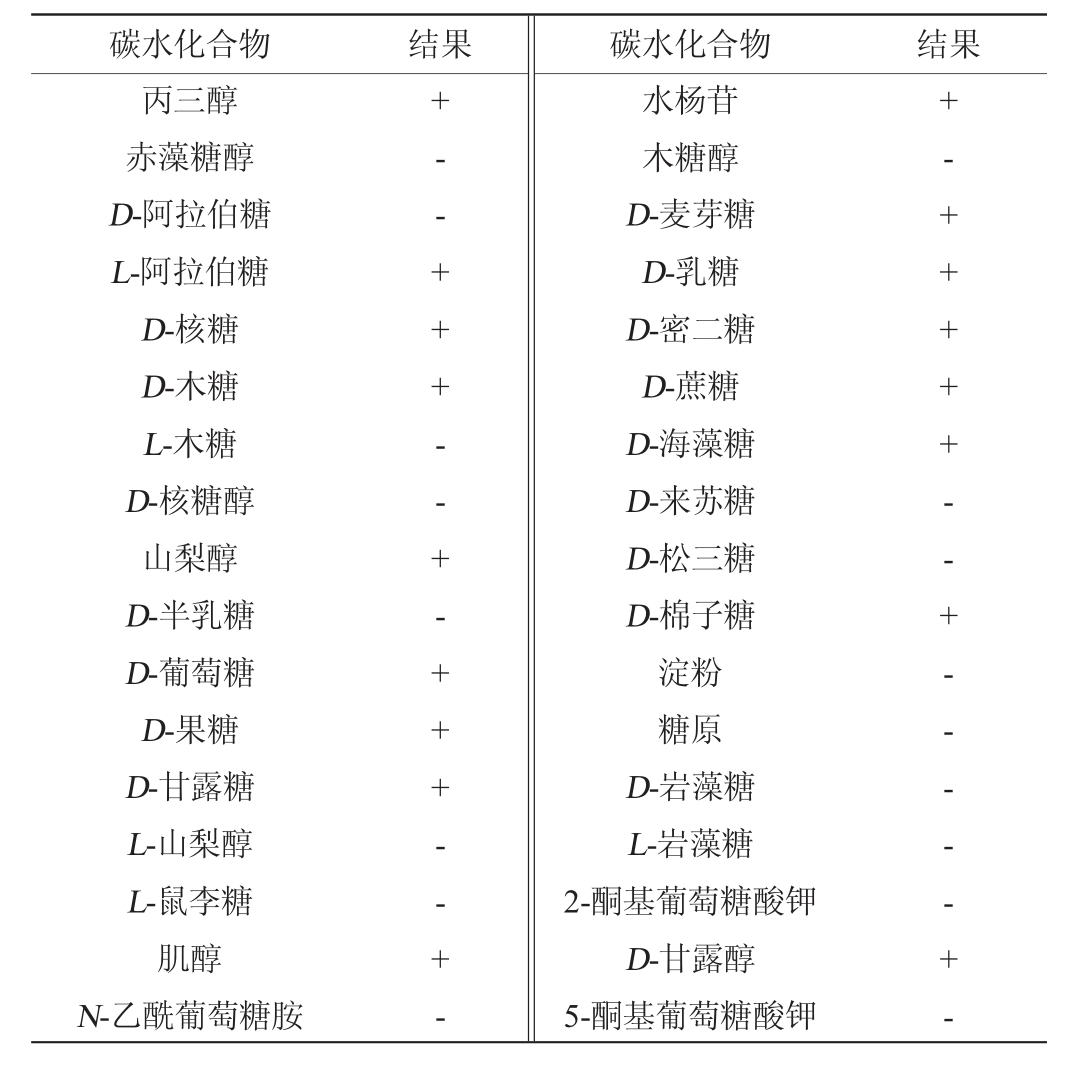
菌株HTGC-10的接触酶反应(contact enzyme reaction,ZYM)和可利用碳源(API 50CHB)试验结果分别见表2、表3。
表2 菌株HTGC-10的接触酶反应结果
Table 2 Contact enzyme reaction results of strain HTGC-10
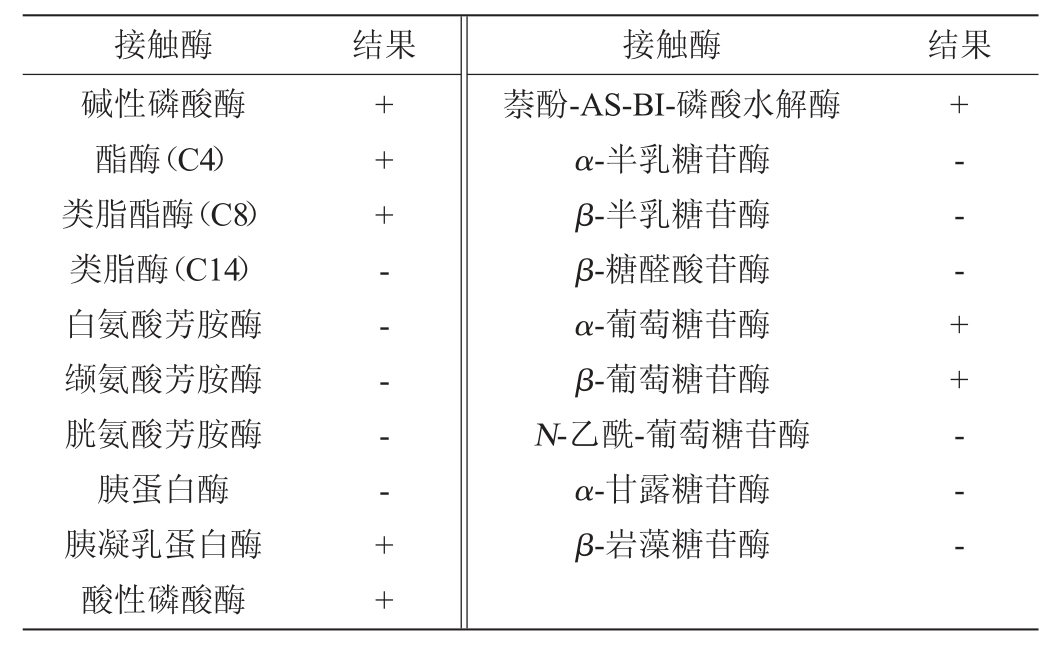
注:“+”表示结果呈阳性或生长;“-”表示结果呈阴性或不生长。下同。
表3 菌株HTGC-10的碳源利用能力
Table 3 Carbon source utilization capacity of strain HTGC-10
菌株HTGC-10的16S rDNA PCR扩增产物电泳结果见图3。由图3可知,菌株HTGC-10在1 500 bp附近有明显条带,经过测序,菌株HTGC-10的16S rDNA序列长度为1 493 bp。
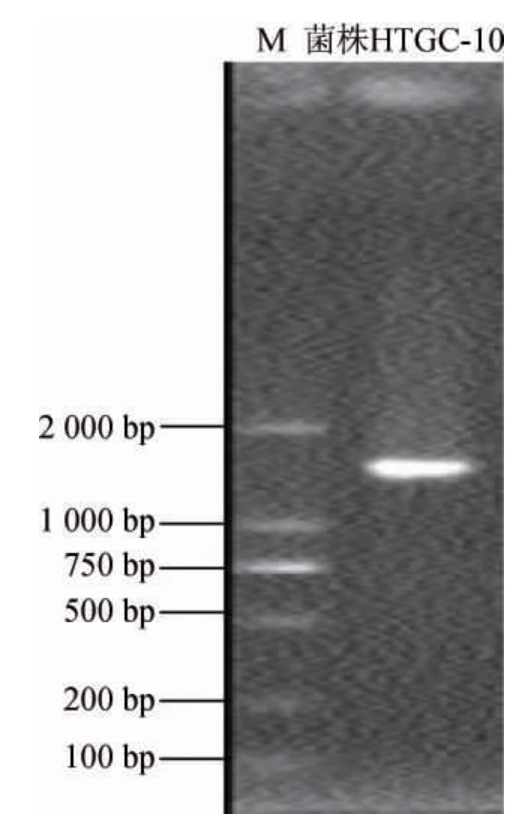
图3 菌株HTGC-10的16S rDNA聚合酶链式反应扩增产物电泳结果
Fig.3 Electrophoresis results of 16S rDNA polymerase chain reaction amplification products of strain HTGC-10
M为DNA Marker。
菌株HTGC-10的系统发育树见图4。由图4可知,菌株HTGC-10与Bacillus amyloliquefaciens的相似度最高,结合菌株HTGC-10的菌落形态特征、生理生化试验结果和16SrDNA分析,该菌株被鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
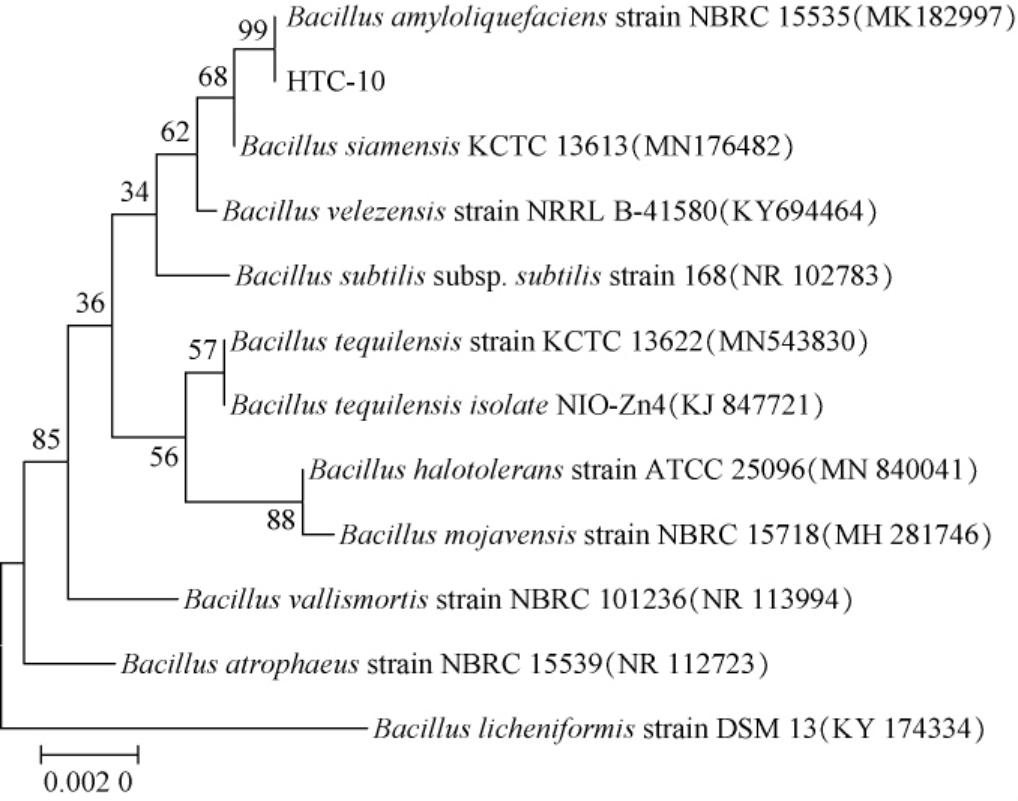
图4 基于16S rDNA序列菌株HTGC-10的系统发育树
Fig.4 Phylogenetic tree of strain HTGC-10 based on 16S rDNA sequence
2.2 菌株HTGC-10产β-甘露聚糖酶的酶学性质
2.2.1 pH值对酶活力的影响
pH值对甘露聚糖酶活力的影响见图5。由图5可知,在pH3.0~6.0时,随着pH值的升高,酶活力迅速升高,并在pH值为6.0时其酶活达到最高,为54.94 U/mL;而在pH 6.0~10.0时,酶活力随着pH值的升高则逐渐下降,在pH10.0时的酶活力仅为pH 6.0时的2.7%,说明该酶适合在弱酸性的条件下发挥作用。因此,菌株HTGC-10产β-甘露聚糖酶的最适反应pH值为6.0,偏酸性,这与已报道[18-20]的芽孢菌产生的β-甘露聚糖酶的酶学性质相似。
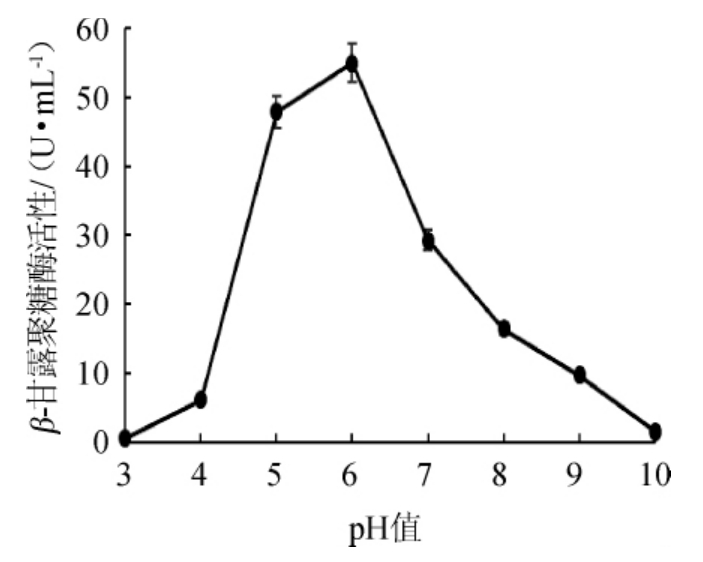
图5 反应pH值对β-甘露聚糖酶活力的影响
Fig.5 Effect of reaction pH value on β-mannanase activity
2.2.2 温度对酶活力的影响
不同反应温度对β-甘露聚糖酶活力的影响结果见图6。由图6可知,当反应温度在30~55 ℃时,随温度的升高,酶活力逐渐升高,并在温度55 ℃时β-甘露聚糖酶达到最高,为84.97 U/mL;而当反应温度>55 ℃之后,酶活力随温度的升高迅速下降,70 ℃时的酶活力仅为55 ℃的15.1%。因此,菌株HTGC-10产β-甘露聚糖酶的最适反应温度为55 ℃,这与黄俊丽等[11]筛选的假单胞菌产生的酶的最适反应温度相似。
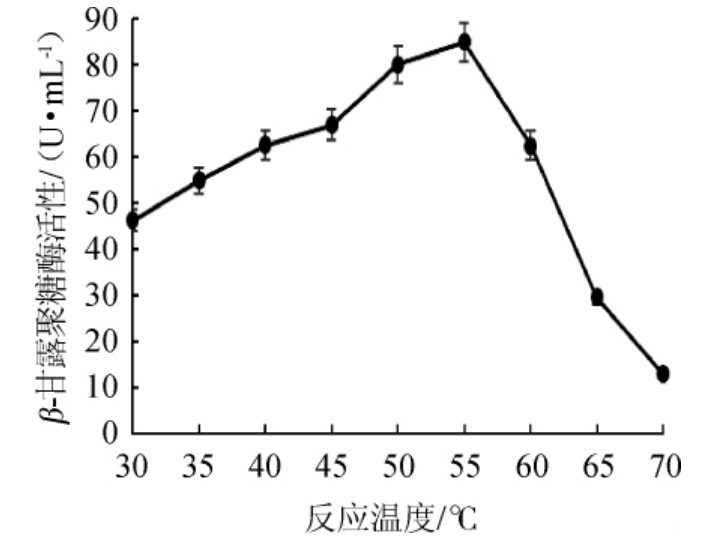
图6 反应温度对β-甘露聚糖酶活力的影响
Fig.6 Effect of reaction temperature on β-mannanase activity
2.2.3 β-甘露聚糖酶的pH稳定性
将酶液与不同pH缓冲液混合,37 ℃保温2 h后,剩余β-甘露聚糖酶活性见图7。由图7可知,在pH 3.0、5.0~9.0保温后,剩余相对酶活力均在60%以上,表明酶在该pH范围内时,活性相对稳定,但当pH值等于4.0或大于9.0 时,酶活力迅速下降,相对酶活力均在5%以下,说明该酶偏碱性条件耐受性较差;这里比较特殊的是,在pH4.0保温2 h后,出现了大量沉淀,酶活力只有最高活力的3.9%,这可能与酶的等电点有关,该观点需要进一步试验证明。
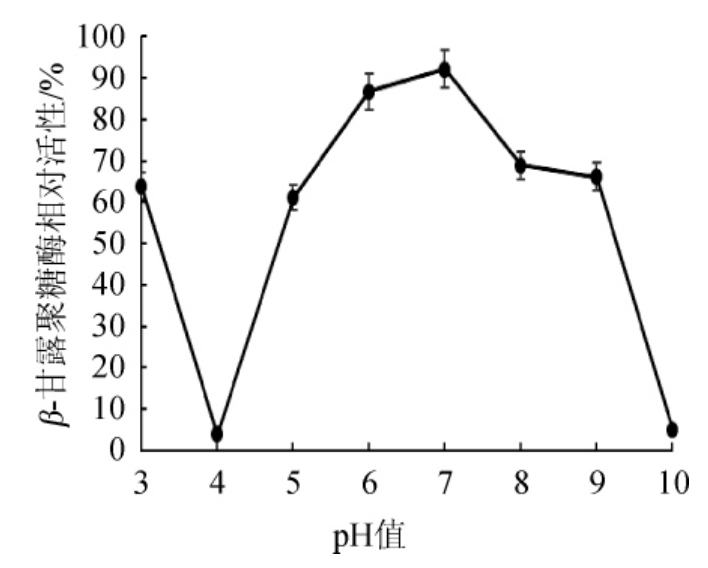
图7 pH值对β-甘露聚糖酶稳定性的影响
Fig.7 Effect of pH value on β-mannanase stability
2.2.4 β-甘露聚糖酶的热稳定性
温度对酶稳定性的影响见图8。由图8可知,该酶在40 ℃相对稳定,保温30 min后剩余酶活力为原酶活力的82.1%,但随着温度的升高,酶活力迅速下降,在45 ℃条件下保温30 min后,活力为原酶活力的24.3%,后随着温度的升高,酶活力继续下降,在温度达到55 ℃以上保温30 min后,β-甘露聚糖酶几乎已经完全失活。由此可知,本试验筛选菌株HTGC-10产β-甘露聚糖酶的热稳定性相对较差。
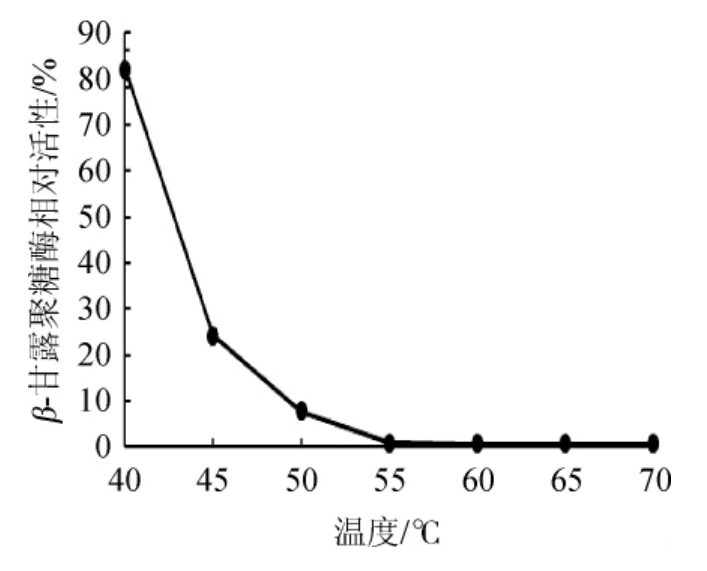
图8 温度对β-甘露聚糖酶稳定性的影响
Fig.8 Effect of temperature on the β-mannanase stability
2.2.5 金属离子和EDTA对酶活力的影响
金属离子和EDTA对酶活性的影响见图9。由图9可知,EDTA对酶活有显著的抑制作用,与对照组相比,酶活力下降了24.3%;金属离子Li+和Co2+对酶活力基本没有影响;其余金属离子Na+、K+、Mn2+、NH4+、Mg2+、Fe2+、Cu2+、Ca2+对酶活力均有不同程度的抑制作用,其中Cu2+对酶活力的抑制作用最显著,加入Cu2+后,酶活力仅为对照组酶活力的11.9%,这与张建新等[14]报道的Cu2+对枯草芽孢杆菌YZ-21产生的β-甘露聚糖酶活性有显著抑制作用相似。
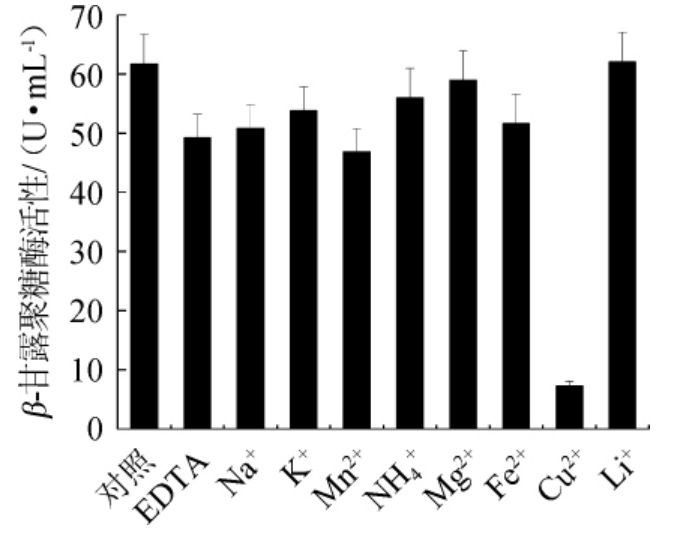
图9 乙二胺四乙酸和金属离子对β-甘露聚糖酶活力的影响
Fig.9 Effect of ethylene diamine tetraacetic acid and mental ions on β-mannanase activity
3 结论
本试验经过平板初筛和液体发酵复筛的方法,从不同地区的魔芋生产基地采集的土壤样品中,筛选出一株高产β-甘露聚糖酶活性菌株HTGC-10,该菌株液体发酵24 h后,β-甘露聚糖酶活力可以达到61.75 U/mL;经过形态学观察、ZYM和API 50CHB生理生化试验及16S rDNA序列分析,鉴定菌株HTGC-10为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。菌株HTGC-10所产β-甘露聚糖酶的最适反应pH值为6.0,具有较强的pH值耐受能力,最适反应温度为55 ℃,热稳定性相对较差;EDTA和金属离子Na+、K+、Mn2+、NH4+、Mg2+、Fe2+、Cu2+、Ca2+对酶活力均有不同程度的抑制作用,其中Cu2+对酶活力的抑制作用最显著。菌株HTGC-10具有较好的产β-甘露聚糖酶能力,有一定的开发利用价值。
[1] PUNTA M,COGGILL P C,EBERHARDT R Y,et al.The Pfam protein families database[J].Nucleic Acids Res,2012,40(1):290-301.
[2]SRIVASTAVA P K,KAPOOR M.Production,properties,and applications of endo-β-mannanases[J].Biotechnol Adv,2017,35(1):1-19.
[3]SAK-UBOL S,NAMVIJITR P,PECHSRICHUANG P,et al.Secretory production of a β-mannanase and a chitosanase using a Lactobacillus plantarum expression system[J].Microb Cell Fact,2016,15:81-92.
[4]张蕊,朱虹,周峻沛,等.β-甘露聚糖酶分子生物学研究进展[J].中国农业科技导报,2018,20(5):34-46.
[5]唐诗涵,李雪晴,袁风娇,等.β-甘露聚糖酶AuMan5Aloop/H321G 在乳酸克鲁维酵母中的高效表达[J].食品与生物技术学报,2019,38(7):25-32.
[6]MADHAVAN A,SUKUMARAN R K.Secreted expression of an active human interferon-β(HuIFN β)in Kluyveromyces lactis[J].Eng Life Sci,2016,16(4):379-385.
[7]张建新,宋宜乐,冯军厂,等.微生物β-甘露聚糖酶的研究进展[J].中国酿造,2019,38(4):7-10.
[8]黄俊丽,包凌霞,王贵学.β-甘露聚糖酶产生菌的分离、鉴定及产β-甘露聚糖酶最适条件的研究[J].生物技术通报,2009,25(7):166-170.
[9]那金,王瑶,郭尚旭,等.异源表达细菌β-甘露聚糖酶研究进展[J].农学学报,2017,7(12):18-21.
[10]DAWOOD A,MA K.Applications of microbial beta-mannanases[J]. Front Bioeng Biotechnol,2020,8:598630.
[11]黑龙江大学.一种短乳杆菌产甘露聚糖酶的方法:CN 20191064507810[P].2019-10-01.
[12]李长影,孔雯,王家昕,等. β-甘露聚糖酶产生菌的分离鉴定和酶学性质[J].华中农业大学学报,2011,30(2):138-142.
[13]国家市场监督管理局,中国国家标准化管理委员会.GB/T 36861—2018 饲料添加剂β-甘露聚糖酶活力的测定分光光度法[S].北京:中国标准出版社,2018.
[14]张建新,韩科芳,刘起丽,等.产β-甘露聚糖酶内生菌最适发酵条件的优化[J].饲料工业,2012,33(14):89-94.
[15]曲丽娜,王瑞明,肖静,等.β-甘露聚糖酶高产菌株发酵条件优化[J].食品与发酵工业,2012,38(12):64-67.
[16]赵月菊,薛燕芬,马延和.β-甘露聚糖酶的结构生物学研究现状和展望[J].微生物学报,2009,4(9):1131-1137.
[17]PRAKRAM S C,PRINCE S,NEENA P,et al.Purification and characterization of an alkali-thermostable β-mannanase from Bacillus nealsonii PN-11 and its application in mannooligosaccharides preparation having prebiotic potential[J].Eur Food Res Technol,2014:2170-2177.
[18] SUMMPUNN P,CHAIJAN S,ISARANGKUL D,et al.Characterization gene cloning and heterologous expression of β-mannanase from a thermophilic Bacillus subtilis[J].J Microbiol,2011,49(1):86-93.
[19]张建新,郭祥瑞,穆广亚,等.椰果内生枯草芽孢杆菌YZ-21 产β-甘露聚糖酶的纯化及酶学性质研究[J].河南师范大学学报(自然科学版),2020,48(3):95-102.
[20]李晓艳,张庆芳,于爽,等.β-甘露聚糖酶生产菌株的筛选鉴定及发酵条件的研究[J].大连大学学报,2016,37(3):51-55.
[21]成莉凤,冯湘沅,段盛文,等.一种耐热偏酸性β-甘露聚糖酶基因克隆与高效表达[J].微生物学通报,2015,42(11):2143-2150.
[22]刘鹏飞,田雪,赵丹,等.碳源对地衣芽孢杆菌产β-甘露聚糖酶的影响[J].中国食品学报,2016,16(10):107-114.
[23]邹业霞,林金钟,卜雪,等.短小芽孢杆菌β-1,4-甘露聚糖酶的酶学性质及其在干酪乳杆菌中的表达[J].微生物学报,2015,55(12):1576-1583.
[24] ZHOU C,XUE Y,MA Y.Characterization and high-efficiency secreted expression in Bacillus subtilis of a thermo-alkaline β-mannanase from an alkaliphilic Bacillus clausii strain S10[J].Microbial Cell Factories,2018,17(1):124.
[25]汪梦昀,缪礼鸿,励飞,等.耐碱性β-甘露聚糖酶产生菌的分离鉴定及发酵条件优化[J].饲料工业,2019,40(5):23-33.
[26]李云程,林娟,梁燕辉,等.产甘露聚糖酶海洋微生物的筛选及酶学性质研究[J].中国食品学报,2015,15(12):66-73.