益生菌是一类活菌数达到一定数量、具有抑制致病菌生长能力的对人体有益的微生物[1]。苹果汁含有多种营养成分,包括糖类、有机酸、多酚、维生素等[2],是良好的益生菌发酵基质[3]。
目前,国内外学者对益生菌发酵果蔬汁进行了许多研究。在挥发性风味物质方面,罗心欣等[4]用电子鼻分析益生菌发酵猕猴桃汁的香气成分,研究了猕猴桃在益生菌发酵过程中香气成分的动态变化规律;钱籽霖[5]用气相色谱质谱联用(gas chromatography-mass spectrometer,GC-MS)仪,从益生菌发酵拐枣子中检出77种挥发性物质,发现其相对含量明显高于未发酵的拐枣子;DI CAGNO R等[6]研究发现,益生菌发酵石榴汁中醇类、酮类、烯烃类等挥发性物质含量较发酵前都有明显增加,而对风味不友好的醛类在发酵后减少;李汴生等[7]利用气相色谱-质谱联用仪分析了苹果汁、梨汁、橙汁和葡萄汁发酵前后挥发性成分的变化,发现不同种类果汁之间挥发性物质的变化存在较大差异;任婷婷等[8]对益生菌发酵苹果浆发酵前后挥发性风味成分进行了分析,发现发酵后苹果浆中的酯类、醇类和酮类挥发性成分含量增加,醛类挥发性成分含量降低。在营养成分方面,CIRLINI M等[9]研究发现乳酸菌发酵接果木果汁过程中苹果酸和柠檬酸含量降低;束文秀等[10]研究发现胡柚汁经乳酸菌发酵后,其乳酸含量远高于苹果酸完全转化所能达到的水平;李维妮等[11]用益生菌发酵苹果汁,发现苹果酸下降明显,酒石酸及柠檬酸显著提高;某些研究表明益生菌发酵可促进结合酚的游离从而提高发酵果汁中多酚的含量[12-15];HASHEMI S M B等[16]用植物乳杆菌发酵甜柠檬汁时发现随着发酵时间的延长多酚含量降低;OH B T等[17]用短乳杆菌发酵蓝莓汁48 h后总酚含量也降低了。
益生菌发酵果蔬汁可改变果蔬汁的挥发性风味物质的组成及含量,同时益生菌在果蔬汁的发酵过程中,糖类和有机酸作为碳源被利用[9,18-19],酚类物质含量也在益生菌的作用下发生变化[20-23],但不同种类的果蔬汁在不同种类不同组合的益生菌发酵过程中,其挥发性风味物质、糖、有机酸及酚类物质的变化趋势存在较大差异。
本实验以静宁红富士苹果为主要原料,通过分析复合益生菌对苹果汁发酵过程中挥发性风味物质、糖类、有机酸及酚类物质的影响,为益生菌发酵苹果汁风味的改良及营养品质的提升提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
苹果(静宁红富士):2020年10月上旬采摘于静宁当地果园,大小均一,无损伤、无烂果。
植物乳杆菌(Lactobacillus plantarum)GDMCCI1.140、发酵乳杆菌(Lactobacillus fermentum)GDMCCI1.985、嗜酸乳杆菌(Lactobacillus acidophilus)GDMCCI1.412:购于广州微生物菌种保藏中心,保存于平凉食品检验检测中心微生物实验室。
苹果酸、酒石酸、乳酸、柠檬酸、奎宁酸、莽草酸、琥珀酸、丙酮酸、3-辛醇、儿茶素、表儿茶素、绿原酸、槲皮素、根皮苷、芦丁标准品(纯度均>98%):坛墨质检-标准物质中心。
甲醇、乙腈、乙酸(均为色谱纯):德国MERCK公司;试验用水为一级超纯水;磷酸、磷酸氢二铵(均为色谱纯):天津市科密欧化学试剂有限公司。
1.2 仪器与设备
PHS-3C型pH计:上海仪电科学仪器股份有限公司;2000JP-1型果汁榨汁机:南通金橙机械有限公司;MVS-83型立式高压蒸汽灭菌器:松下冷链(大连)有限公司;DRP-9162型恒温培养箱:上海森信实验仪器有限公司;SW-CJ-2FD型超净工作台:苏州安泰空气技术有限公司;A2S-T-1024-BE型超纯水机:美国艾科浦国际有限公司;手动固相微萃取(solid phase micro-extraction,SPME)进样器:美国Supelco公司;50/30 μm DVB/CAR/PDMS萃取头、赛默飞Trace1310-TSO8000Evo气相色谱-三重四级杆质谱联用(gas chromatography-triple quadrupole mass spectrometry,GC-MS/MS)仪:赛默飞世尔科技有限公司;LC20A高效液相色谱(high performance liquid chromatography,HPLC)仪、SPD-M20A二极管阵列检测器:日本岛津公司。
1.3 试验方法
1.3.1 复合益生菌发酵苹果汁的制备
将植物乳杆菌、发酵乳杆菌、嗜酸乳杆菌以1∶1∶1的菌种比例混合,以3%的接种量接种至300 mL苹果汁中,36 ℃条件下发酵24 h。每隔一定时间取样测定发酵苹果汁中的有机酸、酚类物质组成及含量,并对发酵前后苹果汁的挥发性风味物质进行测定。
1.3.2 发酵苹果汁有机酸含量的测定
参照李佳秀等[24]的方法,取1 mL发酵苹果汁,定容至10 mL,经0.22 μm滤膜过滤后采用高效液相色谱仪进行分析。色谱条件:InertSustain AQ-C18色谱柱(250 mm×4.6 mm,5 μm);流动相0.02 mol/L的磷酸氢二铵,用磷酸调节pH为2.40;等度洗脱;流速1.0 mL/min;检测波长210 nm;柱温30 ℃;进样量10 μL。
1.3.3 酚类物质的测定
总酚的测定采用福林酚比色法[25],取1 mL苹果汁样品,加入2.5 mL福林酚试剂,50 ℃水浴避光反应5 min,冷却,加入2 mL 75 g/L碳酸钠溶液,摇匀,避光反应30 min。于波长760 nm处测定吸光度值。构建没食子酸标准曲线,含量以没食子酸当量(gallic acid equivalent,GAE)表示。
6种酚类物质的测定参照仵白敏[26]的方法,取20 mL苹果汁样品,用60 mL乙酸乙酯分次萃取,合并有机相,37 ℃减压浓缩至干,用甲醇定容至2 mL,过0.22 μm滤膜上机测试。色谱条件:C18色谱柱(250 mm×4.6 mm,5 μm);流动相:甲醇(B)、0.02%甲酸(A),梯度洗脱程序见表1;流速1.0mL/min;检测波长190~800nm;柱温35℃;进样量10μL。
表1 梯度洗脱程序
Table1 Gradient elution procedure

1.3.4 挥发性风味物质的测定
(1)香气成分的富集
参照李维妮等[27]的方法,吸取5 mL苹果汁样品于20 mL顶空瓶中,加入1.5 g氯化钠和一定量的内标物,于45 ℃平衡30 min,将老化过的萃取头插入顶空瓶中吸附30 min,取出萃取头插入GC-MS/MS进样口,250 ℃解吸5 min。
(2)GC-MS条件
色谱柱:DB-5毛细管色谱柱(30 m×0.25 mm,0.5 μm);手动进样,进样口温度250℃,载气为氦气(He),流速1mL/min,不分流进样。升温程序:起始温度40℃,保持3min,以3℃/min速率升温至160 ℃,再以6 ℃/min升温至220 ℃。
电子电离(electron ionization,EI)源,离子源温度230 ℃,传输线温度280 ℃,质量扫描范围35~500 m/z。
(3)定性定量方法
利用GC-MS分析软件和美国国家标准与技术研究所(national insititute of standard and technology,NIST)质谱数据库检索对比,根据匹配度和保留时间定性,按照以下公式计算各香气物质的含量:
1.3.5 数据处理
试验重复3次,采用Excel 2016初步分析,SPSS20.0进行方差显著性分析。
2 结果与分析
2.1 发酵过程中有机酸含量的动态变化
有机酸的种类与含量不仅影响产品的稳定性、感官特性、营养品质等,还能在一定程度上抑制有害微生物的生长[28-29]。复合益生菌发酵苹果汁发酵过程中各有机酸的变化如表2所示。
表2 苹果汁发酵过程中各有机酸含量的变化
Table 2 Changes of organic acids contents in apple juice during fermentation process
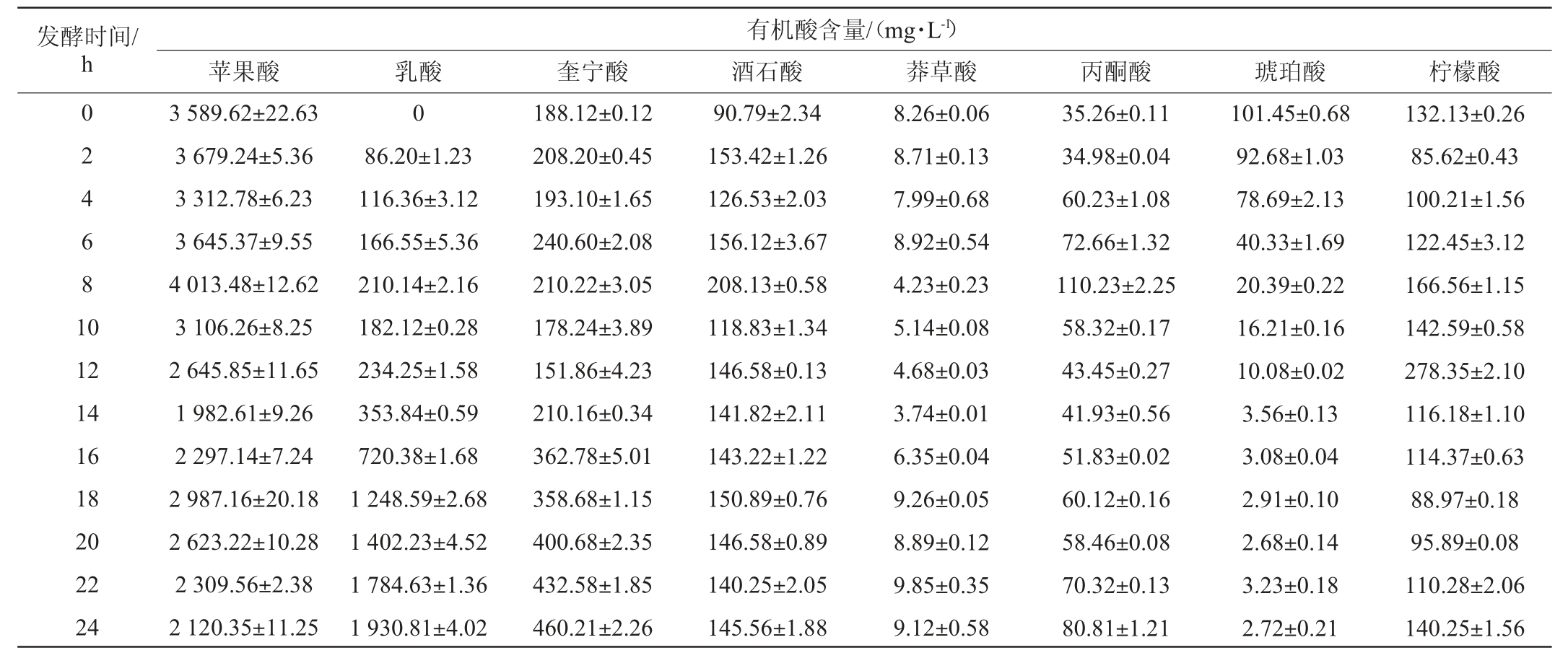
由表2可知,未发酵的苹果汁中含量最高的有机酸是苹果酸,其发酵初始含量为3 589.62 mg/L,发酵8 h后含量达到最大值为4 013.48 mg/L,说明发酵初期有其他物质合成苹果酸,之后迅速下降,这可能是由于乳酸菌在进行苹果酸-乳酸发酵时分解了苹果酸,在发酵期间,苹果酸的含量一直在动态变化中,说明苹果酸参与了多个不同的合成与分解的生化反应。乳酸在发酵过程中,一直处于上升趋势,发酵初期变化不大,后期上升显著,这可能主要是因为发酵过程中存在苹果酸-乳酸发酵,且作为糖酵解产物的丙酮酸也能转化为乳酸导致乳酸含量一直上升,至发酵结束时,乳酸的含量达到1 930.81 mg/L。
由表2可知,奎宁酸在未发酵的苹果汁中含量仅次于苹果酸,其发酵起始含量为188.12 mg/L,发酵过程中,其含量一直处于上升状态,至发酵结束,其含量值为460.21 mg/L。酒石酸在未发酵的苹果汁中的起始含量为90.79 mg/L,在益生菌发酵8 h时,含量达到最大值为208.13 mg/L,之后总体呈下降趋势,发酵结束,其含量为145.56 mg/L,较未发酵时显著提高。莽草酸在苹果汁中含量较低,其发酵起始含量为8.26 mg/L,在整个发酵过程中,苹果汁中莽草酸的含量变化不大,至发酵结束,其含量为9.12 mg/L。在发酵过程中,苹果汁中的丙酮酸含量呈先上升后下降的趋势,在发酵8 h时,含量达到最大值为110.23 mg/L,这可能主要是因为在发酵早期,糖酵解、三羧酸循环及苹果酸-乳酸发酵产物的积累,使得丙酮酸的含量上升,发酵后期在厌氧条件下,丙酮酸转化成乳酸及其他产物[30]。苹果汁中琥珀酸的含量在益生菌发酵过程中,呈下降趋势,其发酵起始含量为101.45 mg/L,发酵结束时含量仅为2.72 mg/L,下降显著。苹果汁中柠檬酸的含量在发酵过程中呈动态变化状态,发酵起始含量为132.12 mg/L,发酵12 h达到最大值,为278.35 mg/L,这可能是因为作为三羧酸循环中间产物的柠檬酸,在发酵早期,乳酸菌的有氧呼吸,丙酮酸代谢产生柠檬酸[31],后期无氧环境下,柠檬酸在乳酸菌的作用下降解生产乳酸、乙酸及双乙酰等风味物质[30]。综上,苹果汁经复合益生菌发酵后,与未发酵的苹果汁相比,苹果汁中的苹果酸和琥珀酸含量显著下降而乳酸、奎宁酸、酒石酸、莽草酸、丙酮酸及柠檬酸均显著上升。
2.2 苹果汁发酵过程中总酚含量的变化
酚类物质是一类生物活性成分,与多种保健功能有关。苹果汁在益生菌发酵过程中总酚及总黄酮含量的变化如图1所示。
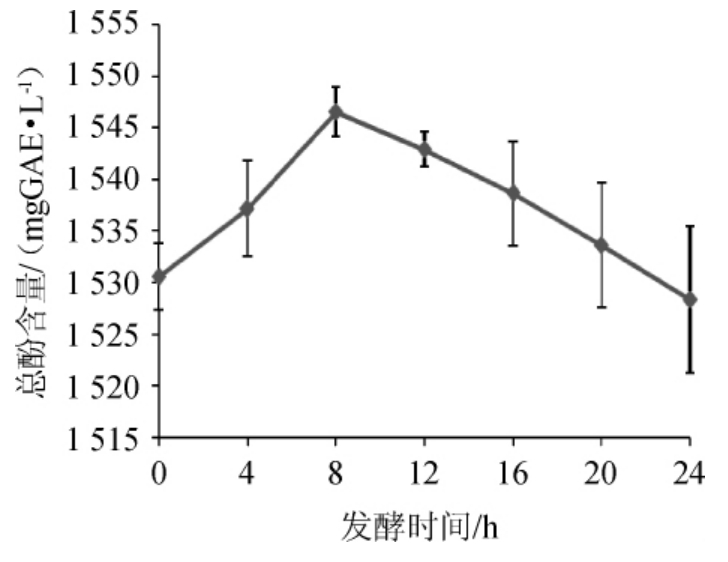
图1 苹果汁发酵过程中总酚含量的变化
Fig.1 Changes of total phenol contents in apple juice during fermentation process
由图1可知,苹果汁发酵前总酚含量为(1 530.55±3.22)mg/L,在复合益生菌发酵的0~8 h,苹果汁中的总酚含量增加,8 h达到最大值为(1 546.53±2.43)mg/L,相比未发酵之前增加了1.04%,发酵8 h之后,苹果汁中的总酚含量开始持续性下降,至发酵结束,总酚含量为(1 528.34±7.11)mg/L,与未发酵相比,下降了0.14%。益生菌发酵对酚类物质的影响因发酵的菌种及发酵的原料不同而不同[15-17]。酚类物质含量的增加可能是因为益生菌能够促进一些结合酚的解离,其含量的降低,可能是因为其自身的氧化损失或者益生菌产生的酚酸脱羧酶对酚类物质的一系列转化。
2.3 苹果汁发酵过程中各酚类物质组成和含量的变化
复合益生菌发酵苹果汁发酵过程中酚类物质的组成及含量的变化如表3所示。
表3 苹果汁发酵过程中酚类物质的组成及含量的变化
Table 3 Changes of phenolic composition and contents in apple juice during fermentation process
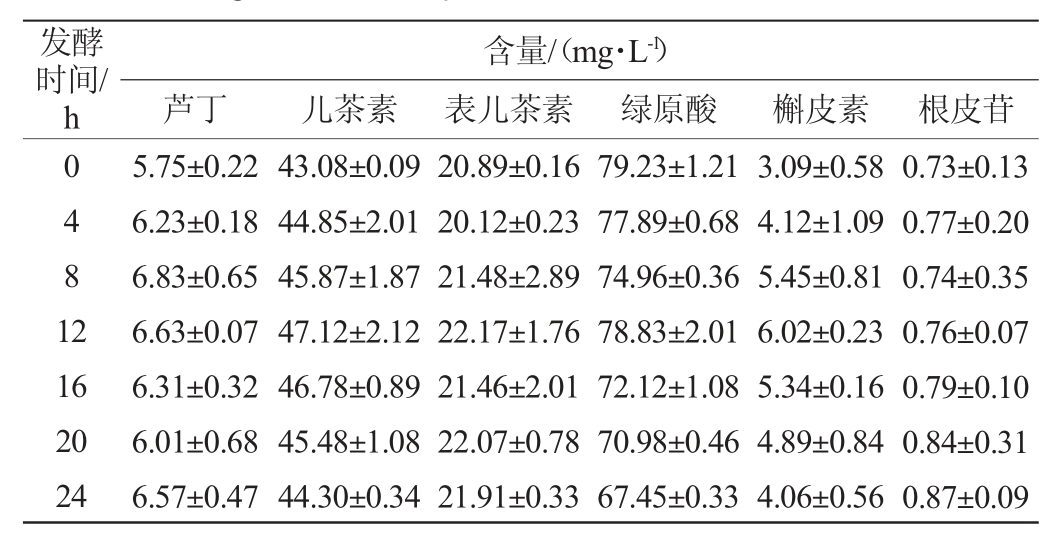
由表3可知,绿原酸在发酵过程中呈下降趋势,发酵之前的含量为(79.23±1.21)mg/L,发酵之后含量为(67.45±0.33)mg/L,下降了14.7%。这可能跟乳酸菌能将绿原酸分解代谢成咖啡酸有关[32]。根皮苷在发酵过程中呈上升趋势,其发酵起始与发酵结束含量分别是(0.73±0.13)mg/L和(0.87±0.09)mg/L,上升了19.2%。儿茶素、表儿茶素、芦丁及槲皮素在发酵初期(0~8)h,其含量均呈上升趋势,随着发酵时间的进一步延长,其含量有所下降,与未发酵时相比,发酵结束时其含量分别增加了5.57%、5.65%、4.52%和5.83%。益生菌发酵对果汁中酚类物质的影响机制复杂,有待进一步更详细的研究。
2.4 发酵前后苹果汁风味物质的变化
发酵苹果汁中风味物质的组成和含量是影响产品感官以及消费者接受程度的重要因素。本研究中益生菌发酵前后苹果汁挥发性物质的变化如表4所示。
表4 发酵前后苹果汁挥发性风味物质及含量
Table 4 Volatile flavor substances and contents in apple juice before and after fermentation
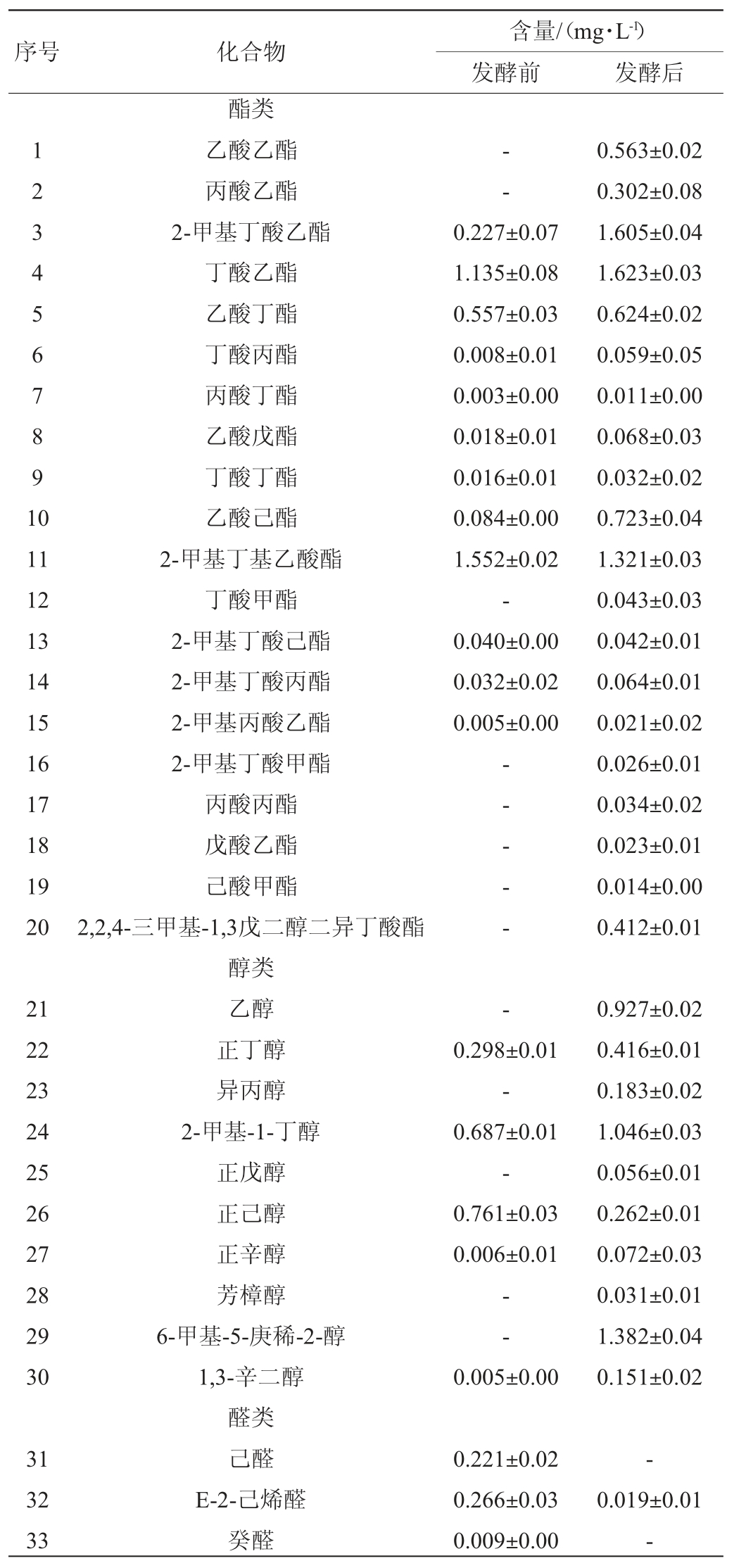
续表
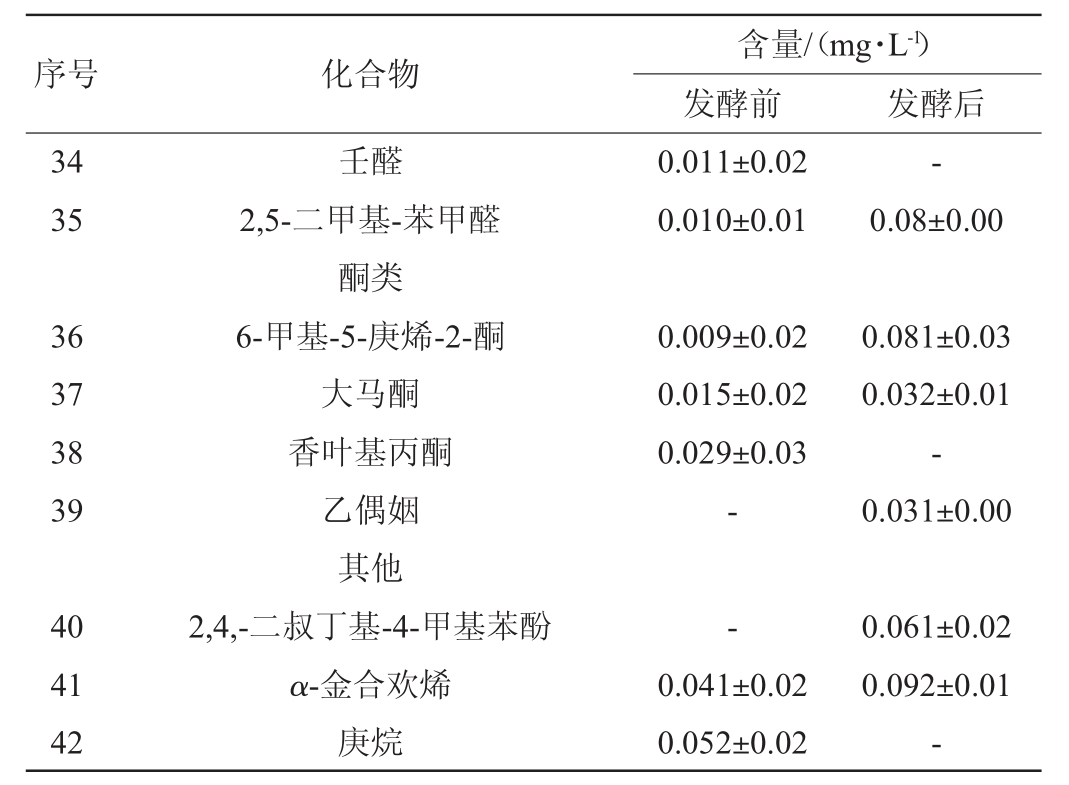
注:“-”表示未检出。
由表4可以看出,苹果汁发酵前,共检测出27种挥发性风味物质,其中酯类12种,醇类5种,醛类5种,酮类3种及其他2种。发酵后共检测出37种挥发性物质,其中酯类20种,较发酵之前新产生8种;醇类10种,较发酵之前新产生5种;醛类2种,较发酵之前减少3种;酮类3种,较发酵之前新产生1种,减少1种;其他类2种,较发酵之前新生成1种,减少1种。可见,苹果汁经混合乳酸菌发酵后,挥发性成分增加,且主要以酯类和醇类为主。
由微生物的氨基酸代谢产生的醇类物质是发酵苹果汁中的一类重要挥发性香气成分[8]。由表4可以看出,苹果汁经混合益生菌发酵后,新产生的5种醇类含量由高到低依次是6-甲基-5-庚稀-2-醇(1.382±0.04)mg/L、乙醇(0.927±0.02)mg/L、异丙醇(0.183±0.02)mg/L、正戊醇(0.056±0.01)mg/L、芳香醇(0.031±0.01)mg/L。正丁醇、2-甲基-1-丁醇、正辛醇、1,3-辛二醇较发酵之前分别增加了39.6%、52.3%、11倍、29倍。6-甲基-5-庚烯-2-醇含量是醇类中含量最高的,但香气阈值高,香气值较低。2-甲基-1-丁醇含量位居醇类第二,含量较高,其香气值也较高,赋予苹果汁青香。乙醇在发酵后的果汁中含量也较高,但其香气阈值很高,对苹果汁的整体香气影响不大。正丁醇属于高级脂肪醇具有水果芬芳的香气,同时也可作为其他香气成分的良好溶剂[33]。其他一些含量较低的醇类如芳樟醇、正辛醇和1,3-辛二醇,因其香气阈值低,对整体的香气成分具有一定的贡献。
由表4可以看出,酯类物质是发酵苹果汁中的种类丰富的香气成分,因其香气阈值相对其他物质普遍较低,对苹果汁的风味贡献较大。苹果中的酯类香气成分主要来源于醇类和有机酸的酯化作用以及醇类和甘油酯或乙酰辅酶A的合成[8]。由表4可知,苹果汁经乳酸菌发酵后,除新生成的8种酯类物质(乙酸乙酯、丙酸乙酯、丁酸甲酯、2-甲基丁酸甲酯、丙酸丙酯、戊酸乙酯、己酸甲酯和2,2,4-三甲基-1,3戊二醇二异丁酸酯),其他酯类物质较发酵之前均有所增加。其中,2-甲基丁酸乙酯、丁酸乙酯、乙酸丁酯、乙酸己酯、2-甲基丁基乙酸酯是苹果汁中发酵前与发酵后均存在的主要酯类物质,发酵前后的含量分别是(0.227±0.07)mg/L和(1.605±0.04)mg/L、(1.135±0.08)mg/L和(1.623±0.03)mg/L、(0.557±0.03)mg/L和(0.624±0.02)mg/L、(0.084±0.00)mg/L和(0.723±0.04)mg/L、(1.552±0.02)mg/L和(1.321±0.03)mg/L,使苹果汁具有强烈的果香。除上述含量较高的酯类物质,苹果汁中还检出了一些含量低但对整体香气有影响的物质,如2-甲基丙酸乙酯、2-甲基丁酸甲酯和戊酸乙酯等。
由表4可知,除醇类和酯类,苹果汁中发酵前后还检出了醛类、酮类及其他一些香气成分。醛类化合物在未发酵的苹果汁中检出5种,发酵后只检出2种且与发酵之前相比E-2-己烯醛减少了14倍,这可能是因为醛类物质不稳定,在微生物的作用下被还原为醇或者被氧化为酸[34]。酮类物质4种,其中6-甲基-5-庚烯-2-酮和大马酮发酵前后均检出且发酵后是发酵前的9倍和2倍。苹果汁经益生菌发酵后,还会产生一些如有机酸、胺类、酚类等其他类的挥发性物质,这些物质的含量都很低[36],其含量之和占总挥发性成分的0.5%左右,在本试验中未列出。香叶基丙酮发酵之前检出含量为(0.029±0.03)mg/L,发酵后未检出;乙偶姻发酵后检出含量为(0.031±0.00)mg/L。其中E-2-己烯醛具有令人愉快的绿叶清香和水果香气;甲基庚烯酮具有柠檬草般的香气;大马酮带有与玫瑰相似的强烈味道;香叶基丙酮是一种带有甜味;青草味和水果香味的香气成分;乙偶姻具有令人愉快的奶香气[27,35],这些物质虽然含量低,但对苹果汁的整体香气有贡献。
3 结论
经高效液相色谱对混合益生菌发酵苹果汁发酵过程中的有机酸、酚类物质的变化情况进行检测分析,结果显示苹果汁经益生菌发酵后,有机酸中的苹果酸和琥珀酸含量显著下降,分别下降了40.9%和97.3%;而乳酸、奎宁酸、酒石酸、莽草酸、丙酮酸及柠檬酸均上升,其中乳酸发酵结束含量达到1 930.81 mg/L,其他有机酸的含量分别上升了144.6%、60.3%、10.4%、129.2%和6.1%。总酚含量在发酵8 h时达到最大值为(1 546.53±2.43)mg/L,发酵结束时,总酚含量下降了0.14%。其中,儿茶素、表儿茶素、槲皮素、根皮苷和芦丁含量分别上升了5.57%、5.65%、5.83%、19.2%和4.52%;绿原酸含量下降了14.9%。
经气相色谱-质谱检测分析,苹果汁未发酵之前,检测出27种香气成分,发酵之后检测出37种,增加了10种挥发性物质,主要是一些醇类和酯类化合物,其中发酵后新产生5种醇类,其含量由高到低依次是6-甲基-5-庚稀-2-醇(1.382±0.04)mg/L、乙醇(0.927±0.02)mg/L、异丙醇(0.183±0.02)mg/L、正戊醇(0.056±0.01)mg/L、芳香醇(0.031±0.01)mg/L;正丁醇、2-甲基-1-丁醇、正辛醇、1,3-辛二醇较发酵之前分别增加了39.6%、52.3%、11倍、29倍。发酵后新生成了8种酯类物质,其他酯类物质较发酵之前均有所增加。其中,2-甲基丁酸乙酯、丁酸乙酯、乙酸丁酯、乙酸己酯、2-甲基丁基乙酸酯是苹果汁中发酵前与发酵后均存在的主要酯类物质,发酵前后的含量分别是(0.227±0.07)mg/L和(1.605±0.04)mg/L、(1.135±0.08)mg/L和(1.623±0.03)mg/L、(0.557±0.03)mg/L和(0.624±0.02)mg/L、(0.084±0.00)mg/L和(0.723±0.04)mg/L、(1.552±0.02)mg/L和(1.321±0.03)mg/L。这些化合物之间的变化平衡构成了发酵苹果汁特有风味。
[1]FIJAN S.Microorganisms with claimed probiotic properties:an overview of recent literature[J].Int J Environ Res Public Health,2014,11(5):4745-4767.
[2]KAPRSOB R,KERDCHOECHUEN O,LAOHAKUNJIT N,et al.Fermentation-based biotransformation of bioactive phenolics and volatile compounds from cashew apple juice by select lactic acid bacteria[J]. Process Biochem,2017,59:141-149.
[3] ESPIRITOSANTO A P,CARLIN F,CMGC R.Apple,grape or orange juice:which one offers the best substrate for lactobacilli growth? A screening study on bacteria viability,superoxide dismutase activity,folates production and hedonic characteristics[J]. Food Res Int,2015,78:352-360.
[4]罗心欣,成雨阳,王周利,等.益生菌发酵猕猴桃工艺优化及香气成分动态分析[J].食品科学,2019,40(12):168-175.
[5]钱籽霖.乳酸菌发酵拐枣汁工艺优化及抗氧化活性评价[D].重庆:西南大学.
[6] DI CAGNO R,FILANNINO P,GOBBETTI M.Lactic acid fermentation drives the optimal volatile flavor-aroma profile of pomegranate juice[J].Int J Food Microbiol,2017,248:56-62.
[7]李汴生,卢嘉懿,阮征.植物乳杆菌发酵不同果蔬汁风味品质研究[J].农业工程学报,2018,40(17):293-299.
[8]任婷婷,岳田利,魏欣,等.益生菌发酵苹果浆工艺优化及发酵前后挥发性风味成分分析[J].食品科学,2019,40(8):87-93.
[9]CIRLNI M,RICCI A,GALAVERNA G,et al.Application of lactic acid fermentation to elderberry juice:Changes in acidic and glucidic fractions[J].LWT-Food Sci Technol,2020,118:108779.
[10]束文秀,吴祖芳,翁佩芳,等.植物乳杆菌和发酵乳杆菌对胡柚汁发酵品质及其抗氧化吧活性的影响[J].食品科学,2019,40(2):152-158.
[11]李维妮,张宇翔,魏建平,等.益生菌发酵苹果汁工艺优化及有机酸的变化[J].食品科学,2017,38(22):80-87.
[12]韩雪,王毕妮,张富新,等.不同乳酸菌发酵对红枣浆游离态酚酸及其抗氧化活性的影响[J].食品与发酵工业,2018,44(3):121-127.
[13]李虹甫,杨鑫焱,刘昕宇,等.植物乳杆菌发酵蓝莓果汁工艺优化及其抗氧化能力[J].食品工业科技,2019,40(17):127-133.
[14]叶盼,吴慧,王德纯,等.发酵苹果汁的抗氧化性能变化[J].食品与发酵工业,2016,42(4):114-119.
[15]KWAW E,MA Y K,TCHABO W,et al.Effect of Lactobacillus strains on phenolic profile,color attributes and antioxidant activities of lactic-acid-fermented mulberry juice[J].Food Chem,2018,250:148-154.
[16] HASHEMI S M B,KHANEGHAH A M,BARBA F J,et al.Fermented sweet lemon juice(Citrus limetta)using Lactobacillus plantarum LS5:Chemical composition,antioxidant and antibacterial activities[J].J Funct Foods,2017,38:409-414.
[17]OH B T,JEONG S Y,VELMURUGAN P,et al.Probiotic-mediated blue-berry(Vaccinium corymbosum L.)fruit fermentation to yield functionalized products for augmented antibacterial and antioxidant activity[J]. J Biosci Bioeng,2017,124(5):542-550.
[18]MOUSAVI Z E,MOUSAVI S M,RAZAVI S H,et al.Effects of fermentation of pomegranate juice by Lactobacillus plantarum and Lactobacillus acidophilus on the antioxidant activity and metabolism of sugars,organic acids and phenolic compounds[J].Food Biotechnol,2013,27(1):1-13.
[19]WEI M,WANG S Y,GU P,et al.Comparison of physicochemical indexes,amino acids,phenolic compounds and volatile compounds in bog bilberry juice fermented by Lactobacillus plantarum under different pH conditions[J].J Food Sci Technol Mys,2018,55(6):2240-2250.
[20] FILANNINO P,BAI Y P,DI CAGNO R,et al.Metabolism of phenolic compounds by Lactobacillus spp.during fermentation of cherry juice and broccoli puree[J].Food Microbiol,2015,46:272-279.
[21] GUMIENNA M,SZWENGIEL A,GORNA B.Bioactive components of pomegranate fruit and their transformation by fermentation processes[J].Eur Food Res Technol,2016,242(5):631-640.
[22]LI Z X,TENG J,LYU Y L,et al.Enhanced antioxidant activity for apple juice fermented with Lactobacillus plantarum ATCCI14917[J].Molecules,2019,24(1):51.
[23]RICCI A,CIRLINI M,MAOLONI A,et al.Use of dairy and plant-derived Lactobacilli as starters for cherry juice fermentation[J].Nutrients,2019,11(2):213.
[24]李佳秀,张春岭,刘慧,等.不同果汁中有机酸的组成及差异性分析[J].果树学报,2017,34(9):1192-1203.
[25] SINGLETON V L,ROSSI J A.Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J].Am J Enol Viticult,1965,16(3):144-158.
[26]仵白敏.复合益生菌发酵葡萄汁工艺优化与营养特性的研究[D].郑州:郑州果树研究所,2020.
[27]李维妮,郭春峰,张宇翔,等.气相色谱-质谱法分析乳酸菌发酵苹果汁香气成分[J].食品科学,2017,38(4):146-154.
[28] SHUI G,LEONG L P.Separation and determination of organic acids and phenolic compounds in fruits juices and drinks by high-performance liquid chromatography[J].J Chromatogr A,2002,977:89-96.
[29] ZOTOU A,LOUKOU Z,KARAV O.Method development for the determination of seven organic acids in wines by reversed-phase high performance liquid chromatography[J].Chromatographia,2004,60:39-44.
[30]WANG Y C,TAO Y,ZHANG X Y,et al.Metabolite profile of ginkgo kernel juice fermented with lactic acid bacteria:a potential way to degrade ginkgolic acids and enrich terpene lactones and phenolics[J].Process Biochem,2019,76:25-33.
[31]王红梅,蒋思睿,陶阳,等.超声辅助植物乳杆菌发酵苹果汁及草莓汁过程中菌体生长及酚类物质等物质代谢[J].食品科学,2020,41(14):72-81.
[32]FILANNINO P,BAI Y,CAGNO R D,et al.Metabolism of phenolic compounds by Lactobacillus spp.during fermentation of cherryjuice and broccoli puree[J].Food Microbiol,2015,46:272-279.
[33]张华.发酵型黑枣酒加工工艺的研究[D].保定:河北农业大学,2013.
[34]DI CAGNO R,SURICO R F,PARADISO A,et al.Effect of autochthonous lactic acid bacteria starters on health-promoting and sensory properties of tomato juices[J].Int J Food Microbiol,2009,128(3):473-483.
[35]LEE P R,ONG Y L,YU B,et al.Profile of volatile compounds during papaya juice fermentation by a mixed culture of Saccharomyces cerevisiae and Williopsis saturenus[J].Food Microbiol,2010,27(7):853-861.
[36]郑若宇.益生菌发酵苹果汁工艺优化及发酵过程中风味物质和功能性成分的变化[D].沈阳:沈阳农业大学,2020.