异亮氨酸在1904年从甜菜浆中分离得到,由于化学结构与亮氨酸相似,理化性质不同,被命名为异亮氨酸。异亮氨酸具有四种光学异构体,但是在自然界中仅存在L-异亮氨酸[1]。L-异亮氨酸是人体必需氨基酸,是三种分支氨基酸之一,作为生物活性分子参与营养代谢和物质合成,在食品、医药和饲料等方面的广泛应用[2]。早期L-异亮氨酸主要通过化学合成法生产[3],但是,化学合成法产量低,合成过程使用强酸、强碱以及有机溶剂造成环境污染,渐渐淡出人们的视线,微生物发酵法受到广泛关注。
目前,用于L-异亮氨酸生产的菌株主要包括黄色短杆菌(Brevibacterium flavum)、大肠杆菌(Escherichia coli)和谷氨酸棒杆菌(Corynebacterium glutamicum)。研究发现,大肠杆菌在发酵过程中会合成内毒素[4],产物的分离纯化技术要求高,生产成本居高不下,工业化生产难以实现;黄色短杆菌在代谢工程改造方面的研究相对较少,随着对谷氨酸棒杆菌认识的不断深入,发现谷氨酸棒杆菌更适合用于生产L-异亮氨酸。谷氨酸棒杆菌是公认的安全(generally recognized as safe,GRAS)菌株,广泛应用于氨基酸和核苷酸的工业化生产中[5]。L-异亮氨酸的生物合成途径冗长且具有复杂精密的自我调节机制,通过随机诱变可以获得产量相对较高的突变菌株[6],但其遗传背景不明且很难通过诱变进一步提高产量。因此,通过代谢工程改造谷氨酸棒状杆菌生产L-异亮氨酸越来越引起重视。2007年,YUKAWA H等[7]对谷氨酸棒杆菌进行全基因组测序,为谷氨酸棒杆菌代谢途径的理论研究奠定了基础。随着对L-异亮氨酸代谢途径、关键酶调控以及菌种选育等方面研究的不断深入和基因工程技术的不断进步,代谢工程逐渐替代经典的随机突变成为菌种改造的主要方法[8]。
在谷氨酸棒杆菌中,L-异亮氨酸生物合成途径冗长,分支途径较多,生物体自身调节机制精密复杂,导致主代谢流较弱,副产物大量产生,代谢调控较为困难。丙酮酸和α-酮基丁酸是L-异亮氨酸代谢途径中两个重要的节点,围绕这两个节点对相关酶编码基因进行编辑,能够有效的调节代谢流分配,强化主路代谢流强度,减少副产物合成。另外,严重的反馈抑制、氨基酸分泌能力不足、辅因子再生能力较弱等也严重制约着产物合成能力的提高。本文综述了近年来代谢工程改造谷氨酸棒杆菌促进L-异亮氨酸生物合成的相关研究,主要涉及代谢通量调控、解除反馈抑制、调节还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)水平以及提高产物分泌能力等方面,对进一步改造菌株和促进L-异亮氨酸发酵合成具有一定的参考意义。
1 围绕L-异亮氨酸合成途径关键节点的代谢工程改造
在谷氨酸棒杆菌中,丙酮酸是新陈代谢中心的开关点。在糖酵解途径(embden meyerhof pathway,EMP)通路和各种氨基酸代谢通路之间起着高度连接的枢纽作用,是合成代谢的基石。在L-异亮氨酸代谢途径中(见图1),丙酮酸主要存在4条去路:①在乙酰羟酸合酶(acetohydroxy acid synthase,AHAS)催化下,与α-酮基丁酸缩合形成α-乙酰-α-羟基丁酸,进而在乙酰羟酸还原异构酶(acetohydroxyacid isomerore ductase,AHAIR)、二羟酸脱水酶(dihydroxy acid dehydratase,DADH)、转氨酶(transaminase,TA)等酶的作用下形成L-异亮氨酸;②在AHAS催化下,两分子丙酮酸缩合形成α-乙酰乳酸,同样在AHAIR、DADH、TA等酶的作用下合成L-缬氨酸和L-亮氨酸;③由基因pqo编码的丙酮酸氧化还原酶催化产生乙酸盐;④经基因alaT编码的丙氨酸转氨酶催化形成丙氨酸。副产物的生成造成碳代谢流损失,降低L-异亮氨酸的转化率和产量。因此,在丙酮酸节点处,通过基因工程手段弱化副产物的合成途径或提高碳代谢流在L-异亮氨酸合成途径中的分配,能够有效促进L-异亮氨酸的合成[3]。

图1 L-异亮氨酸生物合成示意图
Fig.1 Schematic diagram for L-isoleucine biosynthesis
phosphotransferase system(PTS):磷酸转移酶系统;tricarboxylic acid cycle(TCA):三羧酸循环;phosphofructokinase(FRK):磷酸果糖激酶;pyruvate kinase(PK):丙酮酸激酶;aspartate kinase(AK):天冬氨酸激酶;aspartyl semialdehyde dehydrogenase(ASD):天冬氨酰半醛脱氢酶;homoserinedehydrogenase(HD):高丝氨酸脱氢酶;homoserinekinase(HK):高丝氨酸激酶;threonine synthase(TS):苏氨酸合酶;threonine dehydratase(TD):苏氨酸脱氨酶。
L-缬氨酸和L-亮氨酸作为主要副产物,生物合成时与L-异亮氨酸共用一套酶系,弱化这些酶的编码基因表达或抑制酶活性,同时会影响L-异亮氨酸的合成[9]。研究表明,AHAS酶对α-酮基丁酸的亲和力远远大于丙酮酸[10],这一特点为进一步提高产物合成提供依据。强化α-酮基丁酸合成途径,能够使更多丙酮酸用于L-异亮氨酸的合成,降低副产物氨基酸的积累。徐庆阳等[11]通过过表达高丝氨酸脱氢酶基因thrA,增强α-酮基丁酸的合成,副产物赖氨酸积累量较出发菌株减少63.8%,L-异亮氨酸产量提高7.0%,达到36.5 g/L。PÁTEK M等[12]从大肠杆菌(Escherichia coli)K12中成功扩增出thrABC基因(苏氨酸操纵子),并在谷氨酸棒杆菌中表达。WANG J等[13]研究表明,在谷氨酸棒杆菌中过表达来自大肠杆菌的thrABC基因,促进α-酮基丁酸合成,经摇瓶发酵,L-异亮氨酸的产量提高5.3%,达到14.1 g/L。此外,提高苏氨酸脱水酶代谢活性也是增强α-酮基丁酸合成的有效方法。DONG X等[14]在谷氨酸棒杆菌中过表达苏氨酸脱水酶基因,利用该菌株进行发酵时,L-苏氨酸完全耗尽,L-赖氨酸碳代谢通量降低83.0%,L-异亮氨酸产量达到3.5 g/L,与出发菌株相比产量具有明显提升。史建明等[15]在谷氨酸棒杆菌(C.glutamicum)YILW中过表达苏氨酸脱水酶,使耗糖高峰期滞后,L-异亮氨酸合成途径的代谢流提高8.5%,产量增加10.3%,达到32.0 g/L。
此外,减少乙酸和丙氨酸等副产物合成,也有利于产物的积累。研究发现,敲除alaT基因可以减少L-丙氨酸的合成,改变碳代谢流向,使更多的丙酮酸转化为草酰乙酸进入苏氨酸合成途径,进一步合成为L-异亮氨酸[13]。EIKMANNS B J等[16]通过敲除pqo基因使发酵过程中几乎没有乙酸的合成,导致丙酮酸的积累,促进三种分支氨基酸的合成。朱福周等[17]在谷氨酸棒杆菌中过表达pyc基因,提高丙酮酸羧化酶的表达量,使丙酮酸直接合成草酰乙酸,L-异亮氨酸产量比出发菌株提高11.7%,达到24.8 g/L。
2 代谢工程改造解除反馈抑制促进L-异亮氨酸合成
谷氨酸棒杆菌合成L-异亮氨酸代谢途径中存在严重的反馈抑制现象[3]。当L-异亮氨酸过量积累时,会抑制苏氨酸脱水酶、乙酰羟酸合酶的活性[18-20];而L-苏氨酸积累时,会抑制高丝氨酸脱氢酶、高丝氨酸激酶以及天冬氨酸激酶的活性,使α-酮基丁酸合成受阻,进而影响L-异亮氨酸的合成。通过代谢工程手段,解除反馈抑制,是促进L-异亮氨酸的代谢合成的有效方法[21]。
2.1 针对解除L-异亮氨酸反馈抑制的代谢工程改造
苏氨酸脱水酶是L-异亮氨酸合成过程中的限速酶[3],受到L-异亮氨酸反馈抑制,通过定点突变对该酶进行改造,缓解或解除反馈抑制有利于产物积累。GUO Y等[18]通过定点诱变技术在苏氨酸脱水酶中分别引入V140M、F383A和V140M-F383A三个不同突变位点,酶的活性均得到明显提高,在谷氨酸棒杆菌中过表达上述三种突变型酶蛋白,L-异亮氨酸产量分别达到0.5 g/L、0.6 g/L、0.7 g/L,比出发菌株分别提高17.1%、34.0%和55.3%。YIN L等[19]对具有抗反馈抑制特性苏氨酸脱水酶的序列进行分析,发现突变后的苏氨酸脱水酶中只有一个氨基酸被取代(Phe383Val),而酶的活性大大提高,表达菌株发酵产物比出发菌株提高33.9%。
乙酰羟酸合酶(AHAS)以二磷酸硫胺素为辅酶,催化两分子丙酮酸缩合成乙酰羟酸,进而合成L-亮氨酸和L-缬氨酸;也可以催化丙酮酸与α-酮基丁酸反应生成α-乙酰-α-羟丁酸,进而合成L-异亮氨酸[21-22]。AHAS是由两个大亚基和两个小亚基组成的四聚体[10],大亚基负责酶的催化功能,小亚基负责酶的调节功能。L-异亮氨酸、L-缬氨酸和L-亮氨酸均能与AHAS的调节位点结合,引起酶构象发生变化,从而抑制AHAS活性[3]。最近,LU J等[23]通过定点诱变技术,对AHAS调节亚基上的一些位点(N11S、T34I、A36V、T104S、N11F、G14E和N29H)进行定点诱变处理,获得AHAS突变体对L-异亮氨酸敏感性显著下降。YIN L等[19]在C.glutamicum JHI3-156中共表达具有抗反馈抑制特性的苏氨酸脱水酶和乙酰羟酸合酶的基因,L-异亮氨酸产量达到30.7 g/L。GUO Y等[24]对不同氨基酸生产菌株的AHAS进行分析,发现AHAS抗反馈抑制能力越强,菌株发酵氨基酸的产量也越高。
2.2 针对解除L-苏氨酸反馈抑制的代谢工程改造
L-苏氨酸是L-异亮氨酸合成途径中重要的中间代谢物,对高丝氨酸脱氢酶(HD)、高丝氨酸激酶(HK)和天冬氨酸激酶(AK)等具有较强的抑制作用,通过代谢工程手段解除或缓解反馈抑制,有利于产物的合成[25-26]。REINSCHEID D J等[27]通过分析一株对L-苏氨酸具有抗性突变株的hom基因,发现高丝氨酸脱氢酶中存在G378E突变,并指出此差异可能是解除反馈抑制的关键。进一步研究表明,氨基酸替换使该位点与L-苏氨酸间的范德华力丧失,导致HD对L-苏氨酸的亲和力变弱,缓解对HD的反馈抑制。徐德雨等[28]研究发现,与野生型谷氨酸棒杆菌相比,髙产菌株的AK存在G359D突变,使L-苏氨酸与L-赖氨酸的协同反馈抑制得到有效缓解,10 mol/L L-苏氨酸和L-赖氨酸同时存在的条件下,AK活性仍保留76.9%,而野生型菌株的AK酶活仅保留4.4%。YOSHIDA A等[29]利用定点突变技术,获得AK的G277A突变体,导致L-苏氨酸与AK调节亚基结合位点发生变化,二者无法结合形成二聚体,解除对AK的反馈抑制。CHEN Z等[30]利用定点诱变技术获得14株AK突变菌株,经验证这些突变菌株对L-苏氨酸均具有一定抗性。PETIT C等[31]通过定点诱变技术对HK进行处理,获得一株突变体CglThrB-A20G,该突变株保留野生型菌株酶的活性,L-苏氨酸与ThrB-A20G位点之间的范德华力丧失,从而解除L-苏氨酸对HK的反馈抑制。
3 代谢工程改造提高胞内NADPH水平促进产物合成
辅因子在细胞新陈代谢过程中起着十分重要的调节作用,对某些代谢产物的生物合成具有重要意义[32]。通过调节辅因子再生速率及比例,能够改变代谢流分配和物质合成。在谷氨酸棒杆菌中,NADPH是L-异亮氨酸合成途径中ASD、HD、AHAIR、TA等诸多酶的辅酶,还是维持细胞内氧化还原水平的重要物质[33-34]。NADPH水平调节是影响L-异亮氨酸合成的重要因素[35]。
NADPH主要通过两种途径产生,一种是与特定反应相偶联将NADP+还原成NADPH,如磷酸戊糖途径中zwf编码的葡萄糖-6-磷酸脱氢酶,基因gnd编码的葡萄糖酸磷酸脱氢酶;另一种是通过基因ppnK表达NAD激酶的催化反应,将NAD+或NADH磷酸化生成NADP+和NADPH[36]。SHI F等[34]分别在C.glutamicum JHI3-156和C.glutamicum ATCC 13869中过表达ppnK基因,胞内NADPH含量分别增加95.0%和42.0%,L-异亮氨酸产量分别增加37.0%和24.0%。SHI F等[37]在C.glutamicum JHI3-156中过表达zwf和ppnK基因,胞内NADPH水平得到显著提升,L-异亮氨酸产量分别增加26.0%和31.0%,将两个基因共表达,菌株发酵72 h后,异亮氨酸产量提高至16.7 g/L。该研究还在C.glutamicum JHI3-156中表达源于酿酒酵母的NADH激酶基因(POS5),菌株发酵72 h,L-异亮氨酸产量达到16.2 g/L,而对照菌株产量仅为12.8 g/L。MA W等[38]通过过表达果糖-1,6-二磷酸酶基因gnd、fbp、6-磷酸葡萄糖酸内酯酶基因pgl,强化谷氨酸棒杆菌的磷酸戊糖途径,使L-异亮氨酸产量分别提高15.2%、13.6%、7.5%;以上三个基因共表达的菌株,在5 L发酵罐中发酵72 h可产生28.9 g/L的L-异亮氨酸。BARTEK T等[39]研究发现,由基因pgi编码的磷酸葡萄糖异构酶的缺失可以为L-异亮氨酸合成提供充足的NADPH,提高L-异亮氨酸的产量。
4 代谢工程改造提高L-异亮氨酸转运能力
L-异亮氨酸快速合成时,需要及时运送到胞外,否则在胞内大量积累会降低相关酶活性,出现反馈抑制现象,影响产物的合成与积累[40]。谷氨酸棒杆菌可以通过brnQ编码的BrnQ转运蛋白从环境中摄取L-异亮氨酸[41],当细胞内L-异亮氨酸积累时,L-异亮氨酸可以结合全局调控因子Lrp,激活brnFE基因的表达,转运蛋白复合体BrnFE将L-异亮氨酸分泌到胞外[36]。通过代谢工程手段降低L-异亮氨酸的摄取速率,提高分泌能力可以有效缓解反馈抑制,是促进产物合成的重要手段。
BrnQ转运蛋白由426个氨基酸残基组成,分子质量为44.9 kDa。TAUCH A等[42]研究发现,将染色体上的基因brnQ敲除后,L-异亮氨酸摄取速率仅为0.04 nmol/(min·mg干质量),而野生型为1.20 nmol/(min·mg干质量),摄取速率显著降低。XIE X等[43]研究表明,利用C.glutamicum YILW△brnQ发酵生产时,35 h前L-异亮氨酸合成速率与对照菌株的相当,发酵结束,L-异亮氨酸产量比对照的提高16.6%,达到22.3 g/L。
BrnFE是一种针对脂肪族疏水氨基酸的渗透酶,对三种分支氨基酸的分泌速率大致相同。MUSTAFI N等[44]研究发现,敲除brnF或brnE后,L-异亮氨酸无法分泌到胞外,而过表达brnFE则使菌株获得更强的分泌能力。XIE X等[43]利用C.glutamicum YILW/pXMJ19和YILW/pXMJ19-brnFE进行发酵生产实验,发现二者菌体浓度相差不大,但YILW/pXMJ19-brnFE的发酵产量比出发菌株提高28.2%(25.9 g/L),YILW△brnQpXMJ19-brnFE的发酵结果表明,L-异亮氨酸产量比出发菌株提高43.6%(29.0 g/L)。
亮氨酸响应蛋白Lrp是L-异亮氨酸分泌到胞外的关键调节因子[45-46]。细胞内存在高浓度L-异亮氨酸时,lrp基因被激活表达,L-异亮氨酸与蛋白Lrp结合激活brnFE基因,转运蛋白BrnFE大量合成,将L-异亮氨酸转运至细胞外[47]。CHEN C等[48]通过在C.glutamicum ATCC 13869中过表达基因lrp,使L-异亮氨酸产量提高9倍。YIN L等[49]在谷氨酸棒杆菌中过表达基因lrp后进行摇瓶发酵实验,与出发菌株相比,L-异亮氨酸产量增加31.9%,达到21.5 g/L;将基因brnFE和lrp共表达,使产量提高63.0%,达到26.6 g/L。因此,蛋白Lrp对L-异亮氨酸的分泌具有重要的调节作用[50]。
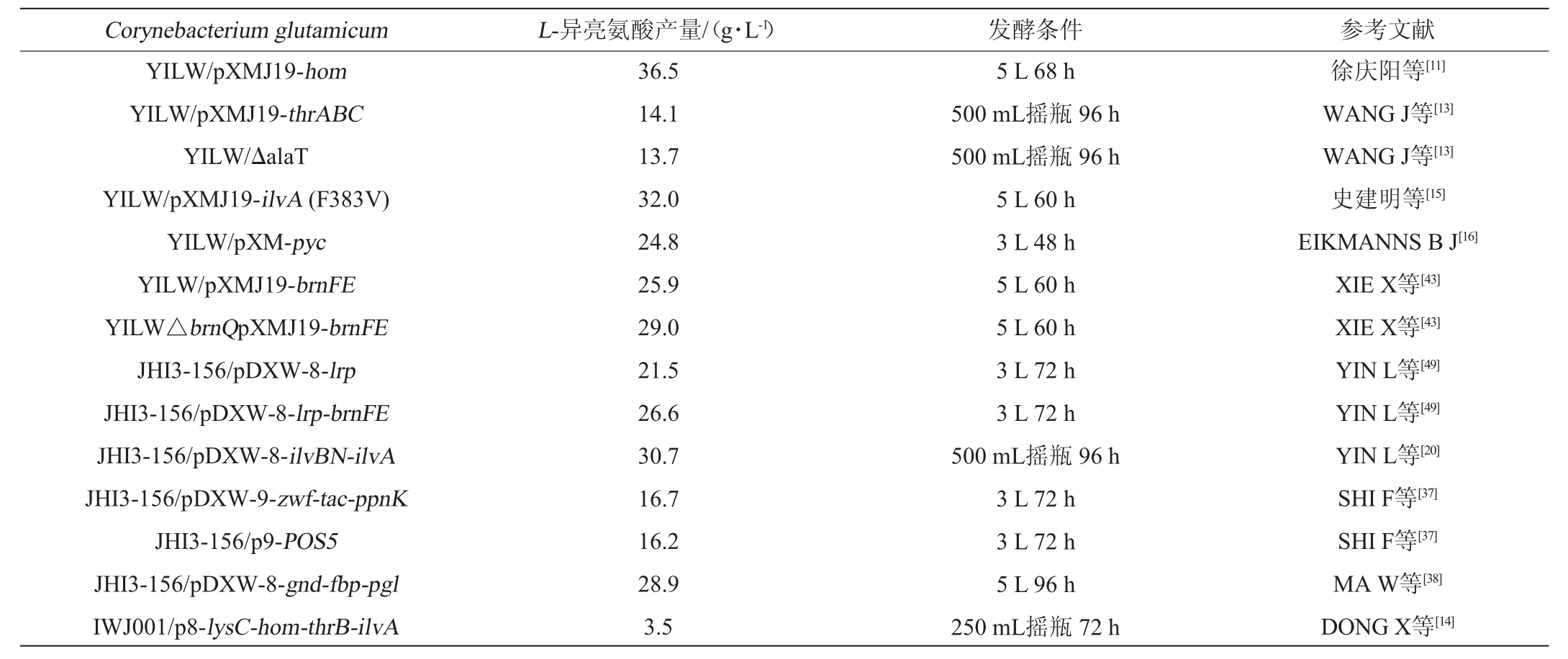
表1 谷氨酸棒杆菌代谢工程改造及L-异亮氨酸发酵性能比较
Table 1 Metabolic engineering modification and L-isoleucine fermentation performance comparison of Corynebacterium glutamicum
5 展望
L-异亮氨酸生物合成途径冗长,分支途径较多,生物体自身调节机制十分复杂,导致主代谢流较弱,副产物大量产生,代谢调控和改造较为困难。另外,严重的反馈抑制、氨基酸分泌能力不足、辅因子再生能力较弱等也严重制约着产物合成能力的提高。谷氨酸棒杆菌是L-异亮氨酸发酵生产的主要菌株之一,具有遗传背景清楚,基因改造手段和工具成熟的特点,为通过代谢工程手段解决上述问题,提高L-异亮氨酸代谢合成提供了良好基础。随着各种组学技术的不断进步,菌种的改造更加便捷。新兴的系统生物学和合成生物学使细胞全基因组重编程得以实现[51],可以快速、高效的重构代谢通路,更方便的对目的基因进行改造[52],为谷氨酸棒杆菌的改造提供有力手段。通过上述技术对谷氨酸棒杆菌进行改造,可以进一步促进L-异亮氨酸的合成与积累,将其提升为氨基酸工业中最成功的微生物。
[1]李忠财.高产L-异亮氨酸谷氨酸棒杆菌的菌种选育及代谢优化[D].大连:大连工业大学,2016.
[2] BAMPIDIS V,AZIMONTI G,BASTOS M D L,et al.Safety and efficacy of L-isoleucine produced by fermentation with Corynebacterium glutamicum KCCM 80189 for all animal species[J].EFSA J,2020,18(2):6021-6033.
[3]YAMAMOTO K,TSUCHISAKA A,YUKAWA H.Branched-chain amino acids[J].Adv Biochem Eng Biotechnol,2017,159:103-128.
[4]WANG J,WEN B,XU Q,et al.Optimization of carbon source and glucose feeding strategy for improvement of L-isoleucine production by Escherichia coli[J].Biotechnol Biotec Eq,2015,29:374-380.
[5] WENDISCH V F,JORGE J M P,PÉREZ-GARCÍA,et al.Updates on industrial production of amino acids using Corynebacterium glutamicum[J].World J Microb Biot,2016,32(6):1-10.
[6]刘丽君.L-异亮氨酸产生菌的选育及发酵条件研究[D].长春:吉林大学,2015.
[7]YUKAWA H,OMUMASABA C A,NONAKA H,et al.Comparative analysis of the Corynebacterium glutamicum group and complete genome sequence of strain R[J].Microbiology,2007,153(4):1042-1058.
[8]GU P,SU T,QI Q.Novel technologies provide more engineering strategies for amino acid-producing microorganisms[J]. Appl Microbiol Biot,2016,100(5):2097-2105.
[9]VOGT M,KRUMBACH K,BANG W G,et al.The contest for precursors:channelling L-isoleucine synthesis in Corynebacterium glutamicum without byproduct formation[J].Appl Microbiol Biot,2015,99(2):791-800.
[10]WANG X,ZHANG H,QUINN P J.Production of L-valine from metabolically engineered Corynebacterium glutamicum[J]. Appl Microbiol Biot,2018,102(10):1-12.
[11]徐庆阳,孙家凯,谢希贤,等.过表达hom 基因对谷氨酸棒杆菌发酵L-异亮氨酸的影响[J].天津科技大学学报,2012(5):5-10.
[12]PÁTEK M,NAVRÁTIL O,HOCHMANNOVÁ J,et al.Expression of the threonine operon from Escherichia coli in Brevibacterium flavum and Corynebacterium glutamicum[J].Biotechnol Lett,1989,11(4):231-236.
[13]WANG J,WEN B,WANG J,et al.Enhancing L-isoleucine production by thrABC overexpression combined with alaT deletion in Corynebacterium glutamicum[J].Appl Biochem Biotech,2013,171(1):20-30
[14] DONG X,ZHAO Y,ZHAO J,et al.Characterization of aspartate kinase and homoserine dehydrogenase from Corynebacterium glutamicum IWJ001 and systematic investigation of L-isoleucine biosynthesis[J].J Ind Microbiol Biot,2016,43(6):873-885.
[15]史建明,徐兰兰,谢希贤,等.过量表达苏氨酸脱水酶对谷氨酸棒杆菌合成L-异亮氨酸的影响[J].天津科技大学学报,2011(3):10-15.
[16] EIKMANNS B J,BLOMBACH B.The pyruvate dehydrogenase complex of Corynebacterium glutamicum:an attractive target for metabolic engineering[J].J Bacteriol,2014,192:339-345.
[17]朱福周,芦楠,李宇虹,等.增强回补途径对谷氨酸棒状杆菌合成L-异亮氨酸的影响[J].食品与发酵工业,2020,46(2):11-17.
[18]GUO Y,HAN M,ZHANG W,et al.Generation of mutant threonine dehydratase and its effects on isoleucine synthesis in Corynebacterium glutamicum[J].World J Microb Biot,2015,31:1369-1377.
[19] YIN L,HU X,XU D,et al.Co-expression of feedback-resistant threonine dehydratase and acetohydroxy acid synthase increase L-isoleucine production in Corynebacterium glutamicum[J].Metab Eng,2012,14(5):542-550.
[20]吴锦荣,李西君,刘世周,等.L-异亮氨酸生产菌Corynebacterium glu-tamicum JHI3-156 中突变酶TD1 及AHAS1 的初研究[J].发酵科技通讯,2016,45(4):240-247.
[21]张炎潮.代谢工程改造谷氨酸棒状杆菌生产L-异亮氨酸[D].无锡:江南大学,2020.
[22]LIU Y,LI Y,WANG X.Acetohydroxy acid synthases:evolution,structure and function[J].Appl Microbiol Biot,2016,100(20):1-17.
[23] LU J,BRIGHAM C J,PLASSMEIER J K,et al.Characterization and modification of enzymes in the 2-ketoisovalerate biosynthesis pathway of Ralstonia eutropha H16[J].Appl Microbiol Biot,2015,99(2):761-774.
[24]GUO Y,HAN M,XU J,et al.Analysis of acetohy droxyacid synthase variants from branched-chain amino acids-producing strains and their effects on the synthesis of branched-chain amino acids in Corynebacterium glutamicum[J].Protein Expres Purif,2015,109:106-112.
[25] MARX A,DE GRAAF A A,WIECHERT W,et al.Determination of the fluxes in the central metabolism of Corynebacterium glutamicum by nuclear magnetic resonance spectroscopy combined with metabolite balancing[J].Biotechnol Bioeng,2015,49(2):111-129.
[26] WANG X.Strategy for improving L-isoleucine production efficiency in Corynebacterium glutamicum[J].Appl Microbiol Biot,2019,103(5):2101-2111.
[27]REINSCHEID D J,EIKMANNS B J,SAHM H.Analysis of a Corynebacterium glutamicum hom gene coding for a feedback-resistant homoserine dehydrogenase[J].J Bacteriol,1991,173(10):3228-3230.
[28]徐德雨,郑小梅,赵晶,等.谷氨酸棒杆菌天冬氨酸激酶G359D 突变解除赖氨酸与苏氨酸协同抑制的研究[J].生物技术通报,2017,33(11):143-152.
[29] YOSHIDA A,TOMITA T,KURIHARA T,et al.Structural insight into concerted inhibition of a2β2-type aspartate kinase from Corynebacterium glutamicum[J].J Mol Biol,2007,368(2):521-536.
[30]CHEN Z,MEYER W,RAPPERT S,et al.Coevolutionary analysis enabled rational deregulation of allosteric enzyme inhibition in Corynebacterium glutamicum for lysine production[J].Appl Environ Microb,2011,77(13):4352-4360.
[31]PETIT C,KIM Y,LEE S K,et al.Reduction of feedback inhibition in homoserine kinase(thrB)of Corynebacterium glutamicum enhances L-threonine biosynthesis[J].ACS Omega,2018,3(1):1178-1186.
[32]SHI F,ZHANG M,LI Y,et al.Sufficient NADPH supply and pknG deletion improve 4-hydroxyisoleucine production in recombinant Corynebacterium glutamicum[J].Enzyme Microb Technol,2018,115:1-8.
[33] ZHANG H,LI Y,WANG C,et al.Understanding the high L-valine production in Corynebacterium glutamicum VWB-1 using transcriptomics and proteomics[J].Sci Rep-UK,2018,8(1):3632.
[34] SHI F,HUAN X,WANG X,et al.Overexpression of NAD kinases improves the L-isoleucine biosynthesis in Corynebacterium glutamicum ssp.Lactofermentum[J].Chin J Biotechnol,2012,51(2):73-80.
[35]SHI F,LI K,HUAN X,et al.Expression of NAD (H)kinase and glucose-6-phosphate dehydrogenase improve NADPH supply and L-isoleucine biosynthesis in Corynebacterium glutamicum ssp.lactofermentum[J].Appl Biochem Biotech,2013,171(2):504-521.
[36]苏跃稳,张昕,王健.L-缬氨酸代谢工程研究进展[J].发酵科技通讯,2016,45(2):118-122.
[37]SHI F,LI K,LI Y.Comparative proteome analysis of global effect of POS5 and zwf-ppnK overexpression in L-isoleucine producing Corynebacterium glutamicum ssp. lactofermentum[J]. Biotechnol Lett,2015,37(5):1063-1071.
[38] MA W,WANG J,LI Y,et al.Enhancing pentose phosphate pathway in Corynebacterium glutamicum to improve L-isoleucine production[J].Appl Biochem Biotech,2015,63(6):877-885.
[39] BARTEK T,MAKUS P,KLEIN B,et al.Influence of L-isoleucine and pantothenate auxotrophy for L-valine formation in Corynebacterium glutamicum revisited by metabolome analyses[J].Bioproc Biosyst Eng,2008,31(3):217-225.
[40]XIONG H,LIU Y,XU Q.Effect of sodium dodecyl sulfate on the production of L-isoleucine by the fermentation of Corynebacterium glutamicum[J].Bioengineered,2020,11(1):1124-1136.
[41]D'ESTE M,ALVARADO M M,ANGELIDAKI I,et al.Amino acids production focusing on fermentation technologies[J]. Biotechnol Adv,2018,36(1):14-25.
[42] TAUCH A,HERMANN T,BURKOVSKI A,et al.Isoleucine uptake in Corynebacterium glutamicum ATCC 13032 is directed by the brnQ gene product[J].Arch Microbiol,1998,169(4):303-312.
[43]XIE X,XU L,SHI J,et al.Effect of transport proteins on L-isoleucine production with the L-isoleucine-producing strain Corynebacterium glutamicum YILW[J].J Ind Microbiol Biot,2012,39(10):1549-1556.
[44]MUSTAFI N,ALEXANDER G,KOHLHEYER D,et al.The development and application of a single-cell biosensor for the detection of L-methionine and branched-chain amino acids[J].Metab Eng,2012,14(4):449-457.
[45] IHARA K,SATO K,HORI H,et al.Expression of the alaE gene is positively regulated by the global regulator Lrp in response to intracellular accumulation of L-alanine in Escherichia coli[J].J Biosci Bioeng,2017,123(4):444.
[46]陈诚,李颜颜,尹良鸿,等.全局调控因子Lrp 的表达强化谷氨酸棒状杆菌发酵生产L-缬氨酸[J].食品与生物技术学报,2016,35(9):920-927.
[47]TAN S,SHI F,LIU H,et al.Dynamic control of 4-hydroxyisoleucine biosynthesis by modified L-isoleucine biosensor in recombinant Corynebacterium glutamicum[J].ACS Synth Biol,2020,9(9):2378-2389.
[48] CHEN C,LI Y,HU J,et al.Metabolic engineering of Corynebacterium glutamicum ATCC 13869 for L-valine production[J]. Metab Eng,2015,29:66-75.
[49]YIN L,SHI F,HU X,et al.Increasing L-isoleucine production in Corynebacterium glutamicum by overexpressing global regulator Lrp and two-component export system BrnFE[J].J Appl Microbiol,2013,114(5):1369-1377.
[50]孔帅,方应浩,周航,等.微生物发酵法生产L-异亮氨酸的研究进展[J].中国酿造,2020,39(9):30-36..
[51] BECKER J,GIEELMANN G,HOFFMANN S L,et al. Corynebacterium glutamicum for sustainable bioproduction:from metabolic physiology to systems metabolic engineering[J]. Adv Biochem Eng Biotechnol,2018,162(3):217-263.
[52] CLETO S,JENSEN J K,WENDISCH V F,et al. Corynebacterium glutamicum metabolic engineering with CRISPR Interference (CRISPRi)[J].ACS Synth Biol,2016,5(5):375-385.