自然界中的多糖主要从植物和微生物中提取,微生物多糖是其在生长代谢过程中产生并分泌到细胞外的一类多糖[1],其在微生物抵抗环境压力(渗透压、干燥、有毒化合物和噬菌体)时发挥重要的作用[2]。微生物多糖分为胞外多糖(exopolysaccharides,EPS)和胞壁多糖[3]。与胞壁多糖相比,胞外多糖更易与菌体分离,在水溶液中呈胶体状态[4-5]。因具有易提取、周期短、不受季节影响而被广泛用于食品添加剂、黏合剂和废水处理。近几十年来,由于微生物EPS在产品结构、性能及生产方面所具有的优势而得到大力研究开发[6]。目前研究证实,EPS具有良好的抗氧化、增强免疫力及抑菌等功能。LIU X等[7]从粗毛纤孔菌子实体提取的多糖对急性酒精肝损伤小鼠有较强抗肿瘤活性;孙晓萌[8]对海参肠道的季也蒙假丝酵母(Candida guilliermondii)产的EPS进行研究,发现EPS-2具有较强的抗氧化活性和还原力;孙建瑞等[9]研究发现,EPS能明显的抑制金黄色葡萄球菌(Staphylococcus aureus)。因此,微生物多糖受到了广泛的关注[10-11]。
罗汉果(Siraitia grosvenorii)为葫芦科多年生藤本植物的果实[12],罗汉果的内生菌种类繁多,张昌志等[13-15]从罗汉果中分离出几十株内生菌,从中筛选出高产环糊精葡萄糖基转移酶、具有抗氧化能力以及对α-淀粉酶有抑制作用的菌株。但是尚有更多其他生物活性值得开发利用[16-18]。
本研究从课题组分离的罗汉果内生菌株中,拟筛选出产EPS的菌株,并通过形态观察、生理生化试验及分子生物学技术进行菌种鉴定。在此基础上,采用单因素及正交试验对其产EPS的发酵条件进行优化,确定最佳发酵工艺条件,以期提高EPS的含量,为微生物多糖的应用研究奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 罗汉果内生菌株
罗汉果内生菌株:38株,保存于广西师范大学生物学实验中心发酵工程实验室[13-15]。
1.1.2 主要试剂
葡萄糖、氯化钠、碳酸钠、蔗糖、硫酸、苯酚(均为分析纯):西陇科学股份有限公司;无水乙醇(分析纯):广东光华科技股份有限公司;酵母浸粉(生化试剂):广东环凯微生物科技有限公司;α-萘酚(生化试剂):国药集团化学试剂有限公司。
1.1.3 培养基
马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:参考龙楚媚等[15]的研究。
牛肉膏蛋白胨培养基、基础培养基、溶菌肉汤(lysogeny broth,LB)培养基、超级肉汤(terrific broth,TB)培养基(胰蛋白胨1.2 g,酵母提取物2.4 g,甘油0.4 mL,磷酸氢二钾1.2 g,定容至100 mL):参考于杰[19]的研究。
甲基红试验培养基、吲哚试验培养基:参考《常见细菌系统鉴定手册》[20]。
以上培养基pH均为7.0~7.2,灭菌条件均为121 ℃灭菌30 min。
1.2 仪器与设备
YM75型立式压力蒸汽灭菌锅:上海三申医疗器械有限公司;ZD-85型恒温振荡器:国华仪器制造有限公司;HP400S型生化培养箱:武汉瑞华仪器设备有限责任公司;BX63型荧光成像分析系统显微镜:日本Olympus公司;Infinite M200Pro酶标仪:帝肯贸易有限公司;TD-5A大容量离心机:常州中城仪器制造有限公司。
1.3 试验方法
1.3.1 胞外多糖样品的制备及测定
胞外多糖的提取方法参考王爽等[21-22]的研究,将罗汉果内生菌接种于LB培养基中,30 ℃、130 r/min条件下培养24 h得到种子液;以4%(V/V)的接种量接种于基础培养基中,30 ℃、130 r/min条件下培养48 h,4 000 r/min离心15 min,去除菌体,加入3倍体积的无水乙醇,4 ℃冰箱静置过夜,相同条件下离心得沉淀,沉淀中加入适量蒸馏水复溶,得粗提的多糖样品溶液,采用苯酚-硫酸法[23]测其EPS含量。
1.3.2 胞外多糖产生菌株的筛选
初筛(定性):采用α-萘酚-硫酸法[24]进行初筛。
复筛(定量):对初筛得到的产EPS较高的菌株进一步采用苯酚-硫酸法测其EPS含量,从而复筛到高产EPS的菌株。
1.3.3 胞外多糖产生菌株的鉴定
形态学观察:依据菌株菌落形态特征和显微形态特征进行形态学观察。
生理生化试验:对菌株进行甲基红试验、接触酶试验、二乙酰试验(V-P试验)等生理生化试验[20]。
分子生物学鉴定:将菌株送往武汉华大基因科技有限公司,完成16S rDNA测序,并在美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中采用基本局部比对搜索工具(basic local alignment search tool,BLAST)对测序结果进行基因同源性的搜索,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA 7.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.4 生长曲线及胞外多糖生产曲线
将复筛得到的菌株活化后,接入基础培养基中,30 ℃、130r/min条件下培养120h,每3h取一次发酵液,在波长600nm处测定吸光度值,绘制菌株的生长曲线。同时,采用苯酚-硫酸法测定EPS含量,绘制菌株产胞外多糖曲线。
1.3.5 胞外多糖产生菌株发酵条件优化单因素试验
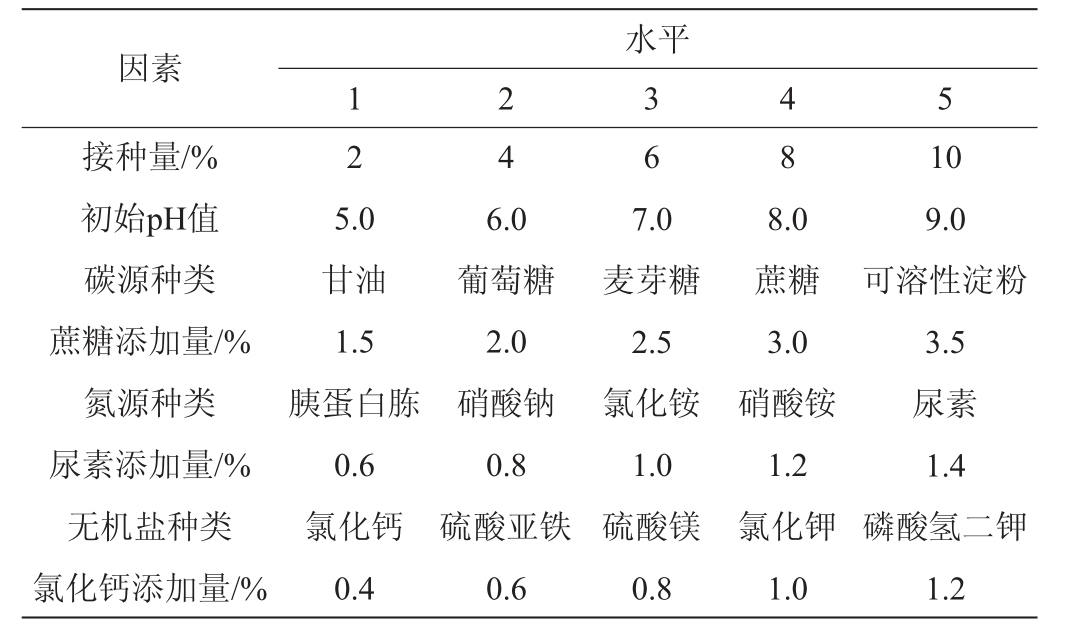
将筛选出的菌株按4%(V/V)的接种量分别接种于牛肉膏蛋白胨培养基、基础培养基、LB培养基、TB培养基、PDB培养基,30 ℃、130 r/min条件下培养48 h,测定EPS含量,筛选出有利于菌株产EPS的培养基。在此基础上,采用单因素轮换法依次考察接种量、初始pH值、碳源种类(2.0%)及添加量、氮源种类(1.0%)及添加量、无机盐种类(1.0%)及添加量对菌株产EPS的影响[19],因素与水平见表1。
表1 发酵条件优化单因素试验因素与水平
Table 1 Factors and levels of single factor tests for fermentation conditions optimization
1.3.6 胞外多糖产生菌株发酵条件优化正交试验
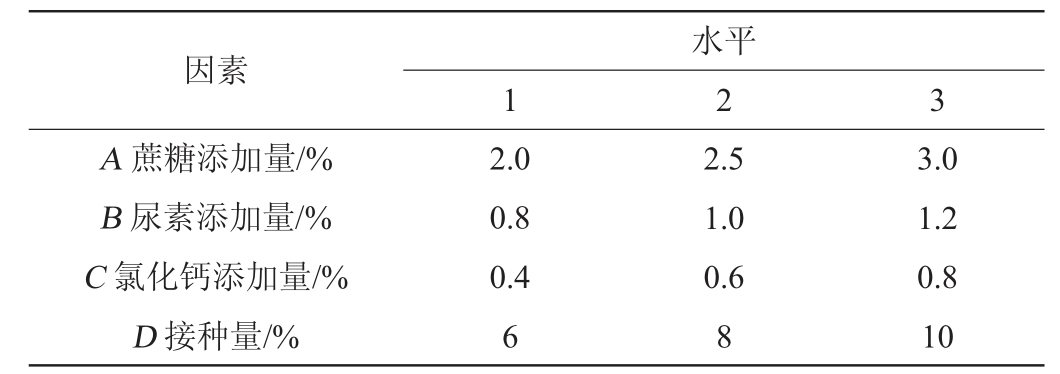
在单因素试验的基础上,选择对试验结果影响较大的因素,以EPS产量(Y)为评价指标进行4因素3水平的正交试验,试验因素与水平见表2。
表2 发酵条件优化正交试验因素与水平
Table 2 Factors and levels of orthogonal tests for fermentation conditions optimization
1.3.7 数据处理
试验数据处理采用Q值检测[25]。利用SPSS 26.0和Excel 2016软件对试验数据进行统计与分析。试验数据以“平均值±标准差”的形式表示,组间差异用Duncan检验。
2 结果与分析
2.1 胞外多糖产生菌株的筛选
采用α-萘酚-硫酸法从38株罗汉果内生菌株中筛选得到6株产胞外多糖的菌株,其中菌株LHG-3发酵液的显色反应的颜色最深,菌株GZ-5的最浅。因此,初步筛选得到菌株LHG-3产EPS的量最高。进一步测定6株菌株发酵液多糖样品的EPS含量,结果见图1。
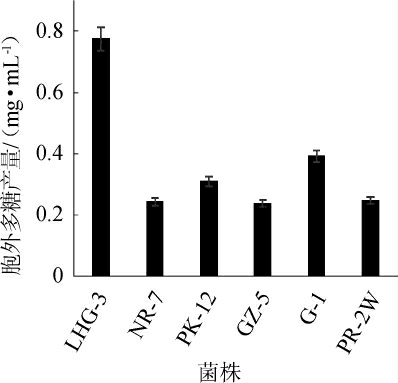
图1 初筛菌株的胞外多糖产量
Fig.1 Extracellular polysaccharide production of preliminary screening strains
由图1可知,菌株LHG-3的EPS含量最高,达(0.78±0.02)mg/mL,明显高于其余菌株(P<0.05),与显色反应的结果相一致。因此,选择该菌株进行后续试验。
2.2 菌株LHG-3的鉴定
2.2.1 形态学观察
菌株LHG-3的菌落及细胞形态观察结果见图2。
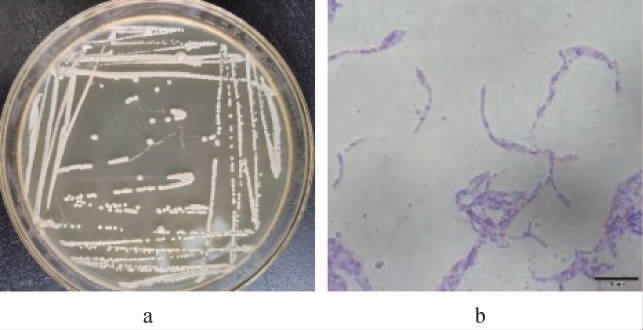
图2 菌株LHG-3的菌落(a)及细胞(b)形态
Fig.2 Colony (a) and cell (b) morphology of strain LHG-3
由图2可知,菌株LHG-3的菌落表面为乳白色,表面湿润光滑,不透明,挑起时有较强黏性。细胞呈杆状,革兰氏染色呈紫色,为革兰氏阳性菌。
2.2.2 生理生化试验
生理生化试验结果表明,菌株LHG-3的甲基红试验、接触酶试验、V-P试验、葡萄糖利用试验、淀粉水解试验、脂酶试验、明胶液化试验、柠檬酸盐利用试验结果均为阳性,吲哚试验为阴性。结合形态特征,参考《常见细菌系统鉴定手册》[17],初步将菌株LHG-3归为芽孢杆菌属(Bacillus sp.)。
2.2.3 分子生物学鉴定
基于16S rDNA基因序列构建菌株LHG-3的系统发育树,结果见图3。由图3可知,菌株LHG-3与韦德曼尼芽孢杆菌(Bacillus wiedmannii)同属一支,BLAST结果显示菌株LHG-3与Bacillus wiedmannii的16S rDNA序列同源性>99%,亲源关系最近。结合其形态观察和生理生化鉴定结果,最终鉴定菌株LHG-3为韦德曼尼芽孢杆菌(Bacillus wiedmannii)。

图3 基于16S rDNA基因序列菌株LHG-3的系统发育树
Fig.3 Phylogenetic tree of strain LHG-3 based on 16S rDNA gene sequences
2.3 菌株LHG-3的生长曲线及产胞外多糖曲线
菌株LHG-3的生长曲线和产EPS曲线见图4。
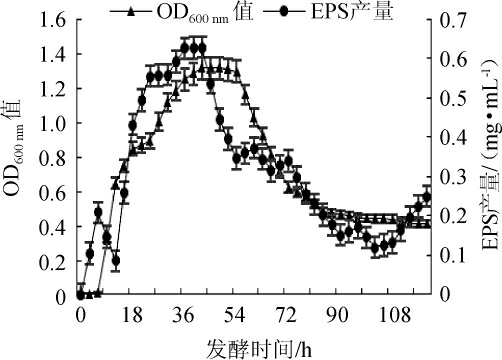
图4 菌株LHG-3的生长曲线及产胞外多糖曲线
Fig.4 Growth curve and extracellular polysaccharide production curve of strain LHG-3
由图4可知,菌株LHG-3的生长和产EPS是同步的,属于生长偶联型,产EPS的最佳发酵时间为42 h。
2.4 菌株LHG-3产胞外多糖发酵条件优化单因素试验结果
菌株LHG-3在5种培养基中培养48 h后的EPS产量见图5。由图5可知,菌株LHG-3在5种培养基发酵48 h都能产EPS,其中TB培养基中EPS产量最高,为(0.83±0.03)mg/mL,明显高于其他培养基(P<0.01)。因此,选择TB培养基作为后续试验的基础发酵培养基。
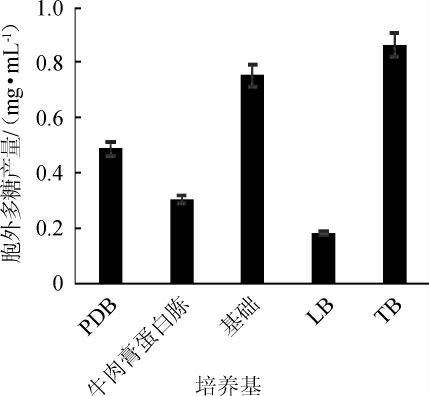
图5 不同培养基对菌株LHG-3产胞外多糖的影响
Fig.5 Effect of different media on extracellular polysaccharide production by strain LHG-3
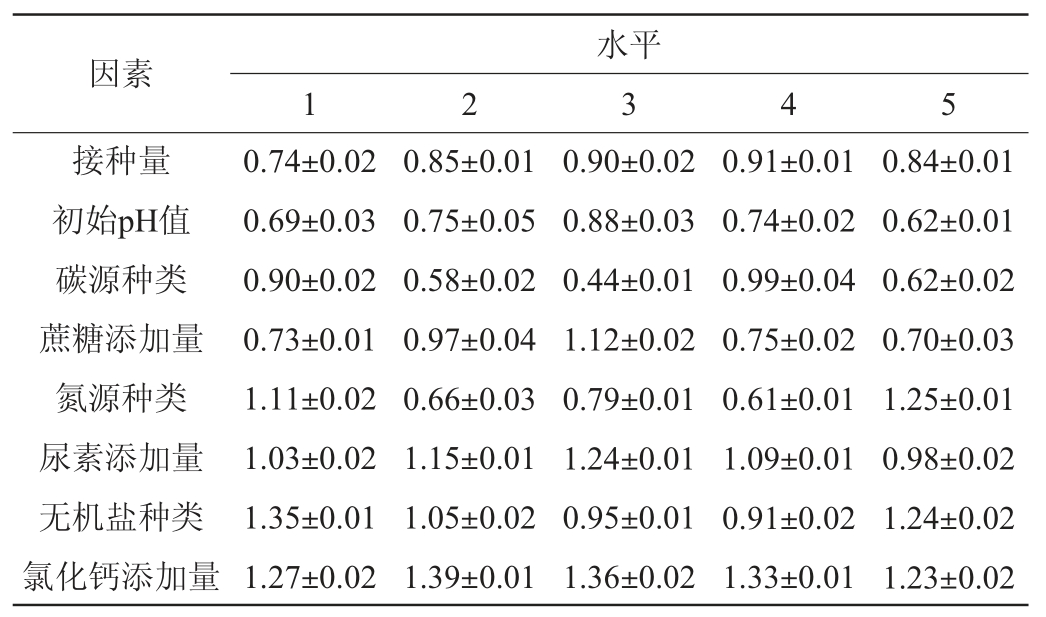
不同因素对菌株LHG-3产EPS的影响见表3。由表3可知,当碳源、氮源和无机盐种类分别为蔗糖、尿素、氯化钙时,EPS产量最高,分别为(0.99±0.04)mg/mL、(1.25±0.01)mg/mL、(1.35±0.01)mg/mL,说明最优碳源为蔗糖,最优氮源为尿素,最优无机盐为氯化钙。随着接种量、初始pH值、蔗糖添加量、尿素添加量、氯化钙添加量的增加,菌株LHG-3的EPS产量均呈先升高后下降的趋势,当接种量、初始pH值、蔗糖添加量、尿素添加量、氯化钙添加量分别为8%、7.0、2.5%、1.0%、0.6%时,EPS产量最高,分别为(0.91±0.01)mg/mL、(0.88±0.03)mg/mL、(1.12±0.02)mg/mL、(1.24±0.01)mg/mL、(1.39±0.01)mg/mL,因此,确定最佳条件为接种量8%、初始pH值7.0、蔗糖添加量2.5%、尿素添加量1.0%、氯化钙添加量0.6%。
表3 不同因素对菌株LHG-3产EPS的影响
Table 3 Effect of different factors on extracellular polysaccharide production by strain LHG-3 mg/mL
2.5 菌株LHG-3产胞外多糖发酵条件优化正交试验结果
在单因素试验的基础上,确定初始pH值为7.0,选择蔗糖添加量(A)、尿素添加量(B)、氯化钙添加量(C)、接种量(D)为考察因素,以EPS产量(Y)为评价指标,采用正交试验研究不同因素对菌株产EPS的影响,结果见表4,方差分析见表5。
表4 菌株LHG-3产胞外多糖发酵条件优化正交试验结果与分析
Table 4 Results and analysis of orthogonal tests for fermentation conditions optimization of extracellular polysaccharide produced by strain LHG-3
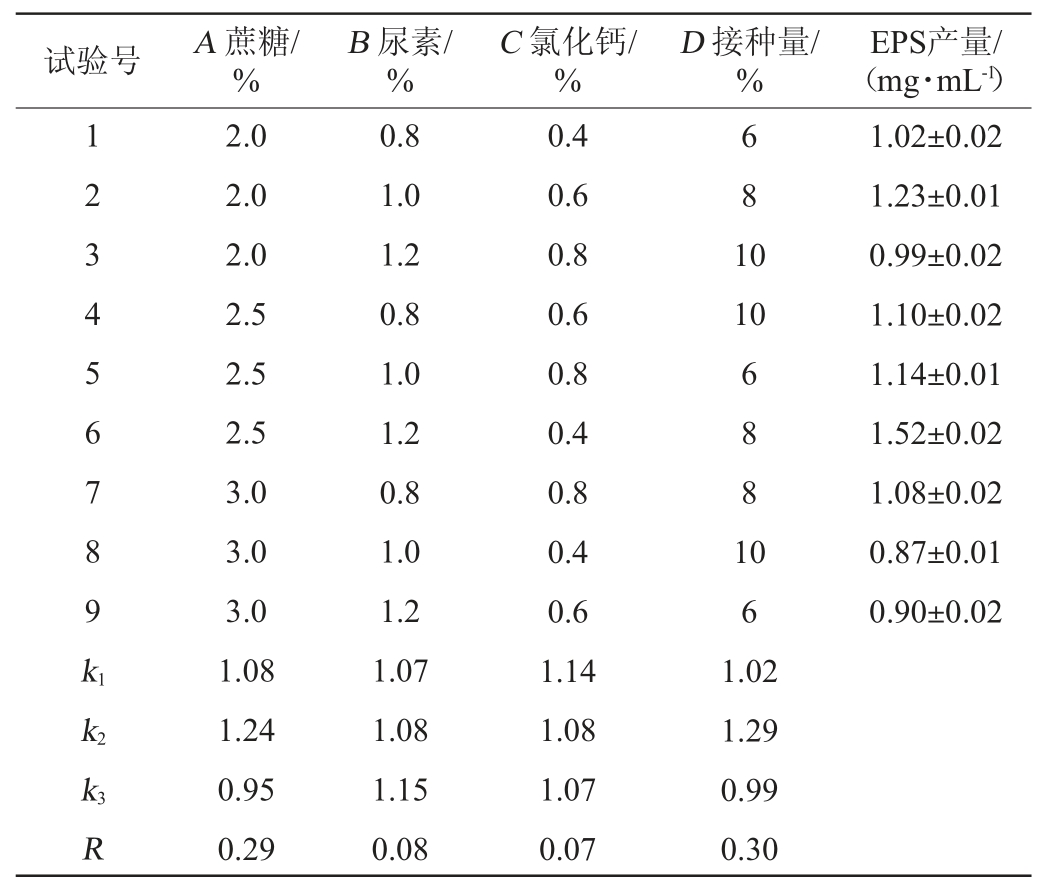
表5 正交试验结果方差分析
Table 5 Variance analysis of orthogonal tests results
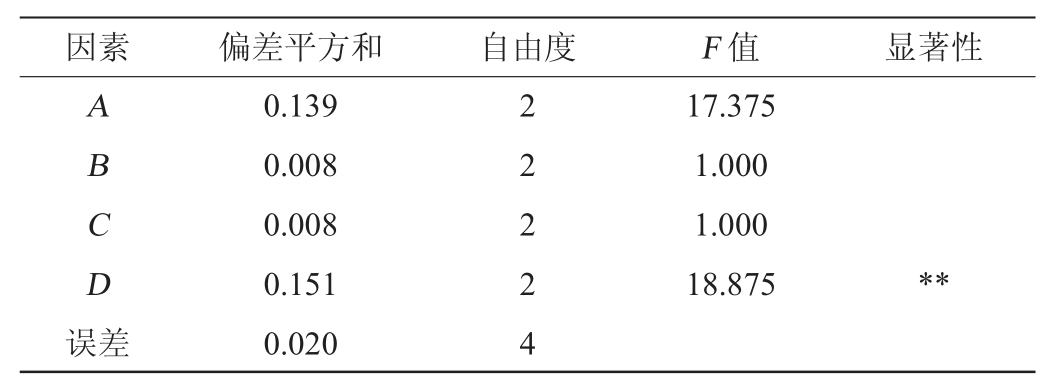
注:F0.01(2,4)=18,F0.05(2,4)=6.94;“**”表示对结果影响极显著(P<0.01)。
由表4可知,根据极差大小可以判断影响菌株产EPS的因素主次顺序为D>A>B>C,即接种量>蔗糖添加量>尿素添加量>氯化钙添加量。菌株LGH-3产EPS的最佳条件组合是A2B3C1D2,即蔗糖2.5%、尿素1.2%、氯化钙0.4%、接种量8%。由表5可知,接种量对菌株LGH-3产EPS的影响极显著(P<0.01)。
2.6 验证试验
采用优化后的培养基和培养条件对菌株LHG-3进行发酵,发酵42 h后,测得EPS的产量为(1.59±0.03)mg/mL,高于试验组6的(1.52±0.02)mg/mL。
3 结论
从罗汉果内生菌中筛选得到1株高产EPS的菌株,编号为LHG-3,经过形态观察、生理生化试验及分子生物学鉴定,最终鉴定其为韦德曼尼芽孢杆菌(Bacillus wiedmannii)。该菌株产EPS的最优培养基为TB培养基,通过单因素和正交试验优化确定该菌株产EPS的最优条件为接种量8%、蔗糖2.5%、尿素1.2%、氯化钙0.4%,初始pH值7.0,在30 ℃条件下培养42 h,菌株LHG-3的EPS产量达到(1.59±0.03)mg/mL,是优化前的1.9倍。由此可见,罗汉果内生菌具有产EPS的潜力,利用菌株LHG-3发酵生产EPS,不仅为EPS的生产提供了菌株来源,也为利用菌株LHG-3大量生产EPS提供了理论基础。
[1]QIANG L,LI Y,SHENG H,et al.Optimization of fermentation conditions and properties of an exopolysaccharide from Klebsiella sp.H-207 and applicationin adsorption of hexavalent chromium[J].PloS One,2013,8(1):e53542.
[2]ZHOU Y,CUI Y,QU X.Exopolysaccharides of lactic acid bacteria:Structure,bioactivity and associations:A review[J].Carbohyd Polym,2019,207(1):317-332.
[3]马岩石,刘韩,裴芳艺.产胞外多糖酵母菌的分离鉴定及其发酵条件优化[J].食品研究与开发,2020,41(14):68-76.
[4] BZDUCHA-WROBEL A,KIELISZEK M,BIAZEJAK S,et al.Chemical composition of the cell wall of probiotic and brewer's yeast in response to cultivation medium with glycerol as a carbon source[J].Eur Food Res Technol,2013,237(4):489-499.
[5] SHAH A M,CHAUDHURI T K,MISHRA S.Strategy for purification of aggregation prone β-glucosidases from the cell wall of yeast:a preparative scale approach[J].New Biotechnol,2012,29(3):311-320.
[6] WANG J,ZHAO X,TIAN Z,et al.Characterization of an exopolysaccharide produced by Lactobacillus plantarum YW11 isolated from Tibet kefir[J].Carbohyd Polym,2015,125(3):16-25.
[7]LIU X,HOU R,YAN J,et al.Purification and characterization of Inonotus hispidus exopolysaccharide and its protective effect on acute alcoholic liverinjury in mice[J].Int J Biol Macromol,2019,129(5):41-49.
[8]孙晓萌.季也蒙假丝酵母胞外多糖的分离纯化及活性研究[D].大连:大连工业大学,2016.
[9]孙建瑞,赵君峰,符丹丹.响应面法优化Chlorella vulgaris 224 胞外多糖积累及其抑菌和抗氧化活性[J].天然产物研究与开发,2020,32(3):489-497.
[10]孟凡岭,万姝含,胡风庆.乳酸菌胞外多糖生物活性研究进展[J].辽宁大学学报(自然科学版),2018,45(4):379-384.
[11] GOPINATH M,CHAYANIKA S.Optimization and extraction of edible microbial polysaccharide from fresh coconut inflorescence sap:An alternative substrate[J].LWT-Food Sci Technol,2021,138(3):110-119.
[12]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1997:197.
[13]张昌志,范彩琴,龙楚媚.罗汉果内生菌中产环糊精葡萄糖基转移酶菌株的筛选及产酶条件优化[J].中国酿造,2018,37(5):97-102.
[14]范彩琴,张昌志,龙楚媚.罗汉果内生真菌的分离及其发酵产物的抗氧化活性研究[J].中国酿造,2017,36(12):46-50.
[15]龙楚媚,付强,王琪.罗汉果内生菌的分离及α-淀粉酶抑制剂产生菌的筛选[J].中国酿造,2019,38(1):71-74.
[16]李俊,黄锡山,陈海燕.罗汉果多糖提取工艺及组成分析[J].广西师范大学学报(自然科学版),2007,25(1):70-73.
[17]李珊,梁俭,刘晓凤.罗汉果籽多糖的提取纯化及其抗氧化活性测试[J].粮食与油脂,2020,33(2):78-83.
[18]吴奔.利用物理及酶法提高罗汉果甙V 含量的工艺研究及酶转化产物的结构鉴定[D].桂林:广西师范大学,2017.
[19]于杰.沙棘根瘤内生细菌胞外多糖对重金属吸附作用的研究[D].兰州:西北师范大学,2019.
[20]东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001:43-44.
[21]王爽.银杏内生菌Endo Gin Ya6 的鉴定及其胞外多糖发酵条件的优化[D].大连:大连工业大学,2015.
[22]张爱梅,于杰,韩雪英.高产胞外多糖沙棘根瘤内生细菌的筛选、鉴定及其发酵条件优化[J].食品工业科技,2019,40(19):81-88.
[23]孙晓燕,蔡昌利,徐丽莉.多糖含量测定方法的比较[J].现代中药研究与实践,2015,29(3):58-62.
[24]张世仙,刘焱,朱彬.α-萘酚-硫酸法测定酒糟多糖含量[J].食品科学,2013,34(18):245-248.
[25]于鸣,杨铭鼎,陈秉衡.毒物联合作用分类评价方法的探讨—Ⅱ.一个新的Q 值检验系统[J].新疆医学院学报,1985,8(2):169-173.