食物过敏是人们摄入某种食物后产生的一种不良反应,其临床症状主要有口腔过敏综合症、荨麻疹、肠道疾病、哮喘及过敏性鼻炎,严重时可导致过敏性休克甚至死亡。近年来,食物过敏己成为全球性不可回避的食品安全问题之一[1]。联合国粮食及农业组织(food and agriculture organization of the united nations,FAO)认定,牛奶、花生、坚果、蛋类、大豆、小麦、鱼虾和水生贝壳类是常见的引起食物过敏反应的八大类食物,在过敏反应中,有90%以上是由这八类食物所引起[2-3]。我国的过敏问题也越来越受到重视,为此,正在修订的GB7718《食品安全国家标准预包装食品标签通则》(征求意见稿)中要求将原标准鼓励标注过敏食物改为强制标准,严格的过敏食品标签管理将为过敏病人的生活提供方便。
酱油味道鲜美,口感醇厚,是中国餐桌上必不可少的调味料。酿造酱油是以大豆、小麦或麸皮为原料,经微生物天然发酵而成的[4],酱油的酿造方式主要有高盐稀态和低盐固态两种方式,这两种工艺在发酵温度、盐水浓度及发酵时间等方面存在区别。酱油在酿造过程中大分子蛋白被降解成小分子的氨基酸和多肽,并以氨基酸态氮的含量作为酱油的分级标准之一。作为酱油生产原料的大豆和小麦均被联合国粮食及农业组织(FAO)认定为过敏食物,根据国际免疫学会联合会过敏原命名分会官方网站,截至2012年9月24日已批准7类大豆过敏原,分别是Gly m 1(疏水蛋白)、Gly m 2(防御蛋白)、Gly m 3(细胞溶质蛋白)、Gly m 4(病程相关蛋白)、Glym5(7S球蛋白)、Glym 6(11S球蛋白)、Glym 7(种子生物素化蛋白)。截至2015年2月12日已批准9类食源性小麦过敏原,分别是Tri a 12(抑制蛋白)、Tri a 14(非特异性脂转移蛋白1)、Tri a 18(同工麦胚凝集素1)、Tri a 19(ω5-麦醇溶蛋白)、Tri a 20(γ-麦醇溶蛋白)、Tri a 25(硫氧还蛋白)、Tri a 26(高分子量麦谷蛋白)、Tri a 36(低分子质量麦谷蛋白GluB3-23)、Tri a 37(α-嘌呤硫素)[5]。
在酱油的酿造过程中,原料大豆、小麦经过蒸煮、制曲、长时间的发酵、加热灭菌以及过滤处理,原料中蛋白质的降解发生在整个酱油的制备过程中。虽然经过发酵降解,但国内外仍然有不少酱油过敏的报道,且过敏人群以婴幼儿为主。目前关于酱油中过敏原的检测报道较少。KOBAYASHI M等[6]报道在日本生产的10个商业酱油样品中未检测到小麦过敏原。KOBAYASHI M等[7]用病人血清未检测到日本酱油中的小麦过敏原,在生酱油中检测到大豆过敏原,但经过热处理和过滤过程的熟酱油中大豆过敏原已检测不到。国内目前邵碧英等[8]采用大豆和小麦过敏原检测试剂盒对烤鳗酱油中过敏蛋白进行了检测,绝大部分烤鳗酱油样品中检测不到大豆过敏原,检测到的含量也很低;检测到小麦过敏原含量很低或没有。目前我国众多种类和级别的酱油中过敏原情况尚不清楚,很有必要了解市售国产酱油的过敏原分布情况。
本研究选取了14种具有代表性的市售国产酱油产品进行其过敏原的定性定量分析,为我国的酱油过敏性分析研究提供科学数据,并为过敏病人选择酱油提供参考。
1 材料与方法
1.1 材料与试剂
14种不同酿造工艺不同等级的国产酱油(编号为1~14,其中1~2为低盐固态三级酱油;3~5(三级)、6~8(二级)、9~11(一级)、12~14(特级)为高盐稀态酱油):市售;乙醇、盐酸、甲醇等(均为分析纯):北京瀚城生物有限公司;磷酸盐缓冲液(phosphate buffer saline,PBS)干粉2L(pH 7.2~7.4)装、脱脂奶粉、含0.05%吐温20的Tris-HCl缓冲盐(Tris-HCl buffer saline with 0.05%Tween 20,TBST)洗涤液、Tris-HCl(Tris-HCl buffered saline,TBS)缓冲液(pH7.2~7.4)、蛋白Marker、30%凝胶储液、Bradford蛋白测定试剂盒、3,3',5,5'-四甲基联苯胺(3,3',5,5'-tetramethylbenzidine,TMB)双组分显色液、酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)终止液、二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒、酶标二抗辣根过氧化物酶(horseradish peroxidase,HRP)、兔血清免疫球蛋白G(immunoglobulin G,IgG)(效价1∶10 000)、HRP-人血清免疫球蛋白E(IgE)(效价1∶1 000):北京索莱宝技术有限公司;96孔酶标板:美国Corning公司;抗大豆兔多克隆抗体:农业农村部农产品质量安全收贮运管控重点实验室自制;抗小麦兔多克隆抗体:中国海洋大学食品安全实验室李振兴教授提供;大豆、小麦过敏病人血清:北京协和医院提供的大豆或小麦过敏原检测为阳性结果的血清。
1.2 仪器与设备
TGL-16A高速冷冻离心机:长沙平凡仪器厂;WD-9405B型水平摇床、DYCN-24D型垂直电泳槽、DYCZ-40D转印芯:北京六一仪器厂;I-mark 型酶标仪、1575型洗板机:美国BIO-RAD公司。
1.3 试验方法
1.3.1 Tris-tricine-十二烷基硫酸钠聚丙烯酰胺凝胶电泳
按照LAEMMLI BUK等[9]的方法,采用不连续垂直凝胶电泳,凝胶厚度1 mm,选用质量分数为16.5%分离胶,10%夹层胶,4%浓缩胶,将提取液稀释至1 mg/mL,用2×Tricine缓冲液稀释样品,上样量为10 μL,Marker上样量为5 μL。设定电泳条件为60 V预电泳10 min,再将样品加入点样孔后60 V电泳30 min,150 V电泳至溴酚蓝到达胶底部后停止电泳(约1.5 h),进行剥胶、考马斯亮蓝R250染色、脱色后拍照。
1.3.2 酱油中蛋白的免疫印迹分析
蛋白样品进行Tricine-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳分离后,夹心法转膜,恒流90 mA电转移120 min,转移完成后取出硝酸纤维素(nitrocellulose filter membrane,NC)膜。已转印的NC膜用封闭液(含5%的脱脂奶粉的TBST溶液)于室温条件下封闭2 h,取出后用TBST洗涤液洗涤5次,每次5~10 min。加入用封闭液1∶1 000稀释的兔抗大豆蛋白多克隆抗体,室温孵育1.5 h,用TBST洗涤5次,每次5~10 min。加入1∶5 000稀释的HRP标记羊抗兔室温孵育1.5 h后,用TBST洗膜5次,每次5~10 min,后用TBS洗涤两次,每次5 min。二氨基联苯胺(DAB)避光显色1 min,以蒸馏水洗涤3次,每次5 min以终止反应。显色之后,及时拍照。
用小麦兔多克隆抗体实验时,抗体1∶800稀释,其余步骤同上。
1.3.3 酱油中蛋白的免疫原性与过敏原性的测定
采用间接竞争酶联免疫吸附(间接竞争ELISA)法测定酱油样品中大豆、小麦蛋白的免疫原性,测定参照王梦莉[10]的方法。抗原性测定中,大豆、小麦蛋白抗原的包被质量浓度为1.0 μg/mL,2种抗原对应的兔抗血清稀释比例分别为1∶10 000和1∶8 000。在过敏原性的测定中,大豆蛋白、小麦蛋白抗原的包被质量浓度为1.0 μg/mL,2种抗原对应的兔抗人血清稀释比例分别为1∶2 000和1∶800。样品的抗原性及过敏原性方面根据标准曲线计算得出的抗原等价质量浓度(μg/mL)来表示。
1.3.4 数据处理
间接竞争ELISA分析每个处理重复3次,数据分析采用Excel 2016统计分析软件进行分析。
2 结果与分析
2.1 Tricine-SDS-PAGE分析酱油中的大豆、小麦过敏原情况
由于酱油中的大分子蛋白经过长时间发酵后被降解为分子质量较小的蛋白,采用普通的SDS-PAGE难以将其分开,故本研究采用小分子蛋白电泳(Tricine-SDS-PAGE)[11]。结果表明,市售的14种国产酱油进行蛋白电泳分析,染色后,所有酱油样品在凝胶上均没有大豆、小麦蛋白条带出现。分析原因可能是在酱油的整个酿造过程中,原料大豆、小麦经过蒸煮、制曲、长时间的发酵、加热灭菌以及过滤处理,原料中的蛋白质逐步降解,原料中的大豆、小麦蛋白经过这一系列的降解过程,残留在酱油成品里的过敏原已经极其微量,在电泳的检测限以下,最终导致在凝胶电泳图上没有蛋白条带出现。
2.2 免疫印迹分析国产市售酱油中的大豆、小麦过敏原情况
用大豆、小麦蛋白的兔血清、对大豆、小麦过敏的病人血清的免疫印迹结果分析国产市售酱油中的大豆、小麦过敏原情况,结果见图1。由图1可知,只有大豆过敏蛋白兔血清分析14种市售国产酱油免疫印迹结果出现过敏蛋白条带,其他3种血清的免疫印迹结果均无过敏蛋白条带出现。

图1 国产市售酱油样品大豆兔血清免疫印迹分析结果
Fig.1 Western blotting analysis results of bean rabbit serum of domestic commercial soy sauce samples
大豆球蛋白和β-伴大豆球蛋白是大豆蛋白中两种最主要的过敏蛋白,分别占大豆总球蛋白的40%和30%,能引起较严重的过敏症状。其中,β-伴大豆球蛋白是由3种亚基组成,包括α'亚基(~71 kDa)、α亚基(~67 kDa)和β亚基(~50 kDa);大豆球蛋白是一种六聚体,由5五种亚基组成:G1、G2、G3、G4和G5,每个亚基由碱性A多肽链(35 kDa)和酸性B多肽链(20 kDa)通过二硫键进行连接[12-13]。虽然电泳图没有呈现条带,但用大豆兔血清对14种市面上在售的酱油成品进行灵敏度更高的免疫印迹分析时,发现酱油中残留的大豆过敏原是分子质量为50 kDa的β-伴大豆球蛋白的β亚基,和分子质量约20 kDa的大豆球蛋白的碱性亚基中的一种或两种。其中,两种亚基都含有的是低盐固态三级酱油(1号和2号泳道);没有过敏蛋白亚基条带是部分高盐稀态三级酱油以及部分高盐稀态特级酱油(3号、6号和13号泳道);其余几种酱油只有大豆球蛋白的碱性亚基的免疫印迹条带。
2.3 间接竞争ELISA测定市售国产市售酱油中的大豆过敏原含量
酱油经过长时间的发酵,其中的大豆过敏蛋白被降解成小分子的肽段和氨基酸,导致抗原表位被破坏而使其免疫原性和过敏原性变得较低。一般来说用大豆全蛋白制备的兔血清的结果表明样品中的蛋白免疫原性,病人血清的结果表明样品中蛋白的过敏原性。间接竞争ELISA方法检测14种国产酱油中大豆过敏原的浓度结果见表1。由表1可知,在兔血清检测免疫原性方面,低盐固态的两种酱油中大豆过敏原含量均远大于1 μg/mL,高盐稀态酱油中仅有部分(三级、二级以及一级各1例)酱油(5号、8号和11号泳道)中大豆过敏原含量略大于1 μg/mL,其余酱油样品中大豆过敏原含量均小于1 μg/mL。高盐稀态酱油中大豆过敏原的含量总体上较低盐固态酱油低,且高盐稀态酱油中等级较高的酱油整体上也比等级较低的酱油所含的大豆过敏原少。
表1 市售国产酱油样品中大豆过敏原含量ELISA测定结果
Table 1 Determination results of soybeans allergens in domestic commercial soy sauce samples by ELISA
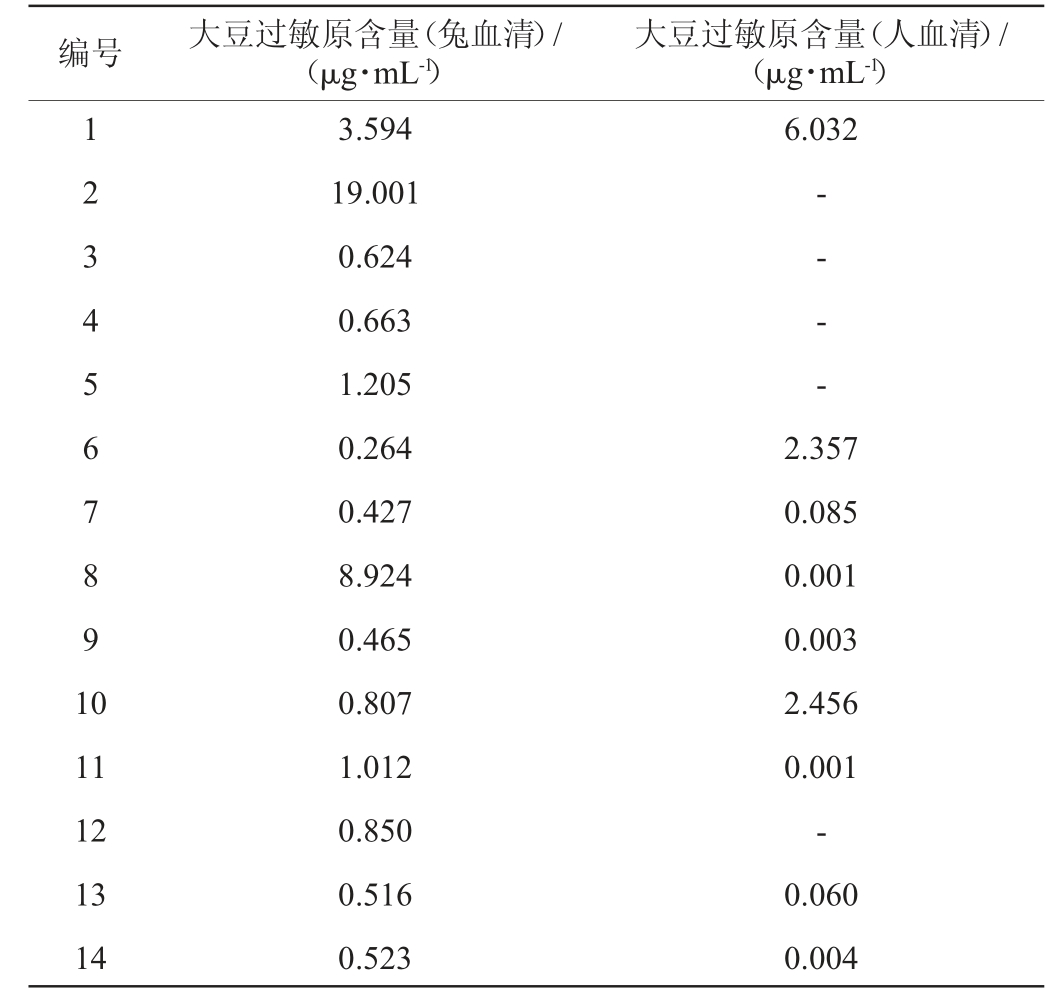
注:“-”表述未检出。下同。
正常人的血清中Ig E含量极低,而在过敏患者体内特异性Ig E的含量会很高。因此Ig E检测成为目前公认的检测Ⅰ型速发型超敏反应的最有效的方法之一[14]。试验通过大豆过敏患者血清制备血清池,测定酱油样品与大豆过敏患者血清Ig E的特异性结合情况。由表1可知,在人血清测定的过敏原性方面,1号、6号、10号3种酱油大豆过敏原含量略高,均大于1 μg/mL,其余酱油产品中可检测到大豆过敏原的含量极低甚至检测不到。根据过敏原性测得的大豆过敏原含量与酿造方式和等级没有太大的关系。
2.4 间接竞争ELISA测定市售国产市售酱油中的小麦过敏原含量
间接竞争ELISA方法检测14种国产酱油中小麦过敏原的浓度结果见表2。由表2可知,在兔血清测定的抗原性方面,不同酿造方式以及不同等级的酱油之间,检测到的小麦过敏原的含量都很低,均远远小于20 mg/kg。在人血清测定的过敏原性方面,所有酱油产品都未检测到小麦过敏原。国际食品法典委员会(Codex Alimentarius Commission,CAC)对无麸质食品规定其麸质含量不能超过20 mg/kg。酱油中小麦过敏原的含量远远小于20 mg/kg的标准,因此酱油可以视为无麸质食品。
表2 市售国产酱油样品中小麦过敏原含量ELISA测定
Table 2 Contents of wheat allergens in domestic commercial soy sauce samples analysis by ELISA

3 讨论
凝胶电泳、免疫印迹以及酶联免疫是过敏原试验中三个常用方法。凝胶电泳法在过敏原检测方面应用较广泛,常被用来定性或定量检测过敏原蛋白,电泳法简单快速,对蛋白影响小,但灵敏度相对较低[15]。酱油原料中的大豆、小麦中的蛋白经过层层降解,含量已经极少,导致电泳无法检测出。免疫印迹是一种将高分辨率的凝胶电泳与免疫化学分析技术相结合的杂交技术,经过PAGE分离后的蛋白,转移并以非共价键的形式吸附到固相载体上,该法能保持电泳分离后得到的多肽其生物学活性不变,是现今过敏原鉴定的主要方法之一[16]。而且免疫印迹灵敏性要高于凝胶电泳,因此免疫印迹结果图上有免疫印迹条带出现。ELISA是一种用酶标抗体进行抗原-抗体反应,以酶作用底物后的显色深浅来反应待测样品中抗原或抗体的含量,是目前食物过敏原检测范围最广的检测方法,具有特异性高、灵敏性强、快速方便、费用低等优点,可以实现较精确的定量检测[17]。原料大豆、小麦中的蛋白虽然降解得较为彻底,但食物过敏反应并不是由蛋白本身引起的,而是蛋白上的某段抗原表位在起作用,表位通常由5~15个氨基酸残基组成,虽然电泳已经无法检测出,但表位存在依然可以发生免疫反应[18],因此用ELISA来半定量样品中的过敏原含量。但由于样本、试剂以及操作等因素造成蛋白成分的破坏,会导致出现假阳性结果[19]。所以即使是同一酿造方式、同一等级的酱油可能存在个别样品在定量结果上有所差别。
14种市售国产酱油中残留的大豆过敏原是β-伴大豆球蛋白的β亚基和大豆球蛋白的碱性亚基中的一种或两种。这两种亚基属于大豆过敏原中较难降解的过敏原亚基,王锦欣等[20]用胃蛋白酶和黑曲霉酸性蛋白酶处理β-伴大豆球蛋白,ELISA结果表明约有89.5%的β-伴大豆球蛋白被去除,处理后的β-亚基仍比较完整。LEE U W等[21]用胰凝乳蛋白酶和胃蛋白酶研究发现,大豆11S球蛋白中的碱性亚基比酸性亚基较难水解。高盐稀态酱油和低盐固态酱油免疫条带的结果存在差异,可能与酿造工艺以及所含的酶系不同有关。高盐酱油发酵时间长,以耐盐的酶为主,低盐酱油发酵温度高,生产周期短,以耐高温的酶为主[22-23]。氨基酸含量作为酱油等级划分的标准之一,其含量越高,酱油的等级越高。氨基酸态氮含量高也从表明原料中大分子的蛋白被酶解小分子的成氨基酸的程度高,这和本研究结果一致,等级越高的酱油过敏原含量相对越低。
小麦过敏原含量极低甚至检测不到,这一点与KOBAYASHI M等[24]研究的结果相一致,通过免疫印迹,抑制ELISA和直接ELISA,在日本生产的十个商业酱油样品中未检测到小麦过敏原。而且小麦在酱油原料中比大豆用量少,酱油原料用的是小麦面粉相较大豆豆粕更易反应降解,最终导致小麦过敏原检测不到。
4 结论
在14种市售国产酱油样品中,大豆过敏原含量与酱油酿造工艺与酱油等级有关,低盐固态酱油中检测到的大豆过敏原含量高于高盐稀态酱油,酱油的等级越高,所含过敏原含量相对越低。检测到大豆过敏原,为β-伴大豆球蛋白的β亚基和大豆球蛋白的碱性亚基中的一种或两种。小麦过敏原含量极低或检测不到,符合无麸质食品的标准。建议对酱油中残留的大豆过敏原采取进一步酶解、加热或过滤等方法生产完全脱敏的酱油。
[1]HENDRA T.Passing the food allergen test[J].Cereal Food World,2003,48(1):20-23.
[2]MONACI L,VISCONTI A.Immunochemical and DNA-based methods in food allergen analysis and quality assurance perspectives[J].Trends Food Sci Tech,2010,21(6):272-283.
[3]VAN BOXTEL E L,VAN DEN BROEK L A,KOPPELMAN S J,et al.Legumin allergens from peanuts and soybeans:effects of denaturation and aggregation on allergenicity[J].Mol Nutr Food Res,2008,52(6):674-682.
[4]永治.几种酱油的酿造方法[J].酿造与检测,2008(3):30-33.
[5]路雪蕊,张卉,李慧静.小麦蛋白过敏原的研究进展[J].食品安全质量检测学报,2015,6(7):2783-2787.
[6]KOBAYASHI M,TANABBE S,TANIUCHI S.Degradation of wheat allergen in soy sauce brewing[J].Jpn J Pediat Allergy Clin Immu,2007,21:96-101.
[7]KOBAYASHI M,HASHIMOTOY,TANIUCHI S,et al.Degradation of wheat allergen in Japanese soy sauce[J].Int J Mol Med,2004,3(6):821-827.
[8]邵碧英,傅碧忠,郑晶.烤鳗酱油中大豆、小麦过敏原的ELISA 检测[J].中国酿造,2011,30(3):69-72.
[9]LAEMMLI B U K.Cleavage of structural proteins during assembly of head of bacteriophage-T4[J].Nature,1970,227(5259):680-685.
[10]王梦莉,高美须,姜小燕.大豆过敏原在低盐固态酱油酿造过程中的降解规律[J].食品工业科技,2020,41(24):197-202.
[11]路金芝,陈伟京,王俊,等.基因工程产品心钠素的Tris-Tricine-SDSPAGE 电泳检测[J].中国医学科学院学报,2001(6):559.
[12]AGUIRRE L,HEBERT E M,GARRO M S,et al.Proteolytic activity of Lactobacillus strains on soybean proteins[J].LWT-Food Sci Technol,2014,59(2):780-785.
[13]HOLZHAUSER T,WACKERMAN O,BALLMER-WEBER B K,et al.Soybean (Glycine max) allergy in Europe:Glym 5 (beta-conglycinin) and Gly m 6(glycinin)are potential diagnostic markers for severe allergic reactions to soy[J].Allergy Clin Immu,2009,123(2):452-458.
[14]石径,许倩,罗永康.乳酸杆菌产酶特性及蛋白酶对牛乳蛋白抗原性与过敏原性的影响[J].中国农业大学学报,2016,21(4):107-112.
[15]诸葛洁婧,潘家荣.食物蛋白致敏成分检测技术研究进展[J].核农学报,2014,28(9):1669-1676.
[16]李晓屿.羽衣甘蓝ARC1 的抗体制备及表达分析[D].哈尔滨:东北林业大学,2014.
[17]何圣发.基于IgE 表位识别检测牛乳β-乳球蛋白过敏原的新技术[D].南昌:南昌大学,2018.
[18]赵鑫.模拟消化对Pen a1 及其抗原表位免疫原性的影响[D].北京:中国农业科学院,2015.
[19]郑义成,华萍,杨安树,等.食品中过敏原检测技术研究进展[J].食品科学,2010,31(21):417-421
[20]王锦欣,秦贵信,龙国徽,等.β-伴大豆球蛋白酶解物的抗消化性及免疫活性变化的研究[J].中国畜牧杂志,2014,50(9):45-49.
[21]LEE U W,KEUM E H,LEE S J,et al.Allergenicity of proteolytic on the soybean 11S globulin[J].J Food Sci,2007,72(3):168-172.
[22]蒋立文,陶湘林,李先淼.大2 种不同工艺酱油原油的挥发性成分的分析[J].中国酿造,2012,31(1):178-183.
[23]尤生萍,肖华志,孙亚培,等.市售酱油常用理化指标的检测分析[J].中国调味品,2011,36(4):98-101.
[24]KOBAYASHI M,TANABE S,TANIUCHI S,et al.Degradation of wheat allergen in soy sauce brewing[J].Mol Med Rep,2007,32(1):144-151.