L-天冬氨酸(L-aspartic acid,L-Asp)又名α-氨基丁二酸,是一种重要的酸性氨基酸[1],广泛应用于食品、医药、化工等领域。在食品工业方面,L-天冬氨酸是多种食品的营养增补剂,还用于合成甜味剂阿斯巴甜[2];在医药方面,其可用作肝功能促进剂、氨解毒剂和疲劳恢复剂等[3-5],且还是合成L-丙氨酸的主要原料和多种医药中间体[6];在化工方面,其可用于合成高分子材料聚天冬氨酸[7]。
L-天冬氨酸可以通过传统发酵法、固定化酶或固定化细胞法和游离整体细胞法进行工业化生产。其中,游离整体细胞法是目前主要的工业生产方法,即利用产生L-天冬氨酸酶的菌种将富马酸与氨直接转化生产L-天冬氨酸。1974年,日本田边制药公司利用反丁烯二酸发酵技术率先实现了工业化生产[8-9]。我国在20世纪80年代中后期开始研制和开发L-天冬氨酸,首先以物理或化学方法将酶制剂包埋或吸附在固相中催化富马酸和氨进行连续生产[10],由于固定化后酶的稳定性降低,故在此基础上研发了固定化细胞法。徐礼生等[11]以反丁烯二酸和氨水为底物,采用天冬氨酸酶基因工程菌固定化细胞生物催化法合成L-天冬氨酸,产率达到96.7%。固定化法生产L-天冬氨酸存在工艺设备投入多、技术要求高、操作复杂等问题,进一步技术改进几乎不可能。1996年,徐虹等[12]以大肠杆菌(Escherichia coli)ATCC11303培养液作酶源,采用游离酶法由富马酸转氨生成L-天冬氨酸。取培养26 h左右的培养液,37 ℃酶反应6 d,可转化富马酸9 kg/L。2000年,王雪根等[13]游离整体细胞法生产L-天冬氨酸,转化率平均在99%以上。随后很多研究者从筛选高产天冬氨酸酶菌株[14]、天冬氨酸酶改造[15]、培养基及培养条件[16-18]等方面对此生产工艺进行优化,以提高L-天冬氨酸合成效率。
游离整体细胞法生产L-天冬氨酸的工艺路线成熟,生产效率高,但L-天冬氨酸转化液中含有菌体、色素等杂质,需用活性炭对其进行净化处理。另外,L-天冬氨酸的提取是用硫酸将pH 8.5左右的酶转化液调至其等电点2.8,结晶沉淀后,再经过滤、干燥得到成品[19]。L-天冬氨酸在等电点附近迅速结出,会包结部分母液,使产品质量受到影响。为此,本研究对L-天冬氨酸提取工艺过程进行了优化,旨在为实现高光学纯度及医药级等高端产品的规模化生产提供技术基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
大肠杆菌HY-05C:烟台恒源生物股份有限公司。
1.1.2 培养基
斜面培养基:玉米浆干粉3 g/L,酵母粉3 g/L,蛋白胨1 g/L,氯化钠5 g/L,硫酸锰0.05 g/L,琼脂20 g/L,pH 7.0~7.2。
发酵培养基:富马酸10 g/L,玉米浆干粉8 g/L,酵母粉2 g/L,蛋白胨7 g/L,氯化钠5 g/L,磷酸二氢钾1 g/L,硫酸镁0.2 g/L,用氨水调节pH值至6.0。
1.1.3 试剂
767型活性炭:安徽大别山活性炭有限公司;富马酸(分析纯):烟台恒源生物股份有限公司;玉米浆干粉(生化试剂):山东康源生物科技有限公司;酵母粉、蛋白胨(均为生化试剂):安琪酵母股份有限公司;氨水(分析纯):武汉制氨厂;L-天冬氨酸标准品(色谱纯):美国Sigma公司;其余试剂均为国产分析纯。
1.1.4 底物溶液
富马酸200 g/L,硫酸镁0.2 g/L,氨水调节pH值至9.0,45 ℃,备用。
1.2 仪器与设备
XNP-9052BS-III生化培养箱:上海馨朗电子科技有限公司;SPH恒温培养振荡器:上海世平实验设备有限公司;722型分光光度计:上海天普分析仪器有限公司;PY-P10 pH计、BSA124S-CW电子分析天平:德国赛多利斯集团;U3000高效液相色谱(high performance liquid chromatography,HPLC)仪:戴安(中国)有限公司。
1.3 方法
1.3.1 转化培养液的制备
取一环活化后斜面菌体接入500 mL(装液量50 mL)摇瓶中,200 r/min、35~37 ℃培养8 h,得到一级培养液;将一级种子液按1%(V/V)接种量转接到发酵培养基中,200 r/min培养10 h,得到二级培养液。
1.3.2 酶法转化反应
大肠杆菌培养液与底物溶液按1∶7(V/V)混合摇匀,于45 ℃进行转化反应,利用高锰酸钾滴定法[20]测定富马酸浓度,待底物溶液中的富马酸浓度降至0.2%以下,结束反应。
1.3.3 L-天冬氨酸提取工艺流程

1.3.4 脱色条件确定
(1)脱色温度的选择:在1 L转化液中加入0.10%活性炭,设置脱色温度30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃、90 ℃,脱色时间1 h条件下过滤,波长640 nm条件下测定透光率,考察温度对脱色效果的影响。
(2)活性炭用量的选择:在1 L转化液中,设置活性炭用量0.05%、0.10%、0.15%、0.20%、0.25%、0.30%,脱色温度60 ℃,脱色时间1 h条件下过滤,波长640 nm条件下测定透光率,考察活性炭用量对脱色效果的影响。
1.3.5 硫酸酸化工艺优化单因素试验
取600 mL滤液,加入60 mL硫酸,分别设置结晶温度75℃、80℃、85℃、90℃、95℃,硫酸滴加速度10mL/h、20mL/h、30 mL/h、40 mL/h、50 mL/h,冷却时间5 min、10 min、15 min、20 min、25 min,考察其对L-天冬氨酸含量的影响。
1.3.6 硫酸酸化工艺优化响应面试验设计
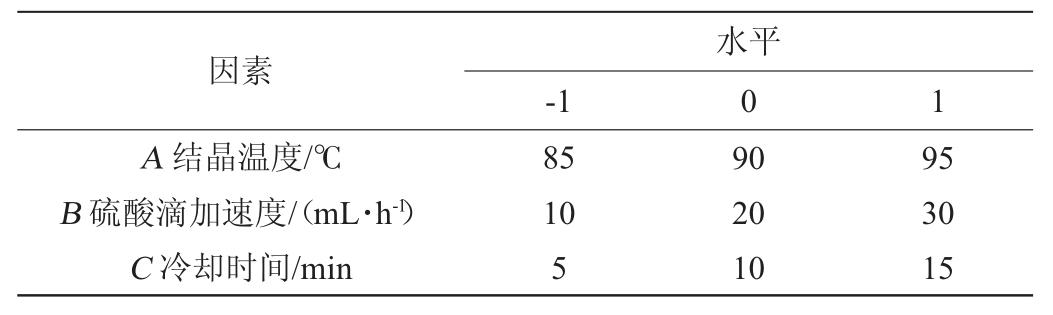
在单因素试验的基础上,以结晶温度(A)、硫酸滴加速度(B)、冷却时间(C)进行Box-Behnken响应面试验设计,以L-天冬氨酸含量(Y)为响应值,进行提取工艺的优化。试验因素与水平见表1。
表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments desigh
1.3.7 测定方法
透光率测定:分光光度法,纯水作参比,10 mm光程,波长640 nm。
L-天冬氨酸含量测定:高效液相色谱法,SinoChrom ODS-BP C18(5 μm×4.6 mm×250 mm)分析柱;流动相为0.03 mol/L KH2PO4-H3PO4缓冲液(pH2.5);检测波长210 nm;流速0.8 mL/min;柱温30 ℃;进样量20 μL。
2 结果与分析
2.1 脱色条件的确定
2.1.1 温度对脱色的影响
温度对脱色效果的影响见图1。由图1可知,在温度为30~60℃时,转化滤液透光率随温度的升高呈快速上升趋势;当温度为60 ℃时,透光率最高,达到96.4%;在温度高于60 ℃之后,透光率逐渐降低。因此,选择最适脱色温度为60 ℃。
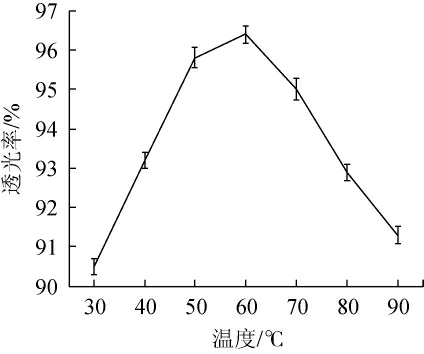
图1 温度对脱色的影响
Fig.1 Effect of temperature on decolorization
2.1.2 活性炭用量对脱色的影响
活性炭用量对脱色效果的影响见图2。由图2可知,随着活性炭用量在0.05%~0.15%范围内增加,转化液滤液透光率随之逐渐增大,当活性炭用量为0.15%时,透光率达到最大值,为99.6%;当活性炭用量>0.15%之后,透光率不再有明显增加。且考虑到活性炭用量过大,一方面增加成本,另一方面其会吸附部分氨基酸,从而影响产品收率,因此,选择活性炭用量为0.15%。
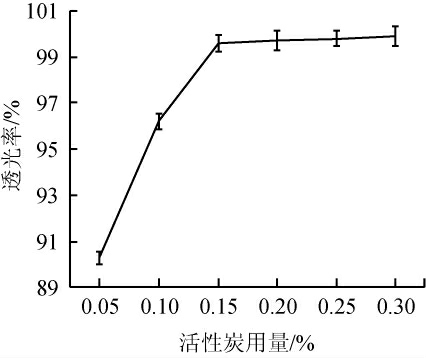
图2 活性炭用量对脱色的影响
Fig.2 Effect of active carbon addition on decolorization
2.2 硫酸酸化工艺优化单因素试验
2.2.1 结晶温度对L-天冬氨酸含量的影响
结晶温度对L-天冬氨酸含量的影响见图3。由图3可知,随着结晶温度在75~90 ℃范围内的上升,L-天冬氨酸含量不断增加;当结晶温度为90 ℃时,L-天冬氨酸含量达到最大值,为94.51%;当结晶温度高于90 ℃之后,L-天冬氨酸含量下降。因此,选择最适结晶温度为90 ℃。
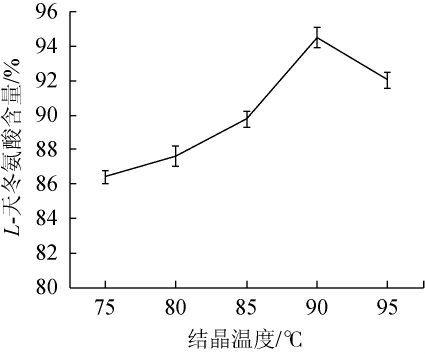
图3 结晶温度对L-天冬氨酸含量的影响
Fig.3 Effect of crystallization temperature on L-aspartic acid content
2.2.2 硫酸滴加速度对L-天冬氨酸含量的影响
硫酸滴加速度对L-天冬氨酸含量的影响见图4。由图4可知,在硫酸滴加速度为10~20 mL/h时,L-天冬氨酸含量随硫酸滴加速度增加呈现上升的趋势;当硫酸滴加速度为20 mL/h时,L-天冬氨酸含量达到最大值,为95.3%;当硫酸滴加速度>20 mL/h之后,L-天冬氨酸含量逐渐降低。因此,选择最适硫酸滴加速度为20 mL/h。
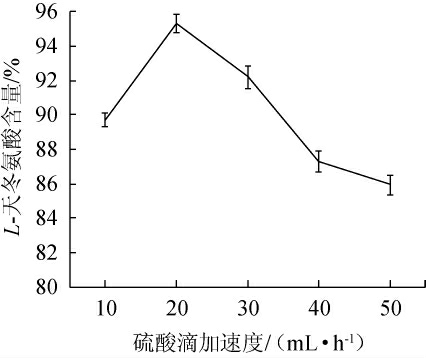
图4 硫酸滴加速度对L-天冬氨酸含量的影响
Fig.4 Effect of dropping rate of sulfuric acid on L-aspartic acid content
2.2.3 冷却时间对L-天冬氨酸含量的影响
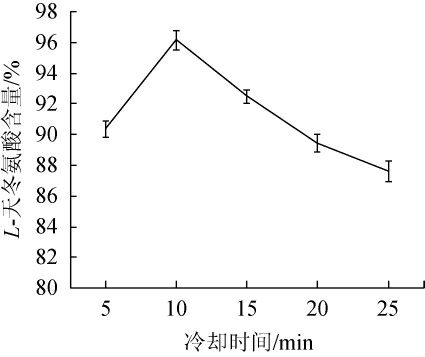
图5 冷却时间对L-天冬氨酸含量的影响
Fig.5 Effect of cooling time on L-aspartic acid content
冷却时间对L-天冬氨酸含量的影响见图5。由图5可知,在冷却时间为5~10 min时,随着冷却时间增加,L-天冬氨酸含量增加;当冷却时间为10 min时,L-天冬氨酸含量达到最大值,为96.15%;冷却时间>10 min之后,L-天冬氨酸含量逐渐降低。因此,选择最适冷却时间为10 min。
2.3 硫酸酸化工艺优化响应面试验结果
根据单因素试验结果,以L-天冬氨酸含量(Y)为响应值,选取结晶温度(A)、硫酸滴加速度(B)、冷却时间(C)进行3因素3水平的Box-Behnken优化试验设计。试验设计与结果见表2,方差分析见表3。
表2 Box-Behnken试验设计与结果
Table 2 Design and results of Box-Behnken experiments
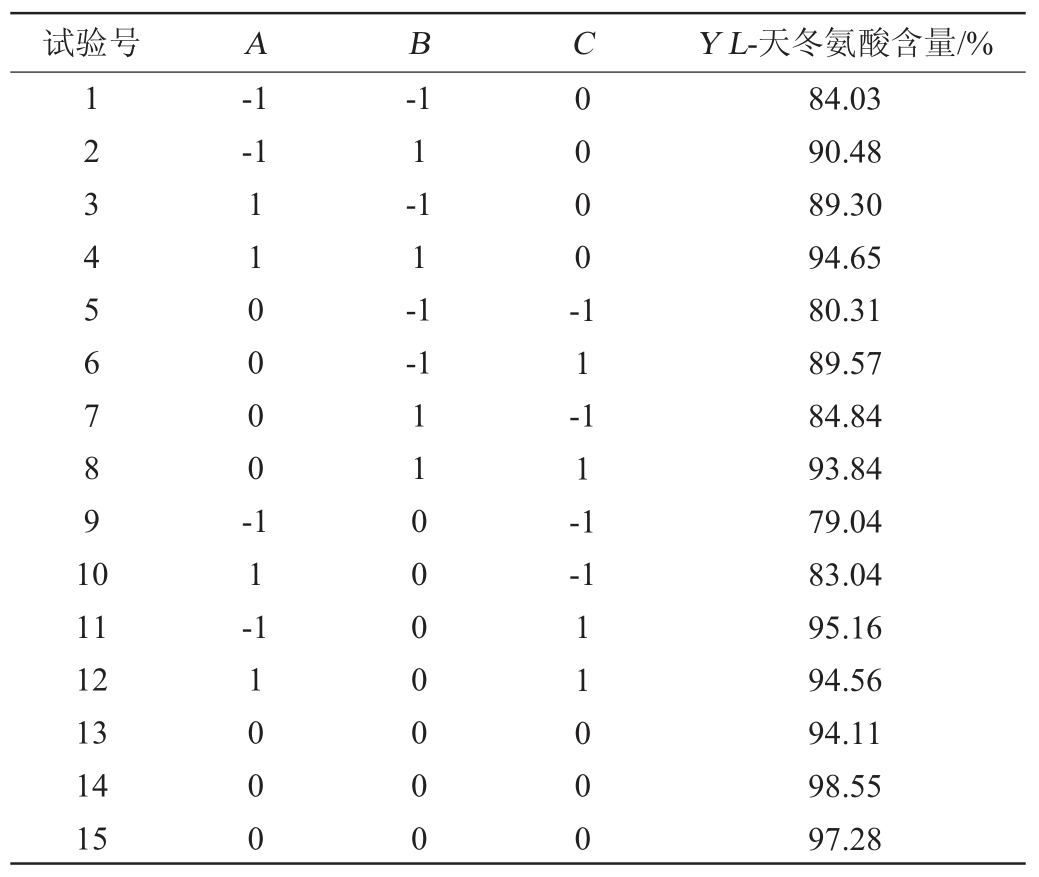
表3 回归模型方差分析
Table 3 Variance analysis of regression model

注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
利用软件Design-Expert 8.0.6对表2中试验数据进行二次多项式回归拟合,得到回归方程为:
由表3可知,该模型极显著(P<0.01),决定系数R2为0.950 9,失拟项不显著(P>0.05),说明试验误差小且拟合度较高,可以应用于试验的分析预测。影响L-天冬氨酸含量的因素顺序为冷却时间>硫酸滴加速度>结晶温度,其中各因素中一次项C、二次项C2对结果影响均达到极显著水平(P<0.01),一次项B、二次项B2对结果影响达到显著水平(P<0.05)。
响应面及等高线图能够直观地反映出各因素的交互作用对响应值的影响程度,曲面越陡,等高线越密集,对相应值影响越显著[21]。根据回归方程得到结晶温度、硫酸滴加速度和冷却时间之间的交互作用对L-天冬氨酸含量影响的响应面及等高线见图6。
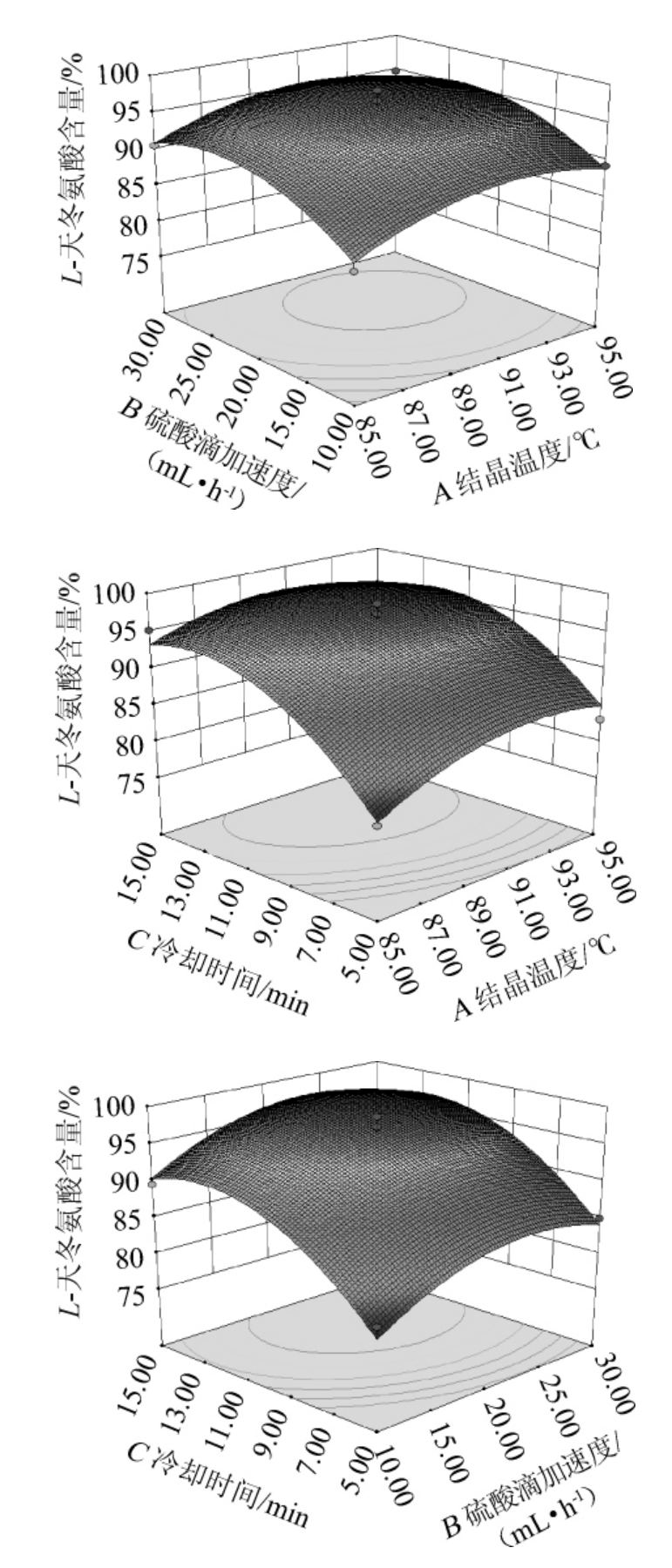
图6 各因素交互作用对L-天冬氨酸含量影响的响应面及等高线
Fig.6 Response surface plots and contour line of effects of interaction among various factors on L-aspartic acid content
由图6可知,各交互因素的最佳作用点基本都落在试验范围内,经过软件分析得到最佳提取工艺条件为结晶温度90.76 ℃,硫酸滴加速度23.19 mL/h,冷却时间12.48 min。在此优化条件下L-天冬氨酸含量预测值为98.60%。
2.4 验证试验
考虑到实际需要对上述工艺条件进行调整,即结晶温度91 ℃,硫酸滴加速度23 mL/h,冷却时间12 min。在此条件下进行3组平行试验,测得L-天冬氨酸含量实际值为98.22%,与预测值接近,表明采用响应面优化方法得到的数据准确可靠,具有实用价值。
3 结论
以大肠杆菌发酵液为原料,采用硫酸萃取法提取L-天冬氨酸。利用单因素和响应面试验,优化确定了最适脱色条件为脱色温度60 ℃,活性炭添加量0.15%;最佳酸化工艺条件为结晶温度91 ℃,硫酸的滴加速度23 mL/h,冷却时间12 min,在此工艺条件下L-天冬氨酸含量为98.22%,较优化前提高了7.42%。
[1]GOETZ K P,CHMIELEWSKI F M,GOEDEKE K,et al.Assessment of amino acids during winter rest and ontogenetic development in sweet cherry buds[J].Sci Hortic,2017,222(5):102-110.
[2]JAIME V C,ISABEL A A,JORGE J H,et al.Ph-responsive poly(aspartic acid) hydrogel-coated magnetite nanoparticles for biomedical applications[J].Mat Sci Eng C,2017,77(3):366-373.
[3]MATHUR N,GOSWAMI G K,PATHAK A N.Structural comparison,docking and substrate interaction study of modeled endo-1,4-beta xylanase enzyme of Bacillus brevis[J].J Mol Graph Model,2017,74(2):337-343.
[4]胡艳丽,马拥军,罗庆平,等.L-天门冬氨酸诱导叠层碳酸钙微晶的形成[J].人工晶体学报,2010,39(3):802-806,812.
[5]邵江娟,王唯,陈斌寅,等.以牡蛎壳为钙源的L-天冬氨酸螯合钙的合成及其生物利用度研究[J].南京中医药大学学报,2012,28(4):371-373.
[6]董学伟,张春枝,金凤燮.中空纤维膜反应器转化L-天冬氨酸生成L-丙氨酸[J].食品与发酵工业,2003,29(1):32-35.
[7]杨士林,黄君礼,张玉玲,等.聚天冬氨酸制造工艺研究进展[J].环境工程学报,2002,9(3):38-41.
[8]CHIBATA I,TOSA T,SATO T,et al.Immobilized L-aspartic acid[J].Meth Enzymol,1974,34:405-411.
[9]SATO T,NISHIDA Y,TOSA T,et al.Immobilization of Escherichia coli cells containing aspartase activity with k-carrageenan[J]. Biochim Biophys Acta,1979,570(1):179-186.
[10]孙玥,徐礼生,张兴桃,等.天冬氨酸酶基因工程菌的研究[J].佳木斯大学学报,2019,37(3):440-442.
[11]徐礼生,高贵珍,赵亮,等.天冬氨酸基因工程菌固定化细胞制备L-天冬氨酸合成条件优化[J].精细化工,2016,33(3):302-306.
[12]徐虹,朱建良,侯钧,等.游离酶法生产L-天冬氨酸的工艺研究[J].南京化工大学学报,1996,18(1):70-73.
[13]王雪根,徐虹,朱建良.游离整体细胞法工业化生产L-天冬氨酸[J].工业微生物,2000,30(1):32-35.
[14]SINGH R S,YADAV M.Single-step purification and characterization of recombinant aspartase of Aeromonas media NFB-5[J]. Appl Biochem Biotechnol,2012,167(5):991-1001.
[15]任慧颖,黎小军,杨丹燕,等.天冬氨酸酶E.coli 融合表达研究[J].氨基酸和生物资源,2012,17(5):99-101.
[16]繆静,冯志彬,张建,等.透膜法生产L-天冬氨酸的工艺研究[J].现代化工,2017,37(4):105-108.
[17]陈军,高贵珍,赵亮,等.金属离子对天冬氨酸酶基因工程菌催化合成L-天冬氨酸影响的研究[J].基因组学与应用生物学,2018,37(8):3422-3425.
[18]乔君,田延军,马玉岳,等.产天冬氨酸酶菌株大肠杆菌HY-05C发酵培养基及培养条件的优化[J].食品工业科技,2016,37(3):139-142,148.
[19]高建,雷以柱,苏健,等.L-天冬氨酸提取工艺的清洁化探讨[J].化工技术与开发,2018,47(10):43-45.
[20]DEPUE R H,AG M.Factors affecting aspartase activity[J]. J Bacteriol,1961,82(3):55-63.
[21]吴伟,李格,向福.响应面法优化火棘果中多酚提取工艺[J].中国酿造,2015,34(12):127-131.