荧光原位杂交技术(fluorescence in situ hybridization,FISH)是利用荧光标记已知序列的核酸碱基(探针),根据碱基互补配对原则,探针与待测样本中目标核酸进行特异性结合,形成待测核酸与标记探针的杂交体,通过荧光激发产生荧光信号。该技术广泛应用于细胞遗传学[1-2]、肿瘤生物学[3-4]、微生物群落研究等领域。在环境微生物群落研究中,FISH技术用于诊断海水、湖泊[5]沉积物中的微生物,河水、溪流[6]和海洋[7]中的菌体微生物,土壤[8]和根系表面[9]的寄居群落等环境微生物;该技术还应用于研究除磷细菌、硝化细菌及厌氧氨氧化菌等环境工程微生物。杜照中[10]用FISH技术检测文登盐场沉积物样品,观察到了慢生单胞菌的细胞类群,然因数量较少,未能明确计数。姚倩[11]采用荧光原位杂交技术对十个城市污水处理系统的脱氮性能及硝化菌的种群结构进行检测,结果表明活性污泥中亚硝酸盐氧化细菌(nitrite-oxidizing bacteria,NOB)的数量明显高于氨氧化细菌(ammonia-oxidizing bacteria,AOB)的数量。樊香妮[12]在研究温度对强化生物除磷(enhanced biological phosphorus removal,EBPR)系统处理性能及种群关系的影响时,采用FISH方法对活性污泥中主要功能微生物(聚磷菌和聚糖菌)的相对数量及分布状态进行分析,结果表明随着温度的升高,活性污泥中聚磷菌(polyphosphate accumulating organisms,PAOs)的比例下降,而聚糖菌(glycogen accumulating organisms,GAOs)的比例显著增加,当30 ℃时,PAOs占总细菌的比例仅为8%左右,而GAOs的比例高达(82±3)%。OEHMENA A等[13]使用该技术研究了序批式反应器(sequencing batch reactor,SBR)中反硝化聚磷菌(denitrifying phosphorus removing bacteria,DPB)及其竞争菌在污泥中的分布及群落形态,结果表明,除磷效果好时反硝化聚磷菌占优势,除磷效果坏时竞争菌占优势。SOEJIMA K等[14]采用FISH技术研究反A2/O反应器中聚磷菌的结果表明,加入亚硝酸盐后聚磷菌数量降低,除磷能力下降,反硝化菌菌量越多越利于脱氮除磷过程。如MOLLER S等[15]研究了生物膜中微生物的空间分布、启动子诱导及其表达的时序进程,同时对不同种类菌体间的相互作用及影响进行了分析;SCHRAMM A等[16]将微传感器和FISH技术结合,剖析了微生物群落结构和代谢活性,揭示了厌氧微生物在有氧环境中的缺氧微生态位。但在众多研究中发现[17-19],FISH虽然实现了可视化(待测样本中目标核酸与带有荧光物质的探针接合,荧光激发产生荧光信号,用荧光显微镜即可直接观察菌体位置),但不同的检测对象可视化程度差异较大,有的样品中菌体可视化程度超过90%,而有的样品可视化程度不到50%。本实验拟以纯培养革兰氏阴性细菌大肠杆菌及革兰氏阳性细菌植物乳杆菌为研究对象,探究纯培养微生物FISH检测的菌体种类、菌体生长时期、菌体分散方式、细胞通透性、杂交条件等影响因素,以期为白酒生产过程中酒曲表层、中层、中心,窖池不同发酵部位(上、中、下层四角、中心)糟醅,窖池不同部位(窖底、窖壁)窖泥中各种酿酒微生物的原位杂交检测奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
大肠杆菌(Escherichia coli)DH5α:四川省微生物资源保藏中心;植物乳杆菌(Lactobacillus planetarium)沪1.08:上海市酿造科学研究所。
1.1.2 化学试剂
多聚赖氨酸(分子质量>15 000 Da)、焦碳酸二乙酯(分析纯):美国Sigma公司;4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)(分析纯):美国Roche公司;甲酰胺、多聚甲醛(均为分析纯):成都科龙化工有限公司;氨丙基三乙氧基硅烷(aminopropyltriethoxysilane,APES)(分析纯):北京中杉金桥生物技术有限公司;十二烷基硫酸钠(sodium lauryl sulfate,SDS)、三羟甲基氨基甲烷(tromethamine,Tris)、焦磷酸钠(分析纯):天津科密欧化学试剂有限公司;抗荧光猝灭封片液:海门碧云天生物技术有限公司;溶菌酶(>20 000 U/mg);乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA):天津市津北精细化工有限公司;丙酮(分析纯):美国Sigma-Aldrich公司。
1.1.3 培养基
牛肉膏蛋白胨培养基:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,蒸馏水1.0 L,pH 7.0~7.2,121 ℃灭菌20 min。
MRS液体培养基:蛋白胨10.0 g,酵母提取物5.0 g,牛肉膏10.0 g,乙酸钠5.0 g,葡萄糖20.0 g,吐温80 1.0 mL,柠檬酸二铵2.0 g,K2HPO42.0 g,MnSO4·H2O 0.25 g,MgSO4·7H2O 0.58 g,蒸馏水1.0 L,pH 6.2~6.4,121 ℃灭菌15 min。
1.2 仪器与设备
BX-51荧光显微镜、CX31RTSF光学显微镜:日本奥林巴斯公司;PHS-3C型酸度计:上海精密科学仪器有限公司;TGL16M高速离心机:湘麓离心机仪器有限公司;722型可见分光光度计:上海棱光仪器有限公司;KQ-100E超声波清洗器:苏州江东精密仪器有限公司;GL-20G-C型高速冷冻离心机:上海安亭科学仪器有限公司;DHP-9162型电热恒温培养箱:上海一恒实验仪器有限公司;QYC-2112型恒温振动培养器:上海福玛实验设备有限公司;YX-450全自动不锈钢双层立式电热压力蒸汽消毒器:上海三申医疗器械有限公司。
1.3 实验方法
1.3.1 菌株生长曲线的测定
E.coli:将(37±1)℃、150 r/min条件下振荡培养8 h活化的E.coli以2%接种量接种到牛肉膏蛋白胨液体培养基,混匀后于(37±1)℃、150 r/min条件下振荡培养,分别用显微镜直接计数0、2 h、4 h、6 h、8 h、10 h、12 h、14 h、16 h、18 h、20 h、22 h、24 h的菌体数量,绘制菌体生长曲线。
L.planetarium:将(30±1)℃条件下静置培养12 h活化的L.planetarium以2%接种量接种到MRS液体培养基,混匀后在(30±1)℃条件下静置培养,分别用显微镜计数0 h、4 h、8 h、12 h、16 h、20 h、24 h、28 h、32 h、36 h、40 h、44 h、48 h、52 h、56 h、60 h、64 h、68 h、72 h的菌体数量,绘制菌体生长曲线。
1.3.2 菌体细胞形态观察及细胞计数
对2种不同生长时期菌体进行简单染色(齐氏石碳酸复红染色液)、观察菌体形态;对菌体进行FISH计数(FISH counting,FISHC)和显微镜直接计数(direct microscopic count,DMC),计算FISHC/DMC值。
1.3.3 FISH检测方法
取培养至稳定期的菌液5 mL,加入磷酸盐缓冲液(phosphate buffer solution,PBS)(pH 7.2)25 mL,涡旋混匀,10 000 r/min高速冷冻离心10 min,收集菌体,重复洗涤1次后收集菌体,进行荧光原位杂交检测[20]。
1.3.4 纯菌株FISH检测条件优化
(1)菌体分散方式的选择
稳定期的菌体用多聚甲醛固定,探讨菌体不同分散方式。方式1:玻珠(Φ:3~5 mm)摇床振荡打散60 min,转速150r/min;方式2:涡旋振荡后超声波处理,超声功率为100W,超声时间分别为:0 s、30 s、60 s、90 s、120 s、150 s、180 s,间隔30 s超停一次。原位杂交后镜检观察FISH检测效果。
(2)细胞通透性对FISH检测的影响
以L.planetarium和E.coli为研究对象,使用溶菌酶在37 ℃条件下分别对稳定期菌体处理0 min、30 min、60 min、90 min(10 mg/mL溶菌酶1 mL)后进行原位杂交,FISH计数(FISHC);同时显微镜直接计数菌液菌体数目;计算菌体检出率(FISHC/DMC)。
(3)杂交条件的优化
针对杂交条件(杂交时间、杂交温度、甲酰胺浓度及洗脱液中NaCl浓度)固定某3个因素,改变另外一个因素进行实验。原位杂交后FISH计数(FISHC)。杂交时间分别为1h、2 h、3 h,杂交温度分别为38 ℃、42 ℃、46℃,甲酰胺浓度分别为10%、20%、30%,洗脱液中NaCl浓度分别为100 mmol/L、300 mmol/L、500 mmol/L。同时对菌液显微镜直接计数(DMC),计算菌体检出率(FISHC/DMC)。
1.3.5 数据处理
FISH 3.0分析软件进行数据处理。
2 结果与分析
2.1 菌体细胞生长曲线测定、形态观察及菌体计数
2.1.1 纯培养菌体生长曲线
由图1A可知,E.coli菌体适应新环境能力强,几乎不经延滞期就直接进入对数生长期;且菌体生长速度较快,8 h后进入稳定期,此后菌体数目几乎无明显变化;16 h后随着营养物质的耗尽和菌体死亡量增加,菌体量减少,E.coli菌体生长进入衰退期。由图1B可知,L.planetarium经4 h延滞期适应新环境后,在营养物质充沛的条件下,菌体迅速增殖进入对数生长期,约在20 h时开始进入稳定期;约52 h后,菌体死亡量增加,菌体进入衰退期。

图1 大肠杆菌(A)和植物乳杆菌(B)的生长曲线
Fig.1 Growth curves of Escherichia coli (A) and Lactobacillus planetarium (B)
2.1.2 不同生长时期菌体形态观察
不同生长时期E.coli和L.planetarium菌体形态观察结果见图2和图3。
由图2可知,不同生长时期的E.coli菌体形态规则,呈单个短杆状,菌体间比较分散且无连接,是革兰氏阴性菌(G-)。由图3可知,对数生长期的L.planetarium呈链状,菌体长短不一,每节菌体形态规则,呈杆状,长度较均一;进入稳定期后,菌体为二联菌体,形态规则,呈短杆状,二联体的两节菌体间或成一定角度或处于同一直线,菌体分散;衰退期的L.planetarium亦主要以二联体为主,菌体分散、菌体形态不太规则,是革兰氏阳性菌(G+)。
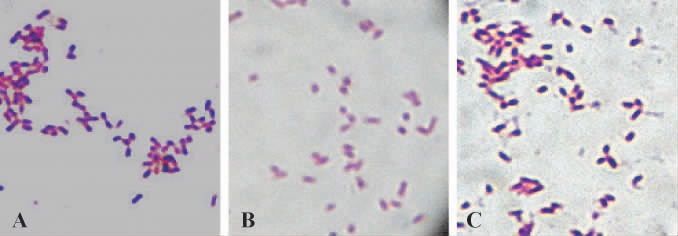
图2 大肠杆菌不同生长期的形态(100×)
Fig.2 Cell morphology of E.coli in different growth phases (100×)
A:对数生长期(6 h);B:稳定期(12 h);C:衰亡期(24 h)。
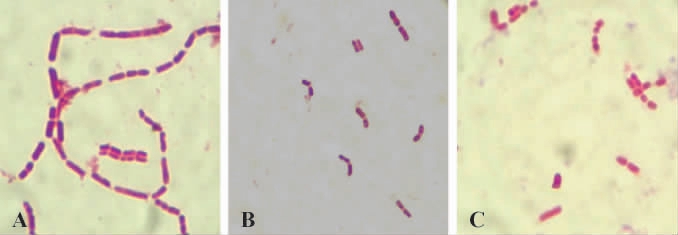
图3 植物乳杆菌不同生长期的形态(100×)
Fig.3 Cell morphology of L.planetarium in different phases (100×)
A:对数生长期(12 h);B:稳定期(36 h);C:衰亡期(60 h)。
2.1.3 不同生长时期菌体计数结果
菌体纯培养物E.coli(G-)和L.planetarium(G+)在对数、稳定和衰减期的FISHC/DMC比值结果见图4。由图4可知,总体而言,革兰氏阴性菌(E.coli)检出率较革兰氏阳性菌(L.planetarium)高,因为前者细胞壁较薄,探针容易进入;在同一菌体的不同生长时期,随着培养时间增加,菌体检出率呈现降低趋势,可能是越到培养后期,菌体rRNA含量及活性有所降低。综上,菌体种类及生理状态对FISH法的定量表征有一定影响,尤其是对衰退期的革兰氏阳性菌影响较明显。
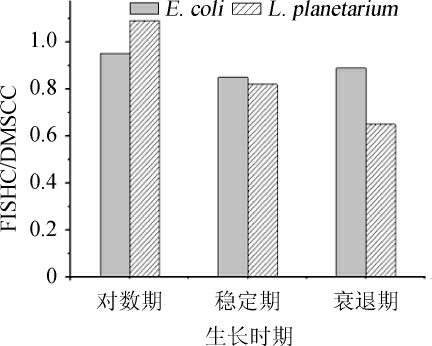
图4 两种菌体不同生长时期的荧光原位杂交技术计数与显微镜直接计数比值
Fig.4 Ratio of FISH count/direct microscopic count of two strains at different growth stages
2.2 FISH条件的优化
2.2.1 菌体分散方式的选择
采用玻珠或超声波处理待杂交菌体分散液,菌体分散状况见图5。经玻珠摇床振荡(150 r/min)处理60 min的样品如图5A所示,菌体分散程度良好;由图5B~5F可知,未经超声波处理的样品,部分菌体聚集,荧光信号强烈,但不便计数;超声处理时间为60 s时,菌体分散状态良好,便于计数;超声处理时间偏长,菌体活性降低甚至使菌体死亡[21],荧光信号减弱。因此选择超声处理时间为60 s,间隔30 s。

图5 不同处理方式下大肠杆菌菌体分布情况
Fig.5 Distribution situation of E.coli under different processing modes
A:玻珠分散60 min;B:未超声;C:超声30 s;D:超声60 s;E:超声90 s;F:超声120 s。
2.2.2 溶菌酶处理
FISH法检测菌体细胞时,改变细胞通透性尤为必要,可增大探针与目标核酸结合的几率,提高菌体检出率。PERNTHALE A等[19]报道了通过改变靶细胞的通透性使得菌体细胞检出率从46%提高到了86%;FILION G等[22]也提到使用不同的化学物质及酶处理菌体,改变菌体通透性,以利于FISH检测。
用溶菌酶处理E.coli和L.planetarium,结果见图6。由图6A可知,溶菌酶处理后,菌体检出率均有较明显提高,尤其是L.planetarium,效果显著,检出率由32.79%提高到70.3%;相同条件下L.planetarium的菌体检测率略低于E.coli,可能是由于前者是革兰氏阳性菌,肽聚糖丰富,细胞壁较厚的细胞结构所致;当溶菌酶处理时间为60 min以上时,菌体检出率达到90%。因此,确定溶菌酶处理时间为60 min。由图6B可知,时间对菌体检出率无显著影响,菌体检出率都较高(>88%)。虽然史俊[23]认为杂交时间有较大的影响,过短使杂交不完全,过长则会增加非特异性杂交,但可能受本实验条件影响,该因素的影响不明显。本研究选定杂交时间为2 h。
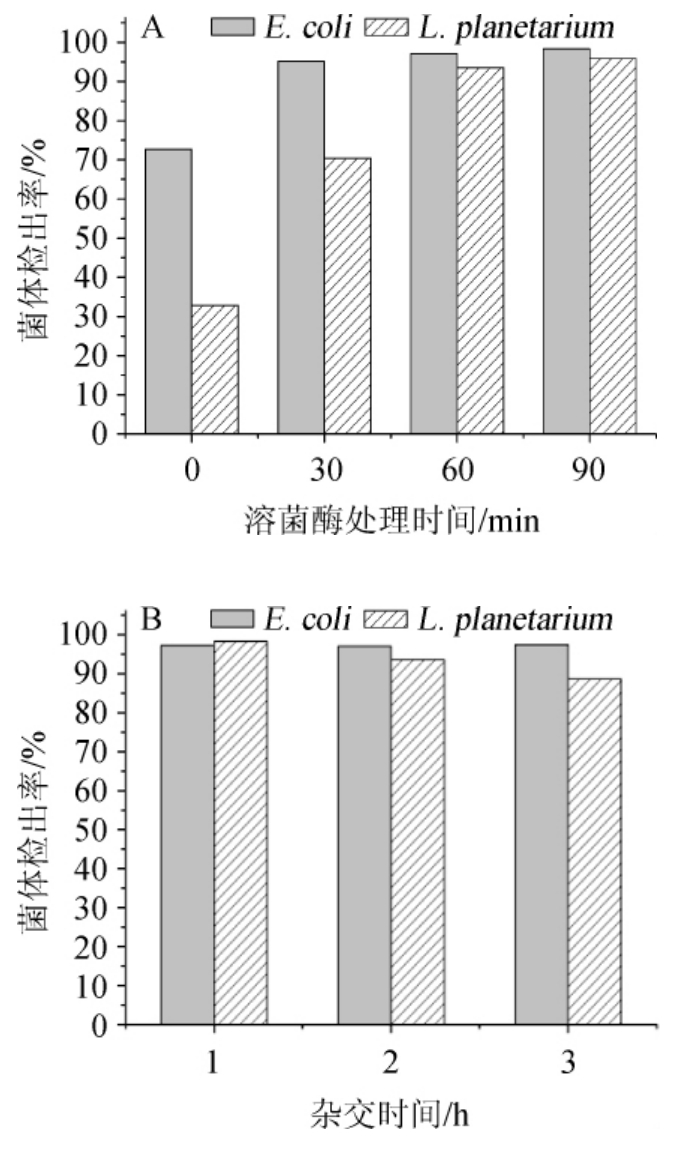
图6 溶菌酶处理时间(A)及杂交时间(B)与菌体检出率的关系
Fig.6 Relationship between lysozyme treatment time (A),hybridization time (B) and bacterial detection rate
2.2.3 杂交温度、甲酰胺及NaCl浓度的影响
杂交条件对其杂交体的稳定性有较大的影响,其中杂交温度、甲酰胺浓度及盐浓度是对其影响的主要因素。当杂交温度过低或盐离子浓度较高及甲酰胺浓度偏低,探针与70%~90%同源顺序的核酸杂交而产生非特异杂交信号[24-25],故可以借杂交后的洗涤过程加以弥补,探针杂交时产生的背景染色特别高时则通过不同盐浓度清洗液的洗涤,以减少探针与标本间的静电作用,降低背景获得较好的对比效果。与寡核苷酸杂交时,其杂交温度应高于60 ℃,然而却对菌体形态的完整及在载玻片上粘附造成不良影响。通常,采用在反应体系中加甲酰胺以降低杂交温度,其浓度每增加1%,RNA:RNA,RNA:DNA,DNA:DNA体系中的Tm值就分别降低0.35 ℃,0.50 ℃及0.65 ℃[27]。杂交温度、甲酰胺及NaCl浓度对菌体检出率影响见图7。由图7A和7B可知,杂交温度和甲酰胺浓度对E.coli检出率影响不大,而对L.planetarium的检出率有一定影响,综合考虑确定杂交温度为42 ℃、甲酰胺含量为20%,此时两种菌体检出率均相对较高(>90%)。由图7C可知,洗脱液中盐浓度在100~300 mmol/L时,纯培养物E.coli及L.planetarium的菌体检出率都较高(>89%),且背景均无明显差异,确定NaCl浓度为300 mmol/L。
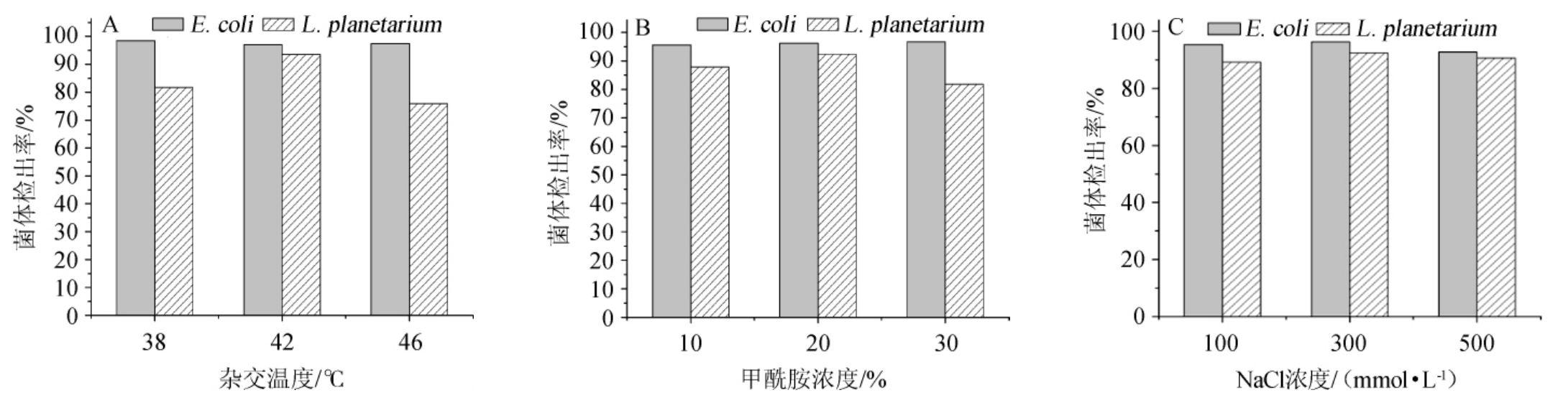
图7 杂交温度(A)、甲酰胺浓度(B)及NaCl浓度(C)与菌体检出率的关系
Fig.7 Relationship between hybridization temperature (A),formamide concentration (B),NaCl concentration (C) and bacteria detection rate
3 结论
本实验以E.coli及L.planetarium为研究对象,研究了不同种属、不同生长期菌株、预处理方式及杂交条件对基于探针EUB338的FISH检测结果的影响。结果表明,菌体种类及菌体生长阶段均较明显影响FISH计数的准确性;确定超声分散菌体时间60 s(100 W、每30 s间歇)、溶菌酶处理60 min可较大幅度提高FISH对菌体的检出率;确定较优条件为杂交时间2 h、杂交温度42 ℃、杂交液中甲酰胺含量20%及洗脱液中NaCl浓度300 mmol/L。
[1]王永想.游离雌三醇检测和荧光原位杂交技术在产前筛查中的应用研究[J].现代医药卫生,2020(14):2234-2236.
[2]张海英,杨艳丽,赵强,等.荧光原位杂交技术检测慢性淋巴细胞白血病分子遗传学异常[J].中国实验血液学杂志,2020(5):1474-1479.
[3]MARKER D F,PEARCE T M.Homozygous deletion of CDKN2A by fluorescence in situ hybridization is prognostic in grade 4,but not grade 2 or 3,IDH-mutant astrocytomas[J].Acta Neurop Commun,2020,8(1):169-173.
[4]王新玲,王文君,张缨.液基薄层细胞制片在尿路上皮癌荧光原位杂交检测中的临床应用[J].肿瘤研究与临床,2020(7):507-509.
[5]王明义,袁晓燕,宋雪珍,等.荧光原位杂交法在检测硫酸盐还原菌中的应用[J].中国现代医学杂质,2008,18(3):302-304.
[6]ARAYA R,TANI K,TAKAGI T.Bacterial activity and community composition in stream water and biofilm from an urban river determined by fluorescent in situ hybridization and DGGE analysis[J].FEMS Microbiol Ecol,2003,43(1):111-119.
[7]SIMON N,BIEGALA I C.SMITH E A,et al.Kinetics of attachment of potentially toxic bacteria to Alexandrium tamarense[J].Aquat Microbial Ecol,2002,28(3):249-256.
[8]BERTAUX J,GLOGER U,SCHMID M,et al.Routine fluorescence in situ hybridization in soil[J].J Microbiol Meth,2007,69(3):451-460.
[9]WATT M,HUGENHOLTZ P,WHITE R,et al.Numbers and locations of native bacteria on field-grown wheat roots quantified by fluorescence in situ hybridization(FISH)[J].Environ Microbiol,2006,8(5):871-874.
[10]杜照中.两处高盐环境中慢生单胞菌检测、细菌群落结构分析及两株新菌的多相分类[D].济南:山东大学,2020.
[11]姚倩.生物脱氮系统中硝化菌的种群结构、功能及反应动力学研究[D].西安:西安建筑科技大学,2018.
[12]樊香妮.温度对强化生物除磷(EBPR)系统处理性能及种群关系的影响[D].西安:西安建筑科技大学,2016.
[13]OEHMENA A,VIVESA M T,LU H B,et al.The effect of pH on the competition between polyphosphate accumulating organisms and glycogenaccumulating organisms[J].Water Res,2005,39(9):3727-3737.
[14]SOEJIMA K,OKI K,TERIDA A,et al.Effects of acetate and nitrite addition on fraction of denitrifying phosphate-accumulating organisms and nutrient removal efficiency in anaerobic/aerobic/anoxic process[J].Bioprocess Biosyst Eng,2006,29(6):305-313.
[15]MOLLER S,STERNBERG C,ANDERSEN J B,et al.In situ gene expression in mixed-culture biofilms evidiens of metabolic interactions between community members[J].Appl Environ Microbiol,1998,64(2):721-732.
[16]SCHRAMM A,SANTEGOEDS C M,NIELSEN H K,et al.On the occurrence of anoxic microniches,denitrification and sulfate reduction in aerated activated sludge[J].Appl Environ Microbiol,1999,65(9):4189-4196.
[17]ODA Y,SLAGMAN S J,MEIJER W G,et al.Influence of growth rate and starvation on fluorescent in situ hybridization of Rhodopseudomonas palustris[J].FEMS Microbiol Ecol,2000,32(3):205-213.
[18]PERNTHALER J,ALFREIDER A,POSCH T,et al. In situ classification and image cytometry of pelagic bacteria from a high mountain lake(Gossenköllesee,Austria)[J].Appl Environ Microbiol,1997,63(12):4778-4783.
[19]PERNTHALER A,PERNTHALER J,AMANN R.Fluorescence in situ hybridization and catalyzed reporter deposition for the identification of marine bacteria[J].Appl Environ Microbiol,2002,68(6):3094-3101.
[20]吴冬梅,何翠容,牛美灿,等.荧光原位杂交(FISH)技术研究窖泥微生物群落[J].食品与发酵工业,2012,38(4):15-19.
[21]郭宇星,潘道东.超声波破碎法提取瑞士乳杆菌氨肽酶条件的优化[J].食品科学,2008,29(8):140-144.
[22]FILION G,LAFLAMME C,TURGEON N,et al.Permeabilization and hybridization protocols for rapid detection of Bacillus spores using fluorescence in situ hybridization[J].J Microbiol Meth,2009,77(1):29-36.
[23]史俊.环境微生物的荧光原位杂交技术研究检测方法的研究[D].苏州:苏州科技学院,2009.
[24]徐克前.分子生物学检验技术实验指导[M].第一版.北京:人民卫生出版社,2003:102.
[25]张维铭.现代分子生物学实验手册[M].第一版.北京:科学出版社,2003:357.