尿酸形成于嘌呤分解途径中最后一步反应,是由黄嘌呤氧化还原酶催化黄嘌呤所生成的产物[1]。人体缺少尿酸氧化酶,不能将尿酸进一步分解为较易溶解的尿囊素,为了维持体内尿酸的正常水平,约有2/3的尿酸只能通过尿液排出体外[2-3]。如果尿酸生成量与排泄量失衡,会导致血清尿酸水平升高,将引发高尿酸血症及其并发的痛风、心血管疾病、肾脏疾病等疾病[4]。调查结果表明,全球高尿酸血症的患病率逐年上升,已达到较高比例,中国和美国于2017年的高尿酸血症患病率分别达到9.32%和10.32%[5]。目前,高尿酸血症的临床治疗方法主要有:通过药物抑制黄嘌呤氧化还原酶,以减少尿酸生成量;或者通过药物促进尿酸排泄量而降低尿酸积累量[6]。由于较多的高尿酸血症治疗药物都具有不同程度的毒副作用,如引起肠胃不适、过敏、肾衰竭等不良反应[7],安全的、有效的高尿酸血症防控方法必将是该领域的重要研究方向[8-9]。
控制外源性嘌呤摄入和进行营养干预是防控高尿酸血症的提倡方法[4,6],但禁忌食用富含嘌呤食物通常给高尿酸血症患者带来诸多不便。近年来,为了降低一些食物的嘌呤含量,国内外研究人员已经采用吸附法、超声波处理法、外加酶法和微生态法等进行去除嘌呤的研究,其中,外加酶法和微生态法初步显现出巨大的应用潜力[10]。尿酸氧化酶是外加酶法和微生态法去除尿酸的关键酶,它能够催化尿酸分解代谢的起始反应,即催化尿酸氧化为尿囊素和过氧化氢[11]。迄今为止,研究人员已经发现黄曲霉(Aspergillus flavus)、产朊假丝酵母(Candida utilis)、微杆菌属(Microbacterium sp.)、枯草芽孢杆菌(Bacillus subtilis)、克劳氏芽孢杆菌(Bacillus clausii)、苛求芽孢杆菌(Bacillus fastidiosus)、彭氏变形杆菌(Proteus penneri)等微生物能够产生尿酸氧化酶[12-13]。但是,发酵产量低、稳定性差等仍是尿酸氧化酶生产的主要问题,导致了价格昂贵,并限制其应用[14]。因此,本实验拟筛选尿酸氧化酶高产菌株,并对尿酸氧化酶进行酶学性质研究,期望为尿酸氧化酶发酵研究提供菌种资源及理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
普洱茶:市售。
1.1.2 化学试剂
尿酸标准品(纯度99%):美国Sigma公司;尿酸氧化酶(10 U/mg)、过氧化物酶(150 U/mg)、4-氨基安替比林、尿酸、腺嘌呤、鸟嘌呤、黄嘌呤(均为分析纯):上海源叶生物科技有限公司;Lowry法稳定性蛋白浓度测定试剂盒、聚合酶链式反应引物和基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、TaqDNA聚合酶、脱氧核糖核酸三磷酸(deoxy-ribonucleoside triphosphate,dNTP):上海生工生物工程股份有限公司;Sephadex G-100:上海弘顺生物科技有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamidegelelectrophoresis,SDS-PAGE)试剂盒:上海如吉生物科技发展有限公司。
1.1.3 培养基
驯化培养基:尿酸10 g/L,蛋白胨5 g/L,酵母膏5 g/L,KH2PO42.5 g/L,调节pH7.0。在驯化培养基中加入20 g/L琼脂,即可制得平板分离培养基。
斜面培养基:葡萄糖10 g/L,酵母膏5 g/L,KH2PO42 g/L,调节pH7.0。
富集培养基:葡萄糖40 g/L,蛋白胨5 g/L,酵母膏5 g/L,KH2PO42 g/L,调节pH7.0。
尿酸发酵培养基:尿酸10 g/L,蛋白胨5 g/L,酵母膏5g/L,KH2PO42g/L,调节pH7.0。上述培养基都经121℃灭菌20min,冷却后备用。
1.2 仪器与设备
ZHWY-C2112F双层可编程恒温摇床:上海智城分析仪器制造有限公司;ABI9700型聚合酶链反应(polymerase chain reaction,PCR)仪:德国Biometra公司;S-3000N扫描电镜:日本日立公司;Biotek Synergy H1多功能酶标仪:美国Biotek公司;低压层析系统(配置QT98探索者紫外检测仪,N2000工作站):上海琪特分析仪器有限公司;Mini-PROTEAN Tetra电泳槽:美国Bio-Rad公司;H1850R高速离心机:湖南湘仪实验室仪器开发有限公司。
1.3 方法
1.3.1 菌种分离及筛选
将10 g普洱茶接入100 mL驯化培养基,于振荡培养箱中30 ℃、180 r/min培养24 h,吸取10 mL培养液体转接到100 mL驯化培养基培养24 h,如此转接培养3次。最后,将培养液进行梯度稀释,涂布于平板培养基上,置于30 ℃生化培养箱中培养5 d,观察平板上菌落周围是否有透明圈,挑取呈现较大透明圈的菌落,接入斜面培养基,经培养后,置于4 ℃冰箱保藏。
将各斜面菌种接入100 mL富集培养基中,于30 ℃、150 r/min的条件下振荡培养16 h,于4 ℃、8 000 r/min的条件下离心收集菌体,用无菌水洗涤菌体2次。将菌体加入100mL尿酸发酵培养基,于30 ℃、180 r/min的条件下振荡培养24 h,离心收集菌体,经无菌水洗涤3次,用硼酸钠溶液(pH 8.0、0.1 mol/L)制成菌悬液,用超声波破碎法制备粗酶液,测定粗酶液的酶活,优选酶活最高的菌株。
1.3.2 菌种鉴定
利用普通光学显微镜观察菌体形态,然后参照文献[15]所述方法,采用试剂盒提取菌体DNA,利用18S rDNA通用引物NS1(GTAGTCATATGCTTGTCTC)和NS8(TCCGCAGGTTCACCTACGGA)PCR扩增DNA,PCR产物经纯化后,进行测序。然后,以基本局部比对搜索工具(basic localalignment search tool,BLAST)方式,在美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行序列比对,再利用软件MEGA7.0将比对数据进行构建系统发育树。
1.3.3 粗酶液制备
参照文献[12]所述方法,将培养液于4 ℃、8 000 r/min条件下离心15 min,收集菌体,经无菌水洗涤3次,加入20 mL硼酸钠溶液(pH 8.0、0.1 mol/L)制成菌悬液,在冰水浴中进行超声波破碎。超声波破碎条件为:超声功率150 W,总时间为12 min,每次破碎5 s,间歇10 s。破碎后的悬液在4 ℃、12 000 r/min条件下离心15 min,获得上清液,即为粗酶液。测定粗酶液酶活和蛋白质含量。
1.3.4 分析检测
(1)尿酸氧化酶酶活测定
按照文献[13]中方法,稍有改进。在具刻度比色管中,依次加入0.5 mL尿酸溶液(10 mmol/L)、0.25 mL 4-氨基安替比林溶液(60 mmol/L)、0.25 mL苯酚溶液(20 g/L)、0.5 mL待测酶液和0.5 mL过氧化物氧化酶(200 U/L),置于30 ℃水浴中反应10 min,加入2.5 mL无水乙醇终止反应,用水定容至5 mL,于波长550 nm处测定吸光度值。以硼酸钠溶液(pH8.0、0.1 mol/L)代替待测酶液,所构成的反应体系作为空白对照。在酶活测定前,配制尿酸氧化酶酶液(200 U/L),利用尿酸标准品配制不同浓度的尿酸标准溶液,按上述方法测定尿酸标准溶液反应后的吸光度值,建立尿酸溶液浓度(x)与吸光度值(y)的尿酸标准曲线回归方程为y=0.045 2x-0.028 3,R2=0.999 6。按照标准曲线回归方程计算样品溶液中尿酸氧化酶酶活。
尿酸氧化酶酶活定义为:在30 ℃、pH 8.0的条件下,每分钟催化1 μmol尿酸生成H2O2所需要的酶量为1个酶活单位(U/mL)。
(2)蛋白质含量的测定
采用Lowry法[14]。配制系列质量浓度的牛血清蛋白溶液,在波长650 nm处测定吸光度值,以牛血清蛋白标准溶液质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制牛血清蛋白标准曲线,得标准曲线回归方程为y=0.052 1x-0.053 5,相关系数为R2=0.999 5。根据蛋白标准曲线回归方程计算酶液中蛋白质含量。
1.3.5 尿酸氧化酶的分离纯化
参照文献[16]的硫酸铵分级沉淀方法,将硫酸铵加入粗酶液,依次使硫酸铵饱和度达到20%、40%、60%、80%,于4 ℃条件下静置12 h,离心收集硫酸铵饱和度80%下的蛋白沉淀。用超纯水溶解蛋白沉淀,放入截留分子质量为10 kDa透析袋,置于4 ℃冰箱中进行透析,再用10 kDa超滤离心管进行超滤浓缩。利用装有Sephadex G-100凝胶柱(1.2 cm×50 cm)的蛋白质对超滤浓缩酶液进行层析分离,上样量为3 mL,用10 mmol/L磷酸盐缓冲液(pH7.5)洗脱,洗脱液流速为0.3 mL/min,以1 mL为1管,分管收集波长280 nm处有吸收峰的流分。测定超滤浓缩液、各流分的酶活和蛋白质含量。
1.3.6 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离
采用SDS-PAGE电泳鉴定纯化后的酶液,按SDS-PAGE试剂盒使用方法,采用12%分离凝胶和5%浓缩凝胶,30 mA恒流电泳2.5 h。电泳后,采用考马斯亮蓝R-250进行染色。
1.3.7 酶学性质分析
将经透析、超滤分离所得的酶液进行酶学性质分析,调节酶活测定反应体系的pH,分别在不同pH(4.5、5.0、5.5、6.0、6.5、7.0、7.5)条件下测定酶活;分别在不同温度(24 ℃、26℃、28 ℃、30 ℃、32 ℃、34 ℃)条件下测定酶活;分别在酶活测定反应体系中加入不同金属离子(Mg2+、Na+、K+、Ca2+、Mn2+、Zn2+),在8 mmol/L金属离子的条件下测定酶活。分别以温度影响实验中的最高酶活、pH影响实验中的最高酶活、不添加金属离子体系的酶活作为对照,计算各类实验的相对酶活,其计算方法为:相对酶活=(特定条件下的酶活/对照条件的酶活)×100%。
2 结果与分析
2.1 菌种筛选与鉴定
如图1所示,具有尿酸代谢能力的微生物能够在尿酸平板培养基呈现透明圈。挑取46个透明圈较大的菌落,经摇瓶发酵、粗酶活测定,以及换算为发酵液中酶活含量,46个菌株的酶活分布范围为2.3~10.8 U/mL,其中菌株UR-05的酶活最高。菌株UR-05的菌落呈白色,圆形饱满,中间凸起,表面粗糙。电子扫描显微镜(scanning electronic microscopy,SEM)下的菌体形态如图2所示,菌株具有酵母的一般形态特征,菌体呈椭圆型,有芽体[17-18]。

图1 平板筛选的透明圈
Fig.1 Transparent zone of plate screening

图2 菌株UR-05的电子显微镜扫描结果
Fig.2 Scanning electron microscope result of strain UR-05
菌株UR-05的18S rDNA经扩增、纯化、测序后,获得1 685 bp的DNA序列,将DNA序列在NCBI数据库中进行比对,并构建系统发育树,见图3所示。由图3可知,菌株UR-05与序列编号AB000659的食腺嘌呤芽生葡萄孢酵母的相似度达到99%,故鉴定菌株UR-05为食腺嘌呤芽生葡萄孢酵母(Blastobotrys adeninivorans)。
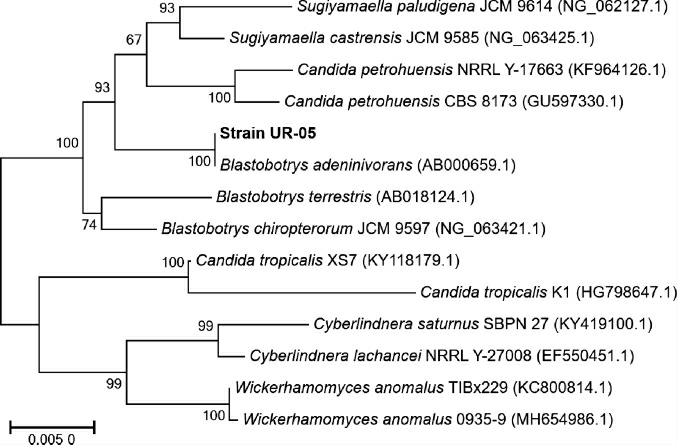
图3 基于18S rDNA基因序列菌株UR-05的系统发育树
Fig.3 Phylogenetic tree of strain UR-05 based on 18S rDNA gene sequences
最早从土壤中分离得到的食腺嘌呤芽生葡萄孢酵母被描述为食嘌呤丝孢酵母(Trichosporon adeninovorans)[19],后经基因分析,Blastobotrys属、Arxula属和Sympodiomyces属的微生物应归为Blastobotrys属[20]。食腺嘌呤芽生葡萄孢酵母是一种非传统的不完全单倍体酵母,被研究人员关注相对较少,主要出现在普洱茶发酵真菌群落的相关报道中[21-24]。食腺嘌呤芽生葡萄孢酵母能够以腺嘌呤、鸟嘌呤、黄嘌呤、尿酸、6,8-二羟嘌呤等作为唯一的碳源和氮源[20],但是,关于食腺嘌呤芽生葡萄孢酵母尿酸氧化酶的研究报道极少,因而有必要进一步对菌株UR-05所产尿酸氧化酶进行研究。
2.2 尿酸氧化酶的纯化与分析
利用Sephadex G-100凝胶柱对超滤浓缩酶液进行分离,获得纯化的尿酸氧化酶洗脱液。分离过程的酶活、蛋白含量与比酶活的测定结果如表1所示,纯化后的比酶活为215.4 U/mg,纯化倍数达到11倍。如图4所示,经SDS-PAGE电泳,尿酸氧化酶显示为单一条带,分子质量约为41.5 kDa。与文献所报道的尿酸氧化酶相比,其分子质量比较接近于丝光绿蝇(Luciliasericata)尿酸氧化酶的分子质量(40.5 kDa)[25],而大于苛求芽孢杆菌尿酸氧化酶(33 kDa)、产朊假丝酵母尿酸氧化酶(34 kDa)、黄曲霉尿酸氧化酶(35 kDa)等的分子质量[26-28]。
表1 尿酸氧化酶纯化的结果
Table 1 Results of urate oxidase purification
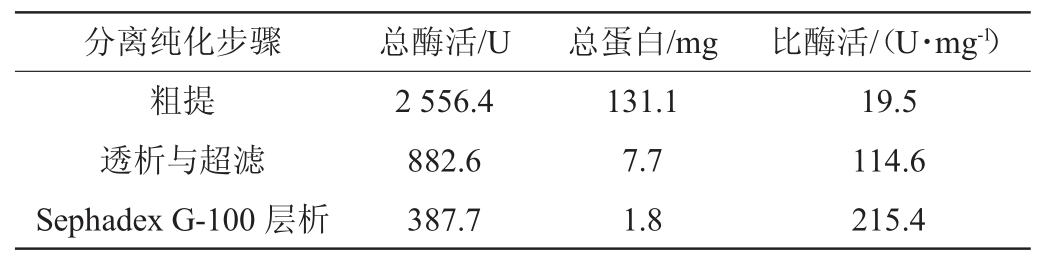

图4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳结果
Fig.4 Result of sodium dodecyl sulfate-polyacrylamide gel electrophoresis
M:标准蛋白质;1:透析与超滤;2:Sephadex G-100凝胶柱层析。
2.3 尿酸氧化酶的酶学性质
由图5A可知,本实验所得尿酸氧化酶的最适酶促反应pH为8.0,与来源于苛求芽孢杆菌、丝光绿蝇的尿酸氧化酶基本一致[12,25]。由图5B可知,本实验所得尿酸氧化酶的最适酶促反应温度是30 ℃,来源于其他食腺嘌呤芽生葡萄孢酵母、产朊假丝酵母的尿酸氧化酶,文献报道有40 ℃、37 ℃等不同最适酶促反应的温度[26,28],但与其他来源的尿酸氧化酶存在一定差别。由图5C可知,不同金属离子对尿酸氧化酶活性均有不同程度的影响。Mg2+和Na+对该酶有激活作用,其中Mg2+的激活作用较明显;K+、Ca2+、Mn2+、Zn2+等离子对该酶具有抑制作用,其中Zn2+能够强烈抑制该酶,这个现象与文献报道的苛求芽孢杆菌尿酸氧化酶性质相似[12]。
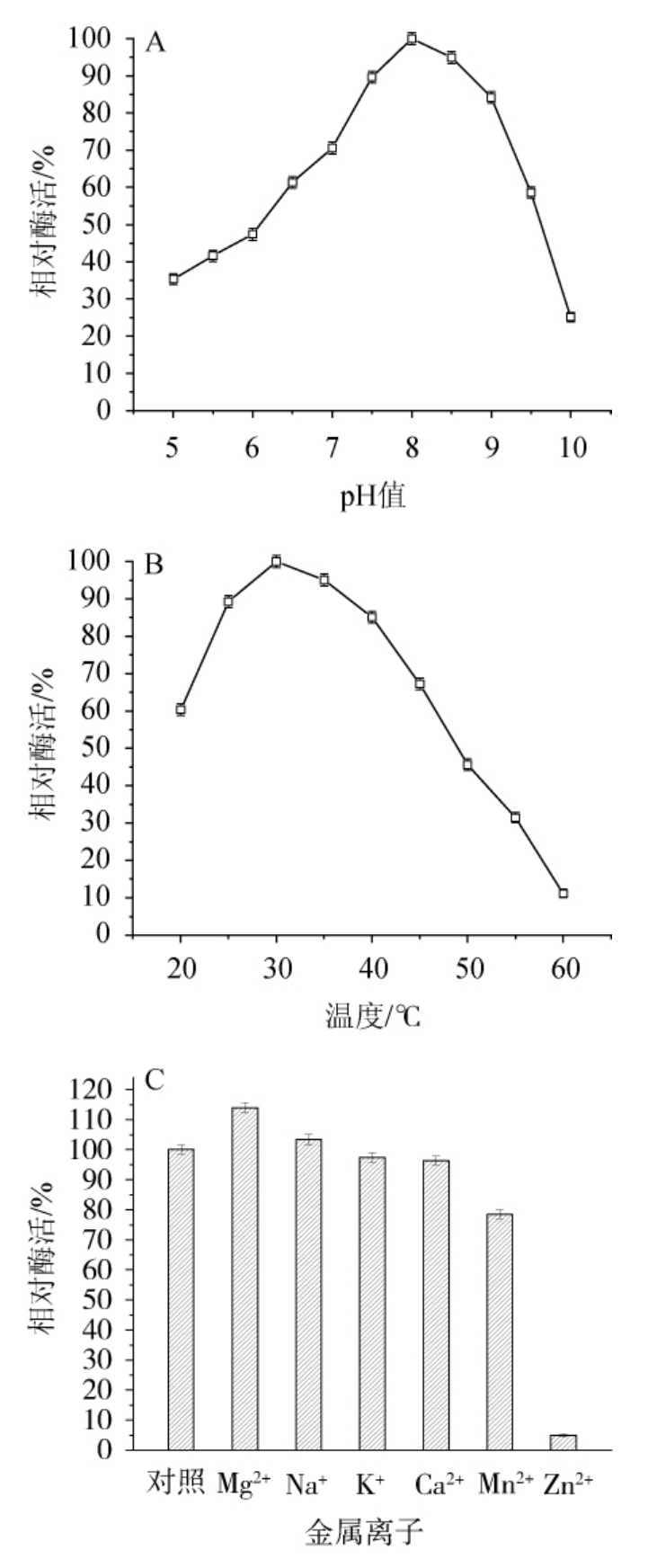
图5 pH值(A)、温度(B)及金属离子(C)对尿酸氧化酶酶活的影响
Fig.5 Effect of pH value (A),temperature (B) and metal ion (C) on urate oxidase activity
3 结论
从普洱茶中筛选获得1株高产尿酸氧化酶的菌株UR-05,经形态特征和18S rDNA序列鉴定,确定该菌株是食腺嘌呤芽生葡萄孢酵母(Blastobotrys adeninivorans)。对尿酸氧化酶进行分离纯化与酶学性质分析,确定该酶的分子质量约为41.5 kDa,比酶活为215.4 U/mg,最适酶促反应pH和温度分别为8.0和30 ℃,在Mg2+和Na+存在的条件下显现激活作用,在K+、Ca2+、Mn2+、Zn2+存在的条件下显现抑制作用。食腺嘌呤芽生葡萄孢酵母UR-05产酶能力较强,所产尿酸氧化酶在一定条件范围内呈现出较强的活性,具有进一步研究及应用的价值。
[1]PUDDU P,PUDDU G M,CRAVERO E,et al.Relationships among hyperuricemia,endothelial dysfunction and cardiovascular disease:molecular mechanisms and clinical implications[J].J Cardiol,2012,59(3):235-242.
[2]CHEN R J,CHEN M H,CHEN Y L,et al.Evaluating the urate-lowering effects of different microbial fermented extracts in hyperuricemic models accompanied with a safety study[J].J Food Drug Anal,2017,25(3):597-606.
[3]JALAL D I,CHONCHOL M,CHEN W,et al.Uric acid as a target of therapy in CKD[J].Am J Kidney Dis,2013,61(1):134-146.
[4]肖晓琴,陈尚茹,姚春,等.多学科联合饮食与运动管理对高尿酸血症患者干预的实践研究[J].中外医学研究,2020,18(1):158-160.
[5]叶文静,程亚伟,邱晓堂.中医药治疗高尿酸血症的研究进展[J].海南医学,2020,31(9):1187-1190.
[6]杜妍妍,赵绮华,邵剑,等.高尿酸血症的营养治疗新进展[J].现代预防医学,2020,47(6):1145-1148.
[7]ZHANG Y Y,LI Q,WANG F Z,et al.A zebrafish(danio rerio)model for high-throughput screening food and drugs with uric acid-lowering activity[J].Biochem Bioph Res Co,2019,508(2):494-498.
[8]邹琳,冯凤琴.食品中降尿酸活性物质及其作用机理研究进展[J].食品工业科技,2018,40(13):352-358,
[9]LIANG G Y,NIE Y C,CHANG Y B,et al.Protective effects of Rhizoma smilacis glabrae extracts on potassium oxonate and monosodium urate-induced hyperuricemia and gout in mice[J].Phytomedicine,2019,59:152772.
[10]刘建林,孙学颖,辛晓琦,等.食品中嘌呤的降低方法及低嘌呤产品研究进展[J].食品研究与开发,2020,41(2):179-184.
[11]ZHANG R,GAO S J,ZHU C Y,et al.Characterization of a novel alkaline Arxula adeninivorans urate oxidase expressed in Escherichia coli and its application in reducing uric acid content of food[J].Food Chem,2019,293:254-262.
[12]张庆芳,逄飞,于爽,等.海洋高产尿酸氧化酶菌株筛选鉴定及酶学性质研究[J].生物技术通报,2019,35(7):61-69.
[13]张庆芳,王浚晨,于爽,等.人体肠道中产尿酸氧化酶细菌的筛选、鉴定与酶学性质研究[J].食品与发酵工业,2020,46(8):34-39.
[14]邱文娜,吴宏斌,方朝东,等.Lowry法测量重组艾塞那肽蛋白含量的不确定度分析[J].中国医药科学,2018,8(11):48-51.
[15]咸静女,郭鑫,李波,等.微生物尿酸氧化酶的筛选、酶学性质及重组表达[J].生物工程学报,2018,34(7):1147-1155.
[16]路雪纯,张根生,张凯,等.冷冻面制品中耐冻藏酵母菌的筛选鉴定及性能研究[J].中国酿造,2019,38(11):149-154.
[17]段晓霞,格日乐其木格,其其日力格,等.产碱性磷酸酶乳杆菌的筛选鉴定、酶的纯化及特性[J].微生物学通报,2020,47(6):1817-1827.
[18]赵雪平,温雅娇,李正英,等.内蒙古乌海地区果园及发酵醪液中酿酒酵母菌的筛选[J].食品与发酵工业,2020,46(11):178-183.
[19]黄怀兴,邓毛程,李静,等.椰子油降解菌的筛选及降解条件优化[J].食品与发酵科技,2020,46(18):192-196.
[20]MIDDELHOVEN W J,NIET H T,RIJ K V. Trichosporon adeninovorans sp.nov.,a yeast species utilizing adenine,xanthin,uric acid,putrescine and primary n-alkylamines as the sole of carbon,nitrogen and energy[J].Anton Leeuw,1984,50:369-378.
[21]VAN DER WALT,J P,SMITH,M T,YAMADA,Y. Arxula gen.nov.(Candidaceae),a new anamorphic,arthroconidial yeast strains[J].Microbiol Res,1990,150:113-120.
[22]MALAK A,BARONIAN K,KUNZE G.Blastobotrys(Arxula)adeninivorans:a promising alternative yeast for biotechnology and basic research[J].Yeast,2016,33(10):535-547.
[23]ABE M,TAKAOKA N,IDEMOTO Y,et al.Characteristic fungi observed in the fermentation process for Puer tea[J]. Int J Food Microbiol,2008,124:199-203.
[24]ZHANG W,YANG R,FANG W,et al.Characterization of thermophilic fungal community associated with pile fermentation of Pu-erh tea[J].Int J Food Microbiol,2016,227:29-33.
[25]BAUMANN A,SKALJAC M,LEHMANN R,et al.Urate oxidase produced by Lucilia sericata medical maggots is localized in Malpighian tubes and facilitates allantoin production[J].Insect Biochem Mol Biol,2017,83:44-53.
[26]LIU X,WEN M,LI J,et al.High-yield expression,purification,characterization,and structure determination of tag-free Candida utilis uricase[J].Appl Microbiol Biot,2011,92(3):529-537.
[27]FAZEL R,ZAREI N,GHAEMI N,et al.Cloning and expression of Aspergillus flavus urate oxidase in Pichia pastoris[J].Springer Plus,2014,3:395
[28]ZHANG R,GAO S J,ZHU C Y,et al.Characterization of a novel alkaline Arxula adeninivorans urate oxidase expressed in Escherichia coli and its application in reducing uric acid content of food[J].Food Chem,2019,293:254-262.