葡萄酒的发酵本质上是酵母菌将葡萄糖转化为酒精及其他代谢产物的过程[1]。由于酿酒酵母(Saccharomyces cerevisiae)发酵性能强,酒精耐受性高,易于控制[2],因此生产者多采用商业化的纯种S.cerevisiae进行葡萄酒的生产,但酒体的风味特性、典型性以及丰富性通常不如采用非酿酒酵母生产的葡萄酒[3]。因此,随着人们对非酿酒酵母认识的不断加深,将各类非酿酒酵母用于酒类的生产逐渐成为一种普遍接受的方法[4-6]。但一般非酿酒酵母对乙醇较为敏感,因此多采用混合接种的方式(包括共同接种、顺序接种两种形式),既保证了发酵的顺利进行,又保留了非酿酒酵母的酿造特性[7-9]。
克鲁维毕赤酵母(Pichia kluyveri)是一种普遍存在于各类水果上非酿酒酵母,某些P.kluyveri在产乙酸乙酯、乙酸异丁酯和乙酸异戊酯等花香和水果香酯类物质方面具有较大的优势[10]。研究发现,P.kluyveri与S.cerevisiae混合发酵可显著增加葡萄酒中高级醇和乙基酯的含量[11];采用P.kluyveri生产的苹果酒,具有更强的热带水果典型风味[12];LU Y Y等[13]探讨了接种P.kluyveri对榴莲果酒的影响,结果表明,混合接种、顺序接种P.kluyveri发酵的榴莲果酒乙酸乙酯、乙酸异戊酯的含量增加,复合香气物质更加丰富。除此之外,P.kluyveri与S.cerevisiae混合发酵,还可以显著提高白苏维浓中挥发性果香硫醇的含量[14];P.kluyveri与S.cerevisiae相比,能产生更多的酒精和乳酸乙酯[15]。另外,某些P.kluyveri菌株还能够分泌一些毒性因子,可抑制葡萄酒生产中一些腐败酵母[16]。因而,P.kluyveri在葡萄酒生产上具有一定的应用潜能。但与其他类非酿酒酵母相比,目前,对P.kluyveri的研究还比较少,且主要来源于酿酒葡萄品种,对来源于鲜食葡萄来源的P.kluyveri酿造学特性研究更少。
因此,本研究采用形态观察及分子生物学技术对鲜食葡萄来源菌株YM7进行菌种鉴定,并以商业化S.cerevisiae X16为对照,从糖发酵性能、生长特性、糖耐受性、酒精耐受性、二氧化硫耐受性、酸耐受性以及β-葡萄糖苷酶、硫化氢生产能力等方面对其酿造学特性进行深入分析;继而将其与S.cerevisiae X16混合发酵葡萄汁,分析其对葡萄酒基本理化指标和香气特性的影响,以期为葡萄酒生产提供潜在的优质酵母菌株,对改善葡萄酒品质特性具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
菌株YM7:分离自阳光玫瑰(Shine Muscat)葡萄,保存于本实验室;商业化的酿酒酵母(Saccharomyces cerevisiae)X16:法国LAFFORT公司。
1.1.2 培养基
WL营养琼脂培养基[17]:酵母浸粉4 g,蛋白胨5 g,葡萄糖50 g,琼脂20 g,储存液A(KH2PO413.75 g/L,KCl 10.625 g/L,CaCl23.125 g/L,MgSO4·7H2O 3.125 g/L)40 mL,储存液B(FeCl32.5 g/L,MnSO42.5 g/L)1 mL,储存液C(0.44 g溴甲酚绿溶于10 mL无菌蒸馏水和10 mL体积分数95%乙醇中)1 mL,定容至1 000 mL,pH自然,121 ℃高压蒸汽灭菌15 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基[17]:酵母浸粉10 g,蛋白胨20 g,葡萄糖20 g,蒸馏水1 000 mL,pH自然。固体培养基另加入20 g琼脂,121 ℃高压蒸汽灭菌15 min。
1.1.3 主要试剂
葡萄糖、蛋白胨、酵母浸粉、琼脂粉、脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker、聚合酶链式反应(polymerase chain reaction,PCR)mix:生工生物工程(上海)股份有限公司;对硝基苯基-β-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,p-NPG):上海源叶生物公司;所有试剂均为分析纯或生化试剂。
1.2 仪器与设备
UH5300紫外分光光度计:日本日立公司;PHSJ-3F pH仪:上海仪电科学仪器股份有限公司;SZM体视显微镜:中国宁波舜禹仪器有限公司;T100 PCR仪:美国伯乐公司;GCMS-TQ8040 NX气相色谱-质谱联用(gas chromatographmass spectrometer,GC-MS)仪:日本岛津仪器有限公司。
1.3 实验方法
1.3.1 菌株YM7的鉴定
形态观察:将菌株YM7划线于WL营养琼脂培养基上,28 ℃倒置培养72 h,记录菌落颜色、形态、光泽等特征,并拍照。采用结晶紫对菌株YM7进行染色,光学显微镜下,观察细胞形态,并拍照。
分子生物学鉴定:参考HOLM C等[18]方法提取菌株YM7的DNA作为模板,以通用引物NL1和NL4对菌株的26S rDNA D1/D2区域基因序列进行PCR扩增,PCR扩增产物采用1%琼脂糖凝胶电泳检测。将合格的PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序,将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行BLAST同源序列搜索比对。选取同源性较高的模式菌株的26S rDNA D1/D2区域基因序列,采用MEGA X软件中的邻接(neighbor-joining)法构建系统发育树。
1.3.2 菌株YM7的酿造学特性分析
(1)生长曲线测定
将供试菌株YM7与酿酒酵母X16分别以终浓度为108 CFU/mL的接种量接种至YPD液体培养基中,28 ℃、180 r/min恒温培养,每隔4 h取样一次,平行重复3次,在波长600 nm处测定菌液的OD600nm值。共计取样10次,取样时间40 h。以各培养时间(x)为横坐标,OD600nm值(y)为纵坐标绘制菌株的生长曲线。
(2)糖发酵试验
将供试菌株YM7以终浓度为108 CFU/mL的接种量分别接种于含2%的葡萄糖、蔗糖、麦芽糖、乳糖、半乳糖的0.6%的酵母浸粉溶液中,酵母浸粉溶液置于含杜氏小管的试管中,以菌株X16为对照组,28 ℃恒温培养48 h,观察杜氏小管顶部是否有气泡。若有气泡产生,记为“+”(阳性反应),反之,则记为“-”(阴性反应)。
(3)生理耐受性测定
葡萄糖耐受性:将供试菌株YM7以终浓度为108CFU/mL的接种量接种于含葡萄糖质量浓度分别为100 g/L、150 g/L、200 g/L、250 g/L、300 g/L的YPD液体培养基中,平行重复实验3次,以菌株X16为对照组,28 ℃、180 r/min培养34 h。培养结束后,在波长600 nm处测定菌液的OD600nm值。
酒精耐受性:将供试菌株YM7以终浓度为108 CFU/mL的接种量接种于含酒精体积分数分别为3%、6%、9%、12%、15%的YPD液体培养基中,平行重复实验3次,以菌株X16为对照组,28 ℃、180 r/min培养34 h。培养结束后,在波长600 nm处测定菌液的OD600nm值。
SO2耐受性:将供试菌株YM7以终浓度为108 CFU/mL的接种量接种于含SO2质量浓度分别为50 mg/L、100 mg/L、150mg/L、200mg/L、300mg/L的YPD液体培养基中,平行重复实验3次,以菌株X16为对照组,28 ℃、180 r/min培养34 h。培养结束后,在波长600 nm处测定菌液的OD600nm值。
酸耐受性:将供试菌株YM7以终浓度为108CFU/mL的接种量分别接种于含不同柠檬酸质量浓度(15 mg/L、20 mg/L、25 mg/L、30 mg/L)的YPD液体培养基中,平行重复实验3次,以菌株X16为对照组,28 ℃、180 r/min培养34 h。培养结束后,在波长600 nm处测定菌液的OD600nm值。
(4)β-葡萄糖苷酶酶活测定
采用p-NPG法分析供试菌株YM7产β-葡萄糖苷酶的能力[16]。酶活力单位定义:在40 ℃、pH 5.0条件下,1 min水解p-NPG产生1 μmol p-NP所需酶量为一个酶活力单位,U/mL。
(5)硫化氢测定
取10 μL菌体浓度为108 CFU/mL的供试菌株YM7的菌液滴加至亚硫酸铋培养基表面的无菌滤纸片上,液体完全吸收后,28 ℃倒置培养5 d,观察滤纸片变色情况。以菌株X16为对照组,菌株产硫化氢能力由高到低,显色情况分别为显棕黑色、棕色、墨绿色、淡墨绿色及不显色[19]。
1.3.3 葡萄酒的制备[20]
取新鲜的北红葡萄汁(带皮压榨),加入50 mg/L的SO2和600 mg/L的二甲基二碳酸盐过夜灭菌处理,加入白砂糖调整糖度至24°Bx,并分成两组,置于2 L无菌三角瓶中,每组平行重复3次。第一组(酿酒酵母组):接种107 CFU/mL的菌株X16;第二组(混合发酵组):同时接种108 CFU/mL的菌株YM7和107 CFU/mL的菌株X16,26 ℃静置发酵。
1.3.4 葡萄酒指标的测定
(1)理化指标的测定
参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定葡萄酒酒精度、总酸及挥发酸含量。采用优化的蒽酮法[21]测定葡萄酒总糖含量。
(2)香气成分测定[22]
采用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)结合GC-MS法测定葡萄酒中的香气成分。美国国家标准与技术研究院(national institute of standards and technology,NIST)14.L标准谱库检索并匹配GC-MS采集得到的数据,进行定性分析。以环己酮(273.5 mg/L)为内标物,采用内标法进行香气物质的定量分析。
1.3.5 数据分析
采用Excel 2007对数据进行整理和作图,数据结果以“平均值±标准差”表示。Adobe Photoshop CS辅助作图。
2 结果与分析
2.1 菌株YM7的鉴定
2.1.1 形态观察
菌株YM7的菌落及细胞形态见图1。由图1可知,菌株YM7在WL营养琼脂培养基上的菌落呈黄白色,平铺,边缘不整齐,有褶皱,不透明;细胞近似椭圆状、出芽生殖。根据菌落形态与细胞形态,初步鉴定菌株YM7为毕赤酵母属[23]。

图1 菌株YM7的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of strain YM7
2.1.2 分子生物学鉴定
基于26S rDNA基因序列构建菌株YM7的系统发育树,结果见图2。由图2可知,菌株YM7与毕赤酵母(Pichia kluyveri)菌株JE-22(JQ771710.1)聚于一支,亲缘关系最近,结合形态观察结果,鉴定菌株YM7为克鲁维毕赤酵母(Pichia kluyveri)。
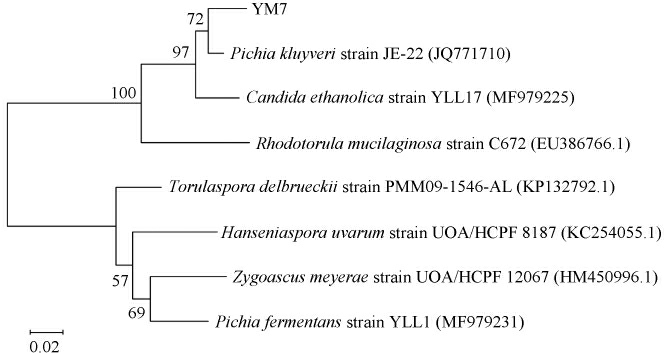
图2 基于26S rDNA D1/D2区域序列菌株YM7的系统发育树
Fig.2 Phylogenetic tree of strain YM7 based on 26S rDNA D1/D2 domain sequence
2.2 菌株YM7的酿造学特性
2.2.1 菌株YM7的生长曲线
菌株YM7的生长曲线见图3。由图3可知,菌株YM7的迟滞期为0~4 h,对数生长期为4~8 h,8 h后进入稳定期,迟滞期、对数生长期与菌株X16的基本一致。在稳定期的20 h以后,菌体浓度略低于菌株X16。因而,菌株YM7与商业化菌株S.cerevisiae X16的生长性能较为相似。
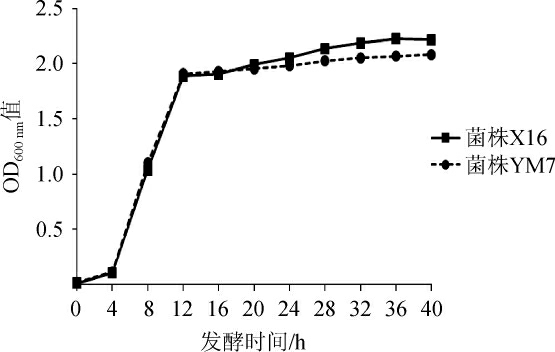
图3 菌株X16与菌株YM7的生长曲线
Fig.3 Growth curves of strains X16 and YM7
2.2.2 菌株YM7的糖代谢能力
糖代谢实验结果表明,菌株YM7可利用葡萄糖、蔗糖、麦芽糖、乳糖和半乳糖进行发酵。
2.2.3 菌株YM7的生理耐受性
菌株YM7的生理耐受性实验结果见图4。

图4 菌株X16与YM7的生理耐受性实验结果
Fig.4 Results of physiological tolerances tests of strains X16 and YM7
与菌株X16组相比,“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。下同。
由图4可知,菌株YM7可耐受300 g/L的葡萄糖,但菌体OD600nm值随着葡萄糖质量浓度的增加有降低的趋势,且在各种葡萄糖质量浓度下,菌体OD600nm值均低于菌株X16;菌株YM7可耐受体积分数3%的乙醇,当乙醇体积分数为6%时,菌体OD600nm值迅速降低,当乙醇体积分数达到9%,菌体无法生长,在各种乙醇体积分数条件下菌体OD600nm值均低于菌株X16;菌株YM7二氧化硫耐受性与柠檬酸耐受性与X16较为相似,差异不显著(P>0.05)。
2.2.4 菌株YM7产β-葡萄糖苷酶能力
采用p-NPG显色法分析了菌株YM7的β-葡萄糖苷酶产生能力,结果见表1。由表1可知,菌株YM7的胞外酶活及胞内酶活均显著低于菌株X16(P<0.01),细胞壁酶活与菌株X16无显著差异(P>0.05)。
表1 菌株X16及YM7的β-葡萄糖苷酶产生能力测定结果
Table 1 Determination results of β-glucosidase production ability of strains X16 and YM7

2.2.5 菌株YM7产硫化氢能力
菌株YM7的硫化氢产生能力见图5。由图5可知,菌株YM7的滤纸片呈棕黑色,且颜色比菌株X16深,因此,说明菌株YM7产硫化氢的能力高于菌株X16。硫化氢是一种具有臭鸡蛋味的气体,对酒体具有不良的影响[19]。菌株YM7产硫化氢量高于商业化S.cerevisiae X16,因而后期可结合各种育种技术,对该菌株进行改造,使其控制在一定的范围。
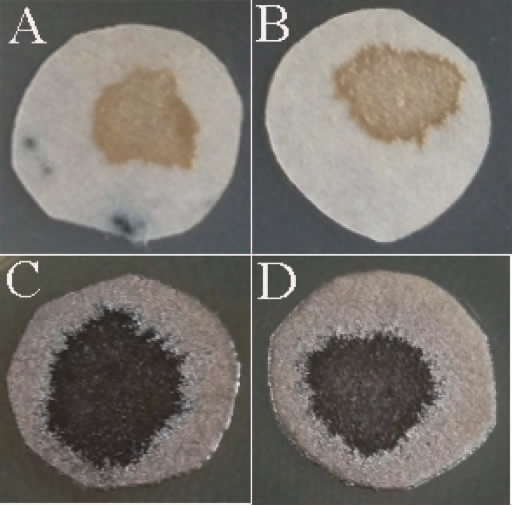
图5 菌株X16及YM7硫化氢产生能力测定结果
Fig.5 Determination results of hydrogen sulfide production ability of strains X16 and YM7
A~B为菌株X16;C~D为菌株YM7。
2.3 葡萄酒检测分析结果
2.3.1 理化指标分析
两组葡萄酒的基本理化指标见表2。由表2可知,两组处理均完成了乙醇发酵,残糖量均<4g/L,酒精度为12.16%vol~12.45%vol。与酿酒酵母组酒样相比,混合发酵组酒样中总酸含量升高,挥发酸含量降低,分别为6.17 g/L、0.29 g/L,说明菌株YM7可调节葡萄酒中酸类物质含量,包括总酸和挥发酸。
表2 葡萄酒基本理化指标测定结果
Table 2 Determination results of basic physical and chemical indicators of wine

注:与酿酒酵母组相比,“*”表示差异显著(P<0.05)。下同。
2.3.2 香气特性分析
由图6可知,从两组酒样中检测到酸类、醇类、酯类及其他类物质,两组酒样其他类物质含量无显著性差异(P>0.05);混合发酵组酒样挥发性醇类物质为127.35 mg/L、酸类物质含量为2.78 mg/L,均低于酿酒酵母组酒样(137 mg/L、3.45 mg/L),挥发性酯类物质含量(75.87 mg/L)高于酿酒酵母组(64.35 mg/L)。

图6 两组葡萄糖酒样中挥发性香气物质含量测定结果
Fig.6 Determination results of volatile aroma compounds contents in two groups of wine samples
非酿酒酵母是一大类除酿酒酵母之外的多种酵母类群总称,由于其最初是从腐败的葡萄中分离得到的,因而一直被认为污染菌,未受到重视[24]。随着人们对非酿酒酵母菌认识的不断加深,发现某些非酿酒酵母菌可产生较多的风味物质,有助于增加酒体风味物质的丰富性和复杂性,对葡萄酒的品质具有积极作用。越来越多的非酿酒酵母被用于多种酒类的生产,且某些菌株已商业化[25-27]。本研究发现来源于鲜食葡萄的一株克鲁维毕赤酵母YM7,可调节葡萄酒酸类物质和挥发性香气物质品质特性,因而在葡萄酒生产中具有一定的应用价值。
3 结论
本研究鉴定并深入分析了一株鲜食葡萄来源酵母菌株的酿造学特性,结果表明,菌株YM7为一株毕赤酵母(Pichia kluyveri),其生长特性、二氧化硫耐受性以及柠檬酸耐受性和商业化的S.cerevisiae X16性能接近,葡萄糖耐受性低于菌株X16。该菌株对乙醇敏感,仅可耐受体积分数3%的乙醇,β-葡萄糖苷酶和硫化氢生产能力分别低于、高于菌株X16。此外,与S.cerevisiae X16单独发酵葡萄酒相比,葡萄酒挥发酸含量,香气化合物中酸类、醇类物质含量均降低,酯类物质含量增加。综上,Pichia kluyveri YM7具有良好生长特性、耐受性和发酵特性等酿造学特性,初步判断为一株优良葡萄酒酿造菌株,具有一定的潜在应用价值。
[1]ELDAROV M A,KISHKOVSKAIA S A,TANASCHUK T N,et al.Genomics and biochemistry of Saccharomyces cerevisiae wine yeast strains[J].Biochemistry,2016,81(13):1650-1668.
[2]SCHMIDT S A,KOLOUCHOVA R,FORGAN A H,et al.Evaluation of Saccharomyces cerevisiae wine yeast competitive fitness in enologically relevant environments by barcode sequencing[J].G3:Genes,Genomes,Genetics,2020,10(2):591-603.
[3]ALONSO-DEL-REAL J,PÉREZ-TORRADO R,QUEROL A,et al.Dominance of wine Saccharomyces cerevisiae strains over S.kudriavzevii in industrial fermentation competitions is related to an acceleration of nutrient uptake and utilization[J].Environ Microbiol,2019,21(5):1627-1644.
[4]ALBERTINW,ZIMMERA,MIOT-SERTIERC,et al.Combined effect of the Saccharomyces cerevisiae lag phase and the non-Saccharomyces consortium to enhance wine fruitiness and complexity[J].Appl Microbiol Biotechnol,2017,101(20):7603-7620.
[5]PADILLA B,ZULIAN L,FERRERES À,et al.Sequential inoculation of native non-Saccharomyces and Saccharomyces cerevisiae strains for wine making[J].Front Microbiol,2017,8:1293.
[6]DUTRAIVE O,BENITO S,FRITSCH S,et al.Effect of sequential inoculation with non-Saccharomyces and Saccharomyces yeasts on Riesling wine chemical composition[J].Fermentation,2019,5(3):79.
[7]MINNAAR P P,DU PLESSIS H W,JOLLY N P,et al.Non-Saccharomyces yeast and lactic acid bacteria in co-inoculated fermentations with two Saccharomyces cerevisiae yeast strains:A strategy to improve the phenolic content of Syrah wine[J].Food Chem,2019,4:100070.
[8]HU L,LIU R,WANG X,et al.The sensory quality improvement of citrus wine through co-fermentations with selected non-Saccharomyces yeast strains and Saccharomyces cerevisiae[J].Microorganisms,2020,8(3):323.
[9]谭玉岩,郝宁.酿酒酵母与非酿酒酵母混合发酵对果酒品质的影响[J].食品工业科技,2020,41(8):353-359.
[10]张文静,杨诗妮,杜爽,等.本土毕赤克鲁维酵母与酿酒酵母混合发酵葡萄酒的增香潜力分析[J].食品科学,2020,41(12):84-90.
[11]PRIOR K J,BAUER F,DIVOL B,et al.The utilisation of nitrogenous compounds by commercial non-Saccharomyces yeasts associated with wine[J].Food Microbiol,2019,79:75-84.
[12]SAERENS S,SWIEGERS J H.Production of cider with Pichia kluyveri yeast:US,15/115,162[P].2016-12-1.
[13]LU Y Y,MARILYN V,CHUA J Y.The effects of co-and sequential inoculation of Torulaspora delbrueckii and Pichi kluyveri on chemical compositions of durian wine[J]. Appl Microbiol Biotechnol,2017,101(21):7853-7863.
[14]ZOTT K,BELY M.The grape must non-Saccharomyces microbial community:Impact on volatile thiolrelease[J]. Int J Food Microbiol,2011,151(2):210-215.
[15]AMAYA-DELGADO L,HERRERA-LÓPEZ E J,ARRIZON J,et al.Performance evaluation of Pichia kluyveri, Kluyveromyces marxianus and Saccharomyces cerevisiae in industrial tequila fermentation[J]. World J Microbiol Biotechnol,2013,29(5):875-881.
[16]冯莉,陈雪,李丽,等.5株克鲁维毕赤酵母的酿造学特性[J].中国食品学报,2018,18(12):66-73.
[17]刘晓柱,李银凤,于志海,等.刺梨自然发酵过程中非酿酒酵母多样性分析[J].微生物学报,2020,60(8):1696-1708.
[18]HOLM C,MEEKS-WAGNER D W,FANGMAN W L,et al.A rapid,efficient method for isolating DNA from yeast[J]. Gene,1986,42(2):169-173.
[19]赵湖冰,黎华,田野,等.一株刺梨非酿酒酵母的分离鉴定、生理特性及混菌发酵研究[J].食品工业科技,2020,41(16):114-120.
[20]冯涛,王旭增,王一非,等.葡萄园土壤中酿酒酵母的分离鉴定及其发酵葡萄酒香气成分分析[J].食品科学,2018,39(14):213-220.
[21]刘晓柱,赵湖冰,李银凤,等.一株刺梨葡萄汁有孢汉逊酵母的鉴定及酿酒特性分析[J].食品与发酵工业,2020,46(8):97-104.
[22]阎贺静,张鸣宇,孙康,等.野生酿酒酵母和葡萄汁有孢汉逊酵母混菌发酵对玫瑰香葡萄酒香气的影响[J].食品与发酵工业,2020,46(11):165-171.
[23]LING L,LI Z,JIAO Z,et al.Identification of novel endophytic yeast strains from tangerine peel[J].Curr Microbiol,2019,76(9):1066-1072.
[24]JOLLY N P,VARELA C,PRETORIUS I S.Not your ordinary yeast:non-Saccharomyces yeasts in wine production uncovered[J].FEMS Yeast Res,2014,14(2):215-237.
[25]李旋,亓桂梅,王超萍.非酿酒酵母在葡萄酒生产中的作用及研究进展[J].中外葡萄与葡萄酒,2019(1):52-56.
[26]WANG C,MAS A,ESTEVE-ZARZOSO B.The interaction between Saccharomyces cerevisiae and non-Saccharomyces yeast during alcoholic fermentation is species and strain specific[J].Front Microbiol,2016,7:502.
[27]TOFALO R,PATRIGNANI F,LANCIOTTI R,et al.Aroma profile of montepulciano d'Abruzzo wine fermented by single and co-culture starters of autochthonous Saccharomyces and non-Saccharomyces yeasts[J].Front Microbiol,2016,7:610.