根据培养基的形态可将细胞发酵方式分为固态发酵和液态发酵[1]。它们各有优缺点,固态发酵方式菌体及其代谢产物密度高,但劳动强度大,且发酵不均匀;液态发酵方式可控性强,但产量低、菌种回收困难[2]。固定化发酵结合了固态发酵的菌体密度高、液态发酵的可控性强的优点,用物理或化学的方法将细胞固载于一定的结构域内,将整个固定化体系放置于液体环境中进行发酵,并实现细胞的回收再利用[3]。根据细胞表面特性及固定化原理的不同,常用的固定化方法有吸附法、包埋法、共价法、交联法等[4]。凝胶珠固定化技术在部分学者论文中表述为“微胶囊固定化技术”,属于包埋法中的一种,因其生物相容性强、囊膜孔隙可控、制作成本低等优点而备受关注[5],但该技术至今尚未得到大规模的推广应用,说明技术本身有很大的改进空间。本文概述了凝胶珠固定化技术,并分析其与微胶囊技术的区别,论述了凝胶珠的制备原理和方法,在前人研究基础上列举了当前的应用研究概况,同时提出今后的发展方向,旨在为更好地利用凝胶珠固定化技术提供借鉴。
1 凝胶珠固定化技术
1.1 凝胶珠固定化细胞技术简介
凝胶珠是用多糖、蛋白质等大分子物质将酶或细胞等生物催化载体包裹起来的毫米级或微米级颗粒物[6-7],其模型如下:

生物催化载体作为壁芯、凝胶膜作为壁材。通过改变凝胶膜的种类、浓度、反应时间、聚合类型等参数,可实现囊内外各种分子不同程度的截留。凝胶成膜时往往需要螯合金属离子,因此金属离子的种类、价态与浓度也会对凝胶囊膜的孔隙大小和截留程度造成影响[8]。对于凝胶珠固定化细胞发酵体系,囊膜可使氧气、小分子营养物质及代谢产物在浓度梯度的作用下进出凝胶球,而多糖、蛋白质等大分子物质被阻隔于囊内或囊外,从而起到催化、发酵或免疫隔离的目的[9]。同时,囊膜可以一定程度上保护酶或细胞等生物催化载体免受机械搅拌对其造成的损伤以及外界有毒物质或微生物的侵害,从而给生物催化载体提供一个相对温和的环境[10]。经过几十年的发展,该技术已在食品与发酵工业、污水处理及能源生产等多个领域中应用。
1.2 凝胶珠与微胶囊的联系与区别
凝胶珠与微胶囊固定化技术都是包埋法固定化技术中的一个分支。本文从包埋的原料、方法、大小、用途等方面对两者的异同点进行分析(见表1)。
凝胶珠和微胶囊在制备材料、方法及应用领域方面有相似之处,但包埋目的和包埋体的大小存在显著区别。包埋体的大小取决于包埋目的,如凝胶珠体积较大,便于回收,同时内部能有足够的空间使被固定化的催化载体与底物之间进行反应,可实现物质转化[11-12];微胶囊体积较小,囊膜与被包埋物质紧密接触,甚至成键,减少外界环境对被包埋物质的影响,在光、热、pH等稳定性上有所改善,便于物质的储藏或运输[13];此外,有些囊膜生物相容性甚好,可制备为载药微胶囊,在特定条件下可实现药物缓释,且小体积的微胶囊能够增加比表面积,进而提高药物的吸收代谢效率[14]。此外,凝胶珠和微胶囊在呈现形式上也有区别,这些区别还是与包埋目的有关。例如:用于生物催化或者化学转化的凝胶珠体系中可能会在多孔结构中或囊膜内部充盈液体;用于保藏的微胶囊则偏向于干性体系,尤其对于经过喷雾干燥或冷冻干燥所制备的微胶囊,几乎以粉末形式呈现。现今对于“凝胶珠”还存在其他形式的名词描述,如“微胶囊”、凝胶微球[15-17],尽管它们在应用形式上存在差别,但凝胶珠与微胶囊相似之处颇多,难以用某种标准来准确区分这两个概念。本文主要论述用于固定化发酵的载体,根据其用途和特征,用凝胶珠来称呼更加合适。
表1 凝胶珠与微胶囊固定化技术比较
Table 1 Comparison of immobilization technology between gel beads and microcapsules

2 凝胶珠的制备原理
常见的凝胶珠制备方法有两种,即聚电解质成膜和自凝聚成膜。凝胶珠形成过程参与反应的阴离子基团
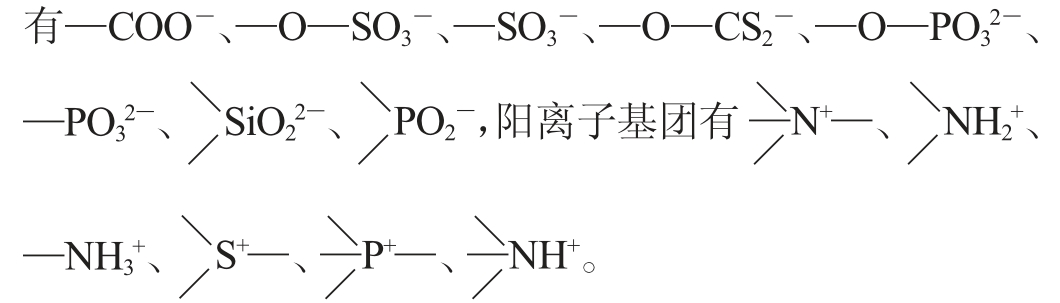
对于聚电解质成膜,多聚物通过聚电解质阴阳离子基团吸引聚集成膜,静电引力是其制备的关键,而对于囊膜的构象及性质,氢键、范德华力、静电斥力、亲水及疏水作用力等因素会带来显著的影响。陈国等[18]认为形成凝胶珠的聚合物种类繁多,通过合成或衍生化得到的制备原料更是不在少数,而聚电解质实际上参与成膜的基团却相对有限,这些有限的基团在不同聚合物中的种类、数量、排布、空间位置的不同,造成聚合而成的囊膜在空间结构和囊内外表面特性上的差异。这些差异宏观上表现为生物相容性、体积大小、物质流动与截留性、凝胶珠弹性与脆性等方面的不同。参与聚合反应的物质除了聚电解质外,金属离子也是一类重要的因素。当金属离子存在时,这些离子表面的电荷可与阴离子基团相互吸引,在空间结构允许的条件下,金属离子充当“盐桥”的作用,使两个或多个阴离子基团搭在一起,从而在没有聚阳离子存在的情况下亦能成膜,其中最典型的当属海藻酸钠与钙离子的结合模型(图1)。
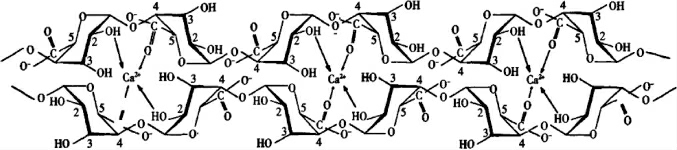
图1 海藻酸钠与钙离子结合示意图
Fig.1 Schematic diagram of sodium alginate binding with calcium ion
对于自凝聚成膜,即多聚物自身具有形成凝胶的能力,分子链上的羟基、羧基等基团能与自身或水分子之间形成氢键,在多聚物分子充分伸展并相互缠绕的情况下,形成网状多孔凝胶,其凝胶的形成过程静电引力不占主导地位。在凝胶的制备过程中,出于应用需求,还可以复配其他物质进行改性,但改性后的凝胶成膜机理依然以非聚电解质成膜为主[19-20]。常见的采用自凝聚成膜的凝胶珠为琼脂糖凝胶珠。琼脂糖是以D-半乳糖和3,6-脱水-L-半乳糖为结构单元组成的多聚物[21-22],其结构单元内存在4个羟基(图2a),在高温条件下琼脂糖分子得以舒展和缠结,在冷却过程中,糖链上3个向外的羟基可通过氢键与相邻的螺旋或复配物或水分子结合,剩余的一个羟基在螺旋内部与水结合,最终形成三维网状凝胶结构[23](图2b)。

图2 琼脂糖凝胶的结构单元及微观形态
Fig.2 Structural units and micromorphology of agarose gel
a.琼脂糖凝胶的结构单元,其中A为D-半乳糖,B为3,6-脱水-L-半乳糖;b.15 g/L琼脂在200倍下的微观形态。
3 凝胶珠的制备方法
3.1 基于聚电解质成膜的凝胶珠
以阴阳离子聚合反应为基础的凝胶珠的制备方法较为复杂。根据反应体系和反应过程的不同,将凝胶珠的制备方法分为3种:两相界面聚合法、液滴成膜法和组装-去核法[18]。
两相界面聚合法指的是2种聚电解质分别分散于两种互不相容的溶液中,通过机械搅拌使两种物质相互接触进而在界面成膜。如TRONGSATITKUL T等[24]在油-水-油的双乳液体系中,通过聚异丙酰胺(poly(n-isopropyl acry lamide),PNIPAM)与聚乙二醇单甲醚单甲基丙烯酸酯(poly(ethyleneglycol)dimethacrylate,PEGMA)的聚合包埋了酵母菌,酵母菌的存活率比单使用PNIPAM由30%提高至60%;GREEN K D等[25]以1,6-己二胺和聚烯丙胺为原料,经十二烷基二氯化物交联,通过界面聚合法包埋了面包酵母,其催化活性要高于游离酵母细胞、海藻酸钙和κ-卡拉胶凝胶珠。
液滴成膜法即溶液A滴入溶液B中,两种溶液的溶剂相容,而溶质在滴入的瞬间迅速反应成膜。在海藻酸钙凝胶珠的制备中用的就是该方法[26]。此法奇妙之处在于由A滴入B与由B滴入A所制备的凝胶珠性质不同。仍以海藻酸钙凝胶珠为例,海藻酸钠溶液滴入钙离子溶液中,两种溶液的界面处形成海藻酸钙膜,随着固定化时间的延长,钙离子逐渐渗透进入囊中心,最后将形成实心的凝胶珠。如OYEAGU U等[27]将海藻酸钠溶液与淀粉或糖溶液混合,再滴入CaCl2溶液中,固定化过程中淀粉或糖会从凝胶珠中渗出,从而避免形成较为致密的实心海藻酸钙凝胶珠,可增加固定化细胞密度。但如果是钙离子溶液滴入海藻酸钠溶液中,钙离子的渗透会在液滴外围形成囊膜,随着固定化时间的延长,囊膜变厚、体积变大、囊内却是充满水溶液的空心凝胶珠[28]。因此凝胶珠的体积及内部容积与固定化方式及固定化时间关系密切。
组装-去核法是先用一种高分子物质包埋细胞制备成预胶珠,再将预胶珠投入另一种含有高分子的溶液中,两种高分子物质在预胶珠的表面反应成膜,此时再用第一种溶液反应掉膜表面的基团,组装成更大的凝胶珠,此时凝胶珠的结构为A-B-A;由于此时凝胶实心程度大,囊膜内部的空间体积狭小,为保证细胞的活动空间,用溶解液将内部的预胶珠溶解,形成中空的微胶囊,整个制作过程包含了组装和去核两个步骤。如王家荣等[29]利用海藻酸钠与壳聚糖制备成ACA凝胶珠:海藻酸钠与Ca2+反应形成海藻酸钙预胶珠,该预胶珠表面的-COO-与所投入的新溶液中的壳聚糖表面的-NH4+发生静电反应成水不溶性高聚物,再经过海藻酸钠溶液的处理,组装成海藻酸钠-壳聚糖-海藻酸钠凝胶珠,最后利用柠檬酸钠溶液螯合掉内核中的Ca2+,使内部的海藻酸钙解聚成海藻酸钠并溶解于水中,变成中空的凝胶珠。
对于包埋细胞而言,要求包埋条件较为温和,两相界面聚合法所用的溶剂可能对细胞有一定的毒性,因此细胞的存活率较低;对于液滴成膜法而言,制备过程中容易形成实心凝胶珠,或者不同凝胶珠之间容易因交联剂的渗透而粘在一起,制备过程的精准控制难度较大;组装去核法可能是相对而言较佳的方法,它在构建珠状凝胶囊膜的同时又能腾出细胞的活动空间,保证细胞活动的正常进行。
3.2 基于自凝聚成膜的凝胶珠
对于自凝聚成膜而形成的凝胶珠,其制备方法较为简单,通常由制液和造粒两个步骤组成。如NÓBILE M L等[30]用无菌熔化的琼脂糖溶液稍微冷却后与柯氏柠檬酸杆菌菌悬液混合,再滴入低温的葵花籽油中造粒,由于葵花籽油不与琼脂糖发生反应,但低温、无水的性能却能促使其糖链内基团之间形成氢键,进而自凝聚成凝胶珠并将菌悬液固定化包埋,之后再将葵花籽油过滤去除,并用正己烷和NaCl溶液清洗即可。对于有特殊需求的凝胶珠,有时候还需要进行改性。如张敏等[20]在琼脂糖凝胶珠的制备基础上接枝聚乙烯亚胺,即将琼脂糖凝胶珠分散在聚乙烯亚胺溶液中使其充分接触,再加入NaOH溶液使聚乙烯亚胺偶联到凝胶珠上,可用于甘油脱氢酶的固定化。
尽管自凝聚成膜的固定化方法也是当下的研究热点,但制液过程中的“高温”难以适用于对温度敏感的细胞,多数应用常见于酶的固定化。故以下对凝胶珠固定化技术的应用仅介绍对温度要求不高的基于聚电解质成膜的凝胶珠。
4 凝胶珠固定化技术的应用
4.1 固定化动物细胞
由于动物细胞无细胞壁,细胞较易受损,凝胶囊膜可充当细胞壁的作用包裹在细胞膜外侧,保护细胞;此外,动物细胞在培养过程中容易遭受微生物的污染,而凝胶囊膜的阻隔作用可避免此问题[31]。在凝胶珠固定化动物细胞领域,固定化杂交瘤细胞、产单克隆抗体等方面的研究较多。GOTOH T等[32]以海藻酸钠、牛血清白蛋白和碳酸氢钠固定化培养杂交瘤细胞,培养后细胞浓度可达到5.7×107个/mL;IVANA P L等[33]利用海藻酸钠-聚赖氨酸固定化杂交瘤细胞,并建立了数学模型,该模型能够预测各种微环境限制效应对细胞生长动力学的影响;JAIN E等[34]分别采用聚丙烯酰胺-壳聚糖(polyacrylamide-chitosan,PAAC)、聚(N-异丙基丙烯酰胺)-壳聚糖、聚丙烯腈(polyacrylonitrile,PAN)和(聚(N-异丙基丙烯酰胺)固定化杂交瘤细胞,PAAC在单克隆抗体的产生和细胞生长方面要优于其他体系,此外,将该固定化体系放置于整体式生物反应器中,其单克隆抗体的最高浓度(115 μg/mL)比细胞培养瓶要高4倍。
4.2 固定化植物细胞
植物细胞在悬浮培养过程中由于细胞的增殖和堆积,易形成细胞团,当细胞团较大时,会限制团块内部细胞的活力,而凝胶珠固定化植物细胞可克服上述缺陷。CHAUHAN P等[35]用海藻酸钙凝胶珠固定化植物细胞,通过海藻酸钙浓度的优化,使细胞数量增加。用凝胶珠固定化植物细胞还可以保护细胞免受剪切力的影响,同时能够转移细胞,进行连续培养。NOHA Y S等[36]利用海藻酸钙凝胶珠固定化植物细胞连续培养表达人粒细胞-巨噬细胞集落刺激因子(human granulocyte-macrophage colony stimulating factor,hGM-CSF),但其固定化效果不如聚氨酯泡沫,说明凝胶珠体系需要改善;KWON S等[37]利用海藻酸钙凝胶珠固定化烟草细胞,其糖苷类细胞产物都有相应的提高:4-异丙基托泊酮2-O-β-D-葡萄糖苷(11%)、4-异丙基托泊酮2-O-β-D-龙胆苦苷(6%)、6-异丙基托泊龙酮2-O-β-D-葡萄糖苷(20%)以及6-异丙基丙烷2-O-β-D-龙胆苷(10%)。
4.3 固定化微生物
固定化技术在微生物方面的应用要广于动物和植物细胞。本文基于凝胶珠固定化微生物发酵的研究,列举了凝胶微球的固定化材料、固定化微生物种类、固定化发酵效果及其对应的应用领域(见表2)。
表2 凝胶珠固定化微生物应用
Table 2 Application of gel beads in immobilization of microorganisms

5 凝胶珠固定化技术发展方向
多数情况下凝胶珠固定化细胞的目的在于重复使用固定化体系以持续地获得细胞产物。尽管相关研究较多,但仍未成为发酵方式的主流,液态游离发酵方式仍是众多学者的首选,说明凝胶珠固定化发酵存在技术瓶颈。这些技术瓶颈可能在于囊膜阻碍了物质传递效率、囊内细胞生长空间受限、提取囊内目标物质较为困难三个方面。因此,突破这三个技术瓶颈将会是该固定化技术的发展方向。
5.1 改善物质传递效率
对细胞包裹的囊膜具有两面性:一方面保护了细胞,免受污染及损伤;另一方面限制了囊内外部分物质的流通。物质传递受阻,囊外的大分子物质难以运送至囊内,囊内的部分代谢产物难以及时排到囊外,会造成各种负面的影响:囊内的胞外酶系难以对囊外的营养物质进行降解和利用、囊内的代谢产物浓度升高反抑制细胞代谢、囊内的细胞因营养供给不足而死亡、自溶的细胞有害物质难以及时排到囊外可能引起其他正常细胞的凋亡。这些负面影响可直观地表现为代谢产物含量低下、囊内活菌数减少。如SHARMA A等[47]利用海藻酸钙、壳聚糖复合海藻酸钠两种固定化方式发酵芽孢杆菌,发酵前三批的α-淀粉酶含量均低于液态游离发酵;DIMITROVSKI D等[48]实验结果表明,固定化发酵乳酸菌的活菌数为3.2×106 CFU/mL,远低于游离发酵时的2.5×109 CFU/mL。为克服上述问题,凝胶珠的囊膜性能需要改善,可施行的调控方法有:凝胶的改性、囊膜制备方法的改进、发酵体系中某些调控因子的添加等。如王建龙等[49]在海藻酸钠溶液中混入氧化石墨烯来进行改性,其制备的凝胶珠对重金属和放射性废水具有良好的生物吸附性能;史雁飞等[50]通过海藻酸钠固定化条件的改进,使包埋有异常威克汉姆酵母Y5的凝胶珠对白酒的酿造提高了酯化能力;GEDAM P S等[51]在发酵体系中添加了非离子表面活性剂,有助于提高固定化生孢梭菌产丁醇的量。
5.2 改良固定化方式
固定化发酵相当于将细胞集中于给定的有限空间内,尽管上文提到的组装-去核法可液化囊心而增加囊内细胞的生长活动空间,但当细胞发酵至一定程度时,微升级的囊内体积限制了细胞的进一步发展。为拓宽细胞生长的空间,部分学者将细胞固定于物理载体中,如粘土卵石、多孔泡沫材料、聚氨酯泡沫等[52-54],或将其半固定于凝胶平面中[55]。这样的固定化方式能够在固定化体系中保留母菌,这些菌的子代既可以留在固定化体系中,也可以散播到环境中,从而减轻了在固定化体系空间有限的情况下细胞竞争行为所带来的生长代谢抑制。
5.3 探索提取和检测囊内物质的方法
通过培养细胞所获得的目标产物并非完全是胞外产物。在固定化培养结束后,要对目标物进行提取往往需要对囊膜进行裂解。常见的海藻酸钙凝胶珠可通过添加金属离子螯合剂去除钙离子而使水不溶性的海藻酸钙转为水溶性的海藻酸钠;琼脂糖凝胶珠可通过破坏氢键来使琼脂糖解聚。其他类型的凝胶球可基于其制备原理来进行裂解,从而提取和检测囊内物质。在聚合物解离时,高吸水性的结构单元可能会使样品的粘度变大,在进行物质分离或测定时难度增加,因此聚合物的去除方式尤为关键。在提取和检测囊内物质方面,倪莉等[56-57]使用柠檬酸钠溶液在加热条件下使海藻酸钠微胶囊溶解,利用定磷法测定了囊内菌量;同时还发现通过金属离子螯合剂、超声、加热、调pH和乙醇萃取后,可提取和检测混在海藻酸钠凝胶中的红曲色素。
6 结语
由聚电解质聚集成膜的凝胶珠为细胞的固定化培养提供了一种廉价而便捷的载体,这种固定化技术可实现连续发酵,并在食品、生物医药、污水处理等多个领域都有其应用之处。现今凝胶珠固定化技术多数停留于实验室研发阶段,技术本身存在着一些瓶颈,需要改善物质传递效率、改良固定化方式、探索提取和检测囊内物质检测方法等。随着现代科技的飞速发展,相信凝胶珠固定化技术会越来越完善,并逐步实现规模化应用。
[1]XIA Y,MA Y,HOU L,et al.Effect of solid or liquid fermentation state,yeast strain,fermentation temperature and time on the flavor content of jujube(Ziziphus jujuba)brandy[J].Am J Food Technol,2017,12(1):14-24.
[2]ZHANG B,LU L,XU G.Why solid-state fermentation is more advantageous over submerged fermentation for converting high concentration of glycerol into Monacolin K by Monascus purpureus 9901:A mechanistic study[J].J Biotechnol,2015,206:60-65.
[3]张强,嵇冶.固定化细胞技术应用于酒精发酵中的研究进展[J].化工进展,2017,36(4):1404-1409.
[4]尹莉,乔丽丽,乔瑞平,等.固定化微生物强化生物处理过程的研究进展[J].环保科技,2016,22(5):55-58.
[5]MORENO-GARCIA J,GARCIA-MARTINEZ T,MAURICIO J C,et al.Yeast immobilization systems for alcoholic wine fermentations:Actual trends and future perspectives[J].Front Microbiol,2018,9:241-254.
[6]KATO G,SATO A,TOKUYAMA H.Continuous esterification using lipaseentrapped amphiphilic copolymericgel beads[J].Kagaku Kogaku Ronbunshu,2018,44(3):185-188.
[7]WU N,LI X,HUANG G,et al.Adsorption and biodegradation functions of novel microbial embedding polyvinyl alcohol gel beads modified with cyclodextrin:A case studyof benzene[J].Environ Technol,2019,40(15):1948-1958.
[8]尤业兵,缪冶炼,陈介余,等.海藻酸钙凝胶颗粒固定化抗冻酵母AFY-1的机制分析及条件优化[J].生物加工过程,2016,14(4):5-11.
[9]梅乐和,姚善泾.生物微胶囊固定化技术的研究进展[J].现代化工,1998(1):19-22.
[10]SILVÉRIO S C,MOREIRA S,MILAGRES A M,et al.Laccase production by free and immobilized mycelia of Peniophora cinerea and Trametes versicolor:a comparative study[J].Bioproc Biosyst Eng,2013,36(3):365-373.
[11]LUO H,ZENG X,LIAO P,et al.Phosphorus removal and recovery from water with macroporous bead adsorbent constituted of alginate-Zr4+ and PNIPAM-interpenetrated networks[J].Int J Biol Macromol,2019,126(1):1133-1144.
[12]AGUILERA D A,SPINOZZI DI SANTE L,PETTIGNANO A,et al.Adsorption of a chiral amine on alginate gel beads and evaluation of its efficiency as heterogeneous enantioselective catalyst[J].Eur J Org Chem,2019,2019(24):3842-3849.
[13]LIN Q,LIANG R,WILLIAMS P A,et al.Factors affecting the bioaccessibility of β-carotene in lipid-based microcapsules:digestive conditions,the composition,structure and physical state of microcapsules[J].Food Hydrocolloid,2018,77:187-203.
[14]CARR E J,PONTRELLI G.Drug delivery from microcapsules:how can we estimate the release time?[J].Math Biosci,2019,315:108216.
[15]陈宏,何蒙,张晗,等.聚丙烯酸钠-海藻酸钠-聚天冬氨酸凝胶球脱除鱿鱼内脏酶解液中的铅[J].中国食品学报,2018,18(3):81-89.
[16]高义霞,杨亮亮,袁毅君,等.A-LBG凝胶珠对碱性品红的吸附特性研究[J].环境科学与技术,2014(9):32-36.
[17]苗敬芝,董玉玮,张建萍.灵芝、金针菇细胞微胶囊化发酵饮料的研制[J].食品工业,2017,(4):55-59.
[18]陈国,姚善泾,方柏山.PEC生物微胶囊研究进展[J].化工进展,2007,26(8):1093-1099.
[19]程文健,叶兴乾.琼脂-麦芽糊精共混物的成膜特性研究[J].中国食品学报,2012,12(1):65-70.
[20]张敏,韩林,胡月月,等.改性琼脂糖微球固定化甘油脱氢酶的研究[J].过程工程学报,2020,20(5):591-598.
[21]ARNOTT S,FULMER A,SCOTT W E,et al.The agarose double helix and its function in agarose gel structure[J].J Mol Biol,1974,90(2):269-284.
[22]IMESONAP.Thickeningandgellingagentsforfood[M].Germany:Springer,1997:35-40.
[23]刘施琳,朱丰,林圣楠,等.琼脂凝胶强度及弛豫特性的研究[J].食品工业科技,2017,38(13):85-89,100.
[24]TRONGSATITKUL T,BUDHLALL B M.Multicore-shell PNIPAm-co-PEGMa microcapsules for cell encapsulation[J].Langmuir,2011,27(22):13468-13480.
[25]GREEN K D,GILL I S,KHAN J A,et al.Microencapsulation of yeast cells and their use as a biocatalyst in organic solvents[J].Biotechnol Bioeng,1996,49(5):535-543.
[26]ORREGO D,ZAPATA-ZAPATA A D,KIM D.Ethanol production from coffee mucilage fermentation by S.cerevisiae immobilized in calcium-alginate beads[J].Bioresource Technol Rep,2018,3:200-204.
[27]OYEAGU U,NWUCHE C O,OGBONNA C N,et al.Addition of fillers to sodium alginate solution improves stability and immobilization capacity of the resulting calcium alginate beads[J].Iran J Biotechnol,2018,16(1):1824.
[28]KLEIN J,STOCK J,VORLOP K D.Pore size and properties of spherical Ca-alginate biocatalysts[J].Eur J Appl Microbiol Biot,1983,18(2):86-91.
[29]王家荣,金谊,刘望才,等.海藻酸钠-壳聚糖-海藻酸钠生物微胶囊的制备[J].宁波大学学报(理工版),2007,20(4):516-519.
[30]NÓBILE M L,IRIBARREN A M,LEWKOWICZ E S.Citrobacterkoseri immobilized on agarose beads for nucleoside synthesis:a potential biocatalyst for preparative applications[J]. Bioproc Biosyst Eng,2020,43(4):637-644.
[31]石凯,熊晓辉,许建生.固定化动物细胞大规模培养技术研究进展[J].化工进展,2002,21(8):556-559.
[32]GOTOH T,HONDA H,SHIRAGAMI N,et al.A new type porous carrier and its application to culture of suspension cells[J].Cytotechnology,1993,11(1):35-40.
[33]IVANA P L,BUGARSKI D,MILENKO P,et al.Influence of microenvironmental conditions on hybridoma cell growth inside the alginate-poly-L-lysine microcapsule[J].Process Biochem,2007,42(2):167-174.
[34]JAIN E,KARANDE A A,KUMAR A.Supermacroporous polymer-based cryogelbioreactor for monoclonal antibody production in continuous culture using hybridomacells[J].Biotechnol Progr,2015,27(1):170-180.
[35]CHAUHAN P,PANIGRAHI M K,BEHERA J P.Effect of plant growth regulators on immobilized cell culture of Adhatoda vasica Nees[J].J Nat Prod Plant Resour,2016,6(5):12-14.
[36]NOHA Y S,NAMA H J,CHOI H Y.Enhanced production of hGM-CSF by immobilized transgenic plant cell cultures[J]. Korean Soc Biotechnol Bioeng J,2015,30(2):82-90.
[37]KWON S,SHIMODA K,HAMADA H,et al.High production of betathujaplicin glycosides by immobilized plant cells of Nicotianatabacum[J].Acta Biol Hung,2008,59(3):347-355.
[38]PETROV K K,PETROVA P M,BESCHKOV V N.Improved immobilization of Lactobacillus rhamnosus ATCC 7469 in polyacrylamide gel,preventing cell leakage during lactic acid fermentation[J].World J Microb Biot,2007,23(3):423-428.
[39]王春喜,余关龙,张登祥,等.固定化反硝化菌联合固体碳源小球处理低碳氮比污水的性能研究[J].环境污染与防治,2018,40(8):870-874.
[40]唐湘华,杨云娟,李俊俊,等.酿酒酵母GY-1的固定化及其对魔芋寡糖中单糖的利用[J].中国酿造,2019,38(2):80-85.
[41]GONG G H,HOU Y,ZHAO Q,et al.A new approach for the immobilization of permeabilized brewer's yeast cells in a modified composite polyvinyl alcohol lens-shaped capsule containing montmorillonite and dimethyldioctadecylammonium bromide for use as a biocatalyst[J]. Process Biochem,2010,45(9):1445-1449.
[42]彭泓杨.固定化黑曲霉对废水中铅和铬的生物吸附[D].哈尔滨:东北农业大学,2014.
[43]张子儒,郑巧东,姚善泾.红曲霉菌微胶囊化培养[J].食品与发酵工业,2003,29(11):1-4.
[44]邢欢,许文宗,张志荣,等.绿色木霉对小球藻细胞壁的酶解作用[J].微生物学通报,2015,42(6):975-980.
[45]翁飞凤,李菲,李以名,等.红茶菌固定化发酵工艺的研究[J].嘉兴学院学报,2018,30(6):87-95.
[46]刘志强,赵军子,李珺,等.双菌共固定化耦合催化发酵生产红色染色剂的研究[J].发酵科技通讯,2014,43(3):30-33.
[47]SHARMA A,SATYANARAYANA T.Production of acid-stable and highmaltose-forming α-amylase of Bacillus acidicola by solid-state fermentation and immobilized cells and its applicability in baking[J]. Appl Biochem Biotechn,2012,168(5):1025-1034.
[48]DIMITROVSKI D,VELICKOVA E,LANGERHOLC T,et al.Apple juice as a medium for fermentation by the probiotic Lactobacillus plantarum PCS 26 strain[J].Ann Microbiol,2015,65(4):2161-2170.
[49]王建龙,陈灿.利用氧化石墨烯改性海藻酸钙制备固定化微生物的方法:CN201610092173.X[P].2016-06-08.
[50]史雁飞,闫凤翔,张泽锟,等.异常威克汉姆酵母Y-5固定化条件优化及对其酿酒过程的影响[J].食品工业科技,2019(12):45-50.
[51]GEDAM P S,RAUT A N,DHAMOLE P B.Enhanced butanol production using non-ionic surfactant-based extractive fermentation:effect of substrates and immobilization of cell[J]. Appl Biochem Biotechn,2019,189(4):1209-1222.
[52]LUTHFI A A I,TAN J P,NFAM I S A,et al.Multiple crystallization as a potential strategy for efficient recovery of succinic acid following fermentation with immobilized cells[J]. Bioproc Biosyst Eng,2020,43(7):1153-1169.
[53]YU B,ZHANG X,SUN W,et al.Continuous citric acid production in repeated-fed batch fermentation by Aspergillus niger immobilized on a new porous foam[J].J Biotechnol,2018,276:1-9.
[54]KUMAR D P,KHARMAWLONG G J,MOHOLKAR V S.Investigations in sonication-induced intensification of crude glycerol fermentation to dihydroxyacetone by free and immobilized, Gluconobacter oxydans[J].Bioresource Technol,2018,256:302-311.
[55]SAGˇIR E,YUCEL M,HALLENBECK P C.Demonstration and optimization of sequential microaerobic dark-and photo-fermentation biohydrogen production by immobilized Rhodobacter capsulatus JP91[J]. Bioresource Technol,2018,250:43-52.
[56]倪莉,周康熙,刘志彬,等.一种测定海藻酸钠微胶囊内菌量的方法:CN201910116324.4[P].2019-04-16.
[57]倪莉,周康熙,刘祖文,等.一种从海藻酸盐色素凝胶中提取色素的方法:CN201810564876.7[P].2019-11-12.