幽门螺杆菌(Helicobacter pylori,Hp)是唯一能栖息于人胃内的微生物,而Hp感染是诱发消化性溃疡、胃癌等的重要原因之一[1-2]。在中国,Hp感染的患病率很高(约60%),而Hp对抗生素的高耐药率导致抗生素和质子泵抑制剂对其治疗效果不佳[3]。
受传统习俗和文化的影响,在中国,饮酒是一种普遍行为。据2002年全国营养与健康调查结果显示,我国15岁以上居民男性饮酒比例为39.6%,女性为4.5%[4]。文献报道,白酒中富含生物活性成分,如酱香型白酒中已鉴定的生物活性成分有500多种[5]。研究表明,乙醇摄入与Hp感染具有一定的关系,而白酒含有的生物活性成分是否具有抑制Hp感染作用的相关报道很少[6],川芎嗪又称四甲基吡嗪,在酱香型白酒中广泛分布,主要具有杀菌抗癌、抗炎、改变微循环、制止血栓形成等功效[7-8]。而研究显示酱香型白酒中含有的风味物质中,吡嗪类化合物(pyrazines,PYRs)占有极大的比例[5]。因此,本实验利用反转录-聚合酶链式反应(reverse transcriptase polymerase chain reaction,RT-PCR)分析PYRs对Hp基因及相关毒力蛋白表达的影响,检测PYRs预处理Hp对胃黏膜上皮细胞(GES-1)活性、细胞凋亡的影响,对吡嗪类物质抗Hp活性及减轻Hp对胃黏膜上皮细胞的损伤活性进行研究,旨在揭示吡嗪类化合物抗幽门螺杆菌活性及机制。
1 材料与方法
1.1 材料与试剂
SydneyStrain 1(SS1)幽门螺杆菌(Helicobacter pylori)标准菌株:深圳大学医学院病原微生物系惠赠。胃上皮GES-1细胞株:美国ATCC公司;胎牛血清(fetalbovine serum,FBS):美国Hyclone公司;青-链霉素、RPMI 1640培养基:美国Hy-Clone公司;磷酸盐缓冲溶液(phosphate buffer saline,PBS):广州瑞舒生物科技有限公司;一氧化氮(NO)、前列腺素(prostaglandin,PG)E2、肿瘤坏死因子(tumornecrosisfactor-α,TNF-α)、白细胞介素(interleukin,IL)1β、白细胞介素-6(IL-6)、细胞计数试剂盒(cellcountingkit,CCK)-8、酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)等试剂盒:四正柏生物科技有限公司;Cag A和VacA抗体:美国Santa Cruz Biotechnology公司;哥伦比亚琼脂、布氏肉汤培养基:英国Oxoid公司。酱香型白酒(Moutai-flavourliquor,MTL):市售。酱香型白酒中生物活性成分(酱香型白酒中含有的非乙醇类化合物的总称)(BMC)、酱香型白酒中吡嗪类化合物(PYRs):阿拉丁试剂有限公司[5]。
1.2 仪器与设备
三菱C-31厌氧培养盒:日本三菱集团;DHP系列恒温培养箱:上海一恒科学仪器有限公司;ACB-4A1型超净化工作台:上海实验仪器厂;SW-CJ-IC型超净工作台:苏州安泰科技有限公司;INC108型CO2培养箱:德国Memmert公司;TECAN infinite M200型多功能酶标仪:瑞士Tecan Trading AG公司;2K15型低温高速离心机:美国Sigma公司;CFX96型PCR仪:美国Bio-Rad公司。
1.3 方法
1.3.1 PYRs细胞毒性检测
胃上皮GES-1细胞接种于96孔板中(5 000 cells/孔),分别加入质量浓度为3.12 mg/mL、0.625 mg/mL、0.125 mg/mL、0.025 mg/mL、0.005 mg/mL、0.001 mg/mL 的BMC、MLT 及PYRs溶液,培养24 h、48 h,CCK-8法检测细胞活力。
1.3.2 体外抑菌实验
将冻存的Hp复苏,接种于哥伦比亚琼脂固体培养基,置于37 ℃微需氧环境(体积分数为5%的O2,体积分数为10%的CO2,体积分数为85%的N2)中培养。72 h后转至布氏肉汤液体培养基,置于37 ℃微需氧环境,在100 r/min的摇床上振荡,扩大培养。取用Hp时,将培养3 d的Hp菌株挑起一部分,用无菌生理盐水洗下后,配成布氏肉汤菌悬液,再用标准比浊管比浊,校正菌液浓度,使其菌液浓度相当于1×108 CFU/mL[9]。
在37 ℃微需氧条件下培养72 h后PYRs对Hp的最低抑菌浓度(minimum inhibitory concentration,MIC)进行检测[10]。
1.3.3 RT-PCR检测Hp毒力基因表达的变化
溶解BMC、MTL及PYR-19(2,5-二甲基-3-正戊基吡嗪)于PBS至终质量浓度为0.125 mg/mL;将培养的Hp菌液用PBS重悬至1×107 CFU/mL,取含0.1 mL Hp的PBS混悬液加入配制好的BMC、MTL及PYRs溶液中,37 ℃振荡微氧孵育72 h,离心弃上清,用PBS冲洗3次后,使用核糖核酸(ribose nucleic acid,RNA)prep pure Cell/BMCteria Kit(TianGen公司,中国)分离总RNA。互补脱氧核糖核酸(complementary deoxyribonucleicacid,cDNA)的合成按试剂盒(SYBR@Prime ScriptTMRT-PCRKit)操作说明进行。引物如表1所示。
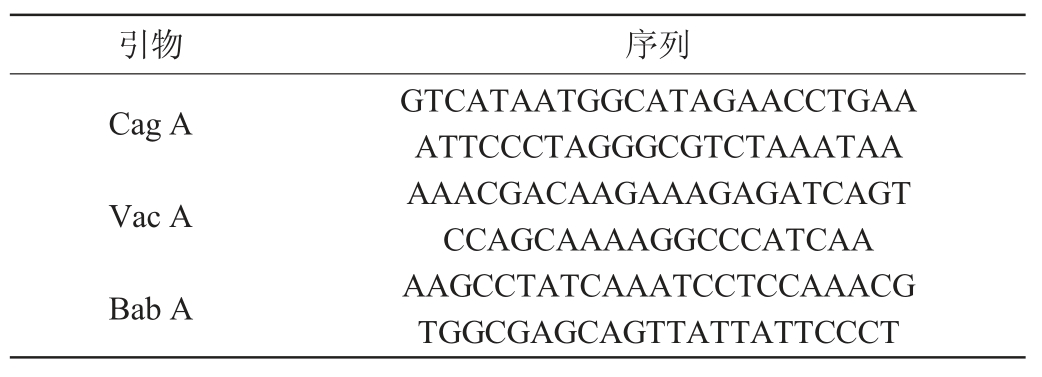
表1 幽门螺杆菌毒力基因(Cag A、Vac A和Bab A)的引物序列
Table 1 Primer sequences of virulence genes (Cag A, Vac A and Bab A) of Helicobacter pylori
1.3.4 Western blotting检测
用PBS作为溶剂溶解BMC、MTL及PYR-19至终浓度为0.125 mg/mL。将培养的Hp菌液用PBS重悬至1×107CFU/mL,取含0.1 mL Hp的PBS混悬液加入配制好的BMC、MTL及PYR-19溶液中,37 ℃振荡微氧孵育72 h,离心弃上清,用PBS冲洗3次后,按细菌蛋白提取试剂盒(Solarbio公司,中国)说明提取细菌总蛋白,Western blotting检测细胞毒素A(Cag A)和空泡毒素A(Vac A)的蛋白表达情况[11]。
1.3.5 细胞活性及凋亡的检测
用PBS作为溶剂溶解BMC、MTL及PYR-19至终浓度为0.125 mg/mL。将培养的Hp菌液用PBS重悬至1×107CFU/mL,取含0.1 mL Hp的PBS混悬液加入配制好的BMC、MTL及PYR-19溶液中,37 ℃振荡摇菌24 h。收集细菌,PBS洗2次,调节细菌终浓度为1×107 CFU/mL。1×105 cells/mL胃上皮GES-1细胞铺于6孔板中培养24h。设置空白对照组(Control);Hp损伤组(Hp);加入BMC处理的Hp为BMC组(BMC);加入MTL处理的Hp为MTL组(MTL);加入PYR-19处理的Hp为PYR-19组(PYR-19);使Hp与GES-1细胞比例为100∶1,GES-1细胞与Hp培养24 h后,收集细胞,PBS洗涤。
CCK-8试剂盒法检测GES-1细胞活性;收集包括上清液漂浮在内的全部细胞,1 000 r/min离心5 min,用预冷的PBS洗2次,按Annexin V-FITC/PI试剂盒使用说明流式细胞术检测细胞凋亡情况;ELISA试剂盒检测细胞中NO、PGE2、TNF-α、IL-1β及IL-6含量;Western blotting检测GES-1细胞i-NOS、COX-2的表达变化。
1.3.6 数据处理
所有数据采用GraphPad Prism 8软件进行统计。P<0.05定为具有显著性差异,结果均以Mean±SEM表示;对样本先进行方差齐性检验,方差齐时,用One-Way ANOVA检验,并进行组间的多重比较;方差不齐时,用非参数秩和检验,先用Kruskal-WallisHtest 比较总的差异,再用Mann-Whitney U 进行两组之间比较。
2 结果与分析
2.1 BMC对GES-1细胞的毒性作用
为避免BMC及PYRs对GES-1细胞的细胞毒性,采用CCK-8法检测了BMC、MTL及PYRs对GES-1细胞活性的影响。实验结果显示,与空白对照组(Control)相比,当BMC、MTL及PYRs质量浓度低于0.125 mg/mL时,细胞活性均无显著性差异(24,48 h,P>0.05),说明GES-1细胞未受到显著的损伤。
2.2 BMC抑制Hp增殖
由表2可知,BMC、MTL及PYRs具有一定的抑菌活性。其中,BMC、MTL、PYRs的抑菌90%细菌生长的最低浓度(90%minimal inhibitory concentration,MIC90)为592.7 μg/mL、655.9 μg/mL、(182.5~426.1)μg/mL,虽远高于阿莫西林及红霉素,但仍说明BMC、MTL及PYRs具有一定的抗Hp活性。吡嗪类化合物中,PYR-19(2,5-二甲基-3-正戊基吡嗪)抑制Hp增殖活性最强,其MIC90为182.5 μg/mL。
表2 吡嗪类化合物、生物活性成分和酱香型白酒体外抑菌活性
Table 2 In vitro antibacterial activity of pyrazines,bioactive components and Moutai-flavour liquor

PYR-19的抗Hp活性结果如图1所示。由图1可知,随着PYR-19质量浓度的增大及作用时间的延长,Hp的增殖能力被显著抑制。因此说明PYR-19对Hp的增殖抑制具有时间和剂量依赖性。
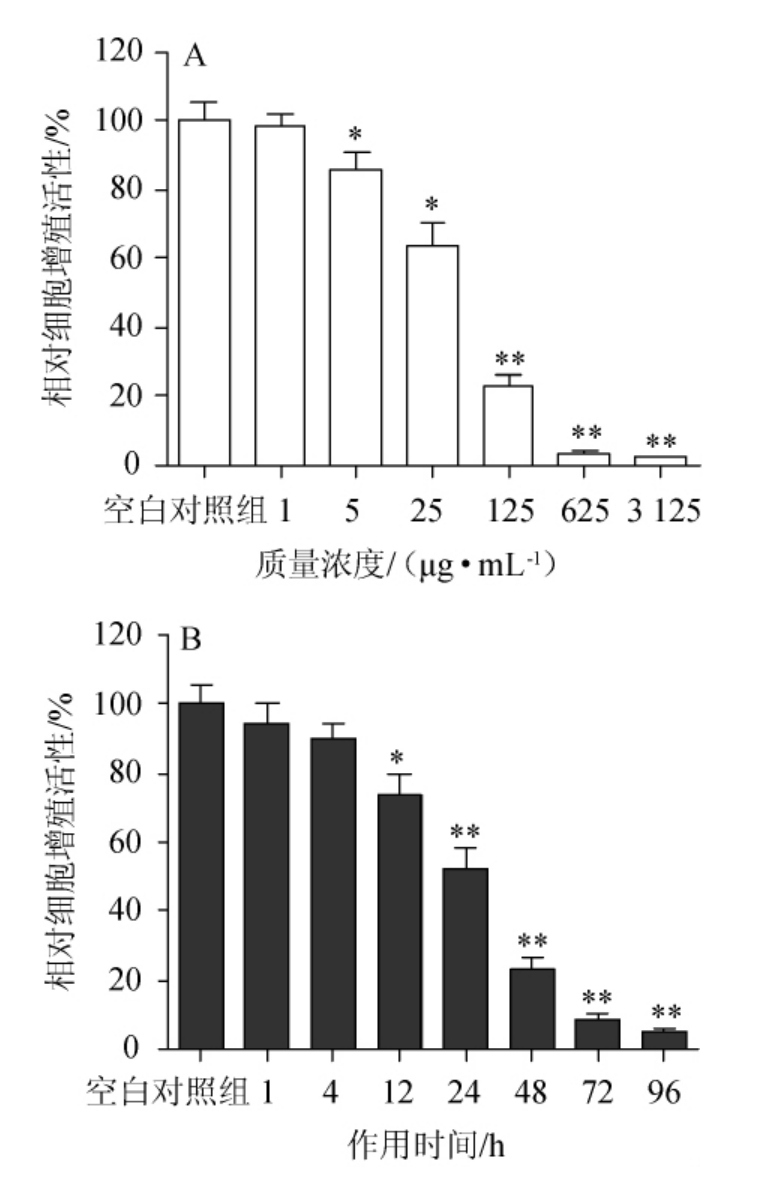
图1 吡嗪类化合物-19质量浓度(A)和作用时间(B)对抑制幽门螺杆菌增殖能力的影响
Fig.1 Effect of pyrazines-19 mass concentration (A) and reaction time(B) on inhibiting Helicobacter pylori proliferation
2.3 PYR-19降低Hp损伤GES-1细胞能力
PYR-19对Hp损伤GES-1细胞能力的影响结果如图2所示。由图2可知,与空白对照组相比,Hp组中细胞活力下降16.9%(P<0.05),说明Hp感染会损伤GES-1细胞,使细胞活力降低;PYR-19、BMC及MTL组中细胞活力比Hp组分别高8.48%(P<0.05)、6.81%(P<0.05)、3.85%,说明BMC、MTL及PYR-19处理Hp能够降低其对GES-1细胞的损伤能力。
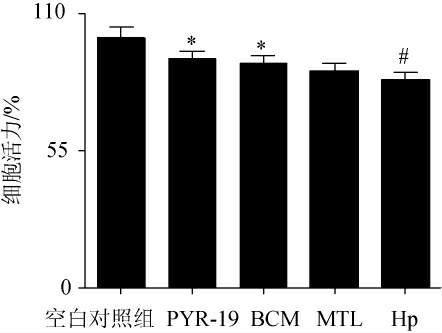
图2 BMC、MTL、吡嗪类化合物-19对幽门螺杆菌损伤GES-1细胞能力的影响
Fig.2 Effect of BMC,MTL and pyrazines-19 on the ability of Helicobacter pylori to damage GES-1 cells
PYR-19抑制Hp诱导GES-1细胞凋亡能力结果如图3所示。由图3可知,与空白对照组(2.96±0.31)%相比,Hp组中GES-1细胞总凋亡率增加18.4%(P<0.05),说明Hp感染会损伤GES-1细胞进而导致细胞凋亡增加。而PYR-19、BMC及MTL组中GES-1细胞凋亡率比Hp低11.6%(P<0.05)、10.4%(P<0.05)、4.80%(P<0.05),说明BMC、PYR-19及MTL能够显著降低Hp对GES-1细胞的损伤,使Hp诱导的GES-1细胞凋亡被抑制。
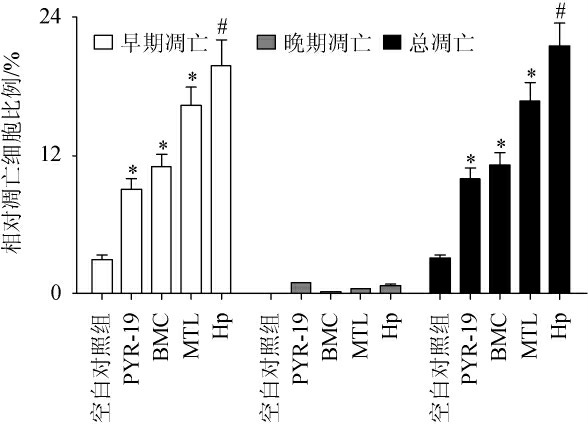
图3 BMC、MTL、吡嗪类化合物-19对幽门螺杆菌诱导GES-1细胞凋亡能力的影响
Fig.3 Effect of BMC,MTL and pyrazines-19 on GES-1 cells apoptosis induced by Helicobacter pylori
2.4 PYR-19抑制Hp对GES-1细胞的炎性损伤能力
研究报道,Hp感染会损伤胃黏膜细胞,诱发炎性细胞因子分泌[12]。而炎性细胞因子(如IL-1β、TNF-α和IL-6)的分泌与病毒、细菌及环境刺激因子暴露有着密切的关系。过量的炎性细胞因子分泌与诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)介导的NO生成与Hp感染诱发的胃肠道上皮细胞损伤具有密切的关系[13]。因此采用ELISA试剂盒检测方法检测培养基中炎性细胞因子(TNF-α、IL-6、IL-1β)的含量以评价PYR-19抑制Hp对GES-1细胞的损伤能力。
由图4A~图4C可知,与空白对照组相比,Hp显著诱导GES-1细胞IL-6、TNF-α和IL-1β的分泌,使GES-1细胞IL-6、TNF-α和IL-1β分泌增加832%(P<0.05)、1 730%(P<0.01)及801%(P<0.01);诱发细胞炎症反应,使炎性细胞因子分泌显著增加。BMC预处理后,与Hp组相比,IL-6、TNF-α和IL-1β分泌减少41.4%(P<0.05),60.7%(P<0.05),42.5%(P<0.05);PYR-19预处理后,与Hp组相比,IL-6、TNF-α和IL-1β分泌减少45.1%(P<0.05),62.6%(P<0.05),46.7%(P<0.05);说明PYR-19能够抑制Hp对GES-1细胞的炎性损伤能力。类似的,MTL处理对Hp显著诱导GES-1细胞IL-6、TNF-α和IL-1β的分泌也有一定的抑制作用,但抑制能力低于PYR-19及BMC。

图4 BMC、MTL、吡嗪类化合物-19对幽门螺杆菌抑制GES-1细胞炎症细胞因子分泌及蛋白表达的影响
Fig.4 Effect of BMC,MTL and pyrazines-19 on inhibiting inflammatory cytokines secretion and protein expression of GES-1 cells by Helicobacter pylori
A,PYR-19对Hp诱导的IL-6分泌的影响;B,PYR-19对Hp诱导的TNF-α分泌的影响;C,PYR-19对Hp诱导的IL-1β分泌的影响;D,PYR-19对Hp诱导的NO及PGE2分泌的影响;E、F,PYR-19对Hp诱导的iNOS及COX-2表达的影响及量化
炎症是由多种分子机制介导的复杂过程,其中包括诱导型一氧化氮合酶(iNOS)和环氧化酶-2(cyclooxygenase-2,COX-2)这两个重要分子以及它们所生成的一氧化氮(NO)和前列腺素E2(prostaglandin2,PGE2)的参与[14-15]。由图4D可知,Hp显著诱导了GES-1细胞NO和PGE2分泌。与Control组比,Hp组NO和PGE2分泌别增加983%(P<0.01)及782%(P<0.01)。与Hp组相比,BMC组NO和PGE2分泌减少50.2%(P<0.05)、42.5%(P<0.05);PYR-19组NO和PGE2分泌分别减少60.8%(P<0.05)、64.9%(P<0.05);说明BMC、PYR-19预处理可降低Hp对GES-1细胞的炎症损伤能力。类似的(图4E,F),与Hp显著诱导GES-1细胞iNOS、COX-2表达不同,BMC、PRY-19显著抑制了Hp对GES-1细胞诱导iNOS、COX-2表达能力。MTL处理对Hp显著诱导Hp对GES-1细胞诱导iNOS、COX-2表达也有一定的抑制作用,但抑制能力低于PYR-19及BMC。
2.5 PYR-19抑制Hp毒力基因及蛋白的表达
Bab A是Hp外膜蛋白基因,Bab A蛋白可特异性结合宿主细胞受体,赋予Hp持久定植能力[16];高毒力的Hp菌株多具有细胞毒素相关基因(Cag A),Cag A蛋白可参与转运及宿主炎症反应[17];空泡细胞毒素A(Vac A)能够破坏宿主细胞内吞作用、抑制免疫细胞导致免疫耐受和慢性感染等[18]。通过检测Hp Bab A、Cag A及Vac A基因转录及蛋白表达以评价BMC预处理对抑制作用。
RT-PCR检测PYR-19预处理对Hp膜蛋白基因Bab A、细胞毒素基因A(Cag A)和空泡毒素基因A(Vac A)基因转录的影响,结果如图5A所示,BMC、MTL及PYR-19预处理能够抑制Hp中Bab A、Cag A及Vac A的转录。其中,PYR-19及BMC预处理对Bab A、Cag A及Vac A基因的抑制作用高于MTL组。相比于Hp未处理组,PYR-19预处理后,Bab A、Cag A及Vac A基因转录下降73.2%(P<0.01)、48.3%(P<0.05)、73.8%(P<0.01);而BMC组,Bab A、Cag A及Vac A基因表达下降66.7%(P<0.05)、30.8%(P<0.05)、65.8%(P<0.05)。因此推测BMC、PYR-19预处理可通过抑制Hp Bab A、Cag A及Vac A基因的转录,进一步抑制Bab A、Cag A及Vac A编码蛋白表达,从而抑制Hp对宿主细胞的黏附,减少其诱发炎症反应导致的宿主细胞损伤,减少Hp对GSE-1细胞的损伤能力[19-20]。
Western Blotting进一步分析PYR-19预处理对Hp Cag A和Vac A蛋白表达的影响,结果如图5B所示。与RT-PCR结果(图5A)类似,BMC、PYR-19预处理能够显著降低Hp中Cag A和Vac A的表达。说明BMC、PYR-19预处理可通过抑制Hp中相关毒力基因的转录及表达发挥抑制Hp对GES-1细胞的损伤活性。
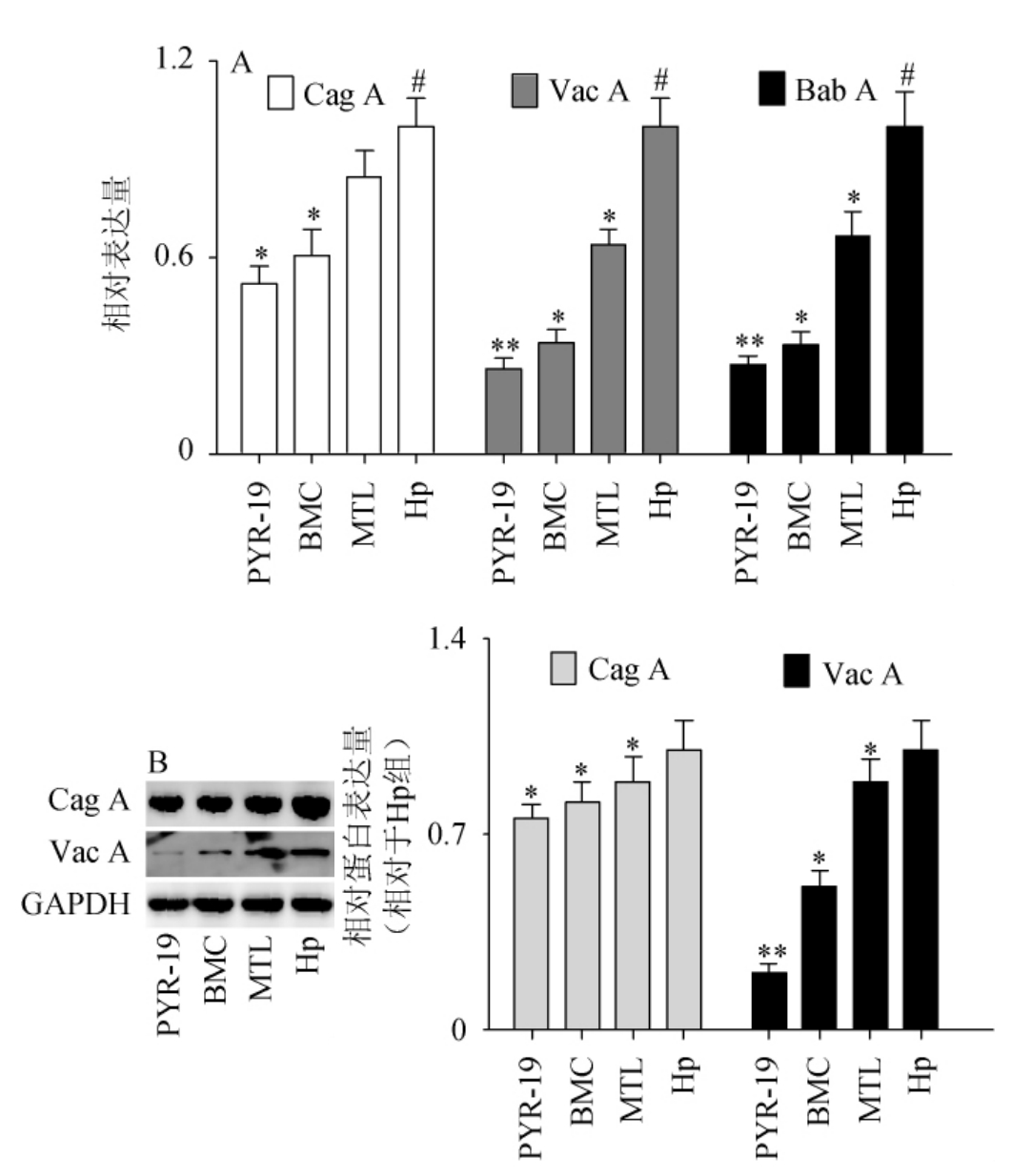
图5 吡嗪类化合物-19抑制幽门螺杆菌毒力基因转录及毒力蛋白表达
Fig.5 Pyrazines-19 inhibiting virulence gene transcription of virulence protein expression of Helicobacter pylori
3 结论
研究发现Hp感染会损伤GES-1细胞,诱导GES-1细胞凋亡;Hp 感染GES-1 细胞会诱发细胞炎性细胞因子(IL-1β、TNF-α和IL-6)分泌。此外,Hp感染也会诱导GES-1细胞NO、PGE2分泌,过量细胞炎性细胞因子分泌会进一步损伤GES-1细胞,使细胞凋亡增加。PYR-19处理Hp后,GES-1细胞炎性细胞因子及NO、PGE2分泌显著减少,iNOS、COX-2表达减少,说明BMC、PYR-19处理抑制了Hp诱导GES-1细胞炎性损伤的能力。
在Hp感染小鼠的动物模型中,Cag A、Vac A阳性Hp菌株感染的胃黏膜炎症反应更显著,凋亡细胞数更多,提示Cag A、Vac A的表达对Hp损伤宿主细胞具有重要的作用。本实验发现酱香型白酒中的生物活性物质及吡嗪类物质可抑制Hp相关毒力基因Bab A、Vac A和Cag A的转录及Vac A、Cag A蛋白的表达,从而降低Hp诱导GES-1细胞炎性因子分泌,进而减少GES-1细胞凋亡。
[1]CONTEDUCA V,SANSONNO D,LAULETTA G,et al.H.pylori infection and gastric cancer:state of the art (review)[J].Int J Oncol,2013,42(1):5-18.
[2]GRAHAM D Y.Helicobacter pylori:its epidemiology and its role in duodenal ulcer disease[J].J Gastroen Hepat,2010,6(2):105-113.
[3]MEGRAUD F.Resistance of Helicobacter pylori to antibiotics:the main limitation of current proton-pump inhibitor triple therapy[J].Eur J Gastroen Hepat,1999,11 Suppl 2:35-43.
[4]马冠生,朱丹红,胡小琪,等.中国居民饮酒行为现况[J].营养学报,2005,27(5):362-365.
[5]ZHU S,LU X,JI K,et al.Characterization of flavor compounds in Chinese liquor Moutai by comprehensive two-dimensional gas chromatography/timeof-flight mass spectrometry[J].Anal Chim Acta,2007,597(2):340-348.
[6]QUEIROZ D,ROCHA G A,ROCHA A,et al.Role of host additive factors in the immune response to H.pylori infection[J].Gut,2002,51:34.
[7]刘亚杰.川芎嗪衍生物的合成及其抗菌活性的研究,广东药科大学.
[8]程先超,刘新泳,徐文方.川芎嗪心脑血管药理学研究进展[J].中国医院药学杂志,2005,25(7):661-663.
[9]聂佳莹,唐磊,杨致邦,等.中药体外抗幽门螺杆菌试验方法研究[J].中国病原生物学杂志,2013,8(3):255-257.
[10]刘宇.荆花胃康胶丸及其拆方抗耐药幽门螺杆菌作用和机制研究[D].北京:北京中医药大学,2014.
[11]王晓刚,孟翔凌,徐阿曼,等.The incident of Helicobacter pylori infection in patients with pigmented biliary calculus[J].中华消化杂志,2007,27(6):397-399.
[12]孙燕,刘南植,赖远全,等.幽门螺杆菌相关胃炎中细胞因子分泌与Fas 抗原的原位关系研究[J].临床内科杂志,2004,21(3):177-179.
[13]TIAN S F,CAI R D,CHU Y Z,et al. In vitro study on bacterial growth enhancement in the presence of TNF-α,IL-1β and IL-6[J].Chinese Journal of Infection and Chemotherapy,2007,7(5):344-347.
[14]HAN M,WEN J K,ZHENG B,et al.Acetylbritannilatone suppresses NO and PGE2 synthesis in RAW 264.7 macrophages through the inhibition of iNOS and COX-2 gene expression[J].Life Sci,2004,75(6):675-684.
[15]赵恒光,罗福玲.Effects of tetrandrine on COX-2/PGE2,iNOS/NO expression in UPS-stimulated RAW264.7 cells[J].中国药科大学学报,2011,42(2):141-144.
[16]ANSARI S,YAMAOKA Y. Helicobacter pylori BabA in adaptation for gastric colonization[J].World J Gastroenterol,2017(23):4158-4169.
[17]CENDRON L,COUTURIER M,ANGELINI A,et al.The Helicobacter pylori CagD(HP0545,Cag24)protein is essential for CagA translocation and maximal induction of interleukin-8 secretion[J].J Mol Biol,2009,386(1):204-217.
[18]TABEL G,HOA N T,TARNAWSKI A,et al. Helicobacter pylori infection inhibits healing of the wounded duodenal epithelium in vitro[J].J Lab Clin Med,2003,142(6):421-430.
[19]LIN J,HUANG W W.A systematic review of treating Helicobacter pylori infection with traditional Chinese medicine[J].World J Gastroenterol,2009(37):4715-471.
[20]徐顺福,施瑞华,苗毅.幽门螺杆菌CagA 及其致病机理的研究进展[J].胃肠病学和肝病学杂志,2006(6):621-623.