维生素E又名生育酚,是人体必需的一种脂溶性维生素。根据生育酚色环上的甲基数目及位置的不同,可分为α-生育酚(α-tocopherol,α-T)、β-生育酚(β-tocopherol,β-T)、γ-生育酚(γ-tocopherol,γ-T)、δ-生育酚(δ-tocopherol,δ-T)以及不饱和形式的α-生育三烯酚(α-tocotrienol,α-T3)、β-生育三烯酚(β-tocotrienol,β-T3)、γ-生育三烯酚(γ-tocotrienol,γ-T3)、δ-生育三烯酚(δ-tocotrienol,δ-T3)[1-2]。生育酚异构体对人体具有重要的生理作用,如能够阻断自由基链式反应、降低低密度胆固醇生物合成等[3-5]。针对常见的油料种子,如花生、油菜籽、芝麻、大豆等,有必要明确此类油料种子中生育酚异构体的种类及含量,对其进一步的利用具有重要意义。
目前,生育酚的检测方法主要有高效液相色谱(high performance liquid chromatography,HPLC)法[6-9]、高效液相色谱-质谱联用(high performance liquid chromatography-mass spectrometry,HPLC-MS)法[10]、气相色谱(gaschromatography,GC)法[11]、毛细管电泳法等[12],但对8种生育酚异构体同时检测的方法鲜有报道。毛细管电泳法灵敏度较低,且对脂溶性成分的分离难度大。高效液相色谱法与气相色谱法比较,前处理过程相对简单,更适用于生育酚的检测,但要达到8种生育酚异构体的同时分离检测,对分离手段有着更高的要求。
加速溶剂萃取(accelerated solvent extraction,ASE)是一种新的萃取技术[13],它能在高温高压条件下使样品与液态溶剂充分接触,从而能够快速和高效萃取样品基质中的分析物。ASE法自动化程度高,全程避光且与氧气接触少,很好的避免了试验过程中生育酚异构体的氧化分解,而且耗时短,有机试剂消耗少,是对油料作物样品理想的前处理方法。本研究采用ASE技术对油料种子样品中的8种生育酚异构体进行提取,选用亲水液相色谱(hydrophilic liquid chromatography,HILIC)技术[14-15],并联用灵敏度与选择性较高的荧光检测器,对8种生育酚及异构体进行分离检测,为8种生育酚异构体的定性与定量检测提供一种高效可行的色谱检测方法。
1 材料与方法
1.1 材料与试剂
α-生育酚(纯度99.2%)、β-生育酚(纯度99.4%)、γ-生育酚(纯度99.2%)、δ-生育酚(纯度99.6%)、α-生育三烯酚(纯度99.0%)、β-生育三烯酚(纯度99.6%)、γ-生育三烯酚(纯度99.0%)、δ-生育三烯酚(纯度99.0%)标准品:德国Dr.Ehrenstorfer GmbH公司;正己烷、叔丁基甲基醚、四氢呋喃、甲醇(均为色谱纯):国药集团化学试剂有限公司;花生、油菜籽、芝麻、大豆等油料种子样品:市售。
1.2 仪器与设备
1120型加速溶剂萃取仪:中国北京吉天公司;Agilent 1200高效液相色谱仪:美国安捷伦公司;Sunfire硅胶柱(2.1 mm×100 mm,5 μm):艾杰尔飞诺美公司;BEH Amide HILIC色谱柱(2.1 mm×100 mm,3 μm):日本岛津有限公司;BUCHI 旋蒸仪:瑞士BUCHI公司。
1.3 实验方法
1.3.1 样品前处理
准确称取2 g油料种子,2 g硅藻土,混匀后装入萃取池中。选择正己烷为萃取剂,萃取温度110 ℃,压强10.0 MPa,静态提取180 s,循环3次。将收集到的提取液转移至旋蒸瓶旋蒸至干,采用流动相定容至2.0 mL,0.22 μm滤膜过滤后分析。
1.3.2 仪器条件
色谱条件:BEH Amide HILIC色谱柱(2.1 mm×100 mm,5 μm);流动相:90%正己烷/10%叔丁基甲基醚-四氢呋喃-甲醇(20∶1∶0.1,V/V);流速:1.0mL/min;进样量10μL,柱温30℃。
荧光检测器参数:激发波长294 nm,发射波长328 nm。
1.3.3 色谱条件的优化
用于亲水交互作用色谱的色谱柱固定相一般为极性,这样易吸附样品溶液中的极性分子,促进目标物从流动相中分配至固定相表面上的极性液层。参考相关文献[16-18],本试验考察了Sunfire硅胶柱、BEH Amide HILIC色谱柱两种色谱柱对生育酚异构体分离效果的影响。
1.3.4 加速溶剂萃取条件的优化
影响ASE提取效果的因素一般有萃取剂、萃取温度、静态萃取时间[19-21],因此,本试验分别考察萃取剂(石油醚、乙醚、正己烷、正己烷-乙醚(1∶1,V/V)、正己烷-石油醚(1∶1,V/V))、萃取温度(90 ℃、100 ℃、110 ℃、120 ℃、130 ℃)、静态萃取时间(60 s、120 s、180 s、240 s、300 s)对萃取后各组分回收率的影响。试验选择大豆种子作为样品基质,添加1.0 mg/kg加标浓度,分别通过改变上述条件后测定的结果计算各组分的回收率。
1.3.5 方法学验证
取各标准物质10.0 mg,用乙醇定容至10 mL,按照GB 5009.82—2016《食品安全国家标准食品中维生素A、D、E的测定》校准储备液浓度。按需求转移一定量的储备液至进样瓶,40 ℃氮吹干后用流动相稀释成混合标准溶液系列,4种生育酚质量浓度均为0.5 μg/mL、1.0 μg/mL、5.0 μg/mL、10.0 μg/mL、20.0 μg/mL、40.0 μg/mL、80.0 μg/mL,4种生育三烯酚质量浓度均为0.5 μg/mL、1.0 μg/mL、2.0 μg/mL、4.0 μg/mL、8.0 μg/mL、15.0 μg/mL、30.0 μg/mL。在优化好的色谱条件下,进行标准曲线的制作。并选择大豆种子作为样品基质,分别添加0.3 mg/kg、1.0 mg/kg和3.0 mg/kg的生育酚异构体混合标准溶液进行加标回收实验。
2 结果与分析
2.1 色谱条件的优化
为了更好地与ASE方法衔接,本试验选用了正相色谱法来分离检测8种生育酚异构体。硅胶柱是正相色谱分离生育酚异构体的常用柱,而本试验首次将BEH Amide HILIC色谱柱应用于正相色谱系统中生育酚异构体的分离检测,并与硅胶柱的分离效果进行对比,结果见图1。
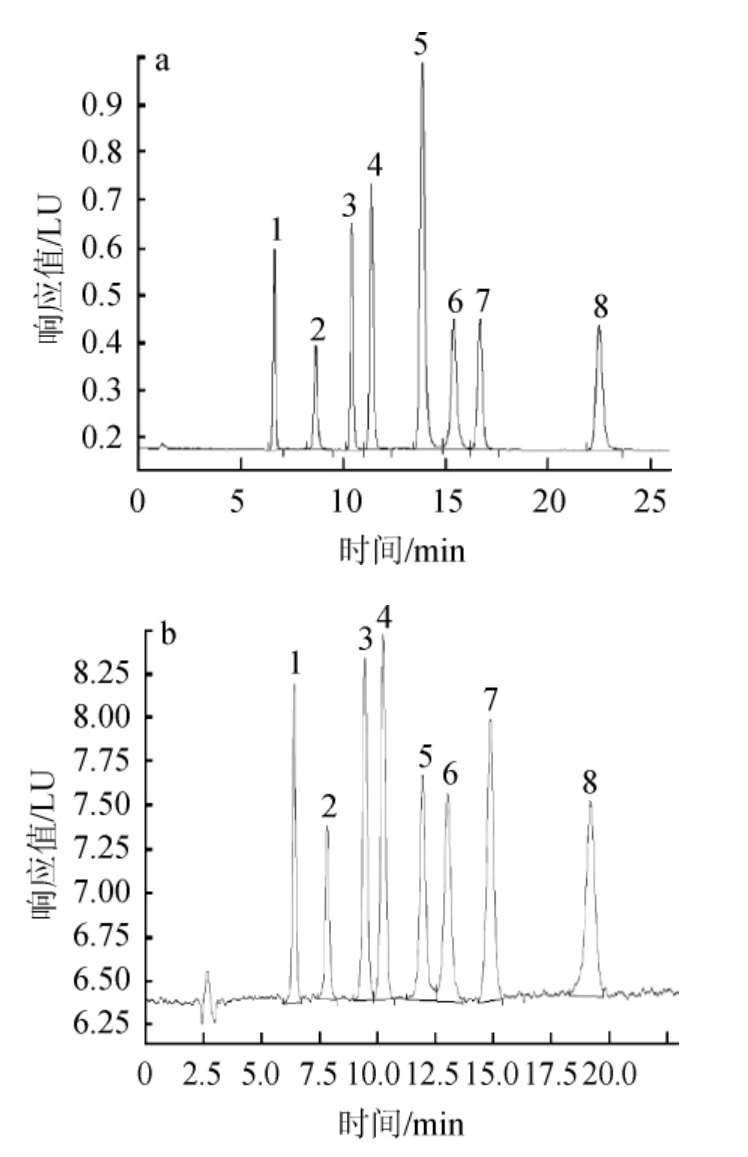
图1 BEH Amide HILIC色谱柱(a)及Sunfire硅胶柱(b)分离生育酚异构体混合标准溶液色谱图
Fig.1 Chromatogram of mixed standard solution of tocopherol isomer separated by BEH Amide HILIC column (a) and Sunfire silicagel column (b)
色谱峰1~8分别为α-T、α-T3、β-T、γ-T、β-T3、γ-T3、δ-T、δ-T3。
由图1可知,使用BEH Amide HILIC色谱柱较硅胶柱分离出的8种目标峰的分离度更好,峰形更对称,保留时间也更稳定,因此,本方法选用BEH Amide HILIC色谱柱作为色谱分离柱。
2.2 加速溶剂萃取条件的优化
2.2.1 萃取剂对目标物回收率的影响
维生素E族为脂溶性维生素,易溶于有机溶剂而不易溶于水溶液,因此本实验选取了石油醚、乙醚、正己烷、正己烷-乙醚(1∶1,V/V)、正己烷-石油醚(1∶1,V/V)作为萃取剂进行比较,在萃取温度110 ℃,静态萃取120 s时间,计算各组分的加标回收率,结果见图2。
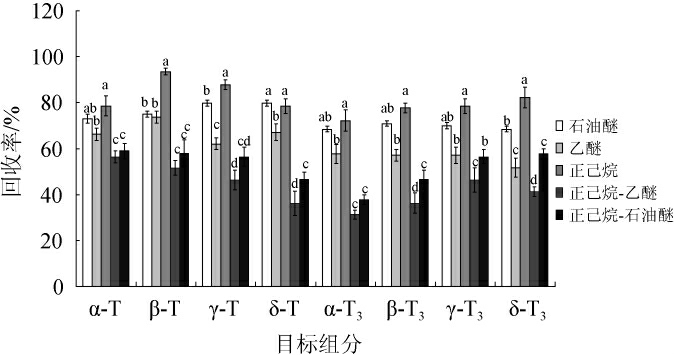
图2 不同萃取剂对目标物回收率的影响
Fig.2 Effect of different extractants on the recovery of target compounds
由图2可知,采用正己烷萃取时,8个目标组分的回收率最高,石油醚次之,正己烷-乙醚以及正己烷-石油醚混合溶剂的萃取效果较差,且不同类型萃取剂间目标组分的回收率差异显著(P<0.05),因此,选择正己烷作为最佳ASE溶剂。
2.2.2 萃取温度对目标物回收率的影响
萃取温度是加速溶剂萃取的重要参数。高温有利于萃取效率的提高,温度增加,溶剂黏度降低,溶剂对基质的浸润能力增强,溶剂对分析物质的溶解能力增大。而且高温能够加速分析组分向基质表面扩散,萃取效率从而得到提高。本试验以正己烷为ASE溶剂,分别在萃取温度90 ℃、100 ℃、110 ℃、120 ℃、130 ℃条件下,静态萃取120 s,考察萃取温度对各种组分回收率的影响,结果见图3。
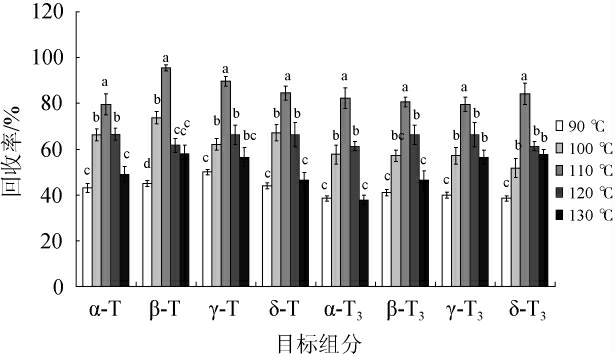
图3 不同萃取温度对目标物回收率的影响
Fig.3 Effect of different extraction temperature on the recovery of target compounds
由图3可知,当萃取温度低于110 ℃时,各组分的提取量随着温度的升高而增加;当萃取温度为110 ℃时,各组分的回收率最高,都能达到80%以上,且不同萃取温度间目标组分的回收率差异显著(P<0.05);当继续提高萃取温度,各组分的回收率开始下降。造成此现象的原因可能是由于温度过高,热溶剂的蒸发导致提取量的降低。综合考虑,选择110 ℃作为最佳ASE温度。
2.2.3 萃取时间对目标物回收率的影响
萃取时间的长短与样品中待提取成分在溶剂中的扩散程度有关,增加萃取时间有利于待萃取物质从样品基质扩散到萃取溶剂中。本试验以正己烷为ASE溶剂,萃取温度为110 ℃,分别静态萃取60 s、120 s、180 s、240 s、300 s,考察萃取时间对各种组分回收率的影响,结果见图4。
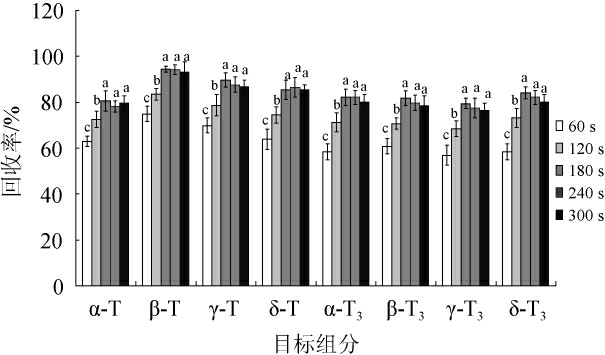
图4 不同萃取时间对目标物回收率的影响
Fig.4 Effect of different extraction time on the recovery of target compounds
由图4可知,在萃取时间在60~180 s范围内,随着萃取时间的延长,各组分的提取量呈现增加的趋势;萃取时间达到180 s时,各组分的回收率最高;继续延长时间,各组分的提取量基本不变,回收率差异不显著(P<0.05)。综合考虑,选择180 s作为最佳ASE时间。
2.3 方法学验证
2.3.1 标准曲线的制作
将8种生育酚异构体系列标准工作液(4种生育酚质量浓度0.5~80.0 μg/mL,4种生育三烯酚质量浓度0.5~30.0 μg/mL)按上述优化后的仪器条件进行测定,绘制目标物质量浓度(X)与峰面积(Y)的标准曲线,进行线性回归分析。依据色谱峰信噪比的3倍确定检出限(limit of detection,LOD),信噪比的10倍确定定量限(limitof quantitative,LOQ)。8种目标化合物的保留时间、线性回归方程、相关系数R2、检测限及定量限见表1。
表1 8种目标物的保留时间、线性回归方程、相关系数、检出限与定量限
Table 1 Retention time,linear regression equation,correlation coefficient,detection limit and quantitation limit of eight targets
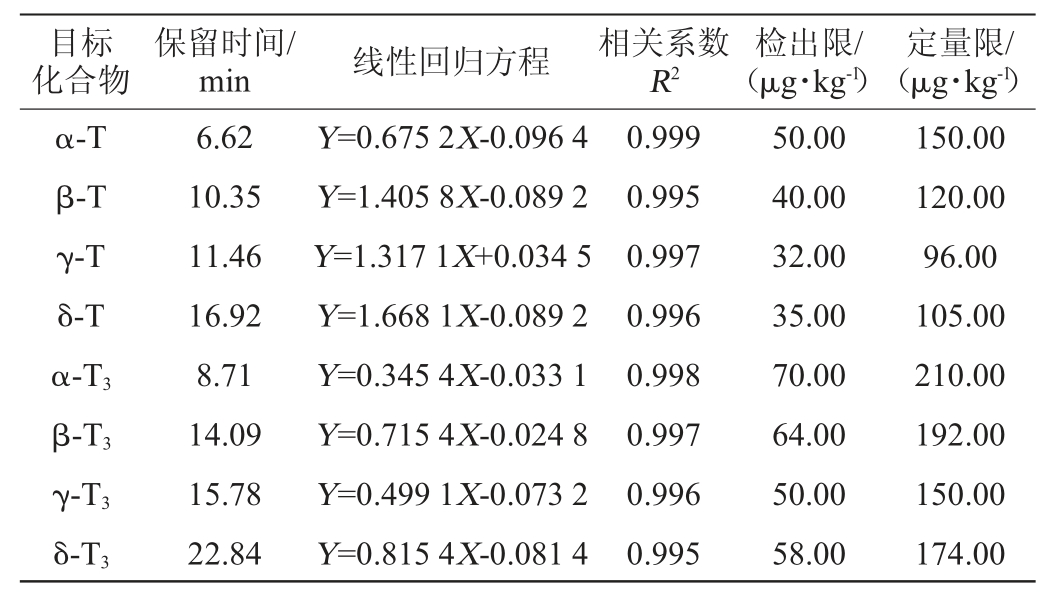
由表1可知,8种目标物回归方程的线性关系良好,相关系数R2在0.995~0.999之间,方法的检出限为32~70 μg/kg,定量限为96~210 μg/kg。
2.3.2 加标回收实验
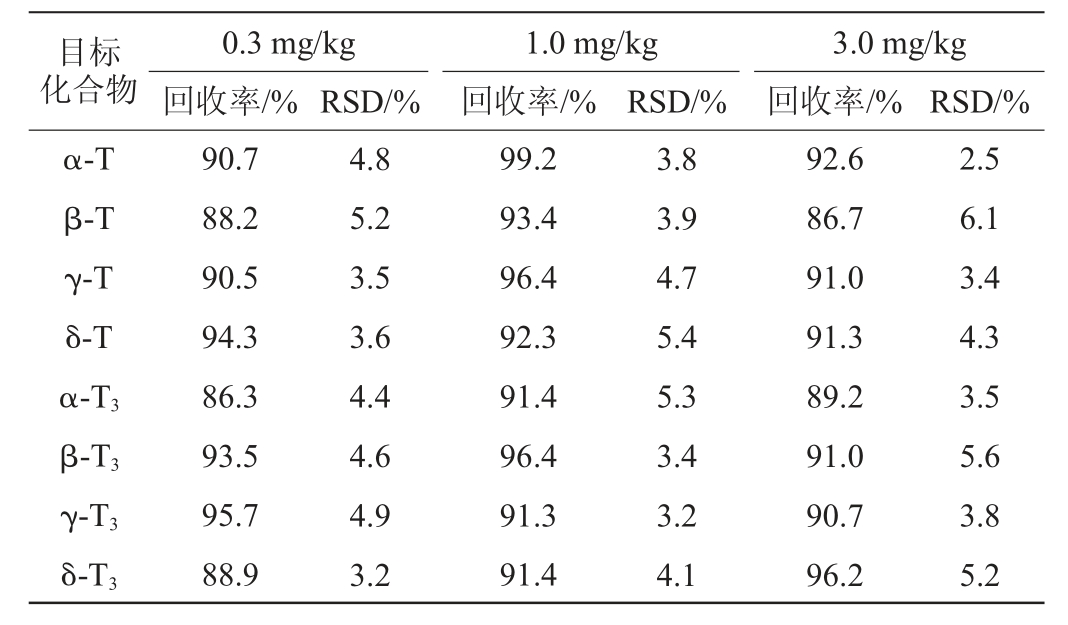
在已知生育酚异构体含量的大豆种子样品中添加0.3 mg/kg、1.0 mg/kg和3.0 mg/kg的生育酚异构体混合标准溶液,于暗处放置30 min,按上述所建立的方法进行样品的前处理和测定,计算加标回收率,结果见表2。由表2可知,各生育酚异构体的加标回收率在86.3%~99.2%之间,相对标准偏差(relative standard deviation,RSD)(n=5)在2.5%~6.1%之间,表明该方法准确度良好。
表2 方法的回收率试验结果
Table 2 Results of recoveries rate tests of the method
2.4 实际样品的检测
在优化的试验条件下,对花生、油菜籽、芝麻、大豆共4种样品中的生育酚异构体含量进行分析,采用保留时间定性,外标法定量,结果见表3。
表3 样品中生育酚及异构体含量的测定结果
Table 3 Determination results of tocopherol and isomer contents in the samples
mg/kg

由表3可知,油料种子中皆富含多种生育酚异构体,但各生育酚异构体的含量分布差异较大。在所检测的样品中,花生具有最大的α-生育酚含量,大豆中同时存在8种生育酚异构体,芝麻中生育酚异构体总量较低且异构体种类相对其他样品少。样品中生育酚异构体的分离状况见图5。结果表明,在本试验设定条件下样品及标准样品均能得到较好分离。
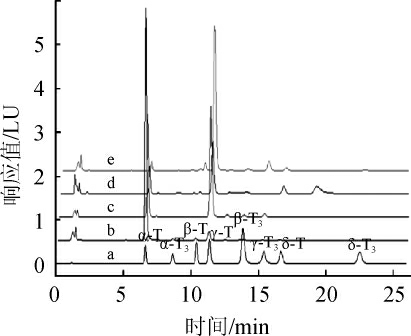
图5 不同批次样品中生育酚及异构体色谱图
Fig.5 Chromatogram of tocopherol and isomer in different batches of samples
a.混合标准溶液;b.花生;c.芝麻;d.油菜籽;e大豆。
3 结论
本试验建立了加速溶剂萃取结合亲水交互作用色谱法同时测定油料种子中8种生育酚异构体含量的方法。样品在110 ℃条件下经正己烷萃取180 s后,采用90%正己烷/10%叔丁基甲基醚-四氢呋喃-甲醇(20∶1∶0.1,V/V)流动相体系,经BEH Amide HILIC色谱柱分离,由荧光检测器外标法定量。4种生育酚在0.5~80.0 μg/mL、4种生育三烯酚在0.5~30.0 μg/mL质量浓度范围内线性关系良好,相关系数R2为0.9995~0.999,检出限为32~70 μg/kg,定量限为96~210μg/kg。加标回收率为86.3%~99.2%,RSD为2.5%~6.1%,该方法具有操作简单、灵敏度高、回收率和重现性好,结果准确可靠的特点,为进一步研究天然食物中脂溶性维生素异构体的分布提供了一种简单、快速的研究方法。
[1]吴轲,孙涵潇,祝捷,等.常见食用植物油中维生素E 异构体含量调查研究[J].中国油脂,2019,44(10):95-99.
[2]SHAHIDI F,DE CAMARGO A C.Tocopherols and tocotrienols in common and emerging dietary sources:occurrence,applications,and health benefits[J].Int J Mol Sci,2016,17(10):1745-1773.
[3]DAS GUPTA S,PATEL M,WAHLER J,et al.Differential gene regulation and tumor inhibitory activities of alpha-,delta-,and gamma-tocopherols in estrogen-mediated mammary carcinogenesis[J].Cancer Prev Res,2017,10(12):694-703.
[4]COOK-MILLS J M.Maternal influences over offspring allergic responses[J].Curr Allergy Asthma Rep,2015,15(2):501-518.
[5]温运启,刘玉兰,王璐阳,等.不同食用植物油中维生素E 组分及含量研究[J].中国油脂,2017,42(3):35-39.
[6]顾强,石晶,袁大炜,等.常见植物油中8 种生育酚和生育三烯酚含量分析[J].食品工业,2017(2):304-307.
[7]郑熠斌,黄百芬,任一平.正相高效液相色谱法测定食物中8 种维生素E 异构体及维生素A[J].色谱,2016,34(7):692-696.
[8]苏琨,石松利,郑东华,等.HPLC 测定蒙古扁桃种仁中α-维生素E 的含量[J].中国实验方剂学杂志,2013,19(12):70-72.
[9]陈燕舞,吴佳文.高效液相色谱法测定植物油中维生素E 的样品前处理方法比较[J].理化检验(化学分册),2016,52(8):928-931.
[10]冯鑫,别玮,郝欣,等.超临界色谱串联质谱法测定橄榄油中维生素E含量的研究[J].食品安全质量检测学报,2015,6(11):4341-4347.
[11]沈伟健,王红,陆慧媛,等.气相色谱-质谱法测定植物油中8 种维生素E 及其在芝麻油真伪鉴别方面的应用[J].色谱,2020,38(5):595-599.
[12]STONE C A,MCEVOY C T,ASCHNER J L,et al.Update on vitamin E and its potential role in preventing or treating bronchopulmonary dysplasia[J].Neonatology,2018,113(4):366-378.
[13]沈爱金,郭志谋,梁鑫淼.亲水作用色谱固定相的发展及应用[J].化学进展,2014,26(1):10-18.
[14]蒲江华,赵峡,韩文伟,等.亲水作用色谱在糖类化合物分析中的应用[J].分析测试学报,2017,12(3):33-36.
[15]PEREIRA H A,KASUS-JACOBI A,GRIFFITH G L.Peptide compounds and methods of production and use thereof:US,9624283[P].2017-04-18.
[16]ARROYO-MANZANARESN,GÁMIZ-GRACIAL,GARCÍACAMPANˇAA M.Alternative sample treatments for the determination of sulfonamides in milk by HPLC with fluorescence detection[J].Food Chem,2014,143:459-464.
[17]刘玉兰,王莹辉,张振山,等.4 种油脂煎炸过程中维生素E 组分含量变化的研究[J].中国油脂,2015,40(12):48-2.
[18]KUMAR P,RBIES A,COMPANY R,et al.Determination of aminoglycoside residues in kidney and honey samples by hydrophilic interaction chromatography-tandem mass spectrometry[J].J Separat Sci,2012,35(20):2710-2717.
[19]潘开林,季敏,牛跃庭,等.植物油中生育酚与生育三烯酚测定方法比较[J].粮油食品科技,2016,24(4):52-55.
[20]BOHM D A,STACHEL C S,GOWIK P.Confirmatory method for the determination of streptomycin in apples by LC-MS/MS[J].Anal Chim Acta,2010,672(1/2):103-106.
[21]方冰,魏翠平,王瑛瑶,等.精炼对大豆油和菜籽油抗氧化活性的影响[J].中国油脂,2014,39(10):45-48.