新鲜果蔬营养丰富,开胃助食,美味可口。我国果蔬产量虽大,但是历来重视采前病虫害防治,忽视采后的贮运及防腐,加上果蔬本身的易腐性,导致我国的果蔬每年的采后腐烂损耗,几乎可以满足2亿人口的基本营养需求[1]。目前的果蔬防腐保鲜方法中物理法如冷藏投资大、能耗高,化学法如化学杀菌剂环境不友好,植物源抑菌剂具有低毒、无污染、广谱抗菌性的优点应用于果蔬的防腐保鲜成为当前科研工作研究的热点[2-4]。桑叶是桑科植物的干燥叶,药食两用,相关研究表明桑叶中的营养物质含量丰富,并且含有多糖、生物碱、黄酮等多种生物活性成分,具有降血糖、抗高血脂、抗氧化、抗肿瘤、抗炎和保肝护肝的生理活性[5-7]。桑叶混合提取物对细菌有抑制作用[8-9],具有植物源杀菌剂的潜力。目前的研究大都集中于对桑叶提取物这一混合物的抑菌作用研究,具体活性成分的抑菌作用比较还鲜有报道。桑叶多糖和黄酮大多为降血糖方面的研究,但是它们的降糖机制不同,还具有降血压、抗衰老、增强免疫方面的功效[10-11]。桑叶生物碱也多为其生理活性方面的研究,其具有较好的抗氧化、抗炎[12-13]、预防高血脂、高血糖[14]方面的功效。本研究采用水提醇沉法、超声辅助提取法及醇酸混合溶液提取法分别提取桑叶的多糖、黄酮及生物碱三种活性成分,采用牛津杯法研究桑叶活性成分的抑菌活性,并对桑叶黄酮的最低抑菌浓度(minimum inhibitory concentration,MIC)和抑菌的稳定性进行探讨,为桑叶黄酮的深度开发和防腐保鲜方面的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
桑叶:学校有机试验农场10月份(霜后)采摘。
1.1.2 化学试剂
氢氧化钠、碳酸钠、氯化钠、葡萄糖(均为分析纯):广州白云山光华制药股份有限公司;无水乙醇(分析纯):西陇科学有限公司;盐酸(分析纯):洛阳市化学试剂厂;芦丁(纯度98%):美国Sigma-Aldrich公司;4-羟基哌啶醇(纯度99%):北京百灵威科技有限公司;胰蛋白胨、酵母浸膏、琼脂粉(均为生化试剂):北京奥博星生物技术有限责任公司;扩展青霉(Penicillium expansum)、链格孢(Alternaria)、灰葡萄孢(Botrytis cinerea):中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center,CGMCC);大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus):本学院微生物实验室。
1.1.3 培养基
Luria-Bertani(LB)液体培养基:950 mL去离子水中加入胰蛋白胨10 g,酵母浸膏5 g,氯化钠10 g,加热溶解后用1 mol/L NaOH调节该培养基的pH达到7.0,用去离子水定容至1 L。121 ℃灭菌20 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯去皮切块称取200 g,加水煮烂,用4层纱布过滤,滤液中加入15 g琼脂粉加热溶解,再加入葡萄糖20 g,搅拌均匀后补足水分至1 L。115 ℃灭菌20 min。
马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:马铃薯去皮切块称取200 g,加水煮烂,用4层纱布过滤,加入葡萄糖20 g,搅拌均匀后补足水分至1 L。115 ℃灭菌20 min。
1.2 仪器与设备
DHG-9203A电热恒温干燥箱、GNP-9160隔水式电热恒温培养箱:上海精宏实验设备有限公司;TGL-16G高速台式离心机:上海安亭科学仪器厂;HH-501电子恒温水浴锅:常州翔天实验仪器厂;KQ2200v超声波处理器:江苏昆山超声仪器有限公司;SC-3612低速离心机:安徽中科中佳科学仪器有限公司;SHZ-28A恒温振荡培养箱:常州诺基仪器有限公司;RE-2000A旋转蒸发仪:上海亚荣生化仪器厂;SW-CJ-2D超净工作台:苏州净化设备有限公司;TUV30W紫外线杀菌灯:飞利浦电器科技集团(中国)有限公司。
1.3 试验方法
1.3.1 桑叶粉制备
采摘新鲜桑叶片去除杂质和梗,自来水清洗干净,干燥箱55~60 ℃干燥24 h,研磨成粉,过60目筛备用。
1.3.2 桑叶多糖提取及含量检测
参照文献[15]的方法提取桑叶干粉中多糖,提取温度92 ℃、提取时间3.5 h、液料比34∶1(mL∶g),提取次数2次进行热水浸提,合并2次浸提液离心(4 000 r/min,20 min),滤液真空浓缩(温度60 ℃)至一定体积,加入3倍体积无水乙醇醇沉,4 ℃放置过夜,离心(4 000 r/min,20 min)得沉淀物,-20 ℃预冻,冷阱温度-65 ℃、60 h冷冻干燥成粉[15]。
采用文献[15]的方法进行葡萄糖标准曲线的绘制和桑叶中的多糖含量检测,得出葡萄糖溶液质量浓度(x)与吸光度值(y)的回归方程为y=2.994x+0.004,相关系数R2=0.993。按照标准曲线回归方程计算桑叶多糖含量为0.639 mg/mL,得率为12.78 mg/g。
1.3.3 桑叶黄酮提取及含量检测
桑叶粉与体积分数为70%乙醇按照料液比1∶20(g∶mL),80 ℃水浴2 h,再放入超声波处理器中超声处理35 min,然后过滤将滤渣再次提取一次,4 000 r/min离心20 min,上清液旋转蒸发定容至50 mL[16]。
采用文献[16]的方法进行芦丁标准曲线的绘制和桑叶中的总黄酮化合物含量检测,得出芦丁溶液质量浓度(x)与吸光度值(y)的回归方程为y=0.519x+0.005,相关系数R2=0.998。按照标准曲线回归方程计算桑叶黄酮含量为0.848 mg/mL,得率为10.18 mg/g。
1.3.4 桑叶生物碱提取及含量检测
取桑叶干粉5 g,按料液比1∶20(g∶mL)加入体积分数为30%乙醇-0.025 mol/L盐酸混合溶液,以提取温度30 ℃,提取时间10 min,提取2次。提取液在室温条件10 000×g转速离心5 min,滤渣以同样条件提取、离心,合并上清液,然后按活性碳:样品质量比为1∶2加入活性碳,放入恒温振荡培养箱220 r/min混匀1 h,取出抽滤,滤液用旋转蒸发仪浓缩至浸膏状[17],柠檬酸溶解浸膏调pH值至2.5,无水碳酸钠调pH值至10.5,产生生物碱沉淀,离心(4 000 r/min,30 min),弃上清液,沉淀冷冻干燥成粉[18],用0.05 mol/L盐酸溶解定容至25 mL。
采用文献[17]的方法进行4-羟基哌啶醇标准曲线的绘制和桑叶中的生物碱含量检测。得出4-羟基哌啶醇溶液质量浓度(x)与吸光度值(y)的回归方程为y=5.662x-0.004,相关系数R2=0.994。按照标准曲线回归方程计算桑叶生物碱含量为0.004 89 mol/L,得率为2.50 mg/g。
1.3.5 菌种活化及菌悬液的制备
将菌种(链格孢、扩展青霉、灰葡萄孢)从安瓿管移至相应的PDA试管斜面,置于28 ℃恒温培养箱培养48 h,传代2~3代。大肠杆菌、金黄色葡萄球菌先转入LB液体培养基中进行活化,再转入LB试管斜面培养基中,置于37 ℃恒温培养箱培养24 h,传代2~3次。分别刮取试面斜面上的菌种入无菌生理盐水中,并将其稀释成1.0×106~1.0×108 CFU/mL的菌悬液备用。
1.3.6 抑菌活性检测
采用牛津杯法[19],用无菌涂布棒将0.1 mL上述制备好的供试菌悬液涂布至相应的无菌平板上,每个平板放置5个直径为8.0 mm的无菌牛津杯,分别加入桑叶多糖(质量浓度为15.98 mg/mL)、桑叶黄酮(质量浓度为20.35 mg/mL)、桑叶生物碱(质量浓度为3.75 mg/mL)、无菌水(桑叶多糖溶剂)、无水乙醇(桑叶生物碱溶剂)各0.2 mL,每种菌3组平行。放入4 ℃冰箱平衡2 h,细菌放入37 ℃恒温培养箱培养12 h,真菌放入28 ℃恒温培养箱培养48 h。取出平板测定其抑菌圈直径,抑菌圈直径>8.0 mm表示其具有抑菌活性,抑菌圈直径越大,表示其抑菌活性越强。
1.3.7 最小抑菌浓度
采用试管二倍稀释法[20]测定供试菌株的最小抑菌浓度(MIC),在5个灭菌试管中分别加入LB培养液3 mL,取第1管加入黄酮原液3 mL,混匀后抽取3 mL加入第2管,依此类推,直到第5管抽取3 mL废弃,在这5管加入供试菌液0.1 mL。另设一管为LB培养液对照组,一管为黄酮提取液对照组,细菌置37 ℃恒温培养18 h,真菌28 ℃下培养48 h后以不出现浑浊的最高药物稀释倍数为该药的最小抑菌浓度(MIC)。
1.3.8 抑菌稳定性实验[21]
(1)热处理对桑叶黄酮抑菌效果的影响
采用抑菌圈法,将桑叶黄酮原液分别于40 ℃、60 ℃、80 ℃、100 ℃下,加热20 min,考察桑叶黄酮对扩展青霉和金黄色葡萄球菌的抑菌效果。每组做三个平行。
(2)pH对桑叶黄酮抑菌效果的影响
用1 mol/L的HCl或NaOH将2 g/mL的桑叶黄酮原液pH分别调节为5、7、9、11,以未经处理的桑叶黄酮和相对应pH的HCl或NaOH溶液作为对照,常温平衡30 min后分别进行恒温培养,用牛津杯法测量抑菌圈的直径,比较pH对桑叶黄酮抑菌活性的影响。每组做三个平行。
(3)紫外线对桑叶黄酮抑菌效果的影响
在30 W紫外灯下将桑叶黄酮原液分别照射10 min、20 min、30 min、40 min、50 min、60 min,分别进行恒温培养后测定其对扩展青霉和金黄色葡萄球菌的抑菌活性,观察在不同的紫外线照射时间下桑叶黄酮的抑菌效果。每组做三个平行。
2 结果与分析
2.1 桑叶活性物质抑菌效果
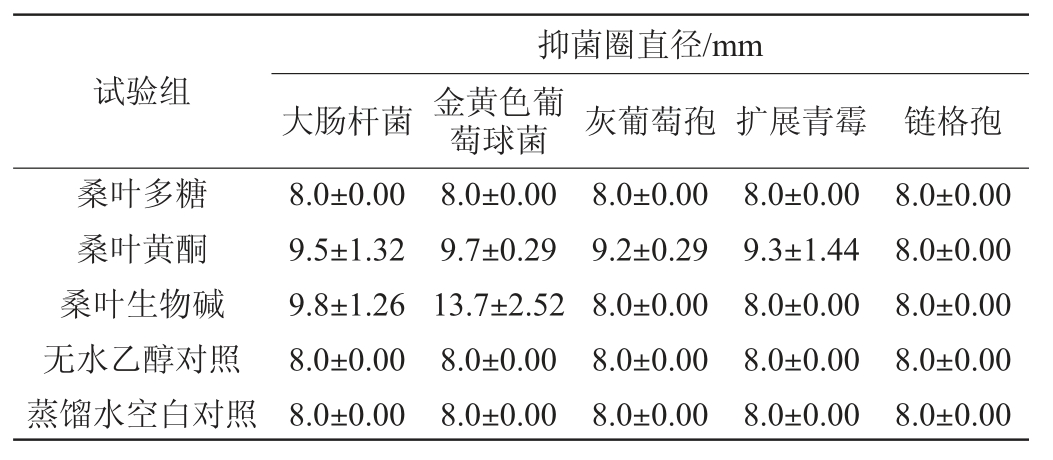
由表1可知,桑叶的三种不同活性物质对供试菌的抑菌效果不同,其中桑叶多糖对5种供试菌的抑菌圈直径均为8.0 mm,表明均无抑制作用;桑叶黄酮对链铬孢的抑菌圈直径为8.0 mm,表明其无抑制作用,对其余的四种菌抑菌圈直径均>8.0 mm,表明均有抑制作用,并且抑菌圈直径越大抑制效果越好,所以其抑制效果顺序为:金黄色葡萄球菌>大肠杆菌>扩展青霉>灰葡萄孢,其对细菌的抑制作用大于真菌,细菌中其对革兰氏阳性菌的抑制作用大于阴性菌,这可能是因为阳性菌与阴性菌不同的细胞壁结构导致的;桑叶生物碱对大肠杆菌和金黄色葡萄球菌的抑菌圈直径均>8.0 mm,并且金黄色葡萄球菌的抑菌圈直径大于大肠杆菌,表明桑叶生物碱对这两种菌都具有抑制活性,抑制效果顺序为:金黄色葡萄球菌>大肠杆菌,但对灰葡萄孢、扩展青霉、链铬孢三种真菌的抑菌圈直径均为8.0 mm,均无抑制性,这与茄非食部分生物碱提取液对细菌和霉菌均具有良好的抑菌效果[22]和苦豆子生物碱浸提物对供试细菌和霉菌都有一定的抑制作用[23]的研究结果不一致,可能是因为不同植物其生物碱的活性成分不同,具体机理还有待进一步的研究。桑叶的三种活性成分中只有桑叶黄酮的抑制作用较为广泛,因此选择桑叶黄酮作进一步研究。
表1 桑叶活性成分对常见腐败菌的抑菌效果
Table 1 Antimicrobial effect of active components from mulberry leaf on common spoilage bacteria
2.2 桑叶黄酮对供试菌的最小抑菌浓度
桑叶黄酮提取物对不同供试菌的最小抑菌浓度(MIC)结果见表2。由表2可知,桑叶黄酮提取物对金黄色葡萄球菌的最小抑菌浓度最低,为5.09 mg/mL;大肠杆菌其次,为10.18 mg/mL;灰葡萄孢和扩展青霉的最小抑菌浓度最高,为20.35 mg/mL。最小抑菌浓度的大小进一步反映出桑叶黄酮对各种供试菌的抑菌效力,MIC越低,抑菌效力就越强,测定结果与牛津杯法测定出的抑菌效果一致。
表2 桑叶黄酮对不同供试菌的最小抑菌浓度
Table 2 Minimum inhibitory concentration of flavonoids from mulberry leaf to different tested bacteria

2.3 桑叶黄酮的抑菌稳定性
2.3.1 热处理对桑叶黄酮抑菌稳定性的影响
不同温度处理下的桑叶黄酮的抑菌结果见表3。
表3 不同温度对桑叶黄酮抑菌稳定性的影响
Table 3 Effect of different temperature on the antibacterial stability of flavonoids from mulberry leaf mm

注:同一行不同小写字母表示差异显著(P<0.05);相同或无字母表示差异不显著(P>0.05)。下同。
由表3可知,随着处理温度在40~100 ℃范围内的提高,桑叶黄酮对金黄色葡萄球菌、扩展青霉的抑菌圈直径均无显著性差异(P>0.05),说明桑叶黄酮抑菌效果具有良好的热稳定性。
2.3.2 pH对桑叶黄酮抑菌稳定性的影响
不同pH的桑叶黄酮的抑菌结果见表4。由表4可知,pH对桑叶黄酮的抑菌效果有影响,在酸性条件下桑叶黄酮对两种菌的抑菌效果与未处理组相比无显著差异(P>0.05),但是碱性条件下与未处理组相比抑菌效果都显著降低(P<0.05)。原因可能为酸性条件下溶液中离子可以降低活性酚类物质上的酚羟基的电离度,从而使其疏水性增加,易于与微生物表面的蛋白质结合,从而有助于其发挥抑菌作用[24-25]。碱性条件下抑菌活性显著降低,可能是由于碱性环境破坏了桑叶黄酮的结构(或活性)[21]。因此,桑叶黄酮在酸性条件(pH5~7)下有良好的抑菌稳定性。
表4 pH对桑叶黄酮抑菌稳定性的影响
Table 4 Effect of pH on the antibacterial stability of flavonoids from mulberry leaf mm

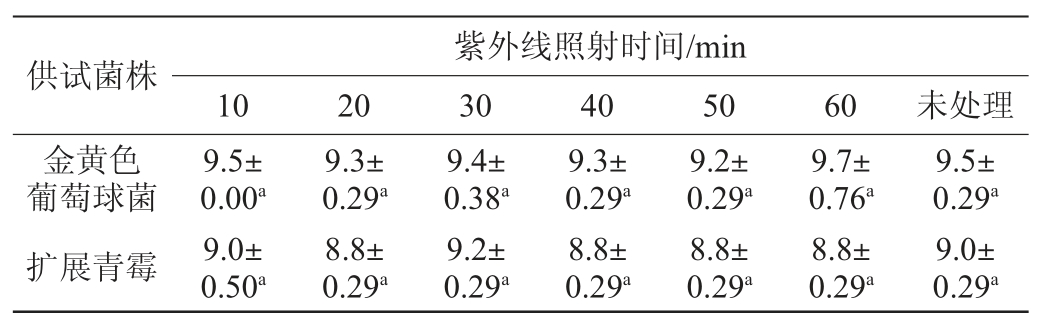
2.3.3 紫外线对桑叶黄酮抑菌稳定性的影响
不同的紫外线照射时间对桑叶黄酮抑菌效果的影响见表5。紫外线不同的照射时间对金黄色葡萄球菌和扩展青霉的抑菌效果均无显著差异(P>0.05),说明紫外线照射不能改变桑叶黄酮中的抑菌活性成分和其活性结构,桑叶黄酮对于紫外线具有良好的稳定性。
表5 紫外照射时间对桑叶黄酮抑菌稳定性的影响
Table 5 Effect of ultraviolet treatment time the antibacterial stability of flavonoids from mulberry leaf mm
3 结论
桑叶的三种活性成分对供试菌种抑菌效果结果表明,多糖对细菌和霉菌均无抑制作用,生物碱仅对细菌有抑制作用,桑叶黄酮的抑菌谱最广,对细菌和霉菌均有抑制作用。桑叶黄酮的抑菌效果为细菌大于霉菌,革兰氏阳性菌大于革兰氏阴性菌。其对金黄色葡萄球菌的MIC为5.09 mg/mL,大肠杆菌为10.18mg/mL;灰葡萄孢和扩展青霉为20.35mg/mL。
加热处理和紫外线照射均对桑叶黄酮的抑菌圈直径无显著影响(P>0.05),但是在pH5~11范围内会随着pH的增加而抑菌效果降低,酸性条件对桑叶黄酮的抑菌效果没有显著影响(P>0.05),这可为桑叶黄酮在食品加工或防腐保鲜方面的应用提供理论依据。
本研究中发现桑叶生物碱在抑制金黄色葡萄球菌方面具有非常突出的效果,将在下一步的实验中进行进一步的研究。
[1]任艳芳,刘畅,何俊瑜,等.药用植物提取物在果蔬防腐保鲜上的应用[J].食品研究与开发,2012,33(1):182-185.
[2]SHARMA R R,SINGH D,SINGH R.Biological control of postharvest diseases of fruits and vegetables by microbial antagonists:A review[J].Biol Control,2009,50(3):205-221.
[3]杜小琴,吴中宝.中草药提取液在果蔬防腐保鲜上的研究进展[J].分子植物育种,2018,16(8):2696-2701.
[4]张炜,吴正云,罗力,等.药食两用植物提取液对李果实采后常见致腐真菌抑制作用[J].中国酿造,2019,38(3):166-169.
[5]黄安民,杨斯佳,虞璐琳,等.桑叶活性成分的研究进展[J].临床医药文献杂志,2017,4(82):16226-16227.
[6]AL-KIRSHI R A,ALIMON A,ZULKIFLI I,et al.Nutrient digestibility of mulberry leaves(Morus alba)[J].Ital J Anim Sci,2013,12(2):219-221.
[7]CAI S Y,SUN W,FAN Y X,et al.Effect of mulberry leaf(Folium mori)on insulin resistance via IRS-1/PI3K/Glut-4 signalling pathway in type 2 diabetes mellitus rats[J].Pharm Biol,2016,54(11):2685-2691.
[8]王丽娟.桑叶提取物抑菌活性及抗氧化活性的研究[D].杭州:浙江工业大学,2012.
[9]刘凡,陈佳佳,廖森泰,等.桑叶提取物抑菌活性及其成分分析[J].食品工业科技,2013,34(1):117-120.
[10]郭牡丹,胡光.桑叶多糖提取工艺及药理作用研究现状[J].重庆理工大学学报(自然科学版),2020,34(3):205-209,239.
[11]杨继华,曹俊明,陈冰,等.桑叶黄酮类化合物提取纯化、生物学功能研究进展[J].广东畜牧兽医科技,2018,43(1):9-15.
[12]王祖文,沈以红,黄先智,等.桑叶生物碱对肝纤维化小鼠抗氧化能力及炎症因子水平的影响[J].食品科学,2020,41(17):202-207.
[13]杨忠敏,沈以红,王祖文,等.桑叶生物碱对D-半乳糖诱导氧化损伤模型小鼠肾脏的改善作用[J].食品科学,2020,41(19):198-203.
[14]叶甜,谢翰祥.桑叶中生物碱提取工艺的优化和功能活性研究[J].中国食物与营养,2019,25(9):42-45.
[15]袁清霞.桑叶多糖分离纯化、结构分析及生物活性研究[D].南京:南京农业大学,2016.
[16]杨青珍,王锋,王帅.龙桑叶黄酮类物质的提取工艺及抗氧化性研究[J].江苏农业科学,2010(2):305-307.
[17]蒲俊松.桑叶生物碱的检测提取及含量分析[D].重庆:西南大学,2016.
[18]李志文,周宝利,刘翔,等.茄子果实中α-茄碱的高效液相色谱法检测[J].沈阳农业大学学报,2008,39(4):479-482.
[19]沈萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,2002:111-113.
[20]王梦远,马昭,刘晓婷,等.中药生物碱体外抑菌作用研究[J].畜牧兽医杂志,2017,36(3):7-9.
[21]吴春,孟雪.玉米苞叶总黄酮的抑菌效应及抑菌稳定性研究[J].哈尔滨商业大学学报(自然科学版),2018,34(2):221-224.
[22]刘艳芳,张德欣,丁寅寅,等.茄非食部分生物碱提取液抑菌活性研究[J].食品与机械,2018,34(1):67-71.
[23]余永婷,冯作山.苦豆子生物碱浸提物的抑菌性研究[J].农产品加工,2018,(5):22-24.
[24]OUSSALAH M,CAILLET S,SAUCIER L,et al.Antimicrobial effects of selected plant essential oils on the growth of a Pseudomonas putida strain isolated from meat[J].Meat Sci,2006,73(2):224-236.
[25]张正海,董艳,姬妍茹,等.汉麻叶提取物抑菌活性及抑菌稳定性研究[J].食品安全质量检测学报,2019,10(4):927-933.