红曲是我国先民的一项伟大发明,在我国和世界微生物学开发与利用发展史上具有极其重要的意义,是我国传统药食同源的宝贵发明和科学文化遗产[1]。传统功能红曲是以大米为原料,用红曲霉发酵而成,含有Monacolin K、红曲色素、γ-氨基丁酸和多糖等多种重要的代谢产物[2-3],其中Monacolin K是红曲中重要的营养功能成分[4],有闭环的内酯式和开环的β-羟基酸式两种结构,具有降血脂、降血压和降血糖[5-6]等功效。
青稞是我国高原特色农作物,其蛋白质、淀粉、纤维素和维生素等营养成分含量高,同时还含有酚类物质、甾醇类物质和膳食纤维等功能成分[7-8]。它具备红曲霉生长的基础营养条件,制备出的青稞红曲发酵物具有许多功能成分,在食品领域有很好的应用[9]。目前国内青稞红曲产品的开发研究处于起步阶段,只有少数企业及学者对青稞红曲进行研究。胡久平等[10]通过对青稞红曲高温发酵温度、低温发酵温度、发酵湿度的优化,得到一条Monacolin K含量达1.94%的生产工艺;周礼红等[11]研究了青稞红曲发酵工艺对色价的影响,通过优化青稞蒸煮时间、料水比、装料量、发酵时间、发酵温度、接种量、初始pH值等工艺参数,得到的青稞红曲米色价高达1 210.84 U/g;谭有莉等[12]对青稞红曲的性状、显微特征、水分、灰分、浸出物、薄层鉴别和高效液相色谱(high performance liquid chromatography,HPLC)定量分析等进行研究,并在此基础上初步制定了青稞红曲的质量标准。西藏月王生物技术有限公司的青稞红曲系列产品受到了广泛的肯定和关注。
为了充分利用青稞,开发出高附加值的青稞衍生产品,本研究以二道脱皮青稞代替大米进行固态发酵,通过对发酵工艺条件的优化提高Monacolin K的含量,以期丰富功能红曲的种类,拓展青稞的应用范围。
1 材料与方法
1.1 材料与试剂
肚里黄青稞:青海华实投资管理有限公司;丛毛红曲(Monascus pilosus):北京市营养源研究所保藏;马铃薯葡萄糖琼脂(potato detroxse agar,PDA)培养基、蛋白胨、酵母粉(均为生化试剂):北京陆桥技术股份有限公司;葡萄糖、硝酸钠、硫酸镁、磷酸二氢钾、冰醋酸、磷酸等(均为分析纯):北京化工厂;甲醇(色谱纯):美国Fisher scientific公司;洛伐他汀(纯度≥98%):北京索莱宝科技有限公司。
基础培养基:青稞米饭;种子培养基:马铃薯葡萄糖琼脂(PDA)培养基;液体培养基:葡萄糖60 g/L,蛋白胨25 g/L,硝酸钠2 g/L,硫酸镁1 g/L,磷酸二氢钾1 g/L,乙酸调节pH值为5.0。以上培养基灭菌条件为121 ℃,15 min。
1.2 仪器与设备
LDZX-30FBS灭菌锅:上海申安医疗器械厂;FCH-1300B超净台:北京亚泰科隆仪器技术有限公司;MJ-500-Ⅱ霉菌培养箱:上海一恒科学仪器有限公司;Hitachi CF16RN高速冷冻离心机:日本日立公司;Vanquish-H高效液相色谱仪(配置二极管阵列检测器):美国Thermo Fisher公司。
1.3 实验方法
1.3.1 功能红曲发酵工艺及操作要点

操作要点:青稞米清洗后浸泡至中间无白心,沥水20 min至表面干燥,上屉蒸饭20 min,摊凉后添加营养成分,分装三角瓶(160 g/500 mL),121 ℃灭菌15 min,冷却后接种液体红曲霉种子(菌落数1×107 CFU/mL),降温培养,高温发酵2 d,低温发酵21 d,培养过程中适时补加pH4.0乙酸水,出曲后60 ℃干燥至水分10%以下。
1.3.2 菌种培养及发酵方法
菌种活化及保藏:将保藏菌种划线接种于PDA斜面上,30 ℃培养7~8 d,至菌丝体长满斜面并变成红色后,4 ℃冰箱保存。
种子培养:用无菌水反复冲洗丛毛红曲菌斜面,制成孢子悬液,并稀释至1×104 CFU/mL,接种到装液量为150 mL/500 mL PDA液体培养基中,30 ℃,200 r/min空气摇床中培养48 h。
固态发酵培养:青稞浸泡至无白心,沥水20 min,蒸饭20 min,摊凉,分装三角瓶,灭菌,接种量10%,放入培养箱培养,每天扣瓶2次,适时补加乙酸水溶液。
1.3.3 菌株生长曲线测定
以试验用菌种为研究对象,利用液体培养基,采用称量菌丝干质量的方法,绘制丛毛红曲菌的生长曲线,确定最佳接种时间。
1.3.4 培养基成分优化单因素试验
蛋白胨添加量优化:基础培养基中分别添加0.4%、0.6%、0.8%、1.0%、1.2%(以干质量计)的蛋白胨,考察不同蛋白胨添加量对Monacolin K产量的影响。
酵母粉添加量优化:基础培养基中分别添加0%、0.1%、0.2%、0.3%、0.4%(以干质量计)的酵母粉,考察不同酵母粉添加量对Monacolin K产量的影响。
磷酸二氢钾添加量优化:基础培养基中分别添加0.15%、0.20%、0.25%、0.30%、0.35%(以干质量计)的磷酸二氢钾,考察不同磷酸二氢钾添加量对Monacolin K产量的影响。
1.3.5 发酵条件优化单因素试验
考察不同青稞米浸泡水初始pH值(3、4、5、6、7)、青稞蒸煮时间(10 min、20 min、30 min、40 min、50 min)、装料量(120 g/500 mL、140 g/500 mL、160 g/500 mL、180 g/500 mL、200g/500mL)、接种量(4%、6%、8%、10%、12%,以青稞米饭质量计)、高温发酵温度(28℃、30℃、32℃、34℃、36℃)、低温发酵温度(23℃、25℃、27℃、29℃))对MonacolinK产量的影响。
1.3.6 发酵工艺优化正交试验
根据单因素试验所得发酵条件,选择发酵温度、菌种接种量和初始pH为影响因素,以Monacolin K含量为考察指标,进行L9(34)正交试验,因素与水平编码如表1所示。
表1 发酵条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for fermentation conditions optimization

1.3.7 指标测定方法
(1)Monacolin K含量检测方法
依据QB/T 2847—2007《功能性红曲米(粉)》对青稞功能红曲中的Monacolin K进行检测,对检测条件进行了适当改进。具体条件为:Agilent SB-C18(250 mm×4.6 mm×5μm)色谱柱,柱温25 ℃;流动相为0.12%的磷酸水溶液(A)和甲醇(B),流速为1.0 mL/min,流动相梯度洗脱程序为:0~20 min,B=77%;22min,B=100%;25min,B=77%;25~30min,B=77%;检测波长为238nm。Monacolin K含量按如下公式计算:
式中:X1为试样中Monacolin K的含量,mg/g;h1为试样中内酯型洛伐他汀峰面积;h2为试样中内酯型洛伐他汀峰面积;c为标准洛伐他汀(内酯)溶液质量浓度,mg/mL;50为试样定容体积,mL;h3为标准洛伐他汀(内酯)溶液峰面积;m为试样称取量,g。
Monacolin K(以绝干计)按如下公式计算:
式中:X为试样中Monacolin K含量(以绝干计),%;X1为试样中Monacolin K的含量,mg/g;X2为试样中水分的含量,%。
(2)水分含量测定
参照GB 5009.3—2016《食品安全国家标准食品中水分的测定》。
2 结果与分析
2.1 Monacolin K测定高效液相色谱图
图1为青稞功能红曲样品中Monacolin K含量测定的高效液相色谱图。由图1可知,青稞红曲中Monacolin K酸式、内酯式完全分离,峰形良好,所得结果为两者之和。
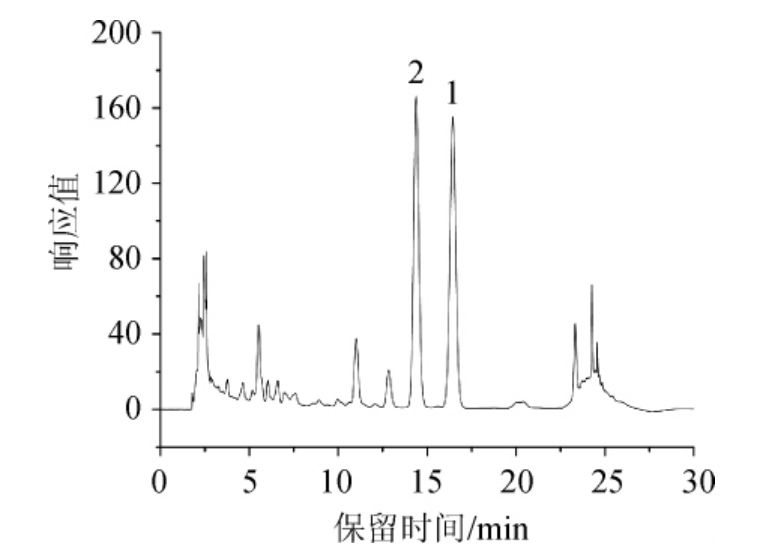
图1 青稞功能红曲样品中Monacolin K高效液相色谱图
Fig.1 HPLC chromatogram of Monacolin K in functional highland barley Monascus sample
1为内酯式Monacolin K,2为酸式Monacolin K。
2.2 菌种生长曲线
以丛毛红曲菌为研究对象,考察32 ℃恒温摇床培养不同时间的菌丝干质量。培养时间对菌丝干质量的影响如图2所示。
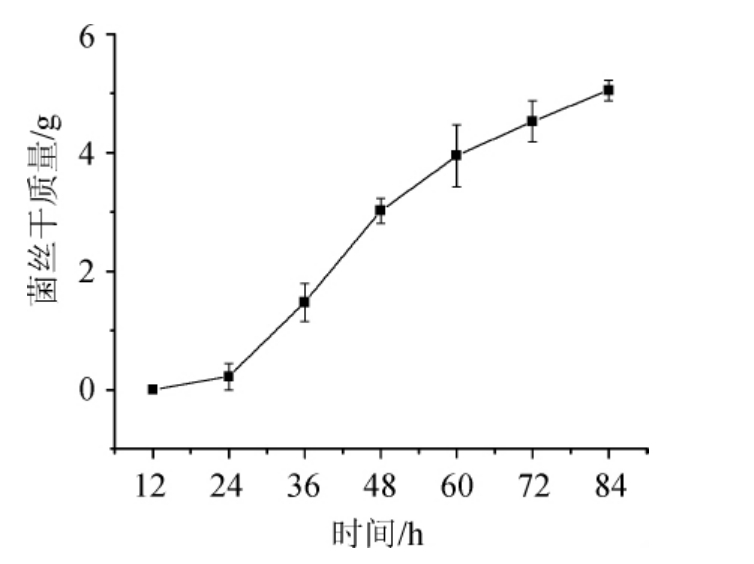
图2 从毛红曲霉生长曲线
Fig.2 Growth curve of Monascus pilosus
由图2可知,保藏菌种在培养第36~48小时菌丝迅速增加,此时霉菌酶系活跃,代谢旺盛,细胞群体的形态与生理特性最一致,微生物细胞抗不良环境的能力最强[13-14]。48~60 h为稳定生长期,但增长速度减缓。为节约时间成本,选取最适宜接种时间为液体培养48 h。培养时间过短,菌种量少、生长缓慢,培养时间过长,菌种衰老,不利于Monacolin K的积累。
2.3 培养基成分优化单因素试验
由图3可知,Monacolin K产量随着磷酸二氢钾、蛋白胨、酵母粉的添加量增加均呈现先升高后降低的趋势。磷酸二氢钾添加量为0.3%时,丛毛红曲霉产生Monacolin K含量达1.32%;蛋白胨添加量为0.6%时,Monacolin K含量达1.30%;酵母粉添加量为0.3%时Monacolin K含量达1.06%。分别为各条件下最高。
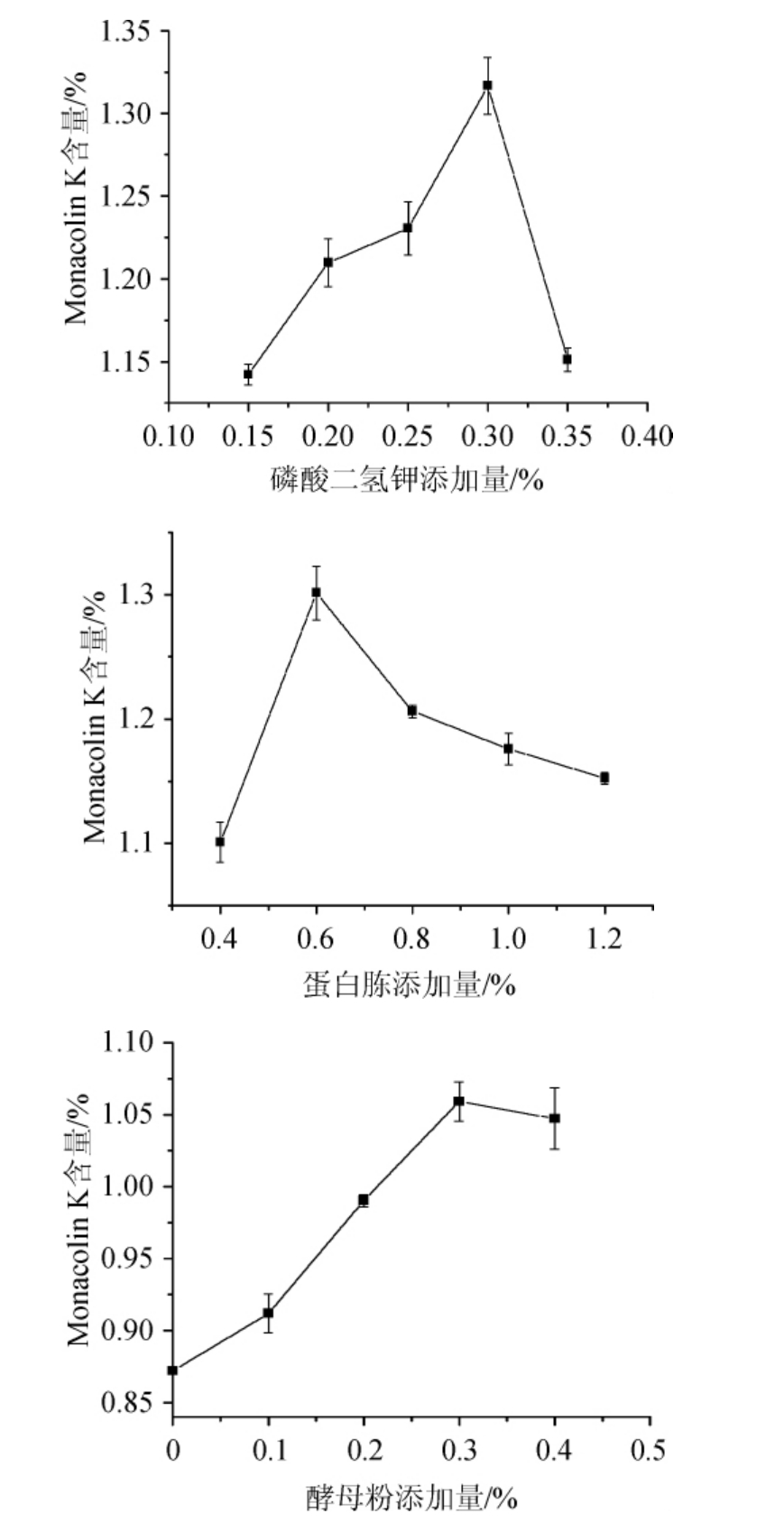
图3 不同培养基成分添加量对Monacolin K产量的影响
Fig.3 Effect of different additions of medium components on Monacolin K yield
2.4 发酵条件优化单因素试验
2.4.1 不同青稞米浸泡水初始pH值对Monacolin K产量的影响
由图4可知,青稞米初始pH值为5、6和7时,红曲中Monacolin K含量较低,在pH值为4时含量最高,这是因为红曲霉菌是喜酸型菌,最适宜生长的pH值为3~5,在pH<3时生长缓慢,在pH≥5时,不利于色素合成。因此,初始pH值为4时最适宜。
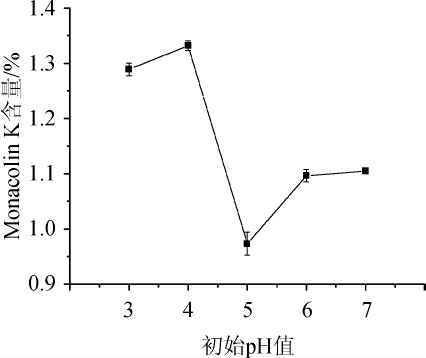
图4 不同初始pH值对Monacolin K产量的影响
Fig.4 Effect of different initial pH on Monacolin K yield
2.4.2 不同青稞蒸煮时间对Monacolin K产量的影响
由图5可知,蒸煮时间为20 min及以上时,红曲Monacolin K的含量无明显差异。蒸煮的主要作用是使青稞米中的淀粉糊化,便于微生物利用。随着蒸煮时间的延长,青稞米黏度及水分含量增加,综合考虑时间成本、能耗及试验的可操作性,选择20 min为最佳蒸煮时间。
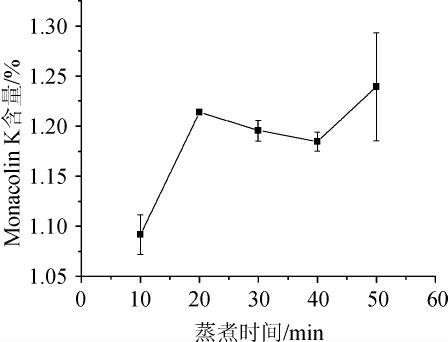
图5 不同蒸煮时间对Monacolin K产量影响
Fig.5 Effect of different cooking time on Monacolin K yield
2.4.3 不同装料量对Monacolin K产量的影响
由图6可知,装料量为120 g/500 mL时,所得Monacolin K的含量为1.38%,装料量为160 g/500 mL时,含量为1.31%,装料量为180 g/500 mL时,含量仅为1.16%。在红曲霉发酵过程中,Monacolin K的生成受培养基水分含量、内部温度及氧气含量影响很大[15]。培养基过少,不利于水分的保持,并且随着发酵时间的延长,米粒逐渐干硬,影响丛毛曲霉正常生长[16];培养基过多,不利于红曲菌体代谢过程中所产生的热量散失,同时也不利于氧气流通,同样会影响生长,继而影响Monacolin K的合成,导致其含量降低。装料量120 g/500 mL与160 g/500 mL Monacolin K的含量没有明显的差异,为了获得更高的产量,选择160 g/500 mL为最优。
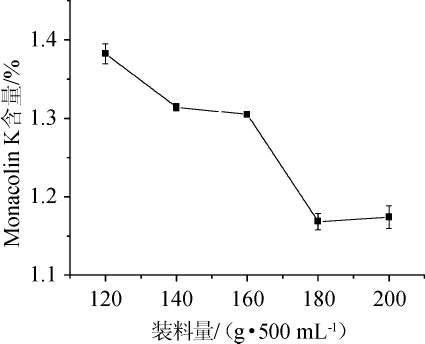
图6 不同装料量对Monacolin K产量的影响
Fig.6 Effect of different loading capacity on Monacolin K yield
2.4.4 不同接种量对Monacolin K产量的影响
由图7可知,在接种量<10%时,所得红曲中Monacolin K的含量随着接种量的增加而逐渐增加,在10%时Monacolin K含量最高,超过10%时Monacolin K含量降低。这是因为接种量过低,菌体繁殖缓慢,接种量过高,菌体过快增殖而积累的大量代谢产物对发酵过程会产生反馈抑制作用,还会使发酵基质的黏度增加,丛而妨碍传质过程,最终影响菌体生长和代谢产物的生成[17]。
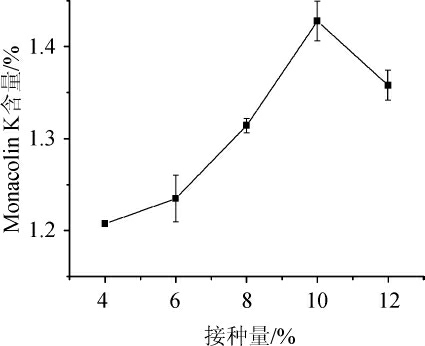
图7 不同接种量对Monacolin K产量的影响
Fig.7 Effect of different inoculum on Monacolin K yield
2.4.5 不同发酵温度对Monacolin K产量的影响
功能红曲的发酵工艺采用变温发酵,高温培养阶段是为了积累生物量[18],低温培养阶段是Monacolin K的合成累积的重要时期[10]。李同乐等[14]以大米为基质发酵生产功能红曲米时采用30 ℃下培养3 d后降温26 ℃培养15 d的工艺,张占军[19]等也用了相同的工艺。本文根据丛毛红曲霉的特性提高了高温发酵的温度,缩短高温发酵时间至2 d,降低了低温发酵温度,延长低温发酵时间至21 d,更有利于Monacolin K的生产。
由图8可知,在不同高温发酵温度下青稞红曲中Monacolin K的含量先升后降,32 ℃时Monacolin K产量最高,32 ℃为最适宜红曲霉菌生长的温度,此时生物量积累最多。在不同的低温发酵温度下,青稞红曲中的Monacolin K含量先升后降,25 ℃时Monacolin K含量较高,为1.18%。在低温培养条件下,红曲霉生长缓慢且向基质内部生长,营养物质不断被消耗用于积累代谢产物。同时,红曲霉经变温刺激由生长期转为稳定期,次级代谢产物开始大量生成[20]。因此确定高温发酵和低温发酵的温度分别为32 ℃和25 ℃。
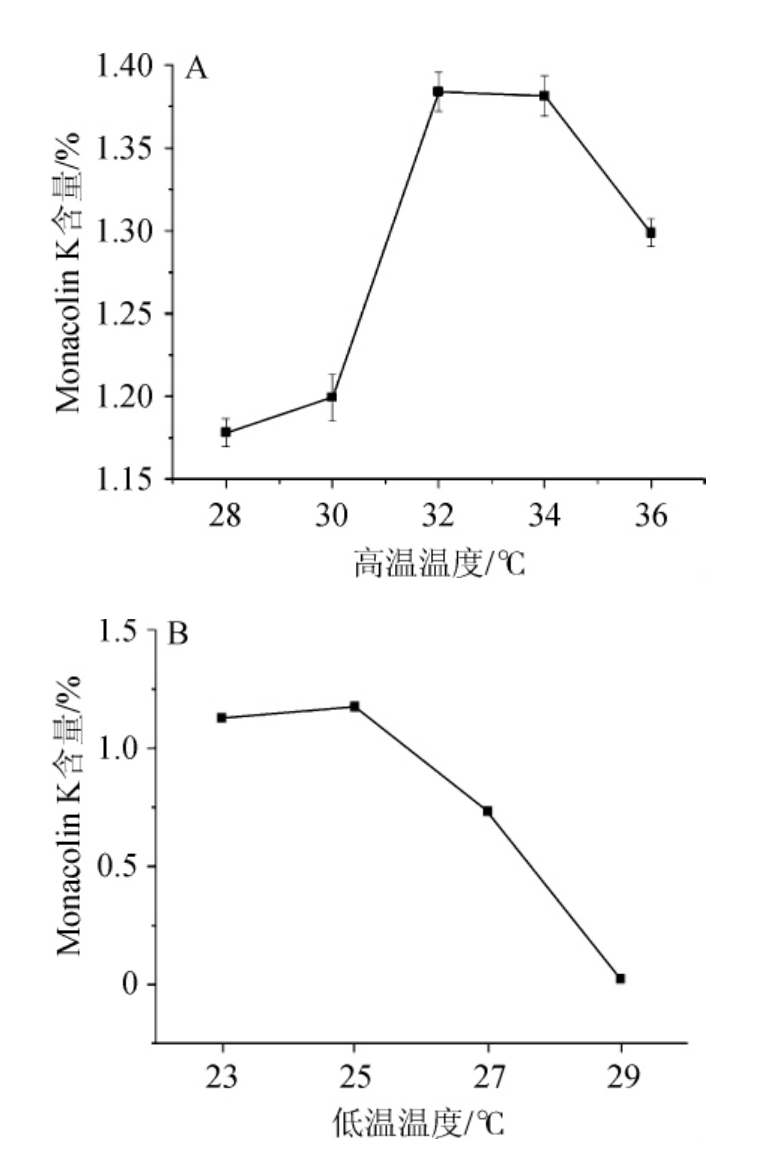
图8 不同发酵温度对Monacolin K产量的影响
Fig.8 Effect of different fermentation temperature on Monacolin K yield
2.5 发酵条件优化正交试验
由单因素试验所得最优的发酵条件,选择发酵温度(A)、菌种接种量(B)和初始pH值(C)为影响因素,以Monacolin K含量为考察指标进行3因素3水平的正交试验,结果见表2,方差分析见表3。
表2 发酵条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for fermentation conditions optimization
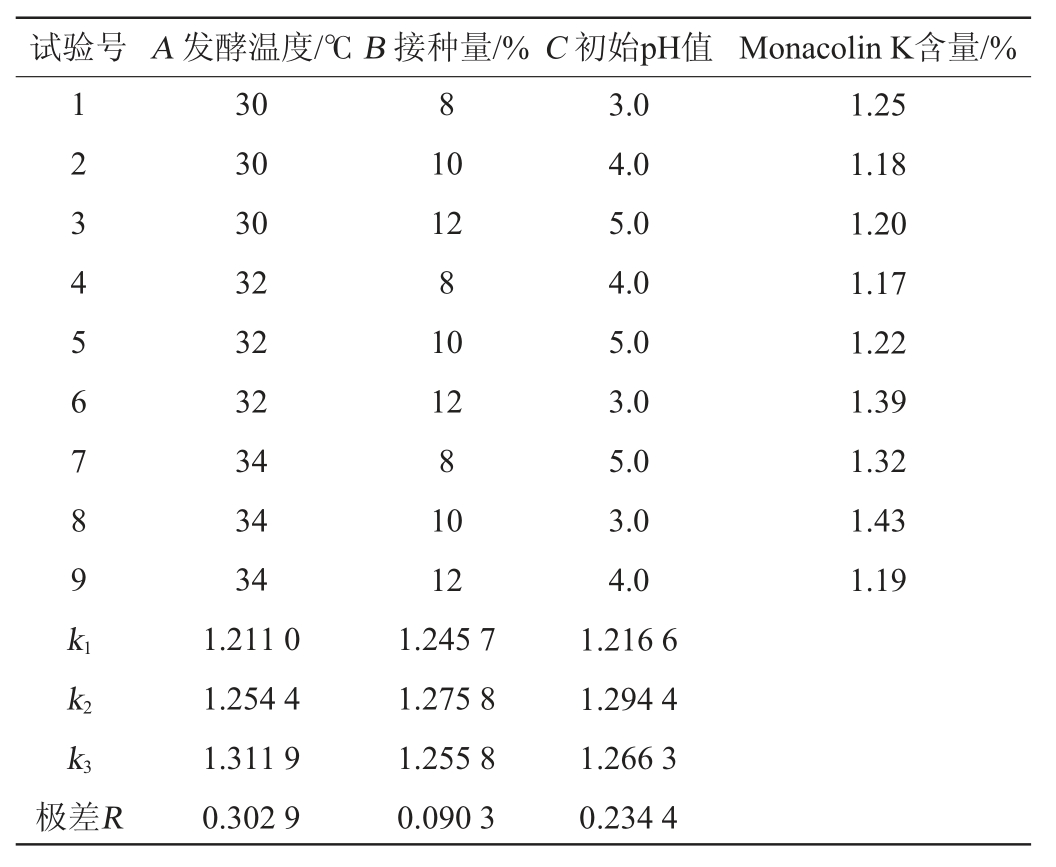
由表2及表3可知,发酵温度对Monacolin K含量的影响显著(P<0.05),对Monacolin K产量的影响因素的主次顺序是A>C>B,即发酵温度>初始pH值>接种量。最优方案是A3B2C2,即最优的发酵工艺为发酵温度34 ℃、接种量10%和初始pH值为4.0。在此最佳条件下进行3次平行验证试验,获得Monacolin K的产量为1.52%。
表3 正交试验结果方差分析
Table 3 Analysis of variance of orthogonal experiments
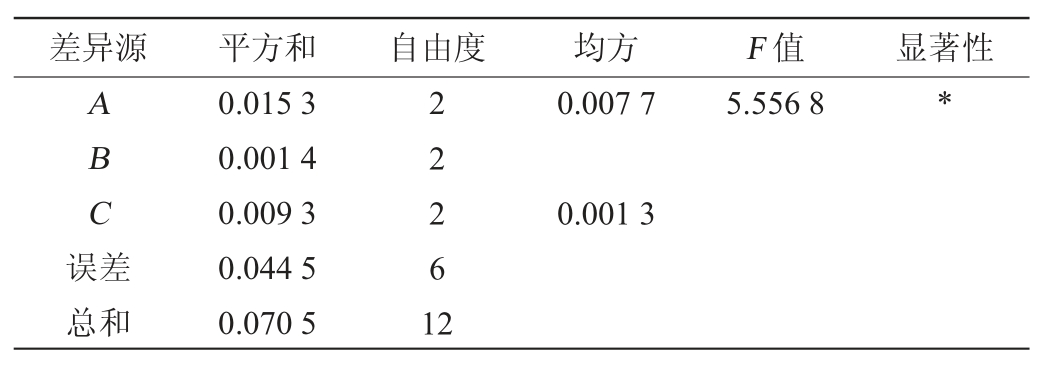
注:“*”表示对结果影响显著(P<0.05)。
2.6 质量指标
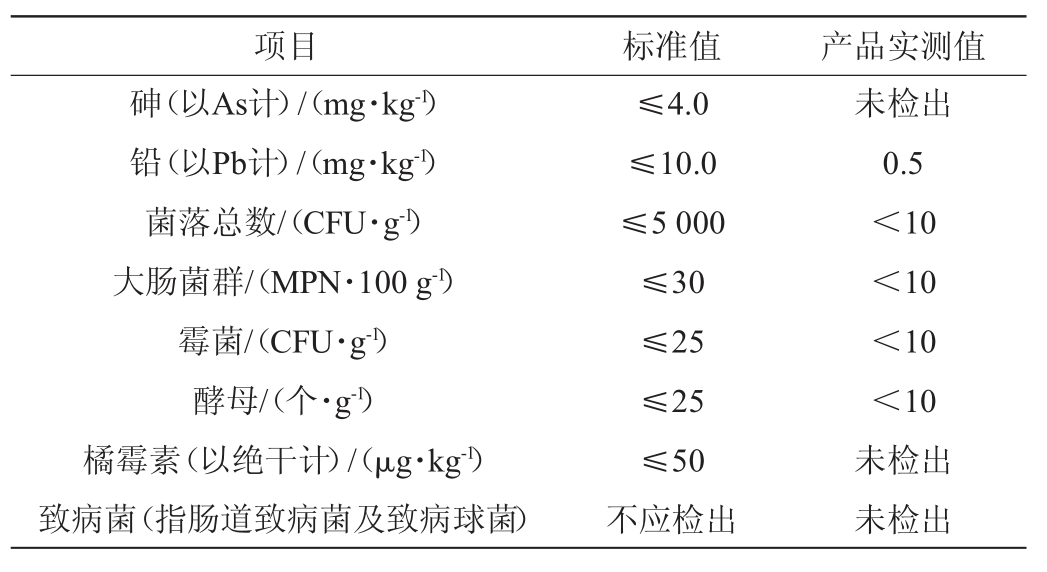
依据QB/T 2847—2007《功能性红曲米(粉)》对青稞功能红曲米的感官指标(外观、断面和香味)、理化指标(水分和Monacolin K含量)和卫生指标(铅、砷、菌落总数、霉菌和橘霉素等)进行检测,结果见表4和表5。由表4和表5可知,青稞红曲的质量指标均符合规定。
表4 青稞功能红曲米理化指标
Table 4 Physical and chemical indexes of functional highland barley Monascus

表5 青稞功能红曲米卫生指标
Table 5 Health indicators of functional highland barley Monascus
3 结论
本试验对青稞功能红曲发酵的工艺进行了优化试验,通过单因素试验和正交试验,获得了高产Monacolin K的青稞功能红曲生产工艺,确定的最优发酵工艺条件为:青稞米用初始pH值为4.0的水浸泡至无白心后蒸煮20 min,以装料量160 g/500 mL分装,添加0.6%蛋白胨、0.3%酵母提取物和0.3%磷酸二氢钾,接种10%培养48 h的液体菌种,采用降温发酵,32 ℃发酵2 d后降温至25 ℃发酵21 d,适时补加pH值为4.0乙酸水溶液,可以得到Monacolin K产量1.52%的青稞功能红曲米。本研究为青稞功能红曲的大规模生产和Monacolin K的进一步研究提供了参考,有利于青稞相关衍生新产品的开发。
[1]SONG J W,LUO J,MA Z B,et al.Quality and authenticity control of functional red yeast rice-a review[J].Molecules,2019,24:1-25.
[2]LOVÁ P J,MARTÍNKKOVÁ L,LOZINSKI J,et al.Ethanol as substrate for pigment production by the fungus Monascus purpureus[J].Enzyme Microbial Technol,1994,16(11):996-1001.
[3]KOHAMA Y,MATSUMOTO S,MIMURA T,et al.Isolation and identification of hypotensive principles in red-mold rice[J].Chem Pharmaceut Bulletin,1987,35(6):2484-2489.
[4]ENDO A.A historical perspective on the discovery of statins[J].Proc Jpn Acad Ser B Phys Biol Sci,2010,86:484-493.
[5]洪智勇,毛宁.红曲霉降胆固醇有效成分的研究[J].海峡药学,2002,14(1):33-35.
[6]HAHN A,HEUSINGER-RIBEIRO J,LANZ T,et al.Induction of connective tissue growth factor by activation of heptahelical receptors.Modulation by Rho proteins and the actin cytoskeleton[J].J Biol Chem,2000,275(43):37429-37436.
[7]周红,杨希娟,张文刚,等.不同品种黑青稞籽粒营养品质的比较分析[A].中国食品科学技术学会.中国食品科学技术学会第十七届年会摘要集[C].北京:中国食品科学技术学会,2020:2.
[8]万强,刘敏,陈兴鹏,等.青稞红曲品质及质量分析初探[J].食品科技,2013,38(9):267-370.
[9]邓鹏,张婷婷,王勇,等.青稞的营养功能及加工应用的研究进展[J].中国食物与营养,2020,26(2):46-51.
[10]胡久平,鄢平,戚珊珊,等.发酵条件对青稞红曲中Monacolin K 和β-葡聚糖的影响[J].食品与发酵工业,2017,43(3):134-139.
[11]周礼红,万强,刘敏,等.青稞红曲固态发酵工艺研究初探[J].中国酿造,2012,31(10):46-49.
[12]谭友莉,马云桐,刘奇,等.青稞红曲的质量标准研究[J].世界科学技术-中医药现代化,2015,17(3):614-619.
[13]胡常琳,高玉荣.高产Monacolin K 红曲菌株筛选及菌种液态培养工艺[J].中国酿造,2013,32(3):48-51.
[14]李同乐,刘秀河,颜丽.功能性红曲发酵条件的优化[J].中国酿造,2019,38(3):144-148.
[15]路俊美,程远欣,李崇达,等.红曲霉固态发酵生产Monacolin K 重视工艺条件的初探[J].中国食品添加剂,2015(6):92-96.
[16]赵鲁玉.高产红曲色素固态发酵工艺及其应用特性研究[D].泰安:山东农业大学,2020.
[17]谭显东,时金栋,黄凡,等.固态发酵三七渣产红曲红色素的工艺条件研究[J].中国酿造,2019,38(8):104-107.
[18]苏槟南,谢海军,潘佩平,等.Monacolin K 红曲菌种的筛选及培养条件研究[J].山西科技,2019,34(2):27-30.
[19]张占军,王富花.基于红曲高产莫纳可林K 的固态发酵工艺条件优化[J].食品研究与开发,2020,41(7):124-130.
[20]于卓然,洪厚胜.功能性红曲Monacolin K 产量控制策略的研究进展[J].食品与发酵工业,2019,45(3):288-292.