碱性蛋白酶是一类在碱性条件下能将多肽链水解为氨基酸的酶,其最适pH值一般在9~11左右,最早发现于猪的胰脏中,属于丝氨酸蛋白酶,其活性中心含有丝氨酸,分子质量在26 000~34 000 Da[1-2]。碱性蛋白酶作为一种重要的蛋白水解酶,可广泛应用于洗涤剂行业、食品加工业、医药行业、皮革制造行业、丝绸制造行业、环保行业等[3-6]。据报道蛋白酶占全球酶制剂销售总量的60%~65%,其中碱性蛋白酶用量最大[7]。
碱性蛋白酶生产以微生物发酵法为主,目前国内碱性蛋白酶的生产效率并不高,产品供不应求,导致部分产品仍依赖进口[8]。因此,碱性蛋白酶高产菌株的缺乏已成为碱性蛋白酶生产的技术瓶颈之一。常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变育种是近年来兴起的一种诱变技术,具有射流温度低,产生的等离子体均匀,对人体安全,操作简便,成本低,与生物大分子和细胞作用明显等优点[9-11]。目前在对霉菌、细菌、酵母诱变改造方面均取得较好的效果,但利用ARTP诱变技术选育高产碱性蛋白酶鲜见报道[12]。物理化学复合诱变方式具有协同效应,比单一诱变效果更好。氯化锂(LiCl)作为化学助诱变剂,可进一步提高高产菌株的筛选几率。邱雁临等[13]利用紫外线-氯化锂复合诱变选育L-组氨酸产生菌,所得高产菌株产L-组氨酸含量比原始菌株提高13.6%,比单一紫外诱变后的菌提高5.1%;李兆飞等[14]利用氯化锂-离子束复合诱变选育高产核酸酶P1菌株,所得高产菌株酶活较原始菌株提高45.8%,比单一离子束诱变后的诱变株产酶量提升20.4%。
本研究以地衣芽孢杆菌(Bacillus chlamydiae)为出发菌株,利用常压室温等离子体(ARTP)结合氯化锂进行物理化学复合诱变。其优势在于在保证安全性的前提下,提升诱变强度,更有利于筛选出高产碱性蛋白酶的菌株,同时以单因素和响应面试验对其发酵条件进行优化,以期用于提升工业生产碱性蛋白酶发酵水平。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
地衣芽孢杆菌(Baclicus lincheniformis)E-417:安琪酵母股份有限公司菌种保藏室。
1.1.2 试剂
牛肉膏、琼脂粉、蛋白胨:北京奥博星生物技术有限责任公司;磷酸氢二钠:天津市科密欧化学试剂有限公司;玉米粉:濮阳县英伦玉米加工有限公司;豆饼粉:安阳天祥瑞食品科技有限公司;碳酸钠、氯化钠:北京西陇化工有限公司;酵母粉、葡萄糖:安琪酵母股份有限公司;酪蛋白:阿法埃莎(中国)化学有限公司。实验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
活化培养基[15]:牛肉膏5 g/L,蛋白胨10 g/L,氯化钠10 g/L,琼脂粉20 g/L,pH 7.0,121 ℃灭菌30 min。
酪蛋白鉴别平板培养基[16]:牛肉膏5 g/L,蛋白胨10 g/L,酪蛋白10 g/L,氯化钠10 g/L,琼脂粉20 g/L,pH 7.0,121 ℃灭菌30 min。
种子培养基[17]:牛肉膏10 g/L,蛋白胨10 g/L,氯化钠10 g/L,pH 7.0,121 ℃灭菌30 min。
发酵培养基[18]:玉米粉35 g/L,豆饼粉25 g/L,磷酸氢二钠2 g/L,碳酸钠1.25 g/L。按配方要求准确称取豆饼粉及玉米粉原料,加水充分溶解后加入高温淀粉酶(20 U/g玉米粉),同时边搅拌边升温至90~95 ℃液化30 min,最后加入其他原料,搅拌均匀,调pH值至7.2,121 ℃灭菌40 min备用。
1.2 仪器与设备
ARTP-M常温常压等离子体诱变仪:无锡源清天木生物科技有限公司;GHP9080隔水恒温培养箱:上海一恒科学仪器有限公司;HHS4水浴锅:江苏金怡仪器科技有限公司;TDL-608离心机:上海安亭科学仪器厂;SP-754紫外分光光度计:上海光谱仪器有限公司;ZWYR-211D恒温摇床:上海智诚分析仪器制造有限公司。
1.3 方法
1.3.1 菌悬液的制备
将地衣孢杆菌E-417甘油管接种至种子培养基中,放置于37 ℃恒温培养箱中培养16~20 h。待菌落铺满整个茄瓶后,倒入100 mL无菌水,用无菌接种铲将菌泥洗出混匀,即得菌悬液。
1.3.2 氯化锂诱变
参考文献[19]的方法。在菌悬液中加入1.5%的氯化锂,于180 r/min、37 ℃条件下进行诱变处理10 min后待用。
1.3.3 氯化锂-ARTP复合诱变
参考文献[20]的方法。将ARTP设备开启预热,调节照射功率为120 W,照射距离为2 mm,氦气(He)流量为10 L/min,开启操作室紫外灯灭菌20 min。取10 μL菌液至无菌金属载片上,涂抹均匀。将载片放入诱变室内,对菌液诱变处理0 s、15 s、30 s、45 s、60 s、75 s、90 s、105 s。将处理好的金属载片放入无菌离心管中,加1 mL无菌水稀释至10-3,振摇3 min,再进一步稀释至10-4、10-5、10-6、10-7,取100 μL菌液至酪蛋白鉴别平板培养基上,37 ℃培养20~24 h,以处理0 s为对照组,计算致死率及正突变率,其计算公式如下:

1.3.4 高产碱性蛋白酶菌株的筛选
初筛:酪蛋白是蛋白酶系的作用底物,将诱变菌液涂布至酪蛋白鉴别平板上会出现明显的水解圈,测量水解圈直径与菌落直径,并计算其比值(HC值),筛选出HC值较大的单菌落为高产碱性蛋白酶诱变株[21]。
复筛:用无菌接种铲刮取初筛得到的诱变株接种至种子培养基,于37 ℃、220 r/min条件下培养12 h后,按10%(V/V)的接种量接种于发酵培养基,于37 ℃、220 r/min条件下培养48 h,离心取上清液,测定酶活。
1.3.5 碱性蛋白酶酶活的测定
取2 mL发酵液在12 000 r/min条件下离心5 min,保留上清液,用硼酸缓冲液(pH 10.5)稀释至合适倍数,按照GB/T 23527—2009《蛋白酶制剂》规定的福林(Folin)法测定酶活力[22]。
碱性蛋白酶酶活力单位定义:在40 ℃条件下,1 min水解酪蛋白产生1 μg酪氨酸,即为1个酶活力单位(U/mL)。
1.3.6 遗传稳定性研究
将复筛得到的正突变菌株连续传代至8代,分别接种至发酵培养基中,于37 ℃、220 r/min条件下培养48 h,离心取上清液,测定酶活,考察高产菌株的遗传稳定性[23]。
1.3.7 诱变株发酵产碱性蛋白酶条件优化
单因素试验:在初始发酵培养基及发酵条件基础上,采用单因素轮换法依次考察不同碳源(葡萄糖、玉米淀粉、玉米粉)、氮源(酵母粉、豆饼粉、豆粕粉)、玉米粉添加量(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L、60 g/L)、豆饼粉添加量(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L、60 g/L)、磷酸氢二钠添加量(1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L、3.0 g/L)、碳酸钠添加量(1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L、3.0 g/L)、初始pH值(6.0、6.5、7.0、7.5、8.0)、接种量(4%、6%、8%、10%、12%)、发酵温度(31 ℃、34 ℃、37 ℃、40 ℃、43 ℃)对碱性蛋白酶活力的影响,确定发酵培养基组分和发酵条件。
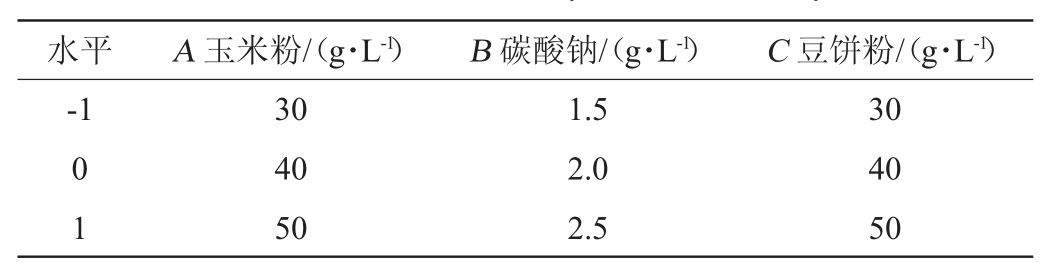
响应面试验:在单因素试验基础上,选取3个对酶活影响较大的因素,进行3水平3因素的Box-Behnken响应面试验设计[24],以玉米粉(A)、豆饼粉(B)、碳酸钠(C)添加量为自变量,以碱性蛋白酶酶活(Y)为响应值进行进一步优化。采用Design-Expert 8.0.6软件对试验数据结果进行分析,响应面试验因素与水平见表1。
表1 响应面试验因素与水平
Table 1 Factors and levels of response surface experiments
2 结果与分析
2.1 氯化锂-ARTP复合诱变结果
氯化锂是一种碱金属卤化剂,为助诱变剂,与ARTP进行复合诱变,更有利于正突变菌株的产生。采用1.5%氯化锂处理10 min后,进行ARTP诱变,将诱变时间设定在0~105 s范围内,不同诱变时间下,地衣芽孢杆菌E-417的致死率及正突变率见图1。
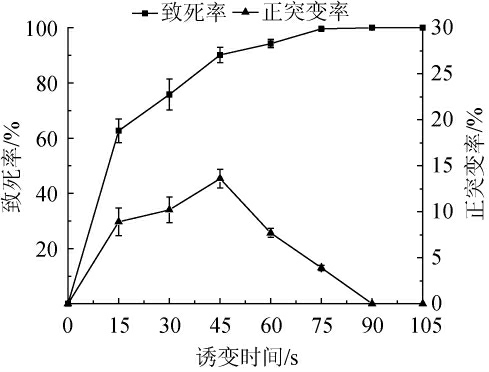
图1 不同LiCl-ARTP复合诱变时间下地衣芽孢杆菌E-417的致死率及正突变率
Fig.1 Fatality rate and positive mutation rate of Bacillus licheniformis E-417 by LiCl-ARTP compound mutation with different mutation time
由图1可知,菌株致死率随ARTP照射时间而增加,正突变率呈先上升后下降趋势。当诱变时间为45 s时,菌株致死率达到94.6%,正突变率为14.7%,达到最高。当诱变时间为60 s时,菌株致死率达到95.3%,正突变率骤降至8.5%。当诱变时间为75 s时,该菌株致死率已达到100%。因此氯化锂-ARTP复合诱变最佳条件为氯化锂添加量1.5%,ARTP照射45 s。
2.2 高产碱性蛋白酶菌株的筛选
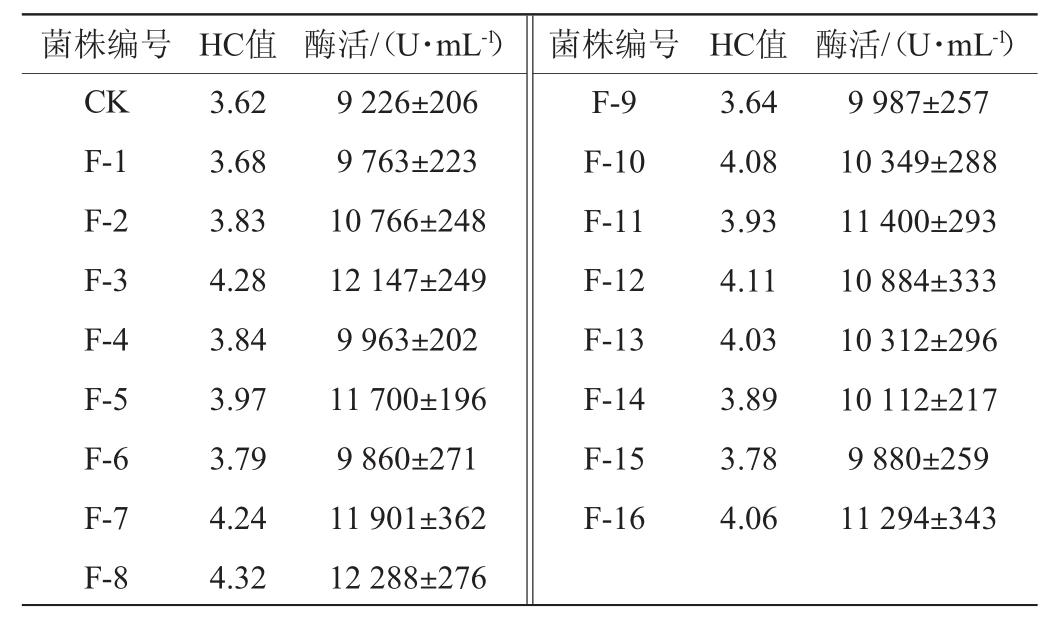
将诱变后的菌液涂布至酪蛋白鉴定平板,地衣芽孢杆菌分泌的碱性蛋白酶可将酪蛋白分解为小分子氨基酸,致使菌落周围形成水解圈(见图2)[25]。经过多次的复合诱变试验,初筛得到132株HC值(3.51~4.32)较大的单菌落,再经摇瓶复筛测定酶活,最终筛选出16株发酵酶活明显高于原始菌株的诱变株,结果见表2。
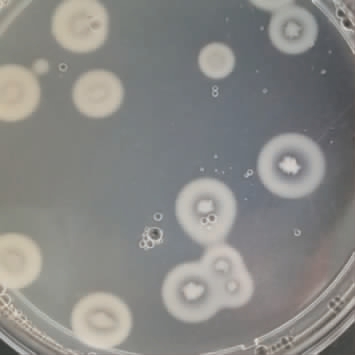
图2 酪蛋白平板筛选结果
Fig.2 Results of casein plate screening
由表2可知,HC值的大小在一定程度上反映了菌株产碱性蛋白酶的能力,HC值越大,酶活越高。16株诱变菌株中,诱变株F-3与F-8的HC值及碱性蛋白酶酶活最高,故对这两株诱变株进行遗传稳定性验证。
表2 复合诱变后高产碱性蛋白酶诱变菌株的筛选结果
Table 2 Screening results of high yield alkaline protease mutant strain after compound mutation
2.3 遗传稳定性验证
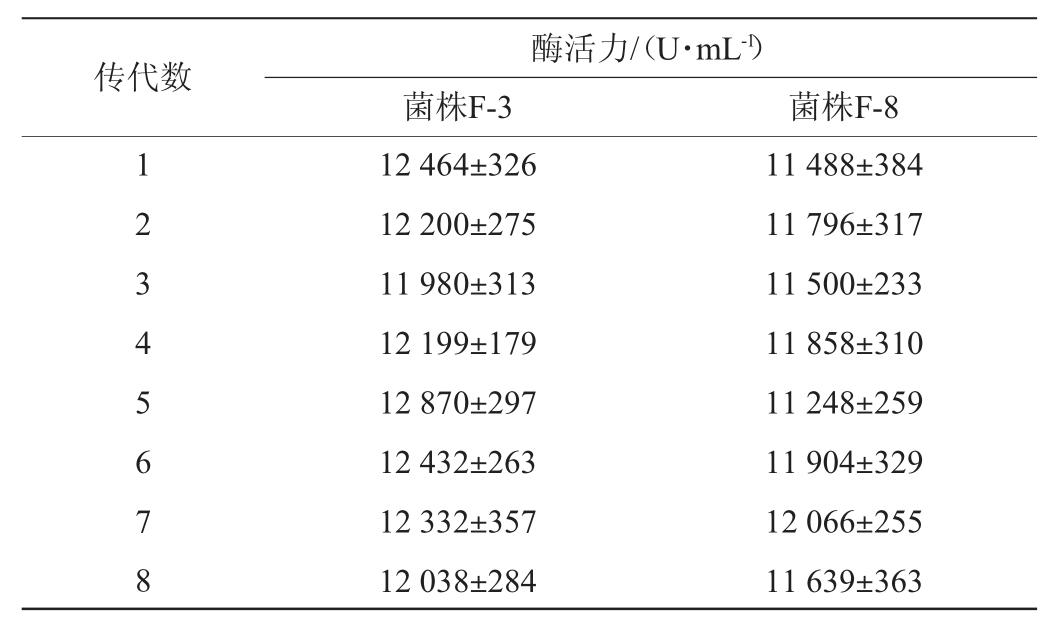
为了检验诱变株F-3、F-8的遗传稳定性,对突变株F-3、F-8进行连续传代8次,并同时进行发酵培养,采用福林(Folin)法对每代菌株的发酵上清液进行酶活测定,结果见表3。
由表3可知,经过8次连续传代,2株诱变菌株均具有良好遗传稳定性,其中诱变株F-3的酶活最高,达到12 870 U/mL,较原始菌株提高了39.5%,因此,选用此菌株进行后续研究。
表3 传代8次后诱变株F-3和F-8的遗传稳定性
Table 3 Genetic stability of mutant strains F-3 and F-8 after 8 passages
2.4 诱变株F-3产碱性蛋白酶发酵条件优化单因素试验
2.4.1 不同碳源及氮源对诱变株F-3产酶的影响
由图3可知,以玉米粉为碳源时,诱变株F-3产碱性蛋白酶酶活最高为12 030 U/mL,明显高于以葡萄糖、玉米淀粉为碳源的酶活,因而选择玉米粉作为最优碳源;以豆饼粉作为氮源时,诱变株F-3产碱性蛋白酶酶活最高为13000U/mL,明显高于以豆粕粉、酵母粉为氮源的酶活,可能是由于豆饼粉粒度更细,更易被菌体代谢利用,经蛋白酶水解后产生出更多的氨基酸,进一步诱导诱变株F-3产酶。因而选用豆饼粉作为最优氮源。
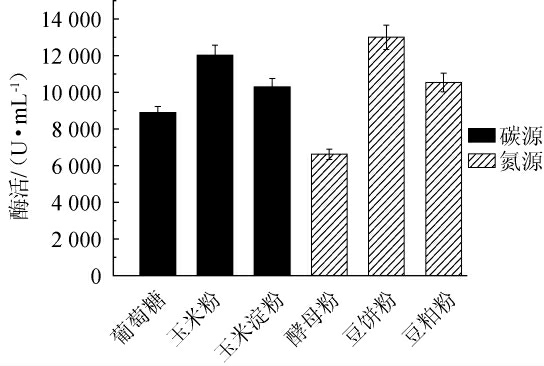
图3 不同碳源及氮源对诱变株F-3产碱性蛋白酶的影响
Fig.3 Effect of different carbon and nitrogen sources on alkaline protease production by mutant strain F-3
2.4.2 玉米粉和豆饼粉添加量对诱变株F-3产酶的影响
由图4可知,随着玉米粉和豆饼粉添加量的不断增大,碱性蛋白酶酶活均呈先上升后下降的趋势,当玉米粉和豆饼粉添加量为40 g/L时,酶活均达到最高,分别为13 536 U/mL、14 870 U/mL,因此,选择最优玉米粉和豆饼粉添加量均为40 g/L。
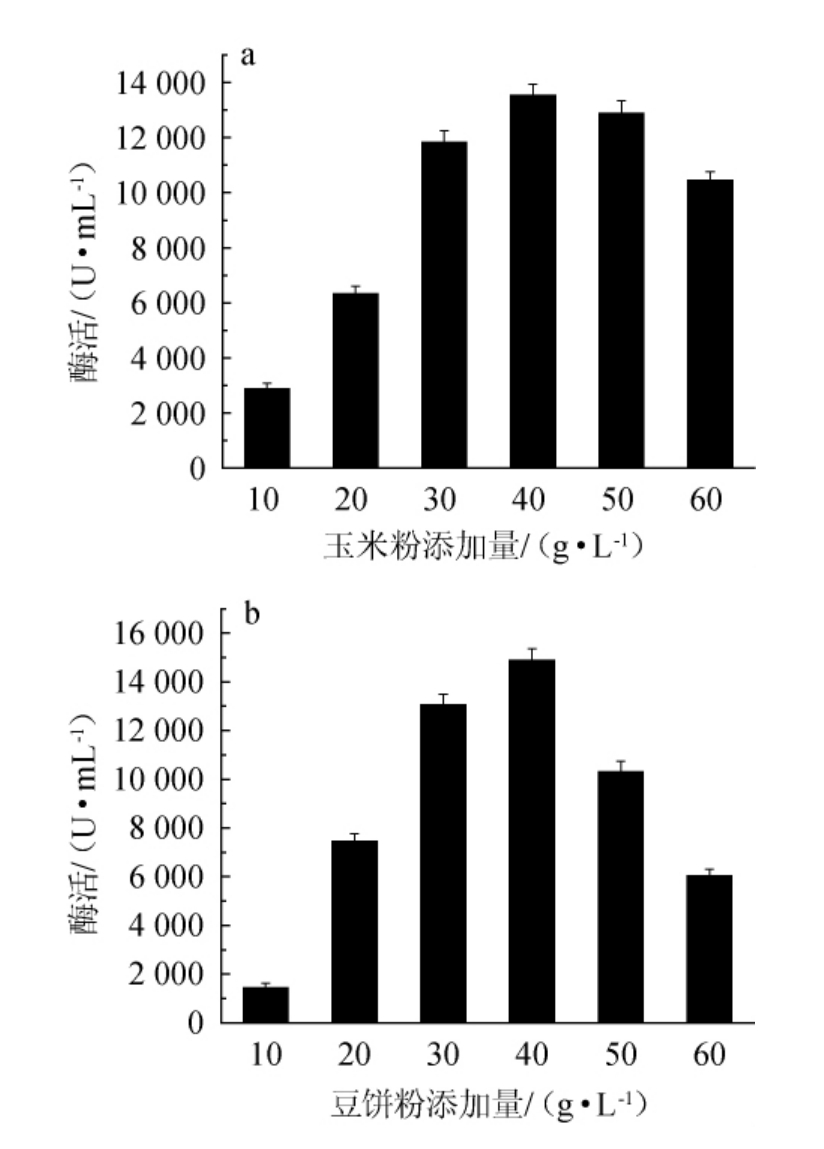
图4 玉米粉(a)和豆饼粉(b)添加量对诱变株F-3产碱性蛋白酶的影响
Fig.4 Effect of corn flour (a) and soybean cake powder (b) additions on alkaline protease production by mutant strain F-3
2.4.3 磷酸氢二钠及碳酸钠添加量对诱变株F-3产酶的影响
由图5可知,随着磷酸氢二钠和碳酸钠添加量的不断增大,碱性蛋白酶酶活均呈先上升后下降的趋势,当磷酸氢二钠和碳酸钠的添加量为2.0 g/L时,酶活均达到最高,分别为13 890 U/mL、15 567 U/mL。因此,选择最优磷酸氢二钠和碳酸钠添加量均为2.0 g/L。
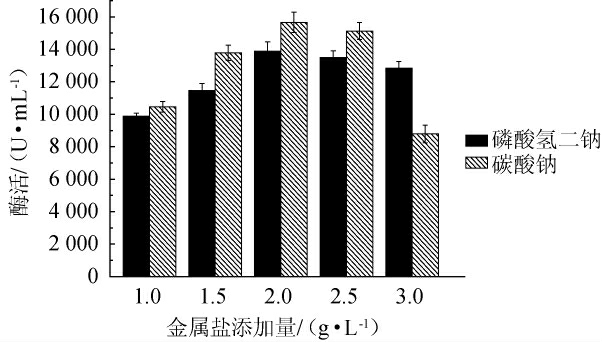
图5 不同金属盐添加量对诱变株F-3产碱性蛋白酶的影响
Fig.5 Effect of different metal salts additions on alkaline protease production by mutant strain F-3
2.4.4 初始pH值对诱变株F-3产酶的影响
由图6可知,诱变株F-3对初始pH值的变化较为敏感,随着pH值的增加,碱性蛋白酶酶活呈先上升后下降的趋势。pH值过低,菌体生长缓慢,影响产酶;pH值过高发酵后期菌体老化过快,从而影响其代谢产物产量。当pH值为7.0时,发酵酶活最高为13 490 U/mL,因此,选择最优初始pH值为7.0。
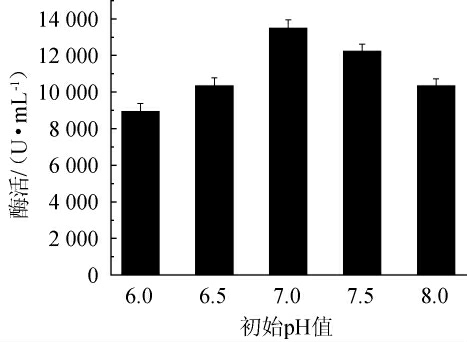
图6 初始pH值对诱变株F-3产碱性蛋白酶的影响
Fig.6 Effect of initial pH on alkaline protease production by mutant strain F-3
2.4.5 接种量对诱变株F-3产酶的影响
由图7可知,接种量对诱变株F-3产碱性蛋白酶影响较大,当接种量为4%时,由于接种量太少,菌体前期生长缓慢,产酶效率低;随着接种量的逐步提高,产酶量逐渐增加。当接种量为8%时,碱性蛋白酶酶活最高为13 212 U/mL。随着接种量的继续提高酶活反而下降,可能是由于接种量过大,菌体生长过快,菌体提前消耗完底物培养基,产生了大量代谢副产物,影响了诱变株F-3产碱性蛋白酶的能力,因此,选择最优接种量为8%。
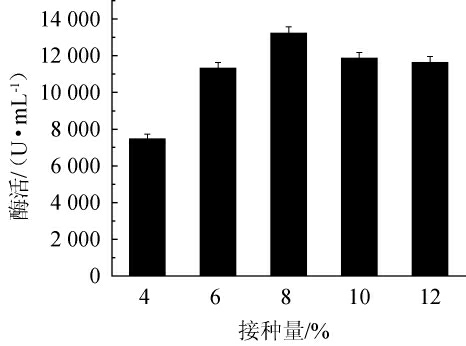
图7 接种量对诱变株F-3产碱性蛋白酶的影响
Fig.7 Effect of inoculum on alkaline protease production by mutant
strain F-3
2.4.6 发酵温度对诱变株F-3产酶的影响
由图8可知,随着发酵温度的提高,菌株产碱性蛋白酶活力呈先上升后下降的趋势。当发酵温度为31 ℃时,发酵温度过低,菌体生长缓慢,产物合成能力降低,发酵酶活最低;当发酵温度为37 ℃时,酶活最高为15 501 U/mL;当发酵温度高于37℃,菌体生长过快,底料培养基过早耗竭,菌体提前衰亡,酶活开始下降。因此,选择最优发酵温度为37 ℃。
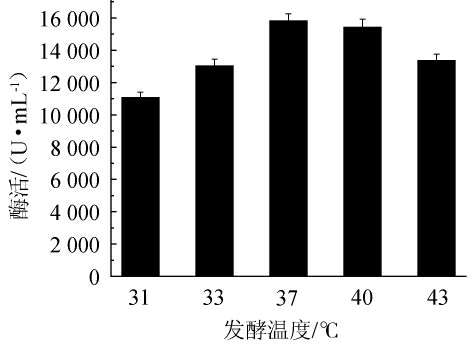
图8 发酵温度对诱变株F-3产碱性蛋白酶的影响
Fig.8 Effect of fermentation temperature on alkaline protease production by mutant strain F-3
2.5 诱变株F-3产碱性蛋白酶发酵条件优化响应面试验
2.5.1 响应面试验设计与结果
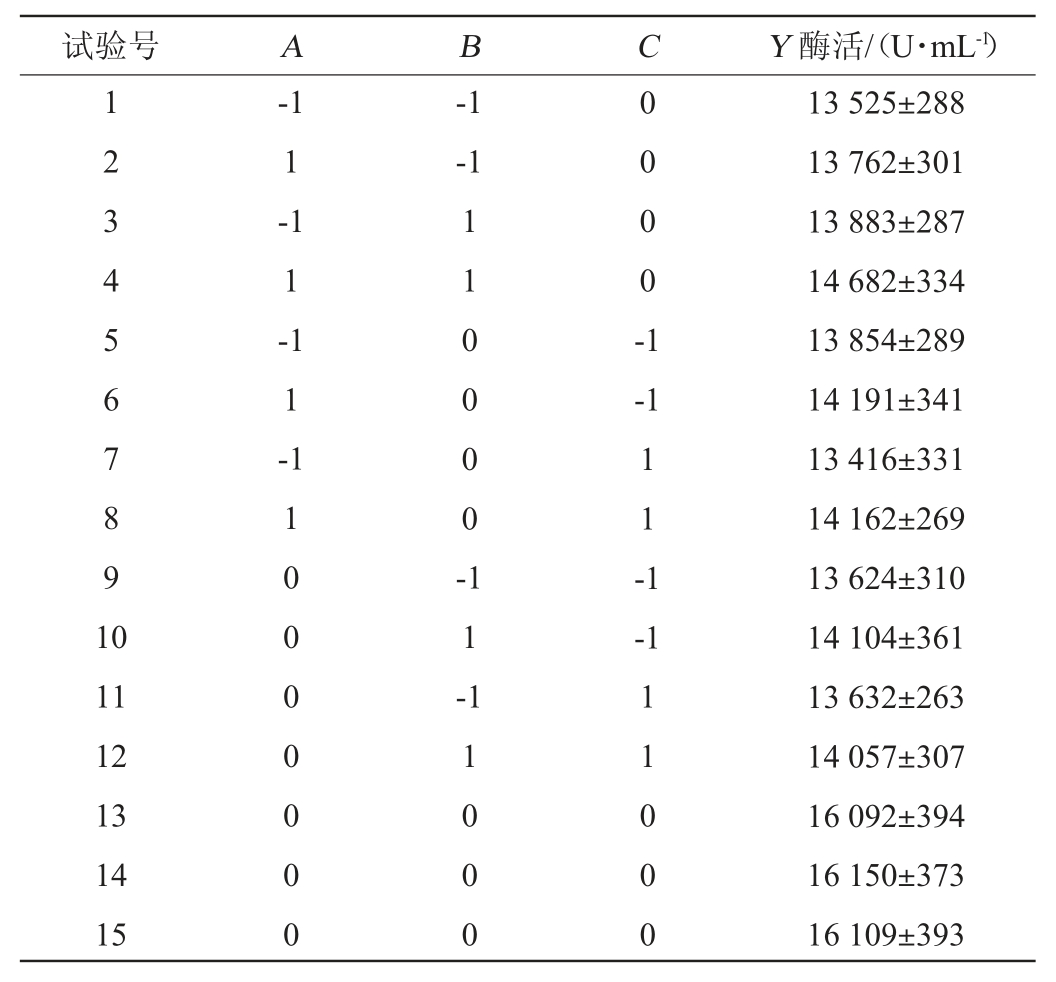
根据单因素试验的结果,以玉米粉(A)、碳酸钠(B)、豆饼粉(C)添加量为自变量,以碱性蛋白酶酶活(Y)为响应值进行响应面试验优化,试验设计及结果见表4。
表4 响应面试验设计及结果
Table 4 Design and results of response surface tests
2.5.2 构建数学模型及方差分析
采用Design-Expert 8.0.6软件对表4试验数据进行分析,构建数学模型。得到最终二次回归方程为:
回归方程决定系数R2=0.996 6,表示有99.68%的数据可以用该模型来解释,调整决定系数R2Adj=0.990 9,说明该方程拟合性较好,可以用于分析。
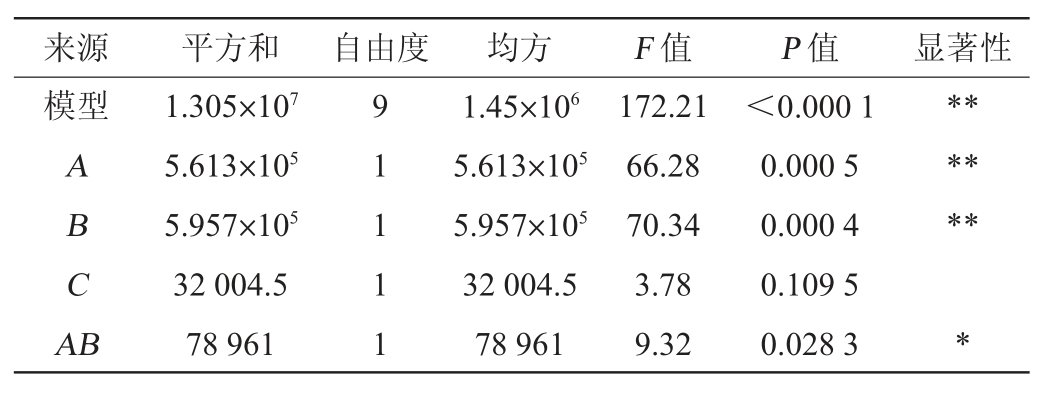
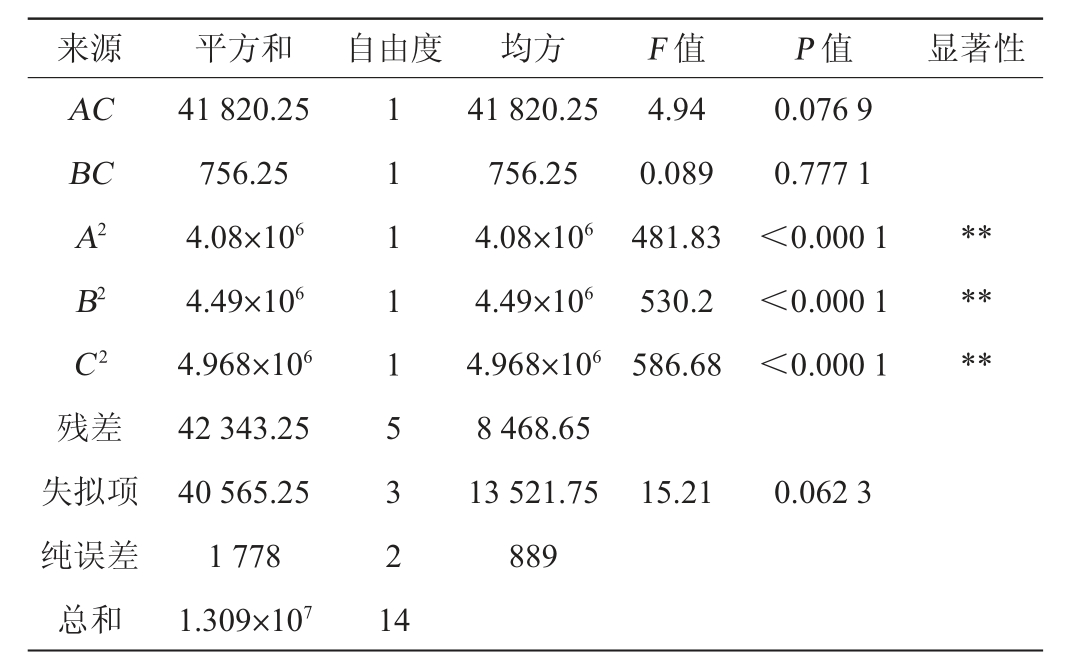
对回归方程进行方差分析,结果见表5。由表5可知,模型的P<0.000 1,表示此模型极显著,失拟项的P=0.062 3>0.05,说明失拟项不显著,说明模型与试验值之间的误差较小。一次项A、B及二次项A2、B2、C2对结果影响极显著(P<0.01),交互项AB对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。
表5 响应面试验结果方差分析
Table 5 Variance analysis of response surface tests results
续表
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极其显著(P<0.01)。
2.5.3 响应面图分析
各因素交互作用对诱变株F-3发酵产碱性蛋白酶影响的响应面及等高线见图9。由图9可知,当3个因素中其中一个固定为零水平时,其他两个因素存在交互作用且存在一个最高的组合点,其中,碳酸钠和玉米粉交互作用较显著,响应面曲线走势较陡,有明显的最高点和最优水平,与方差分析结果一致。
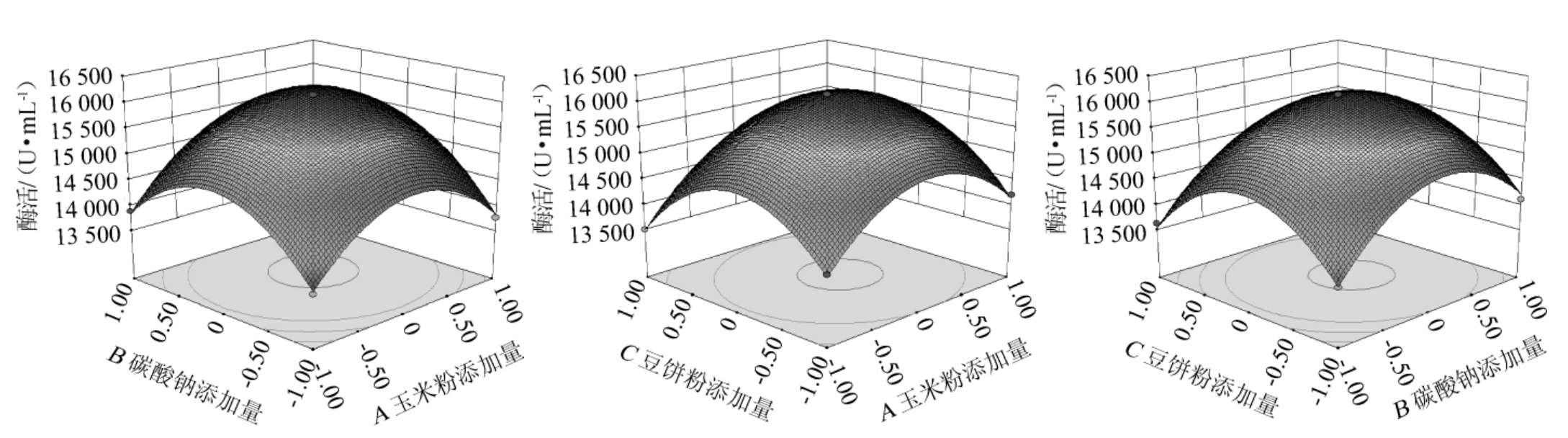
图9 各因素交互作用对诱变株F-3产碱性蛋白酶的响应面和等高线
Fig.9 Response surface plots and contour lines of effect of interaction between each factors on alkaline protease production by mustant strain F-3
2.5.4 响应面预测与验证
对回归方程求解产碱性蛋白酶酶活的极大值,得出培养基玉米粉、碳酸钠、豆饼粉的添加量分别为41.34 g/L、2.07 g/L、39.78 g/L,预测的产碱性蛋白酶酶活最高可达16 153.5 U/mL。为方便实际应用,将培养基调整为玉米粉41g/L、碳酸钠2.1g/L、豆饼粉40g/L。在此优化条件下进行3组平行试验,得出平均碱性蛋白酶酶活实际值为16 156 U/mL,与预测值基本吻合。说明本次试验模型对地衣芽孢杆菌产碱性蛋白酶具有一定指导意义。
3 结论
本研究以提高碱性蛋白酶酶活为目标,采用ARTP与氯化锂复合诱变方法对地衣芽孢杆菌E-417进行诱变,确定氯化锂添加量1.5%,ARTP照射45 s为最适复合诱变条件。对诱变后的菌株进行酪蛋白平板初筛、摇瓶复筛、遗传稳定性验证,最终筛选出诱变株F-3为高产碱性蛋白酶的优良菌株,酶活达到12 147 U/mL,较原始菌株提高了31.7%。通过单因素及响应面试验对其发酵产碱性蛋白酶的条件进行优化。结果表明,诱变株F-3产碱性蛋白酶的最佳发酵培养基为玉米粉41 g/L、豆饼粉40 g/L、碳酸钠2.1 g/L、磷酸氢二钠2.0 g/L;最佳发酵条件为发酵温度37 ℃、初始pH值7.0、接种量为8%。在此优化条件下,碱性蛋白酶酶活达到16 156 U/mL,为进一步提高碱性蛋白酶酶活奠定基础。
[1]叶思帆,赵媛.微生物源碱性蛋白酶的生产及其应用[J].青海科技,2018,25(2):73-76.
[2]王兴吉,佟新伟,王克芬,等.芽孢杆菌产碱性蛋白酶的研究进展[J].食品与发酵科技,2019,55(1):62-65.
[3]SARKER P K,TALUKDAR S A,DEB P,et al.Optimization and partial characterization of culture conditions for the production of alkaline protease from Bacillus licheniformis P003[J].Springer Plus,2013,2(1):506
[4]杨金龙,潘康成.高产碱性蛋白酶地衣芽孢杆菌的研究进展[A].中国畜牧兽医学会动物微生态学分会.中国畜牧兽医学会动物微生态学分会第三届第七次学术研讨会论文集[C].中国畜牧兽医学会动物微生态学分会:中国畜牧兽医学会,2004:3.
[5]SHARMA K M,KUMAR R,PANWAR S,et al.Microbial alkaline proteases:Optimization of production parameters and their properties[J].J Genet Eng Biotechnol,2017,15(1):115-126.
[6]PALSANIYA P,MISHRA R,BEEJAWAT N,et al.Optimization of alkaline protease production from bacteria isolated from soil[J].J Microbiol Biotechn Res,2017,2(6):858-865.
[7]HUSSAIN F,KAMAL S,REHMAN S,et al.Alkaline protease production using response surface methodology,characterization and industrial exploitation of alkaline protease of Bacillus subtilis sp.[J].Catal L,2017,147(5):1204-1213.
[8]支君.蛋白酶高产菌株的选育及酶学性质研究[D].新乡:河南师范大学,2011.
[9]赵志军,李敏,刘延波,等.高糖化力白曲霉的复合诱变及固态发酵条件优化[J].中国酿造,2020,39(9):80-85.
[10]孔帅,陈敏,郑美娟,等.常温常压等离子体诱变选育高产L-异亮氨酸谷氨酸棒杆菌[J].中国酿造,2019,38(7):76-79.
[11]张雪,张晓菲,王立言,等.常压室温等离子体生物诱变育种及其应用研究进展[J].化工学报,2014,65(7):2676-2684.
[12]韩经,张华东,许忠平,等.常压室温等离子体诱变选育乳酸乙酯酯化酶高产菌株[J].中国酿造,2019,38(11):129-133.
[13]邱雁临,梁亮,汪亮.紫外线与氯化锂复合诱变选育L-组氨酸产生菌[J].现代食品科技,2008(3):217-219.
[14]李兆飞,姚鹃,余华顺,等.氯化锂-离子束复合诱变核酸酶P1 高产菌株研究[J].食品科技,2013,38(12):2-4,8.
[15]蒋彪,王常高,杜馨,等.响应面法优化芽孢杆菌CJPE209 产角蛋白酶发酵培养基的研究[J].中国酿造,2017,36(5):76-80.
[16]王珊珊,陈燕,刘盾,等.地衣芽孢杆菌LS-1 产蛋白酶发酵条件的优化[J].安徽农学通报,2018,24(24):22-24.
[17]蒋彪,王常高,杜馨,等.产角蛋白酶菌株的筛选及发酵条件优化[J].食品工业科技,2017,38(12):182-185.
[18]敖静,桓明辉,李杨,等.1 株耐高温产蛋白酶细菌的筛选鉴定及其液体发酵条件的优化[J].河南农业科学,2016,45(11):116-121,125.
[19]莫怡琴,刘杰,刘芸,等.紫外链霉素复合诱变选育高产surfactin 菌株研究[J].中国饲料,2020(3):32-36.
[20]梁剑光,顾秋忆,秦修东,等.利用常压室温等离子体(ARTP)诱变选育高产核酸酶P1 菌株[J].食品工业科技,2015,36(21):183-186.
[21]李晓林.碱性蛋白酶高产诱变菌株的选育及发酵工艺研究[D].洛阳:河南科技大学,2017.
[22]黄文晶.高产碱性蛋白酶重组菌及其发酵性能[D].无锡:江南大学,2012.
[23]卢利娜,陈建华.紫外-氯化锂复合诱变选育高产α-淀粉酶菌株[J].化学与生物工程,2015,32(6):54-56.
[24]李云雁,胡传荣.试验设计与数据处理[M].北京:化学工业出版社,2008:199-200.
[25]郑海燕.枯草芽孢杆菌S1-4 的ARTP 诱变、发酵条件优化及BsuKER-68基因的克隆与表达[D].成都:四川师范大学,2019.