L-组氨酸(L-histidine)是含有咪唑基团的半必需碱性氨基酸,因其具有免疫调节[1]和抗氧化[2]等多种生理功效而被广泛应用于食品[3]、饲料[4]和医药[5]等领域。以血粉等天然蛋白质为原料的水解提取法是目前L-组氨酸的主要生产方式,但由于单一分离组氨酸成本高、提取损失率高等因素导致该方法在组氨酸大规模工业生产中的应用受到限制[6]。发酵法是最理想的氨基酸生产方法,通过发酵法生产的L-谷氨酸[7]、L-赖氨酸[8]等大宗氨基酸品种早已形成产业化。然而L-组氨酸是为数不多的几种未能实现大规模发酵生产的氨基酸品种之一,因此选育L-组氨酸产生菌株对加快发酵法生产L-组氨酸具有非常重要的意义。然而由于从头合成L-组氨酸的途径长、代谢调控复杂,完全利用系统代谢工程改造菌株难度大并且L-组氨酸产量提高不明显[9]。通过选育氨基酸结构类似物抗性突变株获得氨基酸产生菌株,依然是目前氨基酸发酵常规育种的有效方法[10]。
常压室温等离子体(atmospheric and room temperature plasma,ARTP)是一种新型的诱变技术,因其具有突变率高、环境友好、操作安全等优势[11],已被广泛应用于氨基酸[12]、维生素[13]、二十二碳六烯酸(docosahexaenoic acid,DHA)[14]等高产菌株的选育。虽然ARTP诱变在突变库容量、突变率等方面发挥的巨大优势,但突变后的菌株仍然面临筛选工作量大的问题。近期基于微流控技术开发出的全自动高通量微生物液滴培养系统(microbialmicrodropletculturesystem,MMC)[15]具有高通量、自动培养、自动传代、化学因子梯度添加、在线检测液滴的生长以及微生物分选等功能,目前已被用于菌种压力富集筛选[16]、菌种适应性进化[17]等方面的研究。
为了获得L-组氨酸过量产生菌株,以野生型谷氨酸棒杆菌ATCC 14067为出发菌株,首先利用常压室温等离子体(ARTP)对菌株进行诱变处理,然后通过全自动高通量微生物液滴培养系统(MMC)和平板相结合选育耐受高浓度组氨酸结构类似物的抗性突变株。通过孔板发酵初筛以及摇瓶发酵复筛,分析各个结构类似物抗性突变体产L-组氨酸的能力并确定最佳L-组氨酸产生菌株。菌株选育流程如下:
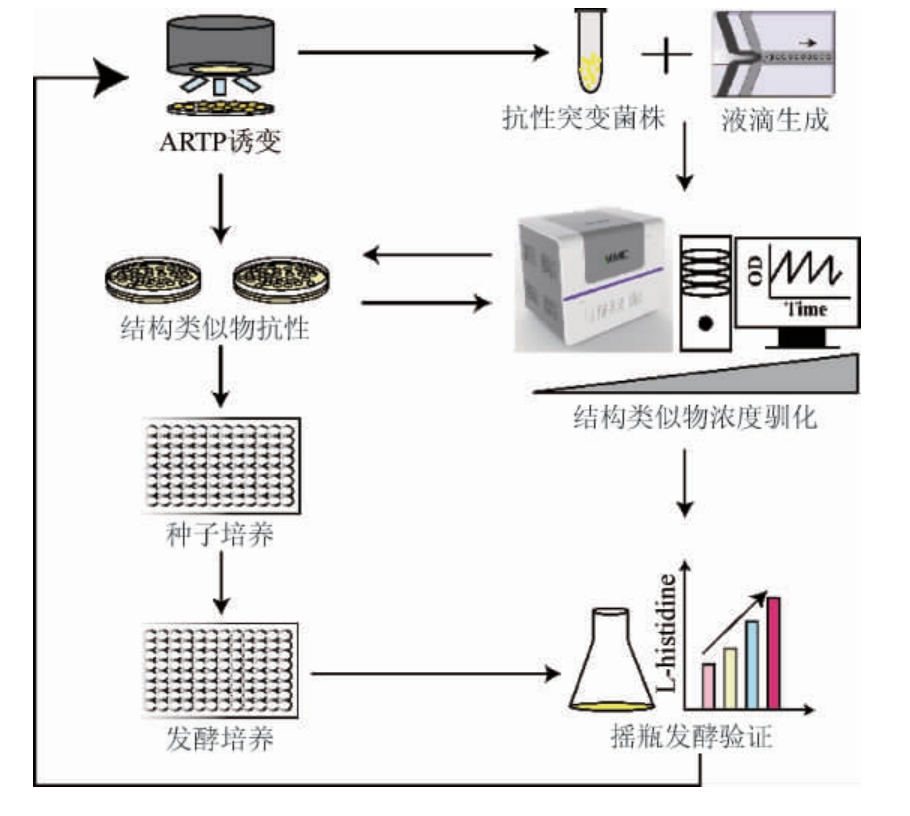
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与主要试剂
野生型谷氨酸棒杆菌(Corynebacterium glutamicum)ATCC 14067:美国菌株保藏协会购买并保存于实验室。
L-组氨酸(L-histidine,L-His)、D-组氨酸(D-His)、对氨基苯磺酸(纯度99.5%)、玉米浆:上海阿拉丁生化科技股份有限公司;3-氨基-1,2,4-三氮唑(3-amino-1,2,4-triazole,AMT)(纯度96%)、3-(N-吗啉基)丙磺酸(3-morpholinopropanesulfonic acid,MOPS)(纯度99.5%):上海麦克林生化科技股份有限公司;脑心浸液(brain heart infusion,BHI):美国BD公司;其他试剂均为国产分析纯。
1.1.2 培养基
脑心浸液培养基:脑心浸液37 g/L,固体培养基中加入琼脂20 g/L,调pH 7.0,121 ℃灭菌20 min。
选择培养基:BHI固体培养基灭菌冷却至60 ℃左右后,添加过滤除菌的不同质量浓度的L-组氨酸类似物3-氨基-1,2,4-三氮唑(AMT)和(或)D-组氨酸(D-His),制成组氨酸类似物抗性平板。
种子培养基:(NH4)2SO45 g/L,玉米浆35 g/L,K2HPO41 g/L,MgSO4·7H2O 0.5 g/L,调pH 至7.0,121 ℃灭菌20 min;葡萄糖25 g/L单独灭菌。
发酵培养基:(NH4)2SO420 g/L,KH2PO41 g/L,K2HPO41 g/L,MgSO4·7H2O 0.25 g/L,3-(N-吗啉基)丙磺酸(MOPS)42 g/L,调pH 7.0,121 ℃灭菌20 min;葡萄糖40 g/L,尿素5 g/L分别单独灭菌;FeSO4·7H2O 10 mg/L,MnSO4·H2O 10 mg/L,CaCl210 mg/L,ZnSO4·7H2O 1 mg/L,NiCl2·6H2O 0.02 mg/L,CuSO40.2 mg/L,生物素0.2 mg/L,原儿茶酸0.03 mg/L,硫胺素HCl 0.1 mg/L(上述微量元素、生物素、硫胺素HCl、原儿茶酸配制母液并过滤除菌后按上述质量浓度加入)。
1.2 仪器与设备
UV-2802S型分光光度计:上海尤尼柯仪器有限公司;ARTP-M诱变系统、MMC-B微生物液滴细胞培养仪:天木生物科技有限公司;5810R台式离心机:德国Eppendorf公司;恒温培养摇床:上海知楚仪器有限公司;DHP-9052A电热恒温培养箱:绍兴市景迈仪器设备有限公司;L550湘仪离心机:济南千司生物技术有限公司;48深孔板:上海甘薇生物科技有限公司;48浅孔板:美国康宁公司。
1.3 方法
1.3.1 ARTP诱变
将活化的菌液转接于种子培养基,控制起始OD600nm值为0.2~0.3,待培养OD600nm值为0.8~1.0时离心收集菌体。用无菌生理盐水洗涤3次,再将菌体稀释至OD600nm值为0.6~0.8。取10 μL菌液均匀涂抹在载片上,随后载片放入ARTP仪器样品板中,与等离子炬喷嘴对齐并暴露于辐射下。ARTP诱变参数:载片与气流端口距离2 mm;射频功率100 W;气流量10 SLM;温度25~35 ℃。实验中各个组ARTP处理为0、30~270 s,处理过后的载片用1 mL 的0.85%无菌生理盐水洗下菌体并稀释适当倍数后,取100 μL均匀涂抹于BHI培养基固体平板上,每组设置3个平行,30 ℃培养3~4 d后进行单菌落计数,并计算致死率,其计算公式如下:
式中:A为未经ARTP诱变处理对照菌的总菌落数,CFU/mL;B为经ARTP诱变处理后对应的总菌落数,CFU/mL。
1.3.2 诱变菌株筛选
初筛:根据菌落生长的大小、圆整和丰度,从组氨酸结构类似物抗性平板上随机挑选单菌落进行孔板筛选。种子培养使用48孔浅孔板,装液量400 μL,于30 ℃、800 r/min条件下摇床培养24 h;发酵培养使用48孔深孔板,装液量800 μL,接种量为10%,每株菌3个平行,于30 ℃、650 r/min条件下摇床培养72 h后,发酵结束后用孔板离心机收集上清液进行组氨酸含量测定。
复筛:将孔板筛选得到的组氨酸生产菌株,进行摇瓶复筛验证。种子培养使用250 mL摇瓶,装液量25 mL,于30 ℃、250 r/min的摇床培养24 h;发酵培养使用500 mL摇瓶,装液量30 mL,接种量为10%,每株菌三个平行,于30 ℃、250 r/min条件下摇床培养72 h后,发酵结束后测定发酵上清液组氨酸含量。
1.3.3 AMT抗性菌株驯化
将从组氨酸结构类似物AMT抗性平板筛选得到的组氨酸生产菌株,接种于含有一定质量浓度组氨酸结构类似物AMT的BHI培养基中,30 ℃、250 r/min振荡培养24 h。培养结束后,用新灭菌的BHI培养基将菌液稀释至OD600nm值为0.8~1.2,之后注入液滴微流控培养仪专用进样瓶(液滴生成进样瓶),同时配制一个含低质量浓度AMT(2 g/L)的BHI培养基进样瓶和一个含高质量浓度AMT(10 g/L)的BHI培养基进样瓶。通过MMC设备使菌株在含组氨酸类似物的培养基中培养、传代并伴随不同质量浓度的AMT添加,最后根据菌株驯化生长情况选择相应液滴,进行收集。
1.3.4 L-组氨酸含量的测定
采用Pauly比色法测定发酵液中组氨酸的含量[18]。L-组氨酸标准曲线的绘制:将配制好的质量浓度为0.1 g/L的组氨酸标准溶液分别准确吸取0、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL于10 mL比色管中,加入0.2 mL 1%对氨基苯磺溶液和0.2 mL 5%亚硝酸钠溶液,混匀后25 ℃水浴反应15 min;反应结束后迅速加入10%碳酸钠溶液0.6 mL,振荡10 s后,加入2 mL体积分数20%的乙醇溶液,混匀后盖上瓶塞,室温条件下静置5 min;之后定容至10 mL。在本实验条件下利用分光光度计分析反应产物最大吸收波长以及对应的吸光度值。
1.3.5 细胞生物量测定
将发酵液稀释20倍,在波长600 nm处测量吸光度值。
1.3.6 突变菌株遗传稳定性分析
将筛选出的组氨酸生产菌株,接种于BHI液体培养基进行活化,然后将其转移至种子培养基中并连续转移7次,之后进行摇瓶发酵,测试突变菌株组氨酸生产能力以及生长状况。
2 结果与分析
2.1 L-组氨酸标准曲线的确定
通过在300~800 nm波长条件下扫描Pauly试剂以及不同浓度的L-组氨酸Pauly显色产物,结果见图1。由图1a可知,当反应中有L-组氨酸参与时,在波长500 nm处存在吸收峰;由图1b可知,在此波长条件下随着反应的L-组氨酸质量浓度增加,对应的吸光度值也在增加;由图1c可知,以L-组氨酸质量浓度(x)为横坐标,对应波长500 nm处吸光度值(y)为纵坐标,绘制L-组氨酸的标准曲线方程为y=13.678x+0.043,相关系数R2=0.996 4,L-组氨酸检测质量浓度在0.01~0.05 g/L范围内线性关系良好,可用于发酵液中L-组氨酸含量的测定。
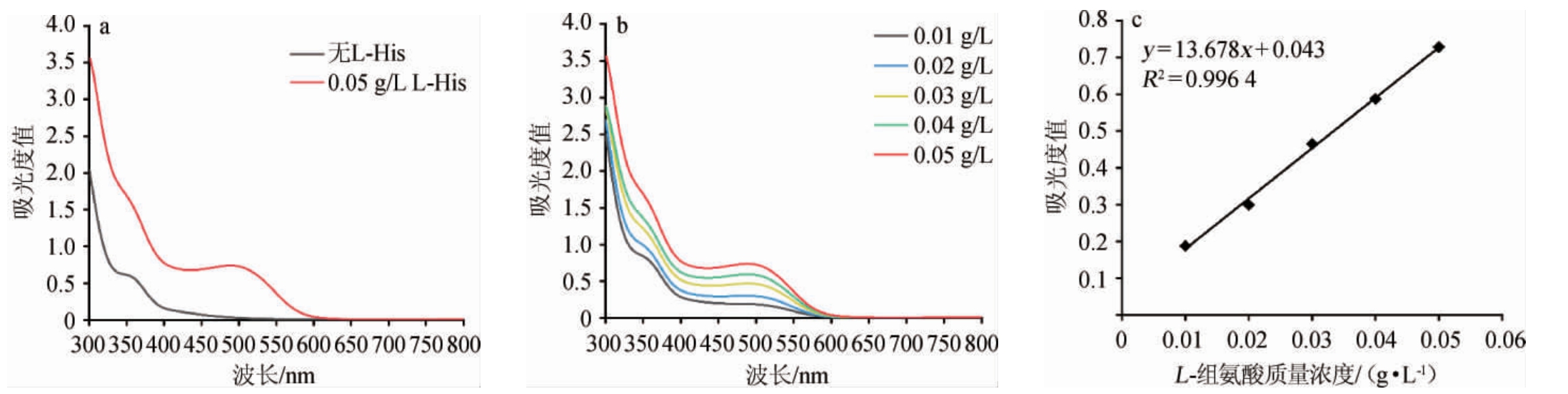
图1 Pauly试剂(a)和L-组氨酸(b)的显色产物吸光度值检测结果及L-组氨酸标准曲线(c)
Fig.1 Result absorbance detection of the color product of Pauly reagent (a) and L-histidine (b) and standard curve of L-histidine (c)
a:不含和含有组氨酸标准溶液时的Pauly显色产物吸光度值检测;b:五种不同质量浓度组氨酸标准溶液的Pauly显色产物吸光度值检测;c:不同质量浓度的组氨酸标准溶液的Pauly显色产物与500 nm处吸光度值的对应关系及线性拟合图。
2.2 ARTP诱变致死曲线的测定
按照方法1.3.1,对出发菌野生型谷氨酸棒杆菌ATCC 14067进行ARTP诱变,按照ARTP处理时间为变量,测定菌株致死曲线。如图2所示,当ARTP照射180 s时,菌株致死率可达83.05%;进一步将ARTP处理时间增至210 s时,菌株致死率高达93.26%;而ATRP处理240 s后菌株致死率基本稳定在98.11%。根据之前的研究报道[19],当菌株致死率约为90%时菌株正突变率最高,但由于本实验ARTP照射时间超过240 s后,几乎没有菌体存活下来,因此确定野生型谷氨酸棒杆菌ATCC 14067最佳的诱变时间210 s。
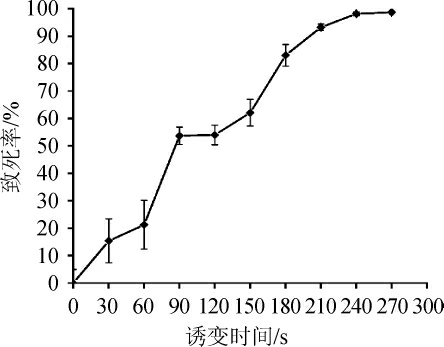
图2 谷氨酸棒杆菌ATCC 14067 常压室温等离子诱变致死曲线
Fig.2 Lethal rate curve of Corynebacterium glutamicum ATCC 14067 mutated by ARTP
2.3 L-组氨酸产生菌的选育
2.3.1 AMT抗性突变株的筛选
将野生型谷氨酸棒杆菌ATCC 14067利用ARTP处理后,分别稀释涂布于含5种不同质量浓度的AMT抗性平板上。从抗性平板上一共挑取264个单菌落,通过孔板发酵72 h后检测组氨酸产量,结果如表1所示。由表1可知,5.0 g/L和4.0 g/L AMT 抗性平板上的菌株明显比1.0 g/L、2.0 g/L、3 g/L AMT抗性平板的菌株的正突变率要高,这说明从抗性较高的突变菌株中,筛选获得组氨酸积累菌株的可能性更大。
表1 不同质量浓度的3-氨基-1,2,4-三氮唑抗性突变株筛选结果
Table 1 Screening results of resistant mutants by different concentrations of 3-amino-1,2,4-triazole

从117株正突变菌株中,挑选出产量最高的6株菌株(编号为Cg-A1~Cg-A6)与出发菌株谷氨酸棒杆菌ATCC 14067(编号为Cg-A0)一起进行摇瓶发酵进一步验证组氨酸产量以及检测对应的细胞生物量,结果如图3所示。由图3可知,菌株Cg-A1组氨酸产量最高可达(110.39±2.09)mg/L,比出发菌株提高约493%,但菌株Cg-A1生长OD600nm值较出发菌株却下降了38.11%,下降幅度较为明显。
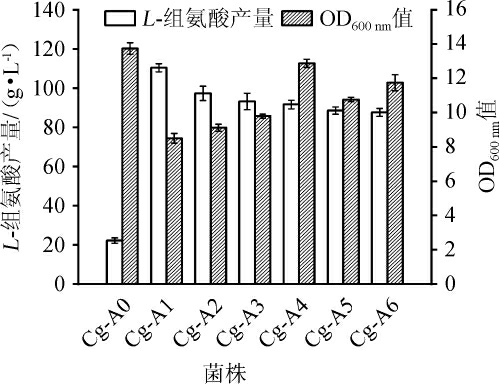
图3 菌株Cg-A0和Cg-A1~A6摇瓶发酵的OD600nm值和L-组氨酸产量
Fig.3 OD600nmvalue and L-histidine yields of Cg-A0 and Cg-A1-A6 after shake-flask fermentation
2.3.2 AMT抗性菌株稳定表型的筛选
以菌株Cg-A1作为出发菌株,按照方法1.3.3对其进行AMT浓度耐受性驯化,结果如图4所示。在传代时间恒定条件下,由图4a可知,随着培养基中AMT的浓度在2~10 g/L范围内增加,菌株整体生长呈现下降趋势,并且当AMT质量浓度为10g/L时,OD600nm值下降至5左右。因此需要在AMT10g/L条件下连续驯化多代,结果见图4b。由图4b可知,液滴在不含AMT的条件下传代培养3代,OD600nm值能够恢复并且稳定在12~14。然后将AMT质量浓度固定为10 g/L,在前两代,液滴生长OD600nm值整体有一个明显的下降,但之后液滴整体生长呈现稳定的趋势,此时表明菌株能够稳定耐受10 g/L AMT。根据生长状况提取驯化OD600nm值最高的6个液滴进行摇瓶发酵检测L-组氨酸产量情况,由图5可知,驯化之后的菌株(编号为Cg-B1~Cg-B6)较驯化之前的菌株Cg-A1,L-组氨酸产量都有明显的提高,其中菌株Cg-B1的组氨酸产量最高可达(0.23±0.013)g/L,同时该菌株的生长OD600nm值与野生型菌株Cg-14067的OD600nm值相接近。
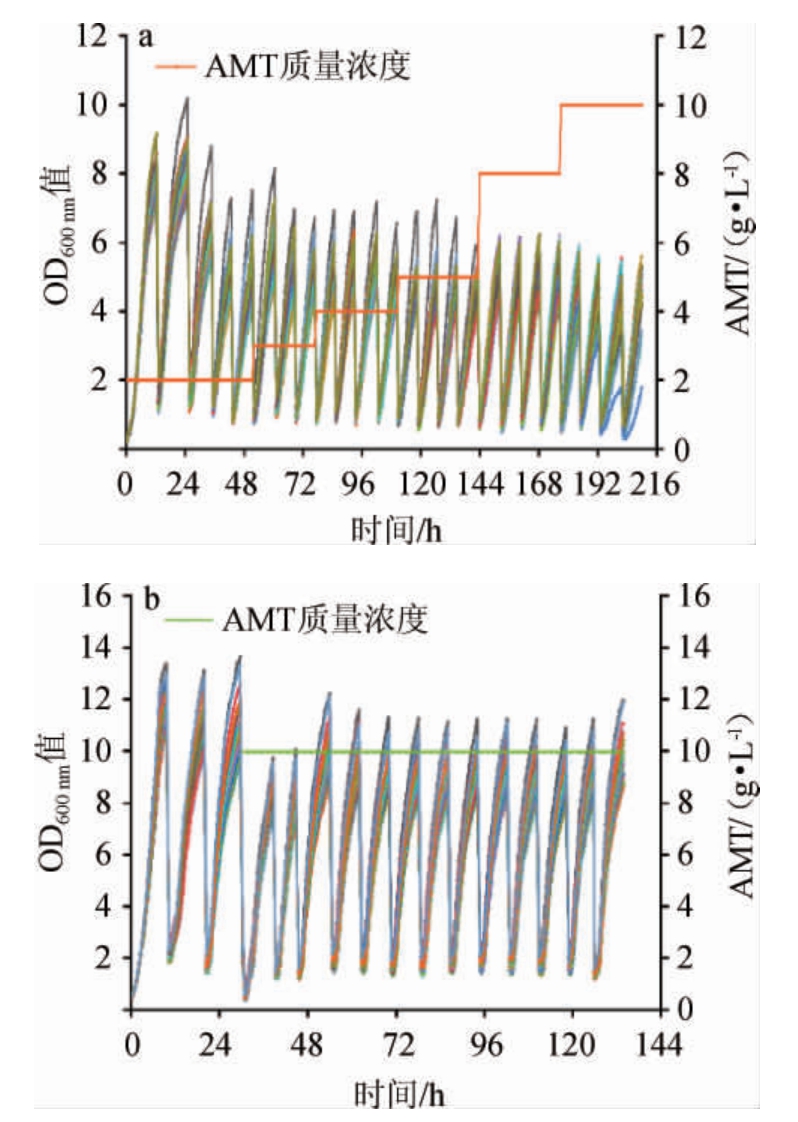
图4 组氨酸类似物3-氨基-1,2,4-三氮唑不同含量条件下菌体生长曲线
Fig.4 Growth curves of the strain under different concentration of histidine analog 3-amino-1,2,4-triazole
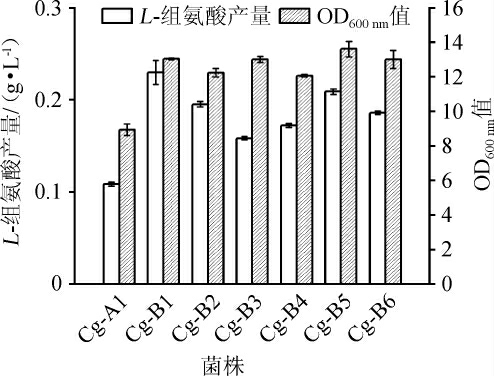
图5 驯化后菌株摇瓶发酵OD600nm值和L-组氨酸产量
Fig.5 OD600nmvalue and L-histidine yields of strain after domestication by shake-flask fermentation
2.3.3 AMT和D-His双重抗性突变株的筛选
D-组氨酸(D-His)与组氨酸结构相似度极高,已被用作组氨酸结构类似物抗性突变株的表型筛选[20]。为了筛选到组氨酸产量进一步提高的菌株,以菌株Cg-B1作为出发菌,采用ARTP迭代诱变的处理方式(即:将每一轮筛选得到组氨酸产量最高的菌株作为下一轮诱变的起始菌株),并且于两种组氨酸类似物AMT和D-His在平板上AMT质量浓度固定为10 g/L、D-His的质量浓度依次从2 g/L递增至8 g/L。从双重抗性平板上的挑取单菌落,通过48孔板发酵72 h后检测发酵上清液中L-组氨酸含量,各轮检测结果如图6所示。由图6可知,最终从耐受组氨酸结构类似物AMT 10 g/L和D-His 8 g/L表型中筛选到L-组氨酸产量最高的菌株Cg-F4,该菌株积累L-组氨酸产量可达(0.561±0.016)g/L。
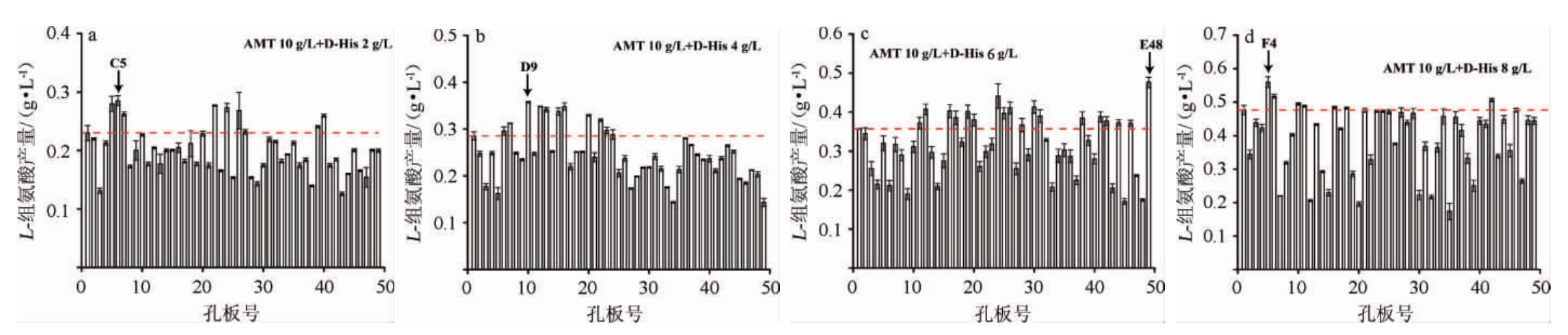
图6 组氨酸结构类似物3-氨基-1,2,4-三氮唑和D-His抗性突变株初筛选结果
Fig.6 Screening results of histidine analogs 3-amino-1,2,4-triazole and D-His resistant mutants
2.4 诱变菌株的遗传稳定性
按照方法1.3.6,对突变株Cg-F4 的生长和组氨酸生产的遗传稳定性进行考察,结果如图7所示。由图7可知,菌株Cg-F4传代7次之后,分别发酵72 h后L-组氨酸可稳定在0.55 g/L左右,OD600nm值都在9左右,表明突变菌株Cg-F4菌株具有良好的遗传稳定性。
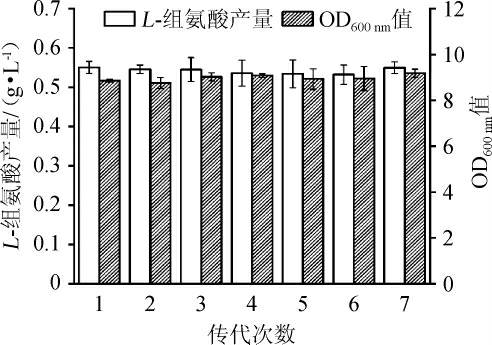
图7 突变菌株Cg-F4的遗传稳定性分析结果
Fig.7 Analysis results of genetic stability for mutant Cg-F4
2.5 讨论
L-组氨酸的生物合成受其自身的反馈抑制和反馈阻遏,消除这种反馈调节是开发组氨酸产生菌株的重要一步[21]。选育组氨酸结构类似物抗性突变株解除L-组氨酸自身的反馈调节,使菌株积累L-组氨酸[22]。本研究通过ARTP诱变技术与MMC技术相结合可以高效选育稳定表型的组氨酸结构类似物抗性突变株,同时利用L-组氨酸与Pauly试剂反应生成颜色化合物这种特性,实现了L-组氨酸的快速测定,提高了L-组氨酸产生菌的筛选效率。目前使用了两种组氨酸结构类似物作为筛选压力,筛选到L-组氨酸产生菌Cg-F4,为了进一步提高菌株产L-组氨酸的能力,可以在下两个方面进行研究:进一步提高目前组氨酸结构类似物的浓度或者引入其他种类组氨酸结构类似物抗性标记,更进一步解除了组氨酸自身的反馈调节,使产量不断提升。发酵条件及工艺控制的优化对进一步提高L-组氨酸的积累至关重要,因此,在选育高产菌种后,还应进行发酵条件及工艺控制的优化,包括发酵培养基的组成、pH值、温度、溶氧量等。
3 结论
本研究首次将ARTP诱变技术与MMC技术相结合定向选育组氨酸结构类似物抗性突变株。通过孔板发酵初筛以及摇瓶发酵复筛,最终从耐受两种组氨酸结构类似物抗性突变株中筛选获得菌株Cg-F4 其L-组氨酸产量可达(0.561±0.016)g/L。菌株Cg-F4经过7次连续传代实验,证明该突变菌株具有良好的遗传稳定性。
[1]O'MAHONY L,AKDIS M,AKDIS C A.Regulation of the immune response and inflammation by histamine and histamine receptors[J].J Allerg Clin Immunol,2011,128(6):1153-1162.
[2]WADE A M,TUCKER H N.Antioxidant characteristics of L-histidine[J].J Nutr Biochem,1998,9(6):308-315.
[3]BERVEN L,ATHINS L,CASTLES D.Origin of the recommended intake of L-histidine by infants[J].Eur J Nutr Food Safety,2014,4(4):404-407.
[4]胡孟,武书庚,王晶,等.组氨酸的生理功能及在动物生产中的应用[J].中国饲料,2018(7):38-45.
[5]孙希叶,杨平平,李旋,等.组氨酸发酵条件及高产菌株选育研究进展[J].中国酿造,2010,29(9):28-30.
[6]何俊锋.L-组氨酸产生菌的选育及其发酵条件优化[D].无锡:江南大学,2006.
[7]梁玲,黄钦耿,翁雪清,等.产L-谷氨酸工程菌株的诱变选育及其发酵效率[J].生物技术通报,2020,36(6):143-149.
[8]XU J Z,RUAN H Z,YU H B.Metabolic engineering of carbohydrate metabolism systems in Corynebacterium glutamicum for improving the efficiency of L-lysine production from mixed sugar[J].Microb Cell Factor,2020,19(1):39.
[9]SCHWENTNER A,FEITH A,MÜNCH E,et al.Modular systems metabolic engineering enables balancing of relevant pathways for L-histidine production with Corynebacterium glutamicum[J].Biotechnol Biofuel,2019,12(1):65.
[10]陈宁.氨基酸工艺学[M].北京:中国轻工业出版社,2016:241-242.
[11]YU Q H,LI Y C,WU B,et al.Novel mutagenesis and screening technologies for food microorganisms:advances and prospects[J].Appl Microbiol Biotechn,2020,104(4):1517-1531.
[12]ZHANG X,ZHANG X M,XU G Q,et al.Integration of ARTP mutagenesis with biosensor-mediated high-throughput screening to improve L-serine yield in Corynebacterium glutamicum[J].Appl Microbiol Biotechn,2018,102(14):5939-5951.
[13]CAI Y Y,XIA M M,DONG H N,et al.Engineering a vitamin B12highthroughput screening system by riboswitch sensor in Sinorhizobium meliloti[J].BMC Biotechnol,2018,18(1):27.
[14]ZHAO B,LI Y F,LI C L,et al.Enhancement of Schizochytrium DHA synthesis by plasma mutagenesis aided with malonic acid and zeocin screening[J].Appl Microbiol Biotechn,2018,102(5):2351-2361.
[15]JIAN X J,GUO X J,WANG J,et al.Microbial microdroplet culture system(MMC):An integrated platform for automated,high-throughput microbial cultivation and adaptive evolution[J].Biotechnol Bioeng,2020,117(6):1724-1737.
[16]赵孝阳.乙酸抗性菌株选育及混菌发酵生产乙醇[D].大连:大连理工大学,2020.
[17]WANG J,JIAN X J,XING X H,et al.Empowering a methanol-dependent Escherichia coli via adaptive evolution using a high-throughput microbial microdroplet culture system[J].Front Bioeng Biotechnol,2020,8:570.
[18]潘军华,张星元.比色法快速测定发酵液中组氨酸[J].无锡轻工大学学报,2002,21(3):254-258.
[19]JIANG M,WAN Q,LIU R M,et al.Succinic acid production from corn stalk hydrolysate in an E.coli mutant generated by atmospheric and roomtemperature plasmas and metabolic evolution strategies[J].J Ind Microbiol Biotechn,2014,41(1):115-123.
[20]侯颖,李江华,刘龙,等.L-组氨酸产生菌的选育及发酵条件优化[J].工业微生物,2013,43(6):18-25.
[21]KULIS-HORN R K,PERSIKE M,KALINOWSKI J. Corynebacterium glutamicum ATP-phosphoribosyl transferases suitable for L-histidine production-Strategies for the elimination of feedback inhibition[J].J Biotechnol,2015,206:26-37.
[22]ZHANG Y,SHANG X L,DENG A H,et al.Genetic and biochemical characterization of Corynebacterium glutamicum ATP phosphoribosyltransferase and its three mutants resistant to feedback inhibition by histidine[J].Biochimie,2012,94(3):829-838.