细菌纤维素(bacterial cellulose,BC)是微生物生产的类似于纤维素的由D-吡喃葡萄糖单体以β-1,4-糖苷键聚合而成的胞外直链高分子多糖;该多糖由直径3~4 nm的微纤维组成40~60 nm纤维束交织形成超精细3D纳米网状结构[1]。细菌纤维素这种独特高分子结构和超细3D纳米结构[2],使其具有高持水能力[3]、高聚合度[4]、高机械强度[5]、高结晶度[6]等优异性能。如细菌纤维素膜抗撕拉能力是等厚度聚乙烯膜、聚氯乙烯膜的6倍[7];其高吸水持水能力,经100 ℃干燥后的再溶胀能力与短棉绒相当[8];其聚合度和结晶度均高于大多数植物纤维,具有更稳定的物理力学和热学性质[9];另外,细菌纤维素还具有生物相容性、生物可降解性,可以将其用于伤口敷料以及组织工程支架的开发[10],是一种新型环境友好型生物材料。目前,细菌纤维素作为诸多传统合成材料的代替品,在生物医学、造纸、化妆品、环境污染治理以及食品制造等多个领域具有广阔的应用前景[11]。
细菌纤维素自1886年BROWN A J[12]首次报道以来,因其优异的材料性能越来越受到广泛关注,尤其是在细菌纤维素合成菌株筛选、鉴定[5],细菌纤维素合成机理及调控机制[10],细菌纤维素发酵工艺优化生产[13],细菌纤维素表面改性[14]等方面研究报道较多。然而,目前细菌纤维素由于生产菌种单一、合成产率低、合成碳源成本高等原因,仍难以满足应用市场对细菌纤维素材料的需求[15-16]。
为解决以上问题,本研究以含糖量较多的腐败葡萄为筛选源,筛选、分离鉴定高产细菌纤维素菌株,并通过扫描电镜(scanning electron microscope,SEM)、傅立叶变换红外光谱(Fourier transform infrared,FT-IR)、凝胶渗透色谱(gel permeation chromatography,GPC)、X-射线衍射(X-ray diffraction,XRD)等观察、分析测试手段鉴定获得菌株合成膜的微观结构、分子表面的官能团特性、分子质量分布特征以及结晶度等,为后续细菌纤维素的规模发酵生产研究奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种来源
腐败葡萄(产地:中国新疆):市售。
1.1.2 试剂
胰蛋白胨、酵母提取物、琼脂粉(均为生化试剂):英国OXOID公司;葡萄糖、十二水合磷酸一氢钠、氯化铵、氢氧化钠、无水乙醇、五氧化二磷、硫酸、硝酸、碳酸钠、二甲基亚砜(均为分析纯):北京化工厂;荧光增白剂:美国Sigma公司;柠檬酸(分析纯):上海源叶生物公司;五氧化二磷(分析纯):上海阿拉丁(Aladdin)公司。
1.1.3 培养基
富集培养基采用马血清(horse serum,HS)液体培养基:葡萄糖20 g/L,胰蛋白胨5 g/L,酵母提取物5 g/L,Na2HPO42.7 g/L,柠檬酸1.15 g/L,蒸馏水;灭菌条件为120 ℃,20 min。
HS平板筛选培养基:HS液体培养基中加入1~3 μg/mL荧光增白剂和15 g/L琼脂粉。
1.2 仪器与设备
FB224电子天平:上海舜宇恒平科学仪器有限公司;ZHJH-C1109B超净工作台:上海智城分析仪器制造有限公司;BXM-30R立式压力蒸汽灭菌器、HPX-9162MBE电热恒温培养箱:上海博迅医疗生物仪器股份有限公司;DW-86L626立式超低温保存箱:海尔集团;BOX EF-E凝胶成像系统:香港基因有限公司;JY-ECP3000电泳仪北京君意东方电泳设备有限公司;Life Touch TC-96/G/H聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:杭州博日科技股份有限公司;5424R高速冷冻离心机:德国艾本德股份公司;DMXY系列光学显微镜:宁波舜宇仪器有限公司;Sigma500场发射扫描电镜:德国蔡司公司;L1600400傅立叶红外光谱仪、Bruker D8 X射线衍射仪:德国Bruker(布鲁克)公司;Waters1515凝胶渗透色谱仪:美国Waters公司。
1.3 实验方法
1.3.1 菌株筛选
将腐败葡萄放入HS液体培养基(30 mL)中,30 ℃静置培养1~3 d,选用液体表面产生纤维素凝胶膜的发酵液保存待用。
1.3.2 菌株分离纯化
取上述从膜上挤压的发酵液进行浓度梯度稀释后(10-2、10-4、10-6、10-8、10-10),用各浓度梯度的稀释液100 μL分别在平板筛选培养基上进行涂布,30 ℃静置培养16~24 h,挑取在紫外灯下发荧光的单菌落接种到富集培养液中再次富集培养。重复进行上述操作6次,至平板筛选培养基上呈现形态一致的单菌落。
1.3.3 菌株特征观察
菌落形态观察:观察记录培养3~5 d的筛选平板培养基中的菌落形态,包括菌落色泽、形状、大小、透明度等。
革兰氏染色:滴一小滴蒸馏水于干净的载玻片上,按无菌操作法用接种环取少许菌体,涂于水滴内并做好标记,涂匀,干燥,加热固定;待涂片冷却后,先滴加结晶紫染色1 min,用水冲去染液,沥干,再滴加碘液媒染1 min,去碘液,水洗;以体积分数95%的乙醇脱色20~30 s,水洗,最后滴加番红复染2~3 min,水洗,干燥,镜检[17]。
生理生化特征:进行接触酶、乙醇氧化成酸[18]、乳酸盐氧化成CO2和H2O[19]、乙酸盐氧化成CO2和H2O[20]、甘油转酮、葡萄糖生酮、丙二酸利用[21]、D-山梨醇产酸、麦芽糖产酸、甘露醇产酸、阿拉伯糖利用、Frateu's Hoyer的生长等项目的检测[22]。具体操作参照《伯杰系统细菌学手册》。
1.3.4 菌株生物学分类
筛选菌株的16S rDNA扩增:利用该菌株的基因组脱氧核糖核酸(deoxyribonucleicacid,DNA)为模版,细菌16SrDNA通用引物1492 R:5'-GGTTAC CTTGTT ACGACT T-3',27F:5'-AGAGTT TGATCC TGGCTC AG-3',通过PCR反应扩增菌株的16S rDNA。扩增程序:94 ℃、5 min,94 ℃、1 min,56 ℃、1 min,72 ℃、1 min,72 ℃、7 min,循环数30。用1%的琼脂糖凝胶电泳检测、回收并纯化PCR样品送至吉林库美公司进行测序。将该菌株16S rDNA提交到美国国家生物技术信息中心(national center of biotechnology information,NCBI)与其他细菌进行比较,用MEGA 6.0软件构建其分子系统进化树,确定该菌株具体生物学分类。
1.3.5 合成物结构表征
菌株的培养及合成物提取:扩大培养规模至100 mL,在30 ℃、7~10 d培养后,取产生的菌膜经蒸馏水多次冲洗至菌膜表面无杂物及培养基后,将其置于0.5%的NaOH溶液中,放入100 ℃烘箱中处理2 h,待其冷却后再用蒸馏水多次冲洗至呈中性,沥干水分并进行冻干处理后得到干膜。
检测分析:扫描电镜观察(SEM)、吸水性、红外光谱检测(FT-IR)、凝胶渗透色谱(GPC)、X射线衍射(XRD)等。
2 结果与分析
2.1 筛选纯化结果
以腐败葡萄作为筛选源,经6次平板涂布筛选得到一株细菌纤维素合成菌,将其命名为菌株ZX C6-15。
2.2 菌株特征
2.2.1 菌落形态学观察
由图1A可知,菌株ZX C6-15单菌落呈乳白色、圆形、略微隆起、表面光滑、不产色素、产酸。由图1B可知,经革兰氏染色制片后光学显微镜(10×100)下看到该菌呈短杆状、单个或成对,颜色反应呈红色,说明ZX C6-15菌株为革兰氏阴性菌。由图1C可知,在紫外灯下发荧光、菌落直径大约为0.5 mm。
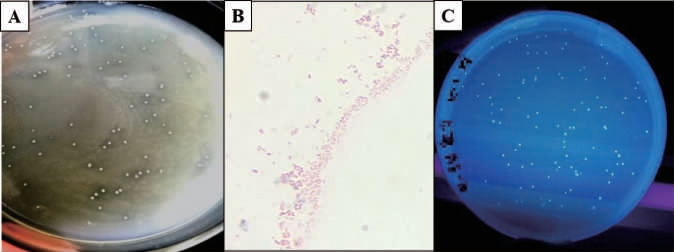
图1 菌株ZX C6-15菌落形态(A)、细胞形态(B)及紫外观察结果(C)
Fig.1 Colony morphology (A),cell morphology (B) and ultraviolet observation results (C) of strain ZX C6-15
2.2.2 生理生化检测
对菌株ZX C6-15进行生理生化特征检测结果见表1。由表1可知,该菌株与醋酸菌类似,对接触酶、阿拉伯糖利用、乙醇氧化成酸、甘油转酮、葡萄糖生酮等反应结果呈阳性,乳酸盐氧化成CO2和H2O、乙酸盐氧化成CO2和H2O、丙二酸利用、D-山梨醇产酸、麦芽糖产酸、甘露醇产酸、Frateu's Hoyer的生长等反应结果呈阴性。
表1 菌株ZX C6-15的生理生化特征
Table 1 Physiological and biochemical characteristics of strain ZX C6-15

注:“+’”代表结果阳性;“-”代表结果阴性。
2.3 菌株生物学分类结果
菌株ZX C6-15的16S rDNA序列全长为1 362 bp,分子系统进化树见图2。由图2可知,菌株ZX C6-15与Acetobacter syzygii strain SZCPY4:KU555381.1相似性达到100%,属于醋酸菌属,因此将其鉴定为醋酸菌属(Acetobacter sp.)ZX C6-15(NCBI登录号为:MT355921.1)。
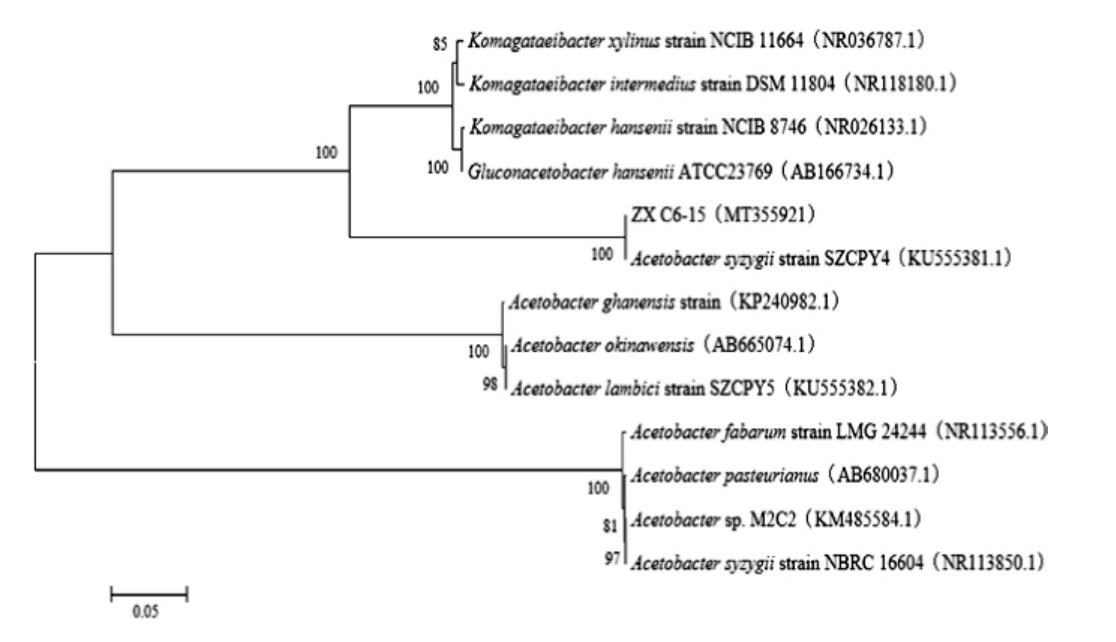
图2 基于16S rDNA基因序列菌株ZX C6-15系统发育树
Fig.2 Phylogenetic tree of strain ZX C6-15 based on 16S rDNA gene sequences
2.4 菌株ZX C6-15产膜的结构和性质表征
2.4.1 SEM观察
由图3可知,Acetobacter sp.ZX C6-15菌株产膜的扫描电镜图中,菌膜表面有少许残留物,纤维细而长,微纤维互相交叉、缠绕、折叠形成密集网状结构,这种超微纤维网结构决定了细菌纤维素的高持水性。产物扫描电镜结果与文献[23]中的细菌纤维素结构类似。

图3 醋酸菌ZX C6-15产膜的扫描电镜图
Fig.3 Scanning electron microscopy image of membrane produced by Acetobacter sp.ZX C6-15
2.4.2 吸水率检测
菌株Acetobacter sp.ZX C6-15产膜干燥后膜的吸水率测定结果见表2。
表2 醋酸菌ZX C6-15产膜的吸水率测定结果
Table 2 Determination results of water absorption rate of membrane produced by Acetobacter sp.ZX C6-15

由表2可知,该菌产膜的吸水率高于细菌纤维素模式菌株ATCC23769的吸水率,达到298%。结果表明,该菌株提取的产物具有良好的吸水性能,取决于产物具有的网状纳米纤维结构。
2.4.3 FT-IR检测
菌株Acetobacter sp.ZX C6-15合成的样品进行红外光谱检测结果见图4。由图4可知,波数3 352 cm-1处峰型宽且较强的为O-H键吸收峰;波数2 918 cm-1处为C-H键吸收峰;波数1 625 cm-1处为纤维素4'端半缩醛基吸收峰;波数1 159 cm-1处为C-O键吸收峰,与模式菌ATCC23769产ATCC-BC所含有的官能团基本吻合,也与MACHADO R T A等[24]的研究结果相符。结果表明,Acetobacter sp.ZX C6-15菌株产生膜是细菌纤维素。
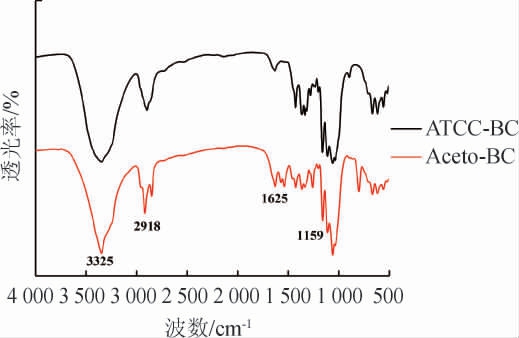
图4 醋酸菌ZX C6-15产膜的红外光谱图
Fig.4 FT-IR spectrum of membrane produced by Acetobacter sp.ZX C6-15
2.4.4 凝胶渗透色谱检测
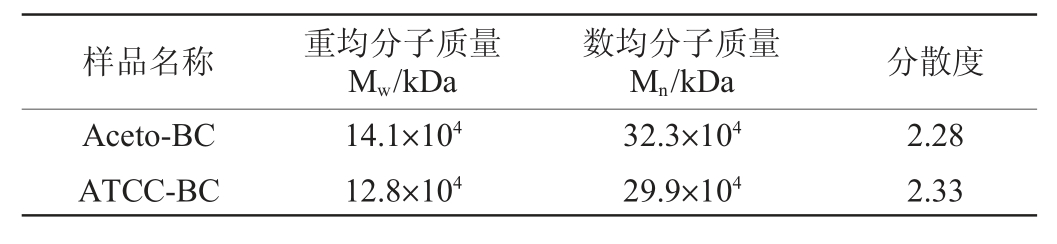
Acetobacter sp.ZX C6-15菌株产膜Aceto-BC样品和模式菌株ATCC23769产膜ATCC-BC样品进行GPC检测。将细菌纤维素样品于硝酸和硫酸混酸溶液中硝化后,蒸馏水洗涤数遍,使用5%碳酸钠溶液浸泡中和后,蒸馏水煮沸30 min。将样品取出,使用无水乙醇浸泡1 h后过夜烘干。取适量处理后的细菌纤维素样品溶于二甲基亚砜(dimethyl sulfoxide,DMSO)中进行检测,分子质量标准品为聚甲基丙烯酸酸甲酯(polymethyl methacrylate,PMMA),检测结果见表3。由表3可知,菌株ZXC6-15产膜的重均分子质量(Mw)为14.1×104kDa,数均分子质量(Mn)为32.3×104 kDa,分散度为2.28。对比细菌纤维素模式菌ATCC23769的产物,重均分子质量增加,分散度降低,表明该菌株合成的细菌纤维素的聚合度更高,平均粒径尺度更均匀。
表3 醋酸菌ZX C6-15菌株产膜的分子质量分析
Table 3 Molecular mass analysis of membrane produced by Acetobacter sp.ZX C6-15
2.4.5 X射线衍射检测
菌株Acetobacter sp.ZX C6-15产膜样品Aceto-BC和ATCC-BC进行XRD检测,结果见图5。由图5可知,在2θ=14.64°,16.48°和22.74°处出现三个主要特征峰,分别对应于Ⅰ型纤维素的(1-10),(110)和(200)晶面[25],表明Aceto-BC属于纤维素Ⅰ型晶体结构。经计算,Aceto-BC的结晶度指数为96%,高于ATCC-BC的结晶度指数82%。生物高分子的结晶度决定其纤维的形态、材料的分解温度、拉伸强度等材料性能[26],该细菌纤维素具有如此高的结晶度表明其具有良好材料性质。
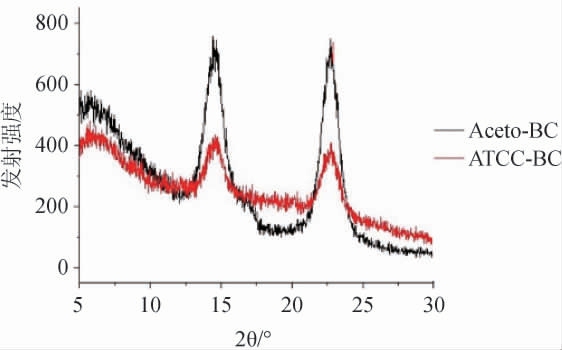
图5 醋酸菌ZX C6-15产膜的X射线衍射图
Fig.5 X-ray diffraction spectrum of membrane produced by Acetobacter sp.ZX C6-15
2.5 讨论
本研究从水果中分离、纯化得到能产膜的菌株ZX C6-15的生理生化分析结果表明该菌株具有接触酶和甘油转酮活性,但不具有甘露醇产酸、丙二酸利用以及麦芽糖产酸活性,说明菌株ZX C6-15与产酸的醋酸菌区别较大[27-28]。本研究得到的菌株ZX C6-15尽管与Acetobacter syzygii SZCPY4具有很高的同源性,但可能是合成细菌纤维素的属于醋杆菌的较新菌种。采用SEM、FT-IR、XRD、GPC等检测手段对该菌株产膜的分析结果表明,该膜与模式菌株ATCC23769所产细菌纤维素类似,具有比模式菌纤维更致密的3D网状结构,且具有细菌纤维素典型基团的特征吸收峰。对比模式菌株ATCC23769所产细菌纤维素,菌株ZX C6-15合成细菌纤维素数均分子质量、分散度、结晶度和吸水率更高,表明该细菌纤维素的分子质量的均度更好,具有更优秀的材料性质。
3 结论
本研究以腐败葡萄作为筛选源,经筛选、分离纯化得到一株能够合成细菌纤维素且传代稳定性良好的菌株;该菌株可能属于醋酸菌属的较新菌种,命名为Acetobacter sp.ZX C6-15;对比细菌纤维素模式菌ATCC23769,该菌株合成产物具有更致密的典型细菌纤维素3D纳米网状结构和分子官能团吸收;合成产物细菌纤维素的重均分子质量为14.1×104kDa,分散度为2.28,结晶度为96%,吸水率为218%,均高于模式菌ATCC23769生产的细菌纤维素,表明Aceto-bacter sp.ZX C6-15所产细菌纤维素具有优良的理化性质和机械性能。
[1]PENTTILA P A,SUGIYAMA J,IMAI T.Effects of reaction conditions on cellulose structures synthesized in vitro by bacterial cellulose synthases[J].Carbohydr Polym,2016,136:656-666.
[2]CHEN P,CHO S Y,JIN H J.Modification and applications of bacterial celluloses in polymer science[J].Macromol Res,2010,18:309-320.
[3]SAIBUATONG O,PHISALAPHONG M.Novo aloe vera-bacterial cellulose composite film from biosynthesis[J].Carbohydr Polym,2010,79(2):455-460.
[4]DAHMAN Y,JAYASURIYA K E,KALIS M.Potential of biocellulose nanofibers production from agricultural renewable resources:preliminary study[J].Appl Microbiol Biotechn,2010,162:1647-1659.
[5]CASTRO C,ZULUAGA R,PUTAUX J L,et al.Structural characterization ofbacterial cellulose produced byGluconacetobacter swingsii sp.from Colombianagroindustrial wastes[J].Carbohydr Polym,2011,84(1):96-102.
[6]KESHK S.Bacterial cellulose production and its industrial applications[J].J Bioprocess Biotechn,2014,4(2):150.
[7]TORRES F G,ARROYO J J,TRONCOSO O P.Bacterial cellulose nanocomposites:An all-nano type of material[J].Mat Sci Eng,2019,98:1277-1293.
[8]ULLAH M W,MANAN S,KIPRONO S J,et al.Synthesis,structure,and properties of bacterial cellulose[M]//Nanocellulose.New York:John&Wiley,2019:81-113.
[9]李斌,钟春燕,王锡斌,等.椰纤果发酵液中降解细菌纤维素酵母菌株的分离及鉴定[J].中国酿造,2014,33(7):51-54.
[10]ZHOU D Y,SUN Y,BAO Z X,et al.Improved cell viability and biocompatibility of bacterial cellulose through in situ carboxymethylation[J].Macromol Biosci,2019,19(5):1-8.
[11]ESA F,TASIRIN S M,RAHMAN N A.Overview of bacterial cellulose production and application[J].Agr Sci Proced,2014,2:113-119.
[12]BROWN A J.On an acetic ferment which forms cellulose[J].J Chem Soc,1886(49):432-439.
[13]赵航,陈沙,张璇,等.葡糖醋杆菌J2-1 静态发酵生产细菌纤维素的培养基优化[J].中国酿造,2020,39(5):152-156.
[14]ULISLAM M,KHAN S,ULLAH M W,et al.Bacterial cellulose composites:synthetic strategies and multiple applications in bio-medical and electroconductive fields[J].Biotechnol J,2015,10(12):1847-1861.
[15]GULLO M,SOLA A,ZANICHELLI G,et al.Increased production of bacterial cellulose as starting point for scaled-up applications[J].Appl Microbiol Biotechn,2017,101:8115-8127.
[16]汪丽粉,李政,贾士儒,等.细菌纤维素性质及应用的研究进展[J].微生物学通报,2014,41(8):1675-1683.
[17]于源华.生物工程与技术专业基础实验教程[M].北京:北京理工大学出版社,2016:186-191.
[18]中科院微生物研究所细菌分类组.一般细菌常用鉴定方法[M].北京:科学出版社,1978:111-193.
[19]郝士海.现代细菌学培养基和生化试验手册[M].北京:中国科学技术出版社,1992:423-492.
[20]王大耜.细菌分类基础[M].北京:科学出版社,1977:121-122.
[21]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:349-398.
[22]周胜虎,薛齐佳,刘传凤,等.细菌纤维素高产菌株的筛选和初步鉴定[J].湖北农业科学,2013,52(15):3514-3517.
[23]袁金霞,王婷,黄显南,等.细菌纤维素在造纸工业中的应用研究进展[J].纸和造纸,2016,35(7):42-46.
[24]MACHADO R T A,BAGLIOTTI M A,MIGUEL S R,et al.Komagataeibacter rhaeticus grown in sugarcane molasses-supplemented culture medium as a strategy for enhancing bacterial cellulose production[J].Ind Crop Prod,2018,122:637-646.
[25]MANSIKKAMAKI P,LAHTINEN M,RISSANEN K.Structural changes of cellulose crystallites induced by mercerisation in different solvent systems;determined by powder X-ray diffraction method[J].Cellulose,2005,12:233.
[26]葛含静.细菌纤维素高产菌株的筛选及鉴定[J].江苏农业科学,2017,45(16):282-285.
[27]CLEENWERCK I,CAMU N,ENGELDEEN K,et al. Acetobacter ghanensis sp.nov.,a novel acetic acid bacterium isolated from traditional heap fermentations of Ghanaian cocoa beans[J].Int J Syst Evolut Microbiol,2007,57(7):1647-1652.
[28]SPITAELS F,LI L,WIEME A,et al.Acetobacter lambici sp.nov.,isolated from fermenting lambic beer[J].Int J Syst Evolut Microbiol,2014,64(Pt-4):1083-1089.