浓香型白酒是我国传统白酒中的典型代表之一,其品质及风格由各种风味物质的量比关系决定[1],优质浓香型白酒中,四大酯类的比例为己酸乙酯>乳酸乙酯>乙酸乙酯>丁酸乙酯[2-3]。乳酸乙酯含量过高,使得酒体发涩、主体香差,严重影响酒的品质。糟醅发酵过程中乳酸含量过高,易与窖池内钙、铁离子反应,形成乳酸钙、乳酸铁和乳酸亚铁,从而导致窖泥板结老化,严重影响窖泥微生物的正常代谢[4-6]。因此“降乳”是浓香型白酒生产企业迫切解决的问题之一。
目前研究中,“降乳”的主要方法有:添加抑制剂或辅酶,如富马酸可抑制乳酸菌的生长[7];控制优化生产工艺,如适当控制入窖淀粉的含量、降低入窖温度、控制用曲量等;添加乳酸降解菌,其中添加乳酸降解菌操作简单,还可以生成乙酸、丙酸、丁酸等香气前体物质[8],从而合成多种酯类物质来增加白酒中的香气成分。因而从酿酒体系中筛选出具有乳酸降解能力的野生微生物菌株对优化白酒指标、改善窖泥理化状态不失为一种较为合理的途径。自然界里能够利用乳酸作为碳源的微生物很多,在已有报道中,分离到的乳酸降解菌主要有丙酸杆菌属、醋杆菌属、固氮菌属、芽孢杆菌属、脱硫弧菌属等多个属的一些种的某些菌株[9-10]。窖泥是传统固态法白酒发酵的基础,窖泥中含有数量庞大、种类复杂的微生物菌群,部分微生物在发酵过程中进入白酒糟醅中繁殖和代谢,产生复杂多样的代谢产物,形成种类丰富的风味物质,形成白酒风格和品质[11-13]。近年来,窖泥微生物菌群的研究表明,窖泥的优势微生物菌群包括:八叠球菌属(Sporobacter)、红蝽杆菌属(Coriobacterium)、梭菌属(Clostridium)、纤维素单胞菌属(Cellulomonas)、Sediminibacter、氨基杆菌属(Aminobacter)、棒杆菌属(Corynebacterium)、Sporosarcina、醋杆菌属(Acetobacter)、互营菌属(Syntrophus)等[14-15]。同时,已有研究团队从窖泥中筛选出具有乳酸降解能力的菌株,如Clostridium、Terrisporobacter、芽孢杆菌属(Bacillus)、泥杆菌属(Ilyobacter)、脱硫肠状菌属(Desulfotomaculum)、葡萄球菌属(Staphylococcus)和拉乌尔菌属(Raoultella)等[10]。
本研究试图从窖泥中筛选出一株乳酸降解菌,以期对浓香型白酒“降乳”提供了一种新的菌株,丰富对窖池稀缺微生物资源的认识。
1 材料与方法
1.1 材料
1.1.1 样品来源
样品取自宜宾五粮液股份有限公司窖龄为20年窖池的窖底泥,窖池分别在窖底4个角落和接近中心点的一点各取一个样,每个样品质量约100 g,在无菌袋中混匀后立即使用。
1.1.2 培养基
富集培养基:NaCl 1 g、K2HPO4 1 g、NH4Cl 1 g、MgCl2 0.5 g、NaNO31 g、葡萄糖2 g,溶于500 mL蒸馏水中,酒糟20 g、黄水10 mL、曲粉6 g、酒尾20 mL,溶于500 mL蒸馏水中搅动0.5 h后用8层纱布过滤,再混合后用NaOH调节pH至6.5~7.0。
无机盐培养基:MgSO4 0.5 g、KH2PO4 1 g、NH4Cl 1 g、6.67 g/L CaCl2 3 mL、17 g/L FeCl3 3 mL、FeSO4·7H2O 0.05 g、NaNO3 1 g、不同浓度乳酸(唯一碳源)、1 000 mL蒸馏水。
保藏培养基:LB培养基[16]。
1.2 仪器与设备
5810高速冷冻离心机:德国Eppendorf公司;BX41生物显微镜:日本Olympus公司;inoLabpH740 pH计:德国WTW公司;LRH生化培养箱、THZ-98C恒温振荡器:上海一恒科学仪器有限公司;Ezup柱式细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒(SK8255):上海生工生物有限公司;API Coryne棒状杆菌鉴定试剂盒:法国生物梅里埃公司;乳酸(色谱纯):比利时Acros Organics公司;乙醇(色谱纯):美国HoneyWell公司;4-辛醇(色谱纯):美国Sigma-Aldrich公司;顶空固相微萃取装置(CAR/DVB/PDMS纤维萃取,50 μm,1 cm长):美国Supelco公司;PAL RTC2多功能样品前处理平台(带有SPME模块):瑞士CTC公司;7890B GC-5977B MSD气相色谱-质谱联用仪、1100系列高效液相色谱(high performance liquid chromatography,HPLC)仪:美国Agilent公司;高效液相色谱色谱柱Venusil ASB C18(4.6 mm×250 mm,5 μm):美国Agela公司。
1.3 方法
1.3.1 乳酸降解菌的筛选
(1)富集培养
将窖泥样品以4%的接种量接种于含4 g/L乳酸的富集培养基,30 ℃静置培养15 d。
(2)初筛
将富集培养液进行梯度稀释,取0.1 mL 10-6稀释液涂布于无机盐培养基平板,30 ℃培养3 d,挑取单菌落在新的无机盐平板上划线纯化。
(3)复筛
方法同上,将上述筛选的菌株接种于无机盐培养基,培养15 d后,取发酵液进行乳酸含量测定。
(4)乳酸测定
取上述发酵液0.1mL,以0.1%的磷酸水溶液稀释至1mL,于2 mL离心管中,振荡均匀,0.2 μm滤膜过滤后作为待测样品。
利用HPLC法测定发酵液中乳酸的含量。色谱条件为柱温30 ℃;流动相A为甲醇,B为0.1%磷酸水溶液。梯度洗脱程序为0 min:100%B;8 min:100%B;25 min:10%B;28.5 min:10%B;29 min:100%B;35 min:100%B;停止:35 min;流速:1.0 mL/min。检测波长:214.8 nm。
1.3.2 乳酸降解菌的鉴定
(1)形态观察实验
形态观察包括菌落形态、革兰氏染色观察[17]。
(2)生理生化特性
生理生化利用API Coryne棒状杆菌鉴定试剂盒进行鉴定。
(3)分子生物学鉴定
DNA提取:将筛选的降解效果最好的菌株接入保藏培养基中,30 ℃培养15 d,取1 mL菌液10 000 r/min离心5 min,弃上清液,收集菌体,按细菌基因组DNA抽提试剂盒(B518225)提取DNA,-20 ℃保藏备用。
聚合酶链式反应(polymerase chain reaction,PCR)扩增:利用引物27F和1492R对细菌基因组16S rRNA进行扩增,27F:5'-AGTTTGATCMTGGCTCAG-3',1492R:5'-GGTTACCTTGTTACGACTT-3'。扩增体系(25 μL):10×PCR buffer 2.5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(2.5mmol/L)1μL,DNA10ng,引物F(10 μmol/L)0.5 μL,引物R(10 μmol/L)0.5 μL,加双蒸H2O至25 μL。扩增程序:94 ℃、4 min;94 ℃、45 s,55 ℃、45 s,72 ℃、60 s,共30个循环;72 ℃10 min,4 ℃终止反应。
16S rRNA序列测定:利用胶回收试剂盒进行PCR扩增产物的纯化;纯化产物的测序工作由上海生工生物工程有限公司完成。
系统发育树构建:将所测定的细菌16S rRNA基因序列分别与GenBank数据库进行BLASTn和RDP Classifier相似性分析,选取与实验菌株亲缘关系相对较近的标准菌株用Clustalw软件进行序列比对,采用MEGA5软件进行系统发育分析,构建系统发育树,采用邻接(neighbor-joining,NJ)法,Bootstrap验证次数为1 000。
序列提交到NCBI Genbank,获得登录号为MH256112。
1.3.3 乳酸降解菌的生长动力学
将菌株WLY-B-L2种子液按5.0%(V/V)的接种量分别接种到LB培养液中(pH7.0),30 ℃、120 r/min培养,于不同时间取菌液测吸光度值(OD600nm值)。每个样品均重复3次,取平均值。
采用Logistic方程描述菌体生长动力学模型。在此方程中比生长速率与尚未利用的负载能力相关联,即生长期细胞的增长速率可以用下式表达[18]。
当t=t0时,X=X0时,将上式积分得到下式。
式中:X为菌体浓度(OD600nm值);t为培养时间,h;um为最大比生长速率,h-1;X0为初始菌体浓度(OD600nm值);Xm为最大菌体浓度(OD600nm值)。
1.3.4 乳酸降解菌的降解动力学
将菌株WLY-B-L2种子液按5.0%(V/V)的接种量分别接种到含2g/L、4g/L、6g/L、8g/L乳酸的LB培养液中(pH 7.0),30 ℃、120 r/min培养,于不同时间取菌液,测乳酸残留量,对照试验接入同体积无菌水作空白对照。每个样品均重复3次,取平均值。
对于乳酸降解动力学模型,采用一级动力学模型[19]:
式中:b为常数;c为底物浓度,g/L;k为一级降解速率常数;t为降解时间,h。
2 结果与分析
2.1 乳酸降解菌株的分离筛选
乳酸质量浓度分别为1 g/L、2 g/L和4 g/L的无机盐培养基平板均能生长出菌落。从乳酸质量浓度为4 g/L无机盐培养基平板上挑取10株菌,在30 ℃静置培养15 d,菌液经液相色谱测定后,筛选出了降解效果最好的菌株WLY-B-L2,其乳酸降解率为16.9%(空白组乳酸含量为4.08 g/L,试验组乳酸含量为3.39 g/L)。
2.2 菌株WLY-B-L2的鉴定
2.2.1 形态观察结果
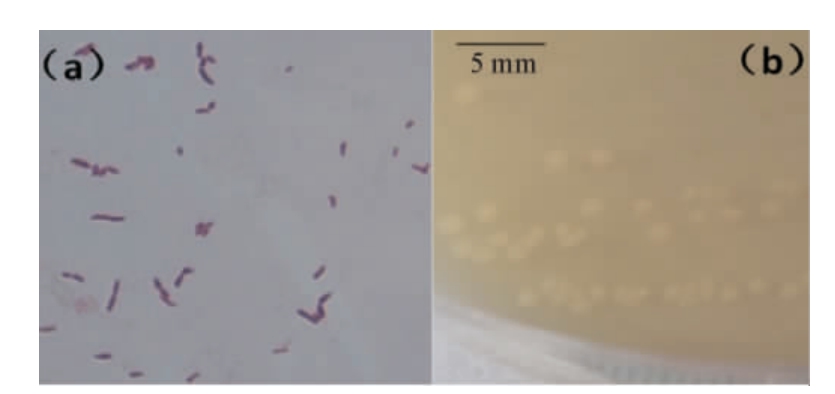
图1 菌株WLY-B-L2的显微(a)及菌落(b)形态
Fig.1 Microscope (a) and colony (b) morphology of strain WLY-B-L2
由图1a可知,菌株WLY-B-L2的细胞革兰氏染色呈阳性,杆状;由图1b可知,菌落呈白色、表面光滑湿润、中间凸起、边缘整齐。
2.2.2 生理生化特性
由表1可知,WLY-B-L2能利用硝酸钾、吡嗪酰胺、2-萘基磷酸、2-奈基-α-D-吡喃糖苷、明胶(牛源)。不能利用吡咯烷酮-2-奈胺、萘酚-ASB1-β-D-葡萄糖醛酸盐、2-奈基-β-D-半乳糖苷、1-奈基-N-乙酰基-β-D-氨基葡萄糖苷、七叶灵柠檬酸铁、尿素、葡萄糖、核糖、木糖、甘露醇、麦芽糖、乳糖(牛源)、蔗糖、糖原。过氧化氢试验结果呈阳性。
表1 菌株WLY-B-L2的生理生化试验结果
Table 1 Results of physiological and biochemical experiments of strain WLY-B-L2

注:“+”表示反应呈阳性;“-”表示反应呈阴性。
2.2.3 分子生物学鉴定

图2 基于16S rDNA基因序列菌株WLY-B-L2的系统发育树
Fig.2 Phylogenetic tree of strain WLY-B-L2 based 16S rDNA gene sequences
将菌株16SrRNA基因序列与GenBank上的其他16SrRNA基因序列进行基本局部比对搜索工具(basic local alignment search tool,BLAST)分析,构建系统发育树结果见图2。由图2可知,菌株WLY-B-L2与Arthrobacter protophormiae strain DSM 20168(NR_026195)相似性为99.9%,结合生理生化特性、形态特征将该菌鉴定为放线菌目下的原玻璃蝇节杆菌(Arthrobacter protophormiae)。经RDP进行分类,其分类地位为:放线菌纲(Actinobacteria)放线菌目(Actinomycetales)微球菌科(Micrococcaceae)节细菌属(Arthrobacter)。
2.3 降解菌WLY-B-L2的生长曲线
在LB培养基中接种WLY-B-L2,测定其菌体在不同培养时间的OD600nm值,利用SPSS 22.0软件对菌株生物量实测值与菌体生长动力学模型进行非线性拟合,如图3所示,得到um=0.219 h-1,X0=0.622,Xm=2.318,代入方程(1)和(2)后得到菌株生长动力学方程:
X=0.622e0.219t/[1-0.268(1-e0.219t)]
其中,R2=0.971。
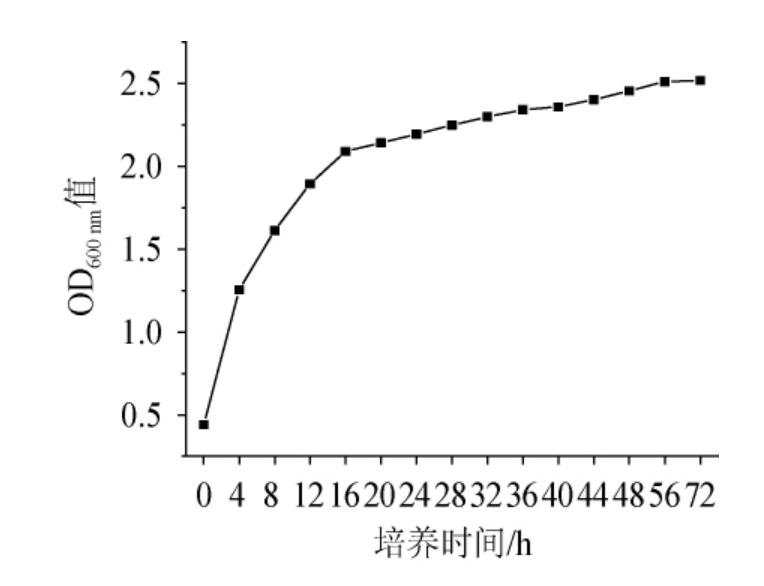
图3 菌株WLY-B-L2的生长曲线
Fig.3 Growth curve of strain WLY-B-L2
2.4 降解菌WLY-B-L乳酸降解生长曲线
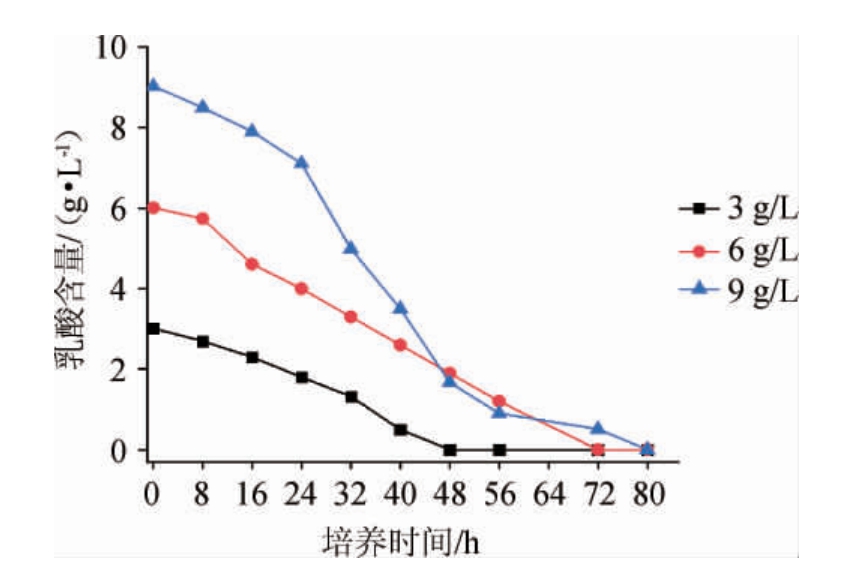
图4 不同培养时间的乳酸残留量
Fig.4 Residual concentration of lactic acid in different cultivation time
由图4可知,菌株WLY-B-L2具有较强的降解乳酸的功能,不同质量浓度下经过80 h后乳酸均未检测到。
进一步采用一级动力学模型对图4数据进行降解方程构建,结果如表2所示,三种不同质量浓度下的降解方程分别为c=3.00-0.037 50t、c=6.01-0.083 75t、c=9.03-0.066 25t。
表2 不同质量浓度乳酸下菌株WLY-B-L2的乳酸降解方程
Table 2 Lactic acid degrading equations of strain WLY-B-L2 under different concentrations of lactic acid

3 讨论
过去研究表明大多数放线菌能产生生物活性物质,如抗生素、有机酸、氨基酸、微生物甾体酶及酶抑制剂、免疫调节剂等[20-22];有些放线菌还能降解大量的各种有机物,从而参与自然界物质循环、净化环境、改良土壤[23-24]。然而,目前关于浓香型白酒窖泥放线菌的报道还较少,至今还未见有关浓香型白酒节细菌属(Arthrobacter)的相关报道。刘茂柯等[25]利用PCR-变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)研究了窖泥放线菌群落结构和多样性,表明窖泥放线菌归于Olsenella,Atopobium,Streptomyces和Corynebacterium四个属,Olsenella,Atopobium优势度随窖龄延长而升高。裴乐乐等[26]利用荧光定量PCR研究了不同窖龄窖泥放线菌,发现随着窖龄的增加,放线菌数量随之增加。此外,王涛等[27]从窖泥中分离到的Streptomyces属的多株放线菌可产酯、酸、醛、酮和醇类等浓香型白酒中的重要呈香呈味物质。
本研究中首次从窖泥中筛选出能降解乳酸的放线菌,在乳酸最大初始质量浓度为9 g/L的培养基体系中发酵80 h后乳酸降解率达100%,降解效果较为理想。邓汉森等[28]从浓香型白酒糟醅中筛选出一株可以降解乳酸的酵母菌。随后,栗连会[10]也从酒醅中筛选分离到归属于Clostridium,Terrisporobacter,Bacillus,Ilyobacter,Desulfotomaculum,Staphylococcus和Raoultella等7个属的17种乳酸降解菌,I.delafieldii的降解效果最佳,降解率为100%,同时C.cochlearium,C.tyrobutyricum和C.roseum的降乳效率也超过50%,分别达到了94.1%,67.6%,55.9%。而S.epidermidis,R.ornithinolytica,B.amyloliquefaciens和B.amyloliquefaciens的降乳效率均低于25%,降乳效果较差。
4 结论
本研究从浓香型窖泥中筛选出了一株乳酸降解菌,经多重鉴定,菌株WLY-B-L2为原玻璃蝇节杆菌(Arthrobacter protophormiae),系国内首次分离到了降解乳酸的放线菌。其生长、降解过程分别符合Logistic生长动力学(um=0.219 h-1,Xm=2.318)和一级降解动力学模型,当乳酸初始质量浓度为3 g/L、6 g/L和9 g/L时,WLY-B-L2完全降解乳酸的时间分别为40 h、72 h和80 h。放线菌是窖泥中栖息的功能微生物菌群之一,并且对乳酸具有显著的降解作用,丰富了对放线菌在窖泥中功能的认识。
[1]施珂,孙啸涛,沈才洪,等.基于直接-气相色谱-嗅闻的整体感官评价模式分析泸香型白酒的关键香气成分[J].食品工业科技,2020,41(7):208-219.
[2]李大和.浓香型曲酒乳酸乙酯偏高的原因及解决措施[J].酿酒科技,2007(2):100-103.
[3]王爱军.降低浓香型白酒中乳酸乙酯含量的研究进展[J].酿酒科技,2017(5):93-98.
[4]赖登燡,梁诚.系统论对浓香型白酒生产中“增己降乳”的解析及应用[J].酿酒科技,2008(8):104-108,112.
[5]何培新,胡晓龙,郑燕,等.中国浓香型白酒“增己降乳”研究与应用进展[J].轻工学报,2018,33(4):1-12.
[6]舒梨,何义国,赵兴秀,等.浓香型窖泥中高产细菌素乳酸菌的鉴定及特性[J].食品工业科技,2019,40(4):119-124.
[7]杨延栋,陈宗敬,范文来,等.用富马酸降低酒醅酸度技术:CN1361241[P].2002-07-31.
[8]侯小歌,王俊英,李学思,等.浓香型白酒窖池主要功能性微生物的研究进展[J].酿酒科技,2013(2):96-101.
[9]张国政,谭五丰,郝晶心,等.乳酸降解菌的选育及其发酵特性的研究[J].酿酒科技,1998(5):10-14.
[10]栗连会.泸型酒酒醅中乳酸菌和乳酸降解菌的多样性和代谢特性[D].无锡:江南大学,2016.
[11]王晖,蒲叶,李霁阳,等.白酒窖泥中乳酸菌分离鉴定及其发酵产挥发性风味物质比较[J].食品科学技术学报,2020,38(1):26-35.
[12]蒲秀鑫,柴丽娟,徐鹏翔,等.泸型酒窖泥中梭菌的分离及代谢产物分析[J].微生物学报,2019,59(12):2427-2436.
[13]张会敏,王艳丽,孟雅静,等.浓香型白酒新、老窖池池壁泥与池底泥原核菌群结构分析[J/OL].食品科学:1-11[2020-06-30].http://kns.cnki.net/kcms/detail/11.2206.TS.20191112.1313.048.html.
[14]邓杰,黄治国,卫春会,等.基于高通量测序的浓香型白酒窖池细菌群落结构分析[J].现代食品科技,2015,31(7):50-55.
[15]唐贤华.高通量测序技术初步解析浓香型白酒窖泥细菌群落结构[J].中国酿造,2020,39(1):160-164.
[16]胡元森,李翠香,孙富林,等.不同培养基组合提高土壤细菌可培养性的研究[J].微生物学报,2007(5):882-887.
[17]苏俊霞.镇江香醋醋醅中醋酸菌多样性及Gluconacetobacter intermedius 特性的研究[D].无锡:江南大学,2014.
[18]刘波,唐洁,陈廷廷,等.一株路德维希肠杆菌的筛选及其对3-苯氧基苯甲酸的降解特性分析[J].微生物学报,2018,58(5):830-841.
[19]王巧蕊,范宇睿,郑春莉,等.一株金黄杆菌对2-吡啶甲酸的好氧生物降解[J].微生物学通报,2018,45(5):990-995.
[20]尤小龙.酱香白酒酿造过程放线菌代谢活性成分研究[D].贵阳:贵州大学,2016.
[21]NITHYA C,PANDIAN S K.Isolation of heterotrophic bacteria from Palk Bay sediments showing heavy metal tolerance and antibiotic production[J].Microbiol Res,2010,165(7):578-593.
[22]SHIMIZU M,NAKAGAWA Y,SATO Y,et al.Studies on endophytic actinomycetes(I)Streptomyces sp.isolated from Rhododendron and its antifungal activity[J].J Gen Plant Pathol,2000,66(4):360-366.
[23]熊明华,杨芮,张少飞,等.原玻璃节杆菌Y1 对磺胺吡啶抗药性及其生长动力学[J].长江大学学报(自然科学版),2018,15(14):24-28,4.
[24]冯利伟,郭姣洁,李辉欣,等.原玻璃蝇节杆菌D-氨基酸氧化酶及突变体的酶学特性[J].微生物学报,2014,54(8):897-904.
[25]刘茂柯,唐玉明,赵珂,等.浓香型白酒窖泥放线菌的群落结构及其多样性[J].生态学报,2015,35(3):858-864.
[26]裴乐乐,罗青春,刘超兰,等.不同窖龄窖泥中放线菌的荧光定量PCR研究[J].酿酒科技,2015(3):1-4.
[27]王涛,姚韬,李涛,等.浓香型白酒酿造相关酵母发酵糟醅产己酸乙酯的研究[J].食品与发酵工业,2013,39(1):41-45.
[28]邓汉森,赵东,唐贤华,等.五粮浓香型白酒糟醅中一株降解乳酸菌株的分离筛选及初步鉴定[J].酿酒,2014,41(3):53-55.