腐乳是我国具有民族特色的传统大豆发酵食品,被称为“中国干酪”[1],年产量达3万t[2]。腐乳在中国拥有1 800余年的历史[3],受到国内外消费者的喜爱。我国传统腐乳较多采用开放式发酵工艺,加工工艺粗放,手工操作环节较多,同时腐乳经微生物发酵后含有丰富的氨基酸,为生物胺的形成提供了较好的条件[4-6]。尽管生物胺在机体内具有重要的生理功能,但当人体摄入过量时会引起中毒反应(如头痛、头晕、高血压、心悸等),严重的甚至危及生命[7-8]。
用于食品中生物胺测定的方法包括薄层色谱法[9]、毛细管电泳法[10]、气相色谱法[11]、离子色谱法[12-13]、柱前衍生液相色谱法[14-15]和液相色谱-串联质谱法(liquid chromatographytandem mass spectrometry,LC-MS/MS)[16-17]等。现行有效的国标方法为GB 5009.208—2016《食品安全国家标准食品中生物胺的测定》[18],该标准中试样用5%三氯乙酸提取,正已烷去除脂肪,三氯甲烷-正丁醇(1∶1,V/V)液液萃取净化后,用丹磺酰氯进行柱前衍生,并用高效液相色谱-紫外检测器进行定量分析。在实际检测过程中,腐乳中存在较多的游离氨基酸,会和丹磺酰氯进行反应,容易对生物胺的检测造成较大干扰[19]。本实验将建立一种液相色谱-串联质谱法检测腐乳中生物胺的方法,为生产中快速测定腐乳中的生物胺含量提供参考。
1 材料与方法
1.1 材料与试剂
组胺(histamine,HIST)、酪胺(tyramine,TYR)、尸胺(cadaverine,CAD)、腐胺(putrescine,PUT)、色胺(tryptamine,TRP)、精胺(spermine,SPM)、亚精胺(spermidine,SPD)、苯乙胺(phenylethylamine,PEA)、章鱼胺(octopamine,OCT)(纯度均≥99%):美国Sigma公司;甲酸、三氟乙酸、乙腈(色谱纯):德国Merck公司;浓盐酸、三氯乙酸(均为分析纯):国药集团化学试剂有限公司;超纯水由Millipore Milli-Q超纯水仪生产;腐乳样品(白1、白2、白2、红1、红2、红3、臭1、臭2、臭3、臭4):市售。
1.2 仪器与设备
XEVO TQXS 液相色谱-串联质谱仪(配有电喷雾离子源(electrospray ionization,ESI)):美国Waters公司;5804离心机:德国Eppendorf公司;Votex3000涡旋振荡仪:德国Wiggens公司。
1.3 方法
1.3.1 色谱条件
采用Waters BEH C18(2.1 mm×100 mm,1.7 μm)色谱柱。流动相A为0.1%三氟乙酸水溶液,流动相B为乙腈,采用梯度洗脱:0~1 min,95%A保持不变;1~6 min,95%A线性变化至0%A;6~8 min,0%A保持不变;8.1 min变化至95%A,平衡2 min。柱温:35 ℃。流速:0.3 mL/min。进样量:2 μL。
1.3.2 质谱条件
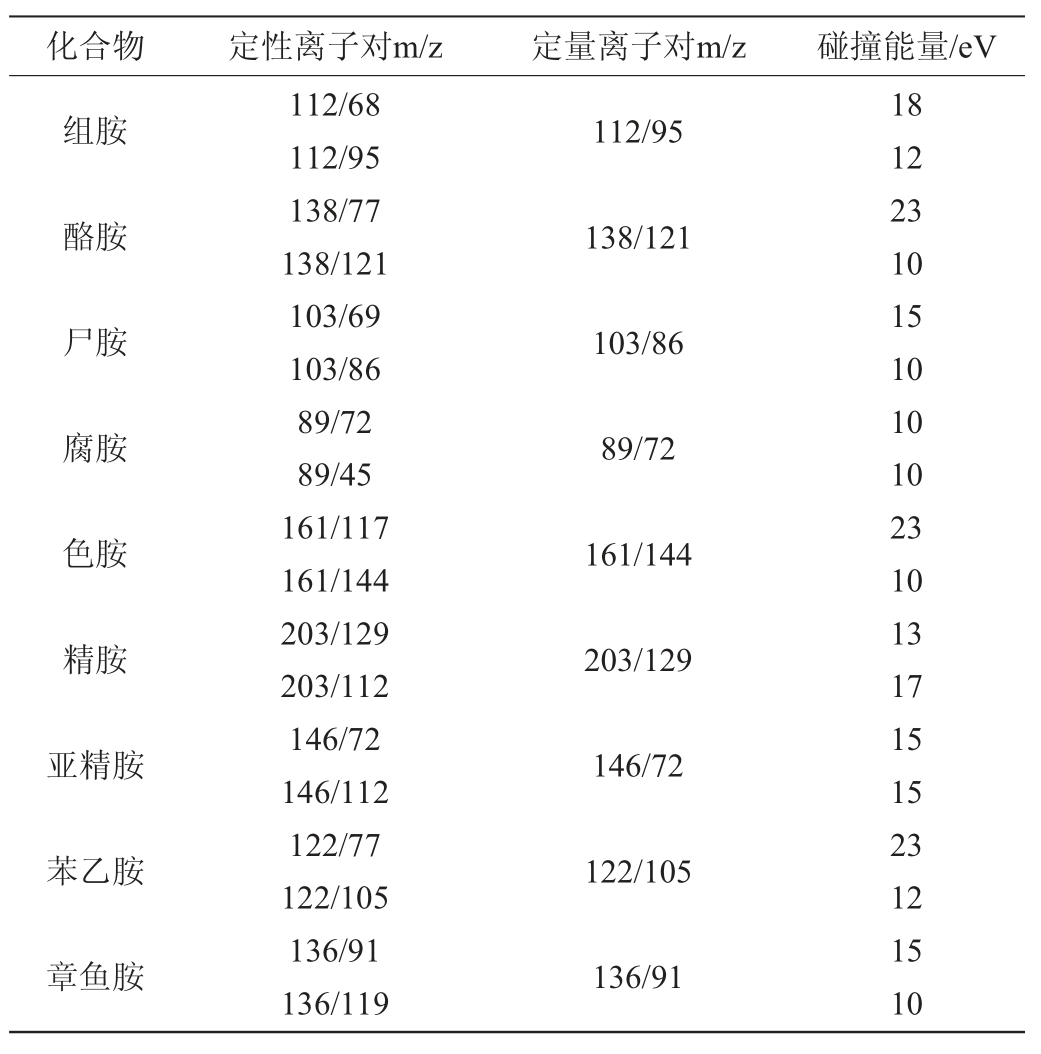
电喷雾离子(electrosprayionization,ESI)源,正电离模式;毛细管电压:3.0 kV;锥孔电压:30 V;干燥气温度:400 ℃;干燥气流速:800 L/h;锥孔反吹气流速:150 L/h;离子源温度:150 ℃;离子对、碰撞能量见表1。
表1 质谱参数
Table 1 Parameters of mass spectrometer
1.3.3 标准溶液的配制
称取9种生物胺标准品各10 mg于10 mL容量瓶中,用0.1 mol/L盐酸溶液溶解并定容至刻度,配制成质量浓度为1 mg/mL的标准储备液。分别取1.0 mL生物胺单组分标准储备液于100 mL容量瓶中,用0.1 mol/L盐酸稀释至刻度,配制成10 μg/mL的混合标准溶液。使用初始流动相将混合标准溶液稀释成10 ng/mL、20 ng/mL、50 ng/mL、100 ng/mL、150ng/mL、200 ng/mL系列质量浓度标准溶液。
1.3.4 样品处理
取出腐乳约10 g于均质机中混匀,取1 g混匀后的样品,加入30 mL 5%三氯乙酸水溶液,涡旋混匀15 s后超声提取30 min。取出后用5%三氯乙酸水溶液定容至50 mL。8 000 r/min离心2 min,上清液经0.22 μm 聚四氟乙烯滤膜后供LC-MS/MS仪器测定。
2 结果与分析
2.1 腐乳前处理方法的优化
生物胺具有较强的极性,前处理时还需要沉淀样品中的蛋白质和肽段等杂质,所以试验中考察了三种提取试剂的提取效果,分别是乙腈-水溶液(8∶2,V/V)、0.1%甲酸乙腈-水(8∶2,V/V)和5%三氯乙酸水溶液。使用上述三种提取溶剂处理同一腐乳样品,进行液相色谱-串联质谱分析后,比较三种处理方法得到的各生物胺的相对峰面积如图1所示。
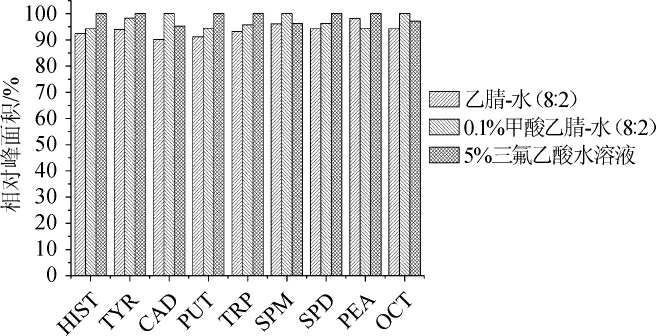
图1 不同提取试剂的提取效果
Fig.1 Extraction effect of different extraction solvents
由图1可知,3种提取溶剂具有相近的提取效果,相对偏差<10%。而5%三氯乙酸水溶液相对于其他两种提取溶剂的提取效率略高,故选取5%三氯乙酸水溶液进行样品前处理。
2.2 液相色谱-串联质谱条件的优化
在优化液相色谱条件时,考察了乙腈-水体系、乙腈-0.1%甲酸水体系、以及乙腈-0.1%三氟乙酸水体系,结果见图2。
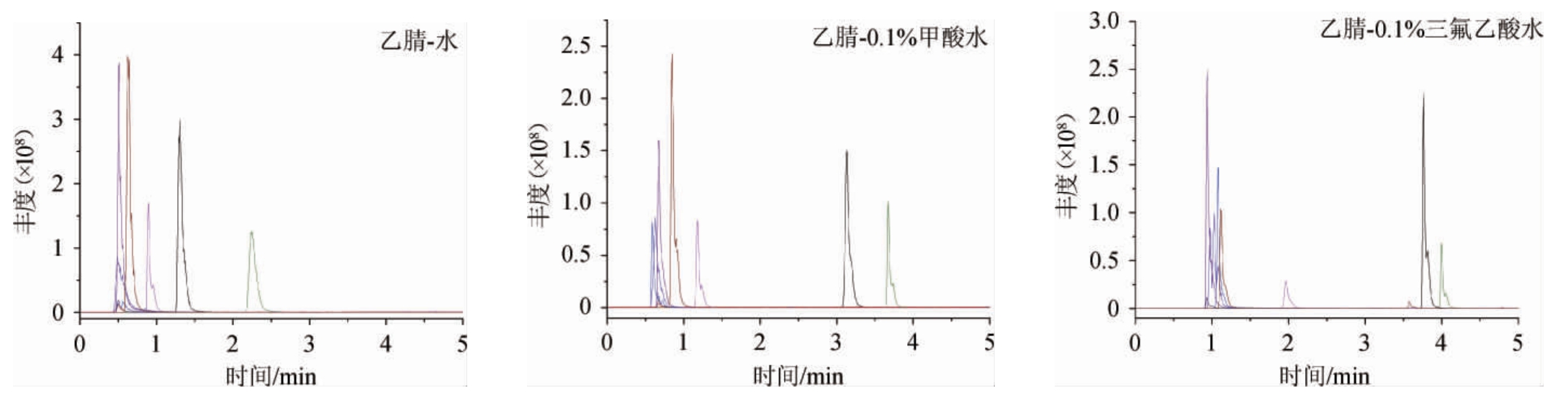
图2 9种生物胺的液相色谱-串联质谱色谱图
Fig.2 LC-MS/MS chromatograph of 9 biogenic amines
由图2可知,由于部分生物胺极性较大,所以在乙腈-水体系、乙腈-0.1%甲酸水体系的色谱条件下基本没有保留,不易和样品中的杂质分离。而使用乙腈-0.1%三氟乙酸水体系时这部分生物胺保留得到改善,因此最终选择乙腈-0.1%三氟乙酸水体系进行后续研究。
2.3 基质效应
质谱的基质效应是指样品中复杂的干扰物对分析物质谱响应的抑制或增强,可用基质标准曲线与标准校准曲线斜率的比值进行评估[21]。结果表明,组胺、酪胺、尸胺、腐胺、色胺、精胺、亚精胺、苯乙胺、章鱼胺在腐乳基质中的基质效应比值分别为0.92、0.91、0.85、0.88、0.82、0.89、0.87、0.94、0.84,在0.82~0.94之间,表明9种生物胺的响应被样品中的干扰物质轻微抑制。
2.4 线性关系、检出限和定量限
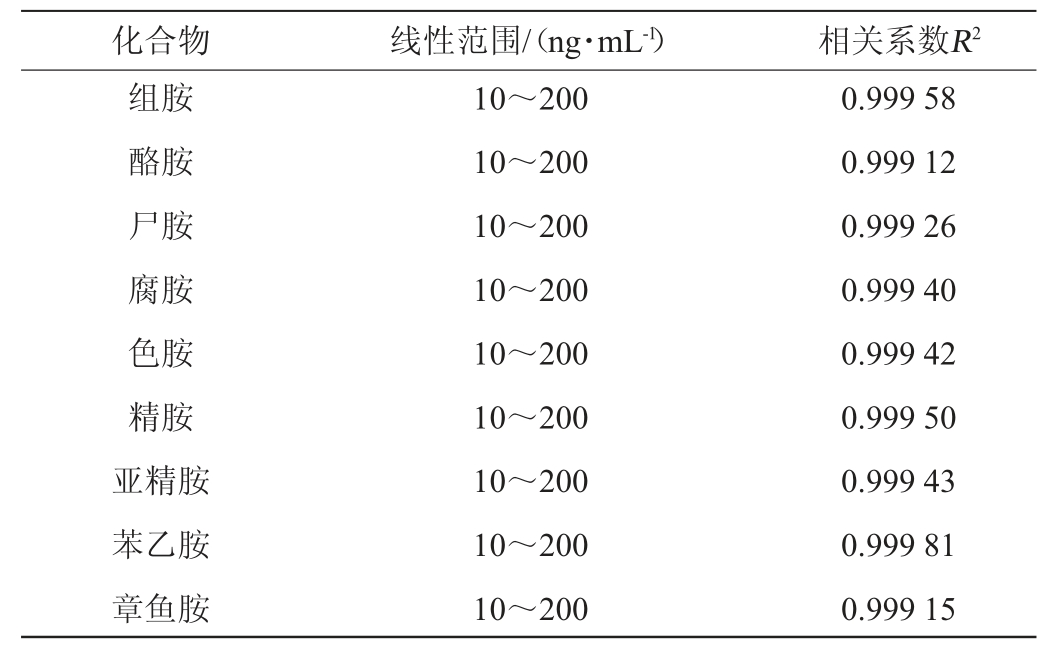
使用初始流动相将混合标准溶液稀释成系列质量浓度标准溶液,进行液相色谱-串联质谱分析。以标准工作液质量为横坐标,各生物胺峰面积为纵坐标制作标准曲线(表2),各分析物的标准曲线的相关系数R2均>0.999,线性相关性较好。
表2 9种生物胺的线性范围和线性关系
Table 2 Linear range and relationship of 9 biogenic amines
取混合标准溶液用5%三氯乙酸水溶液稀释后测定,以3倍信噪比作为方法的检出限,以10倍信噪比作为方法的定量限,获得目标物的检出限和定量限。本方法针对9种生物胺的检出限为0.03 mg/kg,定量限为0.1 mg/kg。
2.5 回收率和精密度
由于腐乳中含有较高含量的生物胺,所以为了消除本底对加标回收的影响,本实验选取了一款本底生物胺含量较低的红腐乳进行基质加标回收率实验,添加量为10 mg/kg和20 mg/kg,平行测定6次,结果见表3。
由表3可知,加标回收率在85%~101%之间,相对标准偏差(relative sandard deviation,RSD)在0.9%~4.8%之间,因此该方法用来检测腐乳中生物胺的含量是可靠的。
表3 腐乳中生物胺的回收率及方法精密度试验
Table 3 Recovery and method precision tests of biogenic amine in sufu
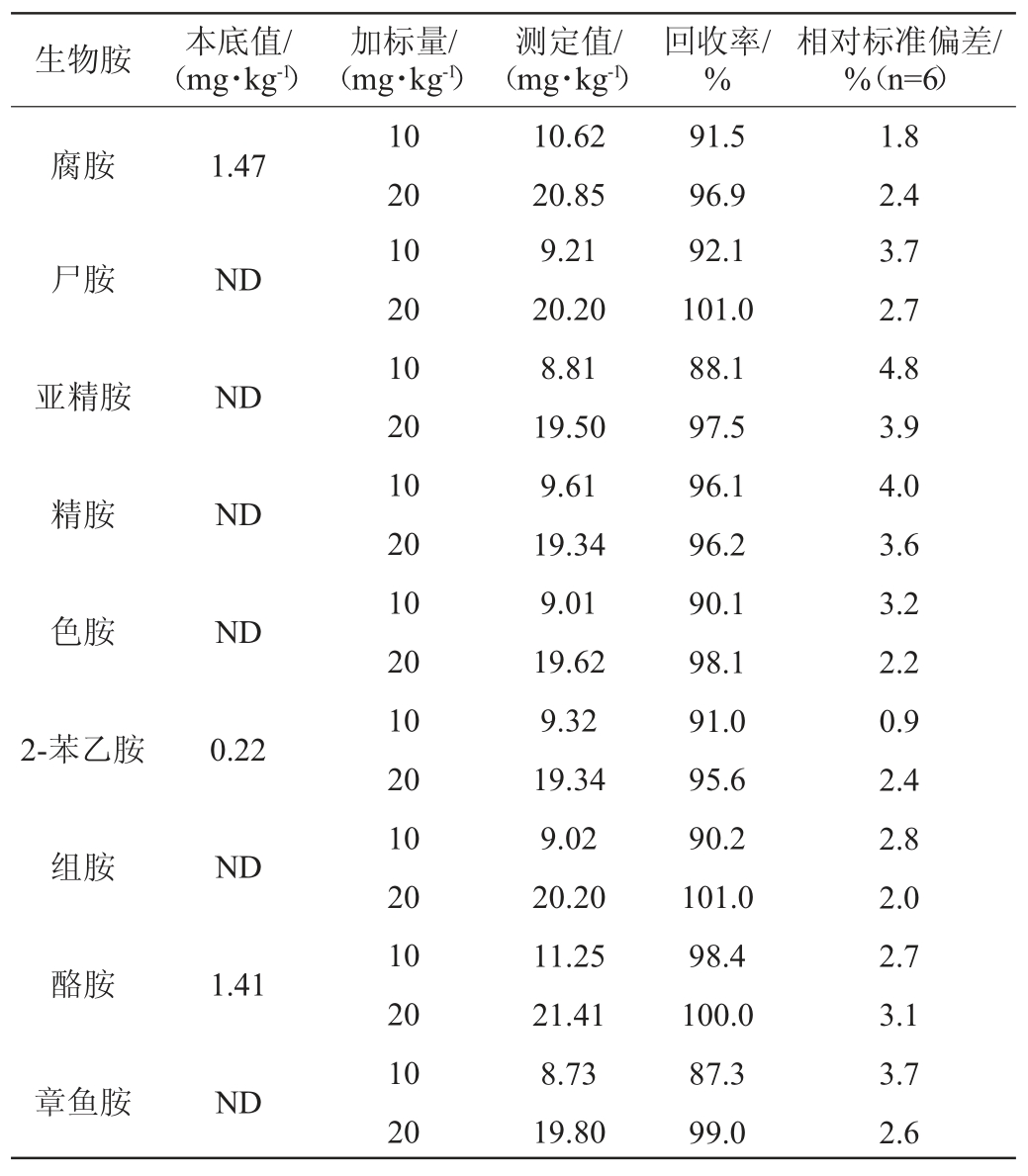
注:“ND”为未检出。下同。
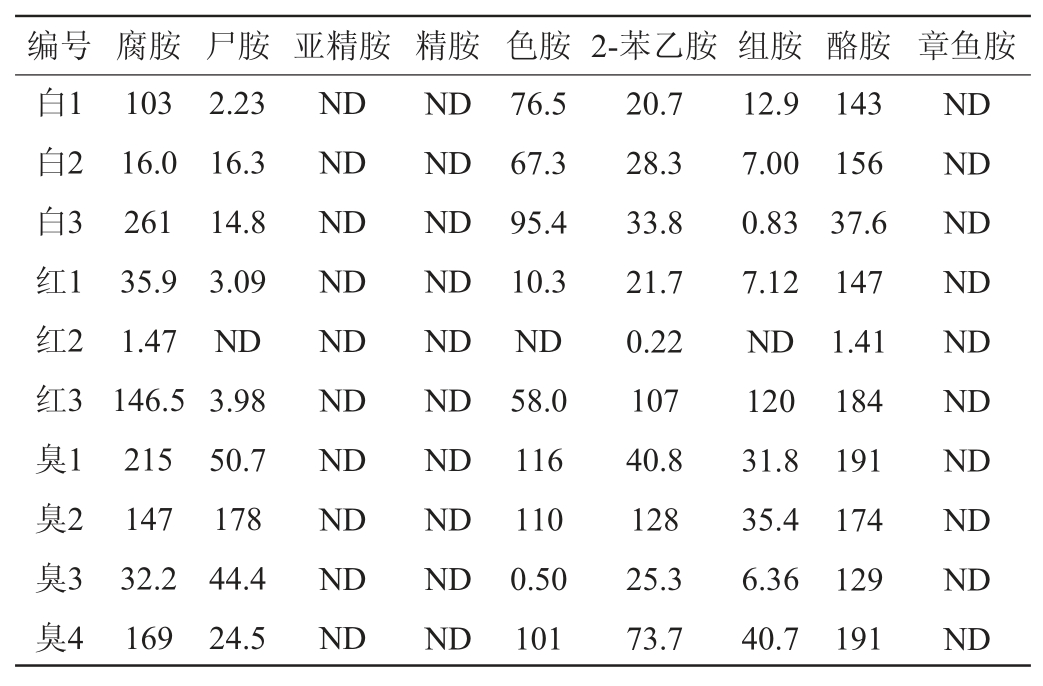
2.6 实际样品中生物胺的检测
采用本方法对市售的10批次不同企业生产的腐乳中生物胺含量进行测定(表4)。结果表明腐胺、尸胺、亚精胺、精胺、色胺、2-苯乙胺、组胺、酪胺以及章鱼胺在腐乳中的含量范围分别是:1.47~169 mg/kg、<50.7 mg/kg、未检出、未检出、<116 mg/kg、0.22~128 mg/kg、<120 mg/kg、1.41~191 mg/kg、未检出。同一品种的腐乳中生物胺含量存在显著差异,可知其加工工艺存在很大区别,或生产的环境良莠不齐。为保证产品的稳定性,有必要对其加工过程制定相应的良好操作规范。
表4 实际样品中生物胺含量的测定结果
Table 4 Determination results of biogenic amines in samples
3 结论
本研究建立了一种使用液相色谱-串联质谱法测定腐乳中9种生物胺的方法。该方法中9种生物胺在质量浓度为10~200 ng/mL范围内线性相关系数R2>0.999;检出限为0.03 mg/kg;定量限为0.1 mg/kg;该方法具非常好的准确度和精密度,回收率在85%~101%之间,相对标准偏差为0.9%~4.8%,适用于腐乳中生物胺的测定。使用该方法对实际样品进行检测,生物胺含量在不同品种、不同生产企业间的腐乳中差异较大,说明我国传统腐乳的加工环境、加工工艺没有统一的良好操作规范,急需腐乳行业引起重视。
[1]彭湘屏,卢红梅.腐乳研究新进展[J].江苏调味副食品,2009,26(4):10-14.
[2]李里特,马艳莉.发酵食品酿造过程中组分和营养功能因子的变化和调控[J].食品科学,2012,11(3):82-92.
[3]张婷,张琪,罗洁,等.腐乳的营养价值及功能性研究进展[J].食品工业,2019,40(8):258-262.
[4]李大伟,李丹丹,梁静静,等.高效液相色谱法测定市售腐乳中生物胺的含量[J].食品研究与开发,2018,39(16):120-129.
[5]杜鹏,包媛媛,杨明,等.结合云南牟定腐乳探究传统发酵豆制品腐乳的研究现状[J].食品工业,2019,40(11):242-247.
[6]许家威,李一红,叶芒,等.腐乳前酵期微生物与理化成分的动态分析[J].中国酿造,2019,38(1):84-88.
[7]罗林,徐振林,沈玉栋,等.食品中生物胺及其检测方法研究进展[J].广东农业科学,2013,40(22):119-124.
[8]景智波,田建军,杨明阳,等.食品中与生物胺形成相关的微生物菌群及其控制技术研究进展[J].食品科学,2018,39(15):262-268.
[9]ROMANO A,KLEBANOWSKI H,LA GUERCHE S,et al.Determination of biogenic amines in wine by thin-layer chromatography/densitometry[J].Food Chem,2012,135(3):1392-1396.
[10]刘方震,徐中其.毛细管电泳—间接紫外检测法分析4 种脂肪族生物活性胺[J].广东化工,2015,42(3):118-120.
[11]PAPAGEORGIOU M,LAMBROPOULOU D,MORRISON C,et al.Direct solid phase microextraction combined with gas chromatography-mass spectrometry for the determination of biogenic amines in wine[J].Talanta,2018,183:276-282.
[12]周勇,王萍亚,赵华,等.离子色谱法测定冷冻海产品中的生物胺[J].食品工业,2014,35(5):238-241.
[13]孙永,刘楠,李智慧,等.抑制性电导检测-离子色谱法快速测定水产品中的生物胺[J].食品安全质量检测学报,2015,6(10):3992-3997.
[14]陈智毅,陈聪汉,肖永坚,等.高效液相色谱法测定米酒中生物胺的含量[J].食品科学,2013,34(12):229-233.
[15]LIU S J,XU J J,MA C L,et al.A comparative analysis of derivatization strategies for the determination of biogenic amines in sausage and cheese by HPLC[J].Food Chem,2018,266:275-283.
[16]孙亚军,廖建萌,雷晓凌,等.液相色谱-串联质谱法同时测定虾仁中八种生物胺[J].食品工业,2015,36(3):273-277.
[17]OCHI N.Simultaneous determination of eight underivatized biogenic amines in salted mackerel fillet by ion-pair solid-phase extraction and volatile ionpair reversed-phase liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,2019,1601:115-120.
[18]国家卫生和计划委员会,国家食品药品监督管理局.GB 5009.208—2016 食品安全国家标准食品中生物胺的测定[S].北京:中国标准出版社,2016.
[19]李冉冉,李洪军,贺稚非.响应面法优化丹磺酰氯衍生生物胺的衍生条件[J].食品与发酵工业,2019,45(17):136-143.
[20]孙钦秀,陈倩,孔保华,等.高效液相色谱技术检测食品中生物胺的研究进展[J].食品工业,2014,35(12):193-198.
[21]XUN Z,LIU D,HUANG R,et al.Simultaneous determination of eight alkaloids and oleandrin in herbal cosmetics by dispersive solid-phase extraction coupled with ultra high performance liquid chromatography and tandem mass spectrometry[J].J Sep Sci,2017,40(9):1966-1973.