果酒是以水果为原料,在酵母菌的作用下,将水果中自身含有及外源加入的糖分转化为酒精而制成的一类发酵酒[1]。因不仅具有水果的清香,同时含有对人体有益的营养物质,果酒深受广大消费者的喜爱。果酒加工也被认为是提高农产品附加值和延长水果种植产业链的有效方式之一。然而目前我国果酒加工使用的发酵剂呈现出产品单一且菌株多来源于国外的不足,在一定程度上限制了我国果酒行业的发展[2]。作为我国特色发酵酒,白酒、黄酒和米酒酿造时均需使用酒曲,酒曲的微生物群系较为复杂,除含有乳酸菌和霉菌外,亦含有大量的酵母菌[3],因而从中分离、保藏并筛选酵母菌用于果酒加工具有较强的可行性。
米酒曲中的酵母菌多样性较高且种系独特,尤其是蕴含了大量的扣囊复膜酵母(Saccharomycopsis fibuligera)和酿酒酵母(Saccharomyces cerevisiae)[4]。作为果酒发酵中最常用的菌株,S.cerevisiae广泛应用于葡萄、猕猴桃和荔枝等果酒的酿造[5]。虽然国内应用尚少,但S.fibuligera的高产酯能力、高糖化力和高蛋白酶活性决定了其在制酒工业中具有较大的应用潜力[6]。红枣在我国的种植面积超2 000万亩,年产量近千万吨,具有糖分高且香味浓郁的特点,较为适合果酒的加工[7]。研究表明,红枣酒中富含的氨基酸不仅具有较高的营养价值且能影响果酒滋味品质的形成[8]。亦有研究表明,不同酵母菌菌株在果酒中的代谢差异较大,且这种差异直接影响了果酒的风味品质[9]。
本研究对广西省南宁市米酒曲中的酵母菌进行了分离鉴定,选取其中的S.cerevisiae和S.fibuligera进行了红枣酒制备,同时采用氨基酸分析仪和气相色谱-质谱联用技术(gas chromatography-mass spectrometer,GC-MS)对其氨基酸和挥发性风味物质种类及含量进行了解析,以期为后续红枣果酒发酵剂的研制提供菌株支持。
1 材料与方法
1.1 材料与试剂
骏枣(Jun jujube):购于新疆维吾尔自治区石河子市;白砂糖:柳州市柳冰食品厂;偏重亚硫酸钾:意大利ESSECO集团;果胶酶(50 000 U/g):和氏璧生物科技有限公司;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:北京博奥星生物技术有限公司;十二烷基硫酸钠、十六烷基三甲基溴化铵、酚、氯仿、异戊醇、乙酸钠、乙醇和乙二胺四乙酸:国药集团化学试剂有限公司;聚合酶、10×聚合酶链式反应(polymerase chain reaction,PCR)缓冲溶液、脱氧核糖核苷三磷酸(deoxy-ribonucleosidetriphosphate,dNTP)混合液、2×PCR混合液和pMD18-T克隆载体:大连宝生物技术有限公司;正向引物(NS1:5'-CATATCAATAAGCGGAGGAAAAG-3')和反向引物(NL4:5'-GGTCCGTGTTTCAAGACGG-3'):武汉天一辉远生物科技有限公司;PCR清洁试剂盒:北京科博汇智生物科技发展有限公司;大肠埃希氏杆菌(Escherichia coli)top10:鄂西北传统发酵食品研究所保存;氨基酸分析仪配套缓冲溶液:英国Biochrom公司。实验所用试剂均为分析纯。
1.2 仪器与设备
Veriti FAST梯度PCR仪:美国ABI公司;9231破壁榨汁机:奥克斯集团有限公司;LRH-150生化培养箱:上海一恒科学仪器有限公司;QYC-2102C全温培养摇床:上海新苗医疗器械制造有限公司;Biochrom 30+氨基酸分析仪:英国Biochrom公司;GCMS-QP2020气相色谱-质谱联用仪:岛津企业管理中国有限公司。
1.3 方法
1.3.1 样品采集
从广西省南宁市淡春菜市场、官塘综合市场和北湖农贸市场采集米酒曲样品10 份,所有米酒曲均无虫蛀和发霉现象,均在南宁市本地制作和销售。
1.3.2 酵母菌的分离、纯化和鉴定
使用研钵将米酒曲粉碎,取1 g加入99 mL生理盐水中,锥形瓶置于摇床25 ℃振荡30 min后按照10 倍梯度进行倍比稀释,取10-3~10-5 3个梯度的菌悬液涂布于PDA培养基上,25 ℃有氧恒温培养2~5 d,挑选具有典型酵母菌形态特征的菌落进行纯化和冻藏。采用消解酶-氯化苄法进行酵母菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取[10],PCR扩增体系:10×PCR 缓冲液(含Mg2+)2.5μL,dNTP(2.5mol/L)2μL,正向引物和反向引物各0.5μL,聚合酶(5 U/μL)0.5 μL,DNA模板1 μL,无菌水18 μL。PCR扩增程序:95 ℃预变性4 min;95 ℃变性1 min,58 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃再延伸10 min[11]。扩增产物经纯化、连接和转化后,挑取阳性克隆子送往武汉天一辉远生物科技有限公司进行测序,反馈回的序列与美国国家生物技术信息中心的GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对进而明确其种系型。
1.3.3 红枣酒的制备
(1)红枣清洗去核,按照1∶5的质量比加入纯水,同时加入总质量0.006%(质量比)的偏重亚硫酸钾,打浆;(2)加入3%果胶酶,45 ℃酶解1 h;(3)酶解后红枣汁的可溶性固形物含量约为13.0°Bx,用白砂糖将其调至22°Bx后,用酒石酸调pH值至3.9;(4)按照5×107CFU/mL红枣浆的比例接入
1.3.2 中鉴定为扣囊复膜酵母(Saccharomycopsis fibuligera)和酿酒酵母(Saccharomyces cerevisiae)的分离株,同时设置不添加酵母菌而自然发酵的样品为对照组;(5)罐口采用4层纱布进行封口,22 ℃恒温发酵,为比较不同分离株的发酵特性,若有1 个分离株制备的样品糖度72 h保持不变,则视为所有样品发酵结束;(6)红枣酒用纱布过滤后,滤液10 000 r/min离心6 min,上清备用[12]。
1.3.4 测定方法
红枣酒酒精度的测定:使用GB/T 15038—2006《葡萄酒、果酒通用分析方法》中约束的密度瓶法。
红枣酒中氨基酸含量的测定:参照GB/T 5009.124—2016《食品中氨基酸的测定》。使用Biochrom 30+氨基酸分析仪,配置磺酸型阳离子树脂色谱柱进行氨基酸含量和种类分析,温度梯度38 ℃、50 ℃和93 ℃,检测波长440 nm和570 nm,流速35 mL/h,缓冲液1、2、5和6分别洗脱9 min、12 min、20 min和6 min。
基于GC-MS对红枣酒中挥发性物质含量的测定:参照文献[13]的方法进行挥发性物质含量测定,并进行适当修改。(1)取10 mL红枣酒于20 mL样品瓶,铝帽封口;(2)H-Rtx-Wax色谱柱(30 m×2.25 mm×0.25 μm),进样口温度200℃,高纯氦气(He)和氮气(N2)为载气(纯度>99.999 9%),分流比10∶1,流速1 mL/min;起始温度30 ℃,保持3 min,以3 ℃/mm升至45 ℃,保持10 min,然后以8 ℃/min升至130 ℃,不保持,然后以10 ℃/min升至200 ℃保持7 min;(3)电子电离(electron ionization,EI)源,离子源温度230 ℃,连接口温度280 ℃,电子轰击能量70 eV;m/z范围33.00~450 amu,采集方式Q3 Scan;(4)使用美国国家标准技术研究所(national institute of standards and technology,NIST)14标准质谱库根据化合物保留指数进行定性分析,利用峰面积占总峰面积的比值对主要化合物进行相对定量分析。
1.3.5 统计分析
使用方差分析对红枣酒酒精度差异性进行分析;使用R软件(V3.6.2)绘制气泡图;使用Origin2017软件绘制柱形图。
2 结果与分析
2.1 酵母菌分离鉴定
将本研究分离的酵母菌进行26S rRNA测序,返回的序列在GenBank数据库中进行BLAST同源性比对,结果如表1所示。
表1 分离酵母菌26S rRNA序列同源性比对结果
Table 1 Result of homology comparison of 26S rRNA sequences of isolated yeast strains

由表1可知,20 株酵母菌与模式株参比序列同源性均在99%以上,被鉴定为5个属的5个种,其中菌株HBUAS61051等10株菌被鉴定为扣囊复膜酵母(Saccharomycopsis fibuligera),占分离株总数的50%;菌株HBUAS61054等5株菌被鉴定为酿酒酵母(Saccharomyces cerevisiae),占分离株总数的25%;菌株HBUAS61059等3株菌被鉴定为弗比恩酵母(Cyberlindnera fabianii),占分离株总数的15%;菌株HBUAS61058和菌株HBUAS61072分别被鉴定为葡萄牙棒孢酵母(Clavispora lusitaniae)和Yamadazyma mexicana,各占分离株总数的5%。由此可见,南宁地区米酒曲中酵母菌多样性较高,且以S.fibuligera为主。
2.2 红枣酒酒精含量的分析
本研究使用分离到的10 株S.fibuligera和5 株S.cerevisiae进行了红枣酒的制备,并以不接入酵母菌且自然发酵的样品为对照,探讨了其对红枣酒酒精度、氨基酸和挥发性风味物质种类及含量的影响。红枣酒酒精度如图1所示。
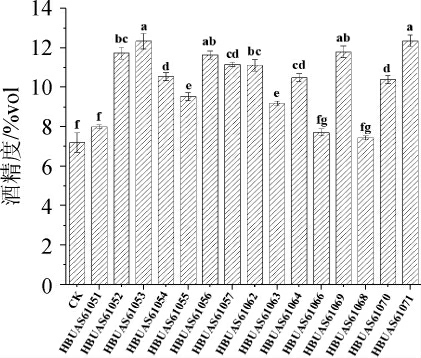
图1 不同菌株酿制的红枣酒酒精度
Fig.1 Alcohol contents of jujube wine brewed with different strains
不同分组间字母不同表示差异显著(P<0.05)。
由图1可知,较之自然发酵,多数接种酵母菌酿造的红枣酒酒精度均显著提升(P<0.05),其中S.fibuligeraHBUAS61053和S.cerevisiae HBUAS61071酿造的红枣酒酒精度最高,均为12.3%vol。而S.fibuligera HBUAS61051、S.fibuligera HBUAS61066和S.cerevisiae HBUAS61070酿造的红枣酒酒精度均约为7.5%vol,与自然发酵红枣酒酒精度差异不显著(P>0.05)。由此可见,虽然接种酵母菌可缩短红枣酒的发酵周期,但不同菌株间存在一定差异。
2.3 红枣酒氨基酸种类和含量的分析
红枣酒中氨基酸种类及含量如表2所示。由表2可知,接种酵母菌发酵的红枣酒共检测出必需氨基酸5种,非必需氨基酸7种,平均氨基酸总量为3271.93mg/L,其中必需氨基酸283.88 mg/L,非必需氨基酸2 988.05 mg/L;除酪氨酸外,自然发酵红枣酒中共检测出必需氨基酸5种,非必需氨基酸6 种,氨基酸总量为1 926.30 mg/L,其中必需氨基酸223.62 mg/L,非必需氨基酸1 702.68 mg/L。脯氨酸和天冬氨酸为2 种红枣酒中的主要氨基酸,在接种酵母菌发酵的红枣酒中平均含量分别为1 857.93 mg/L和771.59 mg/L,而在自然发酵红枣酒中含量分别为1057.97mg/L和441.16mg/L。值得一提的是,必需氨基酸与氨基酸总量的比值在接种酵母发酵和自然发酵红枣酒中分别为8.7%和11.6%,而必需氨基酸与非必需氨基酸的比值在2类红枣酒中分别为9.5%和13.1%。由此可见,接种酵母菌酿造的红枣酒中氨基酸种类和含量均明显提升,但增量主要体现在脯氨酸和天冬氨酸等非必需氨基酸上。
表2 红枣酒中氨基酸种类及含量
Table 2 Types and contents of amino acids in jujube wine
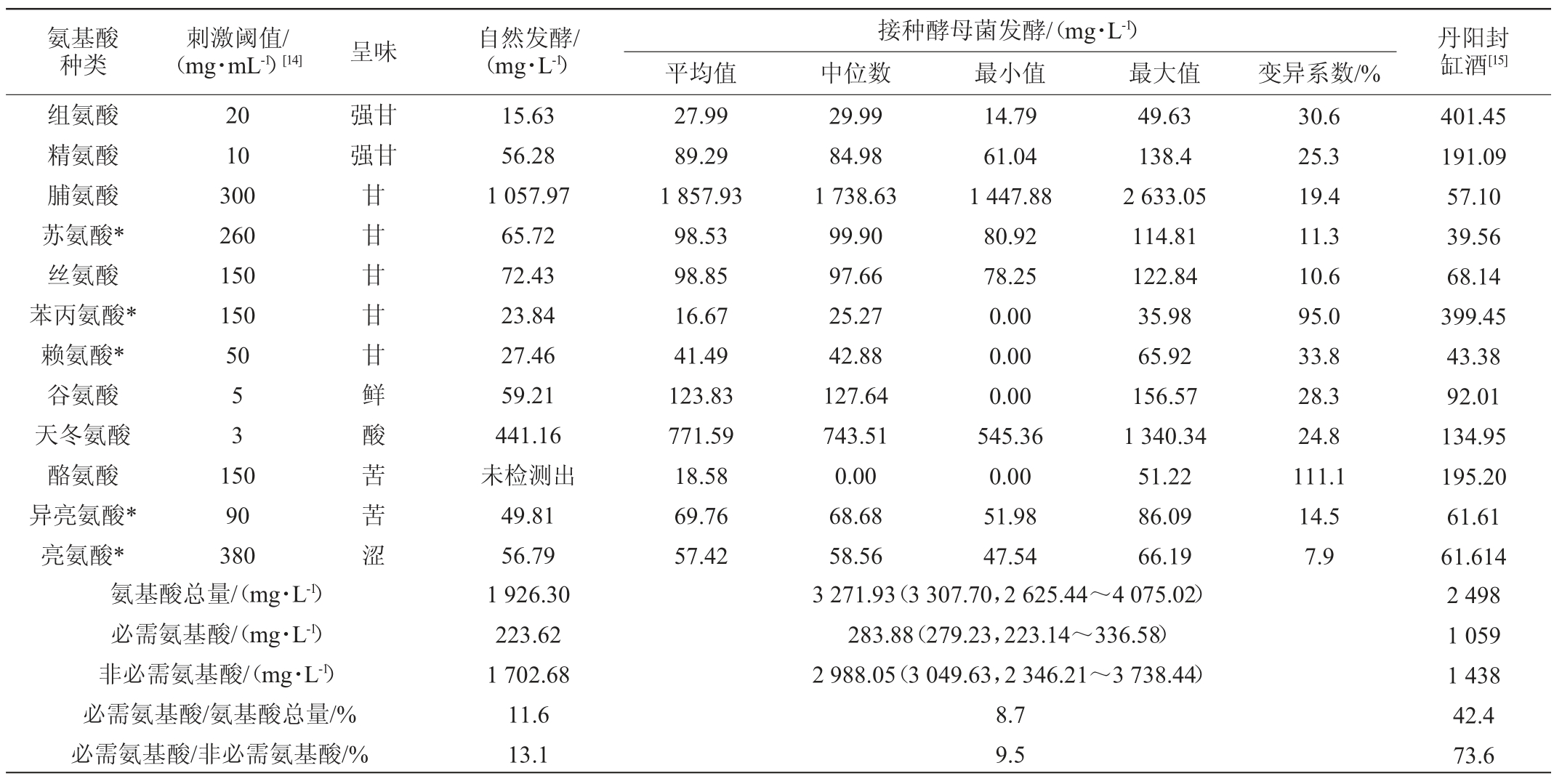
注:3 271.93(3 307.70,2 625.44~4 075.02)代表平均值(中位数,最小值~最大值)。“*”代表必需氨基酸。
由表2可知,丹阳封缸酒中必需氨基酸与氨基酸总量的比值为42.4%,而必需氨基酸与非必需氨基酸的比值高达73.6%。由此可见,红枣酒中氨基酸总量明显高于丹阳封缸酒,但其氨基酸种类较之丹阳封缸酒偏少,且主要以非必需氨基酸为主。本研究进一步对红枣酒中呈味氨基酸的构成进行了分析,结果如表3所示。
表3 红枣酒中呈味氨基酸的构成
Table 3 Composition of flavor amino acids in jujube wine

由表3可知,接种酵母菌发酵和自然发酵的红枣酒中甘味呈味氨基酸含量均最多,分别为1 319.33 mg/L和2 230.75 mg/L,占氨基酸总量的68.5%和68.2%;其次为酸味呈味氨基酸,含量分别为441.16 mg/L和771.59 mg/L,占氨基酸总量的22.9%和23.6%;而涩、苦和鲜味呈味氨基酸的含量均相对较少。由此可见,甘味和酸味呈味氨基酸为红枣酒中主要呈味氨基酸,2 类红枣酒中呈味氨基酸的构成比例无明显差异。由表3亦可知,丹阳封缸酒中甘味呈味氨基酸平均含量最高,占氨基酸总量的56.4%,其次为涩味和苦味呈味氨基酸,含量分别为19.6%和14.9%,而酸味和鲜味呈味氨基酸均较少。由此可见,红枣酒和丹阳封缸酒在呈味氨基酸构成上存在明显的差异。
2.4 红枣酒挥发性风味物质种类及含量的分析
果酒中通常含有多种挥发性风味物质[16],其中醇类化合物在果酒中主要发挥呈香呈味的作用,对果酒的香气和味道形成有着重要影响[17];酯类化合物是酵母进行酒精发酵时的次级代谢产物,乙酸乙酯和己酸乙酯等酯类化合物具有明显的果香特性[18-19];醛类化合物多源于醇类的氧化或酸类物质的还原,亦是果酒的重要呈味物质[20]。红枣酒中挥发性风味物质种类及含量的分析如表4所示。
由表4可知,峰图中约有80%左右的化合物可以被鉴定,2类红枣酒共检测出40种挥发性风味物质,包括酯类25种,醇类9种,醛类5种和胺类1种。酵母菌发酵红枣酒共检测出35种挥发性风味物质,其中酯类、醇类和醛类物质分别为22种、8种和4种,平均相对含量依次为13.26%、50.72%和13.20%;自然发酵红枣酒共检测出28 种挥发性风味物质,其中酯类、醇类和醛类物质分别为21种、4种和3种,相对含量依次为8.04%、62.04%和2.94%。由此可见,接种酵母菌发酵可提升红枣酒中酯类物质的相对含量。红枣酒中相对含量大于1.0%挥发性风味物质的气泡图如图2所示。
表4 红枣酒中挥发性风味物质中化合物的种类数量
Table 4 Types and numbers of volatile flavor compounds in jujube wine
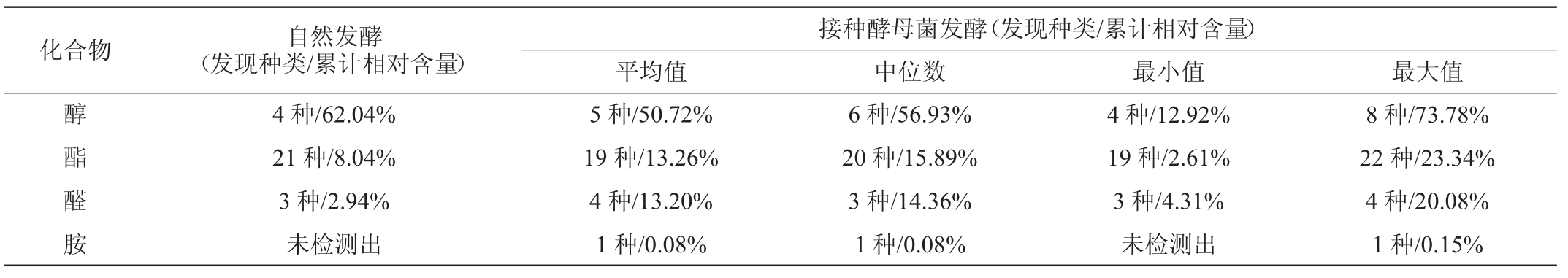
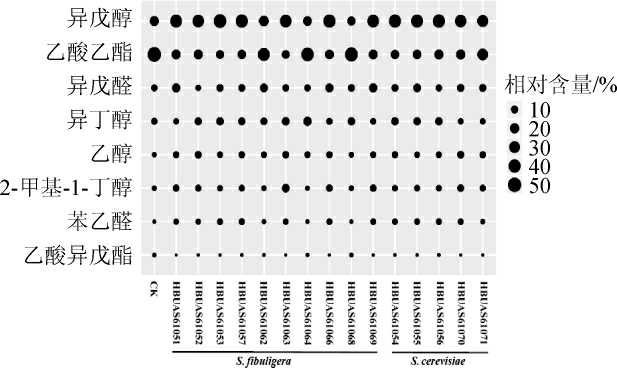
图2 红枣酒中平均相对含量>1.0%挥发性风味物质的气泡图
Fig.2 Bubble chart of volatile flavor substances in jujube wine with average relative content more than 1.0%
由图2可知,红枣酒中有8 类化合物的平均相对含量大于1.0%,其中酯类2 种、醇类4 种和醛类2 种。异戊醇和乙酸乙酯为酵母菌发酵红枣酒中主要挥发性风味物质,平均相对含量分别为33.03%和24.37%,两者亦为自然发酵红枣酒中的主要挥发性风味物质,平均相对含量分别为18.91%和51.34%。
3 结论
南宁地区米酒曲中酵母菌多样性较高,且以S.fibuligera为主。使用S.fibuligera和S.cerevisiae分离株进行红枣酒制备发现,脯氨酸和天冬氨酸为红枣酒中的主要氨基酸,甘味和酸味氨基酸为主要呈味氨基酸,异戊醇和乙酸乙酯为主要挥发性风味物质。较之自然发酵,接种酵母菌发酵可缩短红枣酒的发酵周期,提升脯氨酸和天冬氨酸等非必需氨基酸的含量,同时提升红枣酒挥发性风味物质中酯类化合物的相对含量。
[1]![]() A,PEJIN B,et al.Fruit as a substrate for a wine:a case studyof selected berryand drupe fruit wines[J].Sci Hortic-Amsterdam,2019,244(1):42-49.
A,PEJIN B,et al.Fruit as a substrate for a wine:a case studyof selected berryand drupe fruit wines[J].Sci Hortic-Amsterdam,2019,244(1):42-49.
[2]陈静,程晓雨,潘明,等.中国果酒生产技术研究现状及其产业未来发展趋势[J].食品工业科技,2017,38(2):383-389.
[3]PARK K H,LIU Z,PARK C S,et al.Microbiota associated with the starter cultures and brewing process of traditional Hong Qu glutinous rice wine[J].Food Sci Biotech,2016,25(3):649-658.
[4]闫华文.甜酒曲中真菌多样性的研究及甜酒酿营养成分分析[D].曲阜:曲阜师范大学,2015.
[5]JIANG X,LU Y,LIU S Q.Effects of different yeasts on physicochemical and oenological properties of red dragon fruit wine fermented with Saccharomyces cerevisiae, Torulaspora delbrueckii and Lachancea thermotolerans[J].Microorganisms,2020,8(3):315.
[6]苏畅,马莹莹,杨建刚.扣囊复膜酵母在酿酒中的应用研究进展[J].食品研究与开发,2018,39(1):205-209.
[7]ZHAO L,LIU F,WU L,et al.Fate of triadimefon and its metabolite triadimenol in jujube samples during jujube wine and vinegar processing[J].Food Control,2017,73(3):468-473.
[8]ZHANG W,ZHANG L,XU C.Chemical and volatile composition of jujube wines fermented by Saccharomyces cerevisiae with and without pulp contact and protease treatment[J].Food Sci Tech,2016,36(2):204-209.
[9]XIA Y,MA Y,HOU L,et al.Effect of solid or liquid fermentation state,yeast strain,fermentation temperature and time on the flavor content of Jujube(Ziziphus jujuba)Brandy[J].Am J Food Technol,2017,12(1):14-24.
[10]赵慧君,董蕴,刘伟,等.襄阳大头菜酱液中酵母菌多样性分析[J].中国调味品,2018,43(12):55-59.
[11]VIMONT A,FERNANDEZ B,AHMED G,et al.Quantitative antifungal activity of reuterin against food isolates of yeasts and moulds and its potential application in yogurt[J].Int J Food Microbiol,2019,289(1):182-188.
[12]吕虎晋,董蕴,单春会,等.不同浸提方式对红枣酒品质的影响[J].中国酿造,2019,38(9):143-147.
[13]曲迪,陈建波,华梅,等.HS-SPME-GC-MS 法分析不同辐照方式的人参酒挥发性成分[J].食品科技,2019,44(7):344-349.
[14]LAMBRECHTS M,PRETORIUS I.Yeast and its importance to wine aroma-a review[J].S Afr J Enol Viticult,2000,21(Special Issue):97-129.
[15]邓娜娜,马永昆,王亚超,等.超高压催陈对丹阳封缸酒中游离氨基酸的影响[J].食品工业科技,2014,35(18):149-152.
[16]WEI J,ZHANG Y,YUAN Y,et al.Characteristic fruit wine production via reciprocal selection of juice and non-Saccharomyces species[J].Food Microbiol,2019,79(6):66-74.
[17]孙时光,左勇,徐佳,等.外源添加物对桑椹果酒高级醇的影响[J].食品与发酵工业,2019,45(19):180-187.
[18]李棒,邓梦菲,陈延儒,等.高酸度水果果酒酿造产酯酵母的鉴定及发酵特性研究[J].中国酿造,2020,39(4):103-108.
[19]ZHU J C,WANG L Y,XIAO Z B,et al.Characterization of the key aroma compounds in mulberry fruits by application of gas chromatography-olfactometry(GC-O),odor activity value(OAV),gas chromatography-mass spectrometry(GC-MS)and flame photometric detection(FPD)[J].Food Chem,2018,245(4):775-785.
[20]刘小雨,李科,韦广鑫,等.野木瓜果酒香气成分提取方法的比较[J].食品与发酵工业,2019,45(3):189-195.