芽孢杆菌是一庞大种群,在自然界中分布范围广并且有着较强的繁殖能力以及稳定的理化性质[1],在科研和生产中应用较广,具有较高的研究价值。芽孢杆菌产酶种类多,抗逆性强,多数菌株可以分泌胞外酶,并且多为安全性高以及人畜无害的非致病菌[2-3],所以在食品等行业得到了广泛的应用[4-5]。截至目前,全球大约有50%的工业酶制剂是由芽孢杆菌产生的[6],芽孢杆菌是蛋白酶的主要生产菌株[7],蛋白酶作为用途最为广泛的工业酶制剂之一[8-10],在食品、医药、环保、酿造和皮革等工业均有广泛应用[11-14];除此之外,近年来发现芽孢杆菌中还存在着丰富的糖基转移酶资源,糖基转移酶是现阶段具有广泛应用潜力的新型酶[15-17],目前利用糖基转移酶合成糖苷类化合物已经取得了一定的研究进展,并且在利用糖基转移酶合成新型甜味剂方面也具备良好的应用前景,是新酶研究的热点之一[18]。
综上,虽然芽孢杆菌具备菌种多样性和产酶能力高等突出优点,但截至目前其丰富的菌种资源还有待深入开发和研究。本研究对实验室芽孢杆菌菌种库中各菌株产蛋白酶、糖基转移酶及胞外蛋白分泌等特性进行了综合检测和评价分析,并从中筛选得到具有开发潜力的蛋白酶和糖基转移酶高产菌株,对于开发有价值的芽孢杆菌菌种资源及其进一步的应用研究奠定了良好基础。
1 材料与方法
1.1 材料与试剂
1.1.1 芽孢杆菌菌种
400株芽孢杆菌菌株(按1~400进行编号并保存于本实验室):前期从天津大港土壤样品中分离筛选获得,形成实验室小型芽孢杆菌菌种资源库,供各种用途的芽孢杆菌菌种筛选备用。
1.1.2 试剂
氯化钠(分析纯):天津市凯通化学试剂有限公司;三氯乙酸(trichloroacetic acid,TCA)(分析纯):天津市大茂化学试剂厂;蛋白胨、酵母粉、酪蛋白(均为生化试剂):上海汉尼生物技术有限公司;琼脂粉(生化试剂):北京索莱宝科技有限公司;尿苷二磷酸葡萄糖(uridine diphosphoglucose,UDPG)、甜菊糖、莱鲍迪苷A(均为分析纯):上海毕得医药科技有限公司。
1.1.3 培养基
LB培养基:蛋白胨10 g/L、酵母粉5 g/L、氯化钠10 g/L;制备固体培养基时添加20 g/L的琼脂粉,pH7.0。
1.2 仪器与设备
ZQWY-200S全温培养摇床:天津亿诺科学仪器有限公司;Epoch 2TC酶标仪:美国Biotek公司;Microfuge 16离心机:德国Sigma公司;CascadaIII.I纯水仪:美国颇尔公司;SPX-150B-Z型生化培养箱:上海博迅实业有限公司医疗设备厂;TW2水浴锅:德国Abo公司;Waters e2695高效液相色谱仪:沃特世科技(上海)有限公司。
1.3 方法
1.3.1 主要溶剂的配制
0.4mol/L三氯乙酸(trichloroacetic acid solution,TCA):称取6.54 g三氯乙酸溶解于蒸馏水中,定容至100 mL。
0.2g/L酪蛋白溶液:称取2.0 g酪蛋白,加入2~3滴氢氧化钠溶液润湿酪蛋白,加入少量对应pH的磷酸盐缓冲液(中性pH为7.5,碱性pH为9.0),沸水浴5 min后加入相应磷酸盐缓冲液80 mL左右,搅拌至酪蛋白完全溶解。冷却到室温后调节至需要的pH,再用相应磷酸盐缓冲液定容至100 mL。放入4 ℃冰箱保存,保质期约为7 d。
甜菊糖(100 mmol/L):80 mg甜菊糖溶于1 mL 50 mmol/L磷酸盐缓冲液(pH6.5)中,于-20 ℃保存,备用。
UDPG(60 mmol/L):36 mg UDPG溶于1 mL无菌水中,保存于-20 ℃备用,保质期60 d。
1.3.2 菌株培养及胞外发酵液制备
将菌种库中的菌株由甘油管经划线活化,共活化成功335株菌株,接单克隆于小试管中(LB培养基)培养9 h后,再接三角瓶进行扩大培养24 h,装液量为20mL/100 mLLB培养基,37 ℃、220 r/min培养24 h后12 000 r/min离心4 min取上清为粗酶液,于-20 ℃保存备用,保存时间2~3 d。
1.3.3 蛋白酶的检测及筛选
以酪蛋白为底物测定各菌株胞外发酵液的蛋白酶酶活力,规定在特定条件下,每分钟水解酪蛋白产生1 μg酪氨酸所需的酶量为一个活力单位(IU)。本研究对蛋白酶的检测及筛选以实验室保存的模式菌株B.subtilis 168、B.subtilis WB600、B.subtilis WB800,以及蛋白酶生产菌株1016和B.amyloliquefaciens BAP为对照菌株,参照生产菌株在本筛选体系的产酶水平,确定野生芽孢杆菌胞外产酶大于100 U/mL为相对高产菌株。
测定条件为中性蛋白酶活性在40 ℃、pH 7.5的条件下测定,碱性蛋白酶活性在50 ℃、pH 9.0条件下测定[19],具体操作如下:
先将酪蛋白溶液放入测定温度的水浴锅中,预热5 min;每株菌酶活的测定都做3个平行实验,准备4个2 mL EP管,1个标为对照组,剩下3个为实验组,将4个EP管均加入250 μL粗酶液,置于测定温度的水浴锅中(中性蛋白酶40 ℃,碱性蛋白酶50 ℃)预热2 min。
对照组加入500 μL、0.4 mol/L三氯乙酸(TCA),实验组加入250 μL2%酪蛋白溶液轻轻混匀,同时置于待测温度(中性蛋白酶40 ℃,碱性蛋白酶50 ℃)水浴锅中水浴10 min,待反应即将结束时轻晃混匀。
反应结束后对照组加入250 μL 2%酪蛋白溶液,实验组加入500 μL 0.4 mol/L三氯乙酸(TCA),混匀后12 000 r/min离心15 min,取200 μL上清于酶标板测OD280nm值。
样品的酶活力按下式计算:
式中:Y为样品与对照之间的吸光度差值带入标准曲线中的酪氨酸含量,μg;4为将250 μL上清酶液换算成1 mL酶液;n为酶液稀释倍数;反应时间为10 min。
1.3.4 糖基转移酶的检测及筛选[20]
利用本实验室构建的成熟转化体系进行糖基转移酶的筛选,以甜菊糖和莱鲍迪苷A各50%的混合物为底物,每个株菌的测定都设一个对照组提前终止反应。
反应体系:粗酶液175 μL、终浓度为60 mmol/L 的UDPG 15 μL、终浓度为100 mmol/L的甜菊糖和莱鲍迪苷A各50%的混合物10 μL,最后于220 r/min、37 ℃反应24 h。
终止反应体系:体积分数60%的甲醇溶液160μL、1mol/L的硫酸溶液16 μL。
反应终止后12 000 r/min离心10 min取上清过膜过滤除菌进行液相定性分析。
色谱条件为Innoval ODS-2色谱柱(4.6 mm×250 mm,5μm);流动相乙腈∶水=68∶32,V/V;柱温40℃;流速0.5mL/min;进样量10 μL;检测时间10 min;检测波长210 nm。
样品的底物转化率按计算公式如下:
式中:A0为St或Reb A的底物初始浓度,mmol/L;At为St或Reb A反应后剩余浓度,mmol/L。
1.3.5 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
发酵液上清经TCA沉淀后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE)分析[21]。
2 结果与分析
2.1 芽孢杆菌菌种库中菌株产蛋白酶的总体情况分析
本研究对菌种库中活化成功的335株菌株进行了产蛋白酶情况的聚类分析,并以实验室保存的模式菌株B.subtilis 168、B.subtilis WB600、B.subtilis WB800,以及蛋白酶生产菌株1016和B.amyloliquefaciens BAP为对照菌株,对335株菌株进行产蛋白酶的测定与分析,结果见图1。
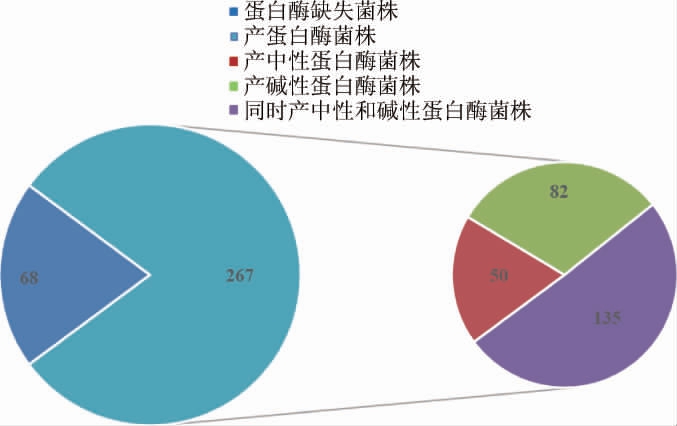
图1 芽孢杆菌菌种库中菌株产蛋白酶的总体情况分析
Fig.1 Analysis of protease-producing characteristics of strains in Bacillus strains library
由图1可知,芽孢杆菌菌种库中可产胞外蛋白酶的菌株共计267株,占79.7%,蛋白酶缺陷菌株68株,占比20.3%,由此可知整个芽孢杆菌菌种库大部分菌株具有产胞外蛋白酶的能力,对于菌种库中的蛋白酶缺陷菌株同样具有良好的研究开发前景,应用该类菌株作为表达外源蛋白的宿主菌,可在不影响胞外蛋白分泌表达的情况下避免外源蛋白的降解,从而形成更具潜力的新型外源蛋白表达系统。除此之外,在可产蛋白酶的267株中只产中性蛋白酶菌株50株,占比18.7%,只产碱性蛋白酶菌株82株,占比30.7%,同时产中性和碱性蛋白酶的菌株有135株占比50.6%,可见,产单一蛋白酶的菌株所占比例相对较小,半数以上的菌株可产多种蛋白酶。因此,在本芽孢杆菌菌种库中筛选不同蛋白酶的高产菌株将具有良好的研究开发前景。
2.2 中性蛋白酶高产菌株的筛选
对185株可产中性蛋白酶的芽孢杆菌菌株,对比发酵24 h后的胞外酶活,得到12株中性蛋白酶高产菌株,分别为388#、304#、81#、295#、94#、71#、88#、366#、21#、270#、206#菌株。具体结果见图2。
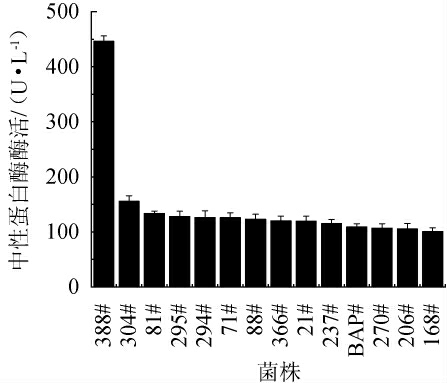
图2 芽孢杆菌菌种库中中性蛋白酶高产菌株的胞外酶活
Fig.2 Extracellular enzyme activity of high-yield neutral protease strains in Bacillus strains library
由图2可知,对照菌株复合蛋白酶生产菌株BAP和模式菌株168的胞外中性蛋白酶活力也在100 U/mL以上,同时可以看出菌种库中筛选到的12株高产菌株均高于菌株168的胞外酶活,10株甚至高于生产菌株BAP,其中388#菌株的胞外中性蛋白酶酶活最高为446.10 U/mL,并且388#菌株的胞外中性蛋白酶酶活是生产菌株BAP的4.0倍,显示了新中性蛋白酶生产菌株的开发潜力。
2.3 碱性蛋白酶高产菌株的筛选
对217株可产碱性蛋白酶的菌株进行了24 h发酵,对比其胞外酶活,并且以复合蛋白酶生产菌BAP和碱性蛋白酶生产菌株1016为对照菌株,筛选获得高产碱性蛋白酶的野生芽孢杆菌菌株,结果见图3。
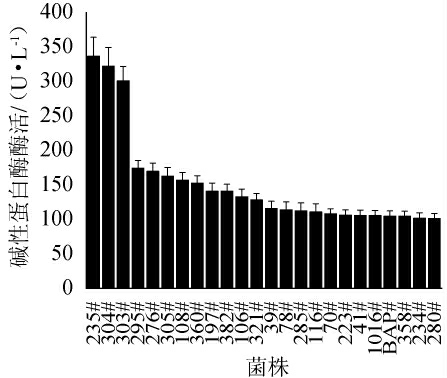
图3 芽孢杆菌菌种库中碱性蛋白酶高产菌株产酶情况
Fig.3 Enzyme production of high-yield alkaline protease strains in Bacillus strains library
由图3可知,芽孢杆菌菌种库中存在22株碱性蛋白酶高产菌株,分别为235#、304#、303#、295#、276#、305#、108#、360#、197#、382#、106#、321#、39#、78#、116#、70#、223#、41#、358#、234#、280#菌株,并且有19株产酶能力高于对照菌株,其中235#菌株酶活最高达336.76 U/mL,分别是菌株BAP和菌株1016胞外碱性蛋白酶酶活的3.2倍和3.1倍,显示了开发碱性蛋白酶生产菌株的潜力。另外,304#菌株碱性蛋白酶酶活达322.31 U/mL,在图2中304#菌株也是中性蛋白酶高产菌株,可见304#菌株是一株产蛋白酶种类丰富的菌株,可作为菌株BAP的替代菌株进行开发,也将具有良好的应用价值。
2.4 产新型糖基转移酶菌株的筛选
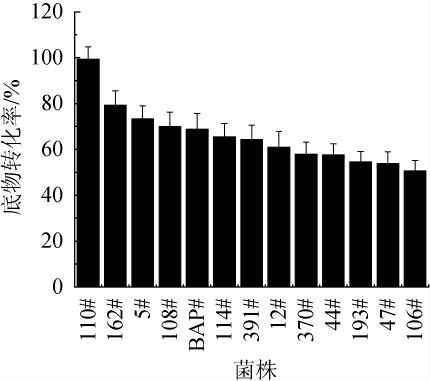
图4 芽孢杆菌菌种库中高底物转化率菌株
Fig.4 Strains with high substrate conversion rate in Bacillus strains library
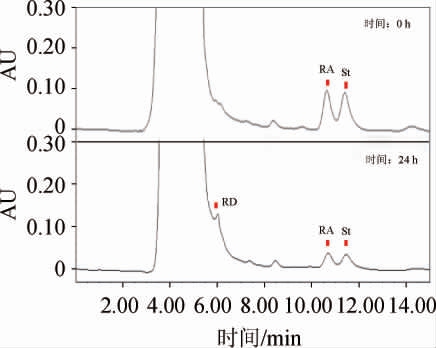
图5 菌株BAP胞外蛋白催化的糖基转化结果
Fig.5 Results of glycosyl conversion of strain BAP catalyzed by extracellular protein
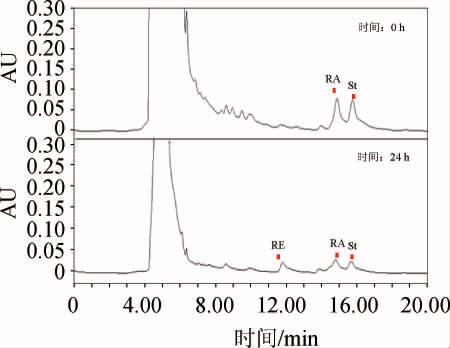
图6 菌株114#胞外蛋白催化的糖基转化结果
Fig.6 Results of glycosyl conversion of strain 114# catalyzed by extracellular protein
应用糖基转移酶合成糖苷类化合物成为当前的一个研究热点,糖基转移酶是通过天然产物合成糖苷类化合物的关键酶[22],相关报道证明,甜菊糖经糖基化后产物的甜度都得到了提高[23]。本研究以甜菊苷(St)和莱鲍迪苷A(RA)为底物,对菌种库中335株菌株的胞外发酵液进行筛选鉴定,得到了12株高底物转化率的菌株(见图4),这些菌株的底物转化率都在50%以上,说明这些菌株的胞外发酵液中具有以St或RA为底物的糖基转移酶。其中对照菌株BAP胞外酶的催化产物在210 nm处有莱鲍迪苷D(RD)的吸收峰(见图5),菌种库中菌株114#的胞外酶催化产物在210 nm处有莱鲍迪苷E(RE)的吸收峰出现(见图6),表明这两株菌株至少产生一种糖基转移酶,可将底物St或RA转化为特定的产物RD或RE,这在甜味剂研究领域将具有广泛应用前景,并且芽孢杆菌来源的新型糖基转移酶在酶的制备成本上将显示巨大的成本优势。另外,其他高底物转化率的菌株,虽然没有检测到特定产物,至少说明其胞外具有以St和RA为底物的糖基转移酶产生,可能受限于本实验的检测条件,没有检测到产物,但这些菌仍然显示了新型糖基转移酶的巨大开发潜力。
2.5 芽孢杆菌菌种库中菌株胞外蛋白分泌情况分析
本研究对菌种库中各菌株的胞外蛋白分泌能力进行了逐一测定,经过胞外蛋白浓度及SDS-PAGE的综合检测分析,结果见图7。
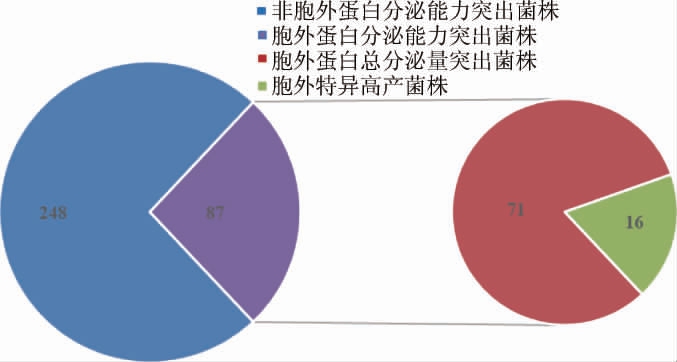
图7 芽孢杆菌菌种库中菌株胞外蛋白分泌情况
Fig.7 Extracellular protein secretion of strains in Bacillus strains library
由图7可知,在菌种资源库中发现了87株胞外蛋白分泌能力相对突出的芽孢杆菌菌株,占比仅为26%,可见,并不是所有芽孢杆菌都具有高水平的胞外蛋白分泌能力。其中,在这87株总蛋白分泌能力突出的菌株中有16株菌具有高产特定蛋白的能力(见图8),其胞外蛋白中有1-2个分泌相对突出的特异蛋白条带,针对这些特异条带可做进一步的蛋白鉴定,从而鉴定获得某种蛋白的高产菌株。结合本研究的高产菌株筛选结果,在这16株菌株中,295#菌为同时高产中性蛋白酶和碱性蛋白酶的菌株,其SDS-PAGE图中恰好显示有两条胞外高分泌水平的蛋白,显示了进一步研究开发潜力;12#菌和114#菌经前期筛选鉴定为新型糖基转移酶的高产菌株;237#菌为中性蛋白酶高产菌株;均显示了良好的研究开发潜力。

图8 高效分泌特异蛋白的芽孢杆菌胞外蛋白电泳图
Fig.8 Electrophoretogram of extracellular proteins of Bacillus strains with efficiently secretion specific proteins
M为蛋白质Marker,数字代表菌株编号。
3 结论
本研究通过对实验室小型野生芽孢杆菌菌种库各菌株产酶情况及胞外分泌能力的逐一测定,成功筛选到12株中性蛋白酶高产菌株、22株碱性蛋白酶高产菌株,还有68株蛋白酶缺失菌株,这些结果对于构建高产酶制剂生产菌株或是构建高效表达系统具有重要意义。同时,通过对糖基转移酶的筛选得到13株高底物转换率菌株包括有目的产物RE生成的114#菌株和RD生成的BAP菌株,这对于利用生物技术法合成新型甜味剂的研究来说具有一定的意义,也表明这些菌株将在食品市场上有一定的应用前景。可见,本实验室的小型芽孢杆菌菌种库具有良好的菌株多样性,将适合于多种食品酶制剂的筛选和开发。
[1]谢心悦,贾慧慧,杨海清,等.芽孢杆菌BJ_10 的鉴定及其抑菌活性与防病作用[J].北京农学院学报,2020,35(2):1-5.
[2]GUAN C,CUI W,CHENG J,et al.Development of an efficient autoinducible expression system by promoter engineering in Bacillus subtilis[J]. Microb Cell Factors,2016,15(1):66.
[3]肖怀秋,李玉珍,林亲录,等.枯草芽孢杆菌Prob1822 复合抗热保护剂的研究[J].中国酿造,2019,38(10):49-54.
[4]易子霆,鲍时翔,朱军,等.产酶芽孢杆菌的筛选及菌株HB13000 的鉴定[J].基因组学与应用生物学,2018,37(2):802-807.
[5]KIMURA K,YOKOYAMA S.Trends in the application of Bacillus in fermented foods[J].Curr Opin Biotechnol,2019,56(56):36-42.
[6]张辞海.产蛋白酶芽孢杆菌的分离鉴定及其粗酶性质[D].合肥:安徽大学,2020.
[7]CONTESINI F J,MELO R R,SATO H H.An overview of Bacillus proteases:from production to application[J].Crit Rev Biot,2018,38(3):321-334.
[8]RAVAL V H,PILLAI S,RAWAL C M,et al.Biochemical and structural characterization of a detergent-stable serine alkaline protease from seawater haloalkaliphilic bacteria[J]. Process Biochem,2014,49(6):955-962.
[9]TORBEN M,REGINA F,BERND S.Latest emerging functions of SPP/SPPL intramembrane proteases[J].Eur J Cell Biol,2017,96(5):372-382.
[10]孙艺轩,郑国栋,林剑.芽孢杆菌NCB-01 胞外蛋白酶酶学特性的初步研究[J].中国酿造,2020,39(8):128-133.
[11]张若兰,刘庆国,王敏,等.枯草芽孢杆菌碱性蛋白酶基因在酿酒酵母中的表达和应用[J].食品与发酵工业,2018,44(7):76-81.
[12]SHARMAK M,KUMAR R,PANWAR S,et al.Microbial alkaline proteases:Optimization of production parameters and their properties[J]. Genet Eng Biotech J,2017,15(1):115-116.
[13]秦艳梅,刘春卯,郑翔,等.微生物中性蛋白酶在食品工业的最新进展及应用前景[J].食品工业,2017,38(3):210-213.
[14]赵顺荣,黄紫娟,滕青.碱性蛋白酶在真丝织物姜黄染料染色中的应用[J].上海纺织科技,2020,48(3):21-23,57.
[15]JOSE D,MANJUSHA K,JOSE S,et al.Purification and characterization of highly active LasB protease from Pseudomonas aeruginosa MCCB 123[J].Indian J Exp Biol,2017,55(5):303-310.
[16]YU P,WANG X X,HUANG X X,et al.Purification and characterization of a propanol-tolerant neutral protease from Bacillus sp.ZG20[J]. Prep Biochem Biotech,2019,49(7):718-726.
[17]DORRA G,INES K,IMEN B S,et al.Purification and characterization of a novel high molecular weight alkaline protease produced by an endophytic Bacillus halotolerans strain CT2[J].Int J Biol Macromol,2018,111:342-351.
[18]LIANG H,HU Z,ZHANG T,et al.Production of a bioactive unnatural ginsenoside by metabolically engineered yeasts based on a new UDP-glycosyltransferase from Bacillus subtilis[J].Metab Eng,2017,44(44):60-69.
[19]王兴吉,佟新伟,王克芬,等.芽孢杆菌产碱性蛋白酶的研究进展[J].食品与发酵科技,2019,55(1):62-65.
[20]SHU W,ZHENG H,FU X.Enhanced heterologous production of glycosyltransferase UGT76G1 by co-expression of endogenous prpD and malK in Escherichia coli and its transglycosylation application in production of rebaudioside[J].Int J Mol Sci,2020,DOI:10.3390/ijms21165752.
[21]ZHAO X,XU J,TAN M,et al.High copy number and highly stable Escherichia coli-Bacillus subtilis shuttle plasmids based on pWB980[J].Microb Cell Factor,2020,DOI:10.21203/rs.2.18382/v2.
[22]赵千婧,程瑶,王佳,等.糖基转移酶合成相关糖苷类化合物研究进展[J].北京化工大学学报(自然科学版),2018,45(5):92-99.
[23]LI S,LI W,XIAO Q Y,et al.Transglycosylation of stevioside to improve the edulcorant quality by lower substitution using cornstarch hydrolyzate and CGTase[J].Food Chem,2013,138(2-3):2064-2069.