水产品是人类食用蛋白质的重要来源之一,而水产养殖中使用的药物残留将会对行业发展和人体健康产生不利的作用。卡巴氧(carbadox)和喹乙醇(olaquindox)属于喹啉类药物,由于其具有明显的抗菌和促生长作用,曾在水产养殖业中应用,但后期证明有较强的毒副作用,已被不同程度地限制或禁止使用[1-2]。3-甲基-喹恶啉-2-羧酸(3-methylquinoxaline-2-carboxylic acid,MQCA)和喹恶啉-2-羧酸(quinoxaline-carboxylic acid,QCA)分别是喹乙醇和卡巴氧在靶动物体内的代谢物,被定为残留检测的标示物[3]。卡巴氧和喹乙醇本身具有潜在的致癌、致畸作用,二者的代谢物也可能带来健康风险,因此多个国家对二者及其代谢产物QCA和MQCA制定了残留监控的限量标准[4-6]。同时,我国现执行的水产行业标准SC/T 3019—2004《水产品中喹乙醇残留量的测定液相色谱法》和农业部1077号公告-5-2008有水产品中喹乙醇残留量分析的高效液相色谱方法,但处理方法的灵敏度低,残留分析的可靠性低;且尚未见直接控制水产品自身组织中卡巴氧的检测标准,而只是有对其饲料中的卡巴氧残留检测的标准。因此,探讨并建立检测水产品中喹乙醇和卡巴氧残留方法,对于完善和改进水产品中2种喹啉类药物残留标准和方法具有实际意义。
目前,检测在动物源食品中QCA和MQCA的方法文献报道较多,最常用的有液相色谱法[7-8]、免疫法[9-10]和液相色谱-质谱联用法[11-14],但对鱼类检测的应用较少。本研究在前人研究工作的基础上,明确了区域定位和增加且细化了检测品种,极大提高了方法的灵敏度。实验以金沙江攀枝花江段6种常见商品鱼为研究为对象,适当改进了样品前处理方法,建立了鱼组织中QCA和MQCA残留的超高效液相色谱串联三重四极杆质谱(ultra-performance liquid chromategr-aphy-triple quadrupole mass spectrometry,UPLC-MS/MS)检测方法,为鱼组织中QCA和MQCA残留的评估检测提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
样品来源于金沙江攀枝花江段6种常见鱼(罗非鱼、草鱼、鲤鱼、鲢鱼、鲫鱼、鲶鱼),且以罗非鱼作为方法验证样品,本地市场或养鱼场随机购得,鲜活的罗非鱼、鲤鱼等水产品去鳞、去皮、沿背脊取肌肉,充分绞碎,均质,-20 ℃以下避光保存。
1.1.2 化学试剂
蛋白酶(5 U/mg)、Tris碱(HOCH2)3CNH2(纯度98.5%):美国Sigma公司;喹恶啉-2-羧酸(纯度98.9%)、3-甲基喹恶啉-2-羧酸(纯度98.1%)、喹恶啉-2-羧酸-d4(纯度99.5%,QCA-d4)标准品:德国Dr.Ehrenstorfer GmbH公司;甲酸、甲醇、乙酸乙酯、乙腈(均为色谱纯):美国Fisher公司;盐酸、乙酸、氯化钙等其他试剂为国产分析纯。
1.2 仪器与设备
Agilent 6460A超高效液相色谱-串联四级杆质谱仪、Bond Elut Plexa PAX 固相萃取柱(200 mg/6 mL,使用前依次用6 mL甲醇、6 mL水活化,保持柱体湿润):美国Agilent 公司;Vortex 4涡旋混合器:比利时LMS公司;Milli-Q IQ7000超纯水器:美国Millipore公司;Nevap-45氮吹仪:美国Organomation公司;FA2014B电子天平:上海越平公司;1-14k离心机:美国Sigma公司。
1.3 方法
1.3.1 标准溶液的配制
分别称取0.0050 g喹恶啉-2-羧酸、喹恶啉-2-羧酸-d4(同位素内标,QCA-d4)、3-甲基喹恶啉-2-羧酸标准品,分别用甲醇溶解并定容至10 mL,质量浓度均为0.5 mg/mL,-20 ℃避光保存。其他浓度标准溶液用甲醇定量混合或逐级稀释即得。
1.3.2 样品前处理
样品提取:分别称取6种鱼的均质样品5.0 g于50 mL离心管中,加入100 μL 100 μg/mL QCA-d4溶液、8 mL 0.2 mol/L(pH=9.6)Tris缓冲溶液和300 μL 10 mg/mL蛋白酶水溶液,涡旋混匀,置于空气浴恒温摇床中47 ℃酶解18 h,取出样品放置至室温,再加1 mL浓盐酸,振摇混匀,4 ℃、9 000 r/min离心5 min。取上层清液加入6 mL乙酸乙酯,涡旋1 min,4 ℃、9 000 r/min离心5 min,再重复乙酸乙酯步骤1次,合并两次上清液。上清液于35 ℃下氮吹浓缩至近干,残渣用10 mL 20%甲醇水溶解,待净化。
样品净化:将样品提取液转移至经活化的PAX柱。依次用6 mL水、6 mL 2%氨水、6 mL甲醇和6 mL 0.5%乙酸-甲醇淋洗PAX固相萃取柱。然后将PAX柱抽干,用6 mL 2%甲酸-甲醇溶液洗脱目标化合物,收集洗脱液,35 ℃下氮吹浓缩至干,用1.0 mL 20%甲醇-水溶液溶解残渣,过0.22 μm滤膜后,备用。
1.3.3 仪器条件
液相色谱条件:流动相:0.1%的甲酸水溶液-乙腈,梯度洗脱;流速:0.25 mL/min;进样体积:5 μL;色谱柱:ZORBAX SB-C18(2.1 mm×100 mm,1.8 μm);柱温:40 ℃;洗脱程序:0~6 min,乙腈由5%线性升至25%;6~7 min,25%乙腈;7.0~7.1 min,乙腈由25%线性降至5%。
质谱条件:电子电离(electronic ionization,EI)源;扫描方式为QCA、MQCA、QCA-d4为正离子扫描;多反应监测(multiple-reaction monitoring,MRM);电喷雾电压:4 000 V;辅助气(auxiliary gas flow,AUX)流速:11 L/min;辅助气温度:350 ℃。
1.3.4 标准曲线的绘制及检出限的测定
配制好的QCA和MQCA标准储备液用甲醇稀释成400 μg/L混合标准溶液,用空白罗非鱼基质提取液将混合标准溶液稀释成2.0 μg/L、4.0 μg/L、10.0 μg/L、20 μg/L、40 μg/L、80 μg/L和100 μg/L系列质量浓度的混合标准溶液分别进行测定。以目标化合物的质量浓度(x)为横坐标和其峰面积(y)为纵坐标,绘制工作曲线。以3倍信噪比(S/N>3)和10倍信噪比(S/N>10)分别确定检出限(detection limit,LOD)与定量限(limit of quantitation,LOQ)[15-17]。
2 结果与分析
2.1 样品提取与净化
鱼肉样品含有15%~20%的蛋白质和5%左右的脂肪[18],而喹噁啉类药物在动物源性食品中的残留具有基质复杂且固体基质内源性干扰较大、含量低(痕量)的特点[19],对药物分析的干扰很大,因而必须进行样品前处理。QCA和MQCA与原药的结构和性质差别较大,为有机强酸,极性较强,在动物体内通过共价键与一些氨基酸(或蛋白质)结合,需要利用酶水解为游离态,再进行提取,且减少了杂质干扰。酶解液经盐酸酸化,乙酸乙酯提取,可有效沉淀蛋白质,消除代谢活性物质及终产物对提取的影响,乙酸乙酯洗脱液的杂质较少,提高了绝对回收率。同时,实验比较了不同规格(60 mg/3mL、200mg/6mL、500mg/6mL)的PAX小柱,直管型柱中填料量和体积过小(60 mg/3 mL)存在回收率低和柱饱和现象,过大又存在浪费特异性固相萃取材料不经济现象,最后选择PAX(200 mg/6 mL)柱回收率较高,可有效除去干扰物质,满足实验要求。
2.2 仪器条件的优化
在MQCA和QCA 残留分析中使用的流动相为0.1%甲酸-乙腈体系,因甲酸可以为化合物提供必需的质子来源,提高其离子化效率。在ESI+模式下,优化碰撞能量,MQCA和QCA经过两级碰撞扫描后,产生不同强度的离子碎片,以丰度最大的m/z 145、m/z133和m/z 129作为3种化合物的定量离子,MQCA 和QCA的MRM色谱图见图1,定量离子色谱图见图2,3种化合物的质谱分析参数见表1。
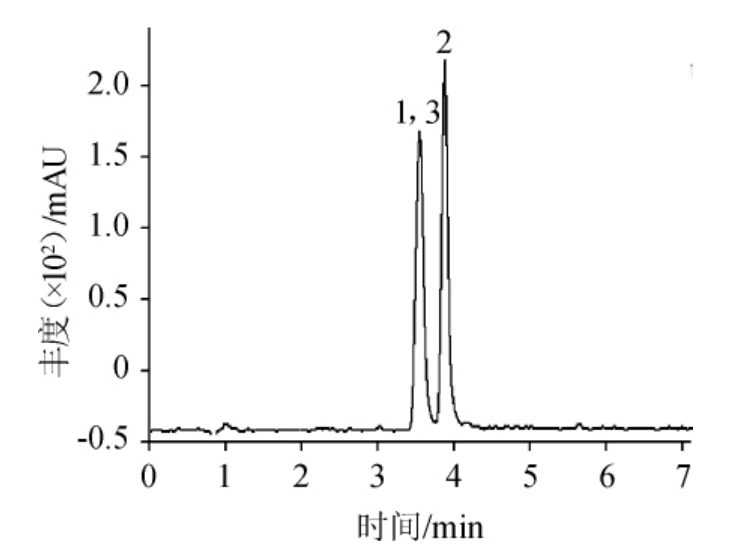
图1 混合标准溶液的UPLC-MS/MS分析总离子流色谱图
Fig.1 Total ion chromatogram of mixed standard solution analysis by UPLC-MS/MS
1.QCA、2.MQCA、3.QCA-d4。

图2 3种化合物的定量离子色谱图
Fig.2 Quantitative ion chromatogram of 3 compounds
表1 多反应监测模式下3种兽药的质谱参数
Table 1 MS parameters of 3 veterinary drugs under MRM mode

注:“*”为定量离子。
由图1和图2可知,MQCA和QCA经色谱分离流出的组分不断进入质谱,质谱连续扫描进行数据采集,每一次扫描得到一张质谱图,将每一张质谱图中所有离子强度相加,得到一个混合标准溶液总的离子流强度。同时,定量离子色谱图反映了色谱峰的定性(目标化合物的特征离子),峰的一致性测定。
2.3 方法的线性关系及检出限
向空白罗非鱼基质溶液中加入系列混合标准溶液和内标溶液,以峰面积对应的浓度进行线性回归,结果见表2。由表2可知,其线性关系良好,相关系数(R)>0.999。定量限(LOQ)为0.2 μg/kg,检出限(LOD)为0.05 μg/kg。结果表明,方法的灵敏度能满足检测要求,并优于已有标准[6]和文献[3,14]。
表2 方法的线性回归方程、相关系数和检出限
Table 2 Linear regression equations,correlation coefficients and detection limits of method

2.4 方法的回收率与精密度
空白的罗非鱼样品分别添加不同浓度的标准液各6份,摇匀、静置后按1.3.2方法处理并进行加标回收率及精密度试验,计算平均回收率和相对标准偏差(relative standard deviation,RSD),结果见表3。由表3可知,各添加水平的回收率为91.4%~100.4%,精密度试验结果RSD为6.3%~11.5%,方法的准确度与精密度均满足药物残留分析的要求[20]。
表3 加标回收率和精密度试验结果
Table 3 Results of adding standard recovery rate and precision tests

2.5 实际样品分析
目前,我国现行标准对水产品中喹乙醇代谢物MQCA的最大残留限量为4 μg/kg[6],还没有对卡巴氧代谢物QCA制定最大残留限量。按试验方法对金沙江攀枝花江段的30份6种常见商品鱼(罗非鱼、草鱼、鲤鱼、鲢鱼、鲫鱼、鲶鱼)进行分析,其QCA和MQCA的残留量均低于方法的检出限,均未检出。
3 结论
罗非鱼、草鱼、鲤鱼、鲢鱼、鲫鱼、鲶鱼作为市场流通的常见水产品,其QCA和MQCA残留也引起越来越多的关注。虽然我国现行标准仅对水产品中喹乙醇代谢物MQCA残留量有限定[6],但由于鱼体中QCA和MQCA残留对人类存在健康风险,非常有必要对鱼体中的卡巴氧及喹乙醇代谢物残留进行检测和监控。本研究采用同位素内标法定量,UPLC-MS/MS法分别测定金沙江攀枝花江段6种常见商品鱼中QCA和MQCA的残留量均未检出,本方法灵敏度较好,回收率和重现性符合检测要求,达到了QCA和MQCA残留分析的要求,为食品安全风险监测鱼类等水产品中药物残留的检测方法和限量标准的制定提供了一定的参考依据。
[1]张秀珍,刘云,徐英江,等.新型喹噁啉类药物在水产养殖中的有效性及安全性研究进展[J].食品安全质量检测学报,2013,4(1):38-44.
[2]曹随忠,张力,梁建平,等.喹恶啉-1,4-二氧化物类抗菌促生长剂特殊毒理学研究进展[J].动物医学进展,2001,22(2):17-20.
[3]赵珊,郭巧珍,张晶,等.超高压液相色谱-串联质谱法测定鱼组织中卡巴氧及喹乙醇代谢物[J].食品安全质量检测学报,2013,4(1):124-128.
[4]林黎,谢丽琪,欧阳姗,等.液相色谱-串联质谱法测定牛奶和奶粉中卡巴氧和喹乙醇代谢物的残留量[J].分析试验室,2010,29(2):38-41.
[5]中华人民共和国农业部.SC/T 3019—2004 水产品中喹乙醇残留量的测定液相色谱法[S].北京:中国标准出版社,2004.
[6]中华人民共和国农业部.农业部1077 号公告-5-2008 水产品中喹乙醇代谢物残留量的测定高效液相色谱法[S].北京:中国标准出版社,2008.
[7]姚蕴珊,沈建忠,吴聪明,等.高效液相色谱法测定猪肝组织中3-甲基喹喔啉-2-羧酸[J].中国畜牧兽医,2011,38(2):187-190.
[8]WU Y J,YU H,WANG Y L,et al.Development of a high-performance liquid chromatography method for the simultaneous quantification of quinoxaline-2-carboxylic acid and methyl-3-quinoxaline-2-carboxylic acid in animal tissues[J].J Chromatogr A,2007,1146(1):1-7.
[9]周秀锦,邵宏宏,张静,等.现代分析技术检测卡巴氧及其代谢物的研究进展[J].分析试验室,2017,36(12):1472-1476.
[10]万宇平,吴鹏,罗晓琴,等.喹乙醇代谢物残留ELISA 试剂盒检测方法的建立[J].现代农业科技,2012(12):247-249.
[11]ZHANG X J,ZHENG B,ZHANG H,et al.Determination of marker residue of olaquindox in fish tissue by ultra performance liquid chromatography-tandem mass spectrometry[J]. J Separat Sci,2011,34(4):469-474.
[12]HUTCHINSON M J,YOUNG P B,KENNEDY D G.Confirmation of carbadox and olaquindox metabolites in porcine liver using liquid chromatography-electrospray tandem mass spectrometry[J].J Chromatogr B,2005,816(1-2):15-20.
[13]欧阳姗,庞国芳,谢丽琪,等.动物组织中卡巴氧和喹乙醇以及相关代谢产物的液相色谱-串联质谱检测方法[J].分析测试学报,2008,27(6):590-594.
[14]赵东豪,黎智广,杨金兰,等.高效液相色谱-串联质谱测定水产品中残留的喹乙醇代谢物[J].分析试验室,2010,29(9):19-22.
[15]李本昌.农药残留量实用检测方法手册[M].北京:化学工业出版社,2001:507-510.
[16]田金凤,尚远宏,郑毅.液质联用法测定野拔子蜂蜜中林可霉素[J].食品工业,2019,40(10):293-295.
[17]图雅,崔建平,赵宏.同位素内标-超高效液相色谱-串联质谱法测定蜂蜜中氯霉素及甲硝唑[J].中国食品卫生杂志,2017,29(4):450-453.
[18]毕思远,曹建涛,李保玲,等.QuEChERS-气相色谱分析厦门海域鱼体中有机氯类农药残留特征及风险评价[J].食品与发酵工业,2019,45(21):229-235.
[19]范立鹏,段振娟,方国臻,等.动物源性食品中喹噁啉类药物残留检测方法研究进展[J].中国食品学报,2012,12(9):171-178.
[20]中华人民共和国农业农村部.NY/T788—2018 农药残留试验准则[S].北京:中国标准出版社,2018.