硫酸软骨素(chondroitinsulfate,CS)是糖胺多糖的一种,是以D-葡萄糖醛酸和2-乙酰氨基-2-脱氧硫酸-D-半乳糖通过β-1,3糖苷键相结合的双糖为基本单位,聚合而成的一类大分子多糖,双糖单位数目一般在50~70个,分子质量约在5~50 kDa之间[1-2]。糖胺多糖作为蛋白聚糖的组成成分,主要分布在细胞外基质和细胞表面,用来指导很多生物过程,如细胞增殖,信号传输和炎症介导等[3-4]。
硫酸软骨素裂解酶(chondroitinase,ChSase)是一类能将糖胺聚糖催化裂解为小分子多糖的酶,ChSase根据其作用底物的不同分为ChSase ABC、ChSase AC、ChSase B以及ChSase C等类型。ChSase ABC作为一种多糖裂解酶,可降解诸多底物,如硫酸软骨素A(CS A)、硫酸软骨素B(CS B)、硫酸软骨素C(CS C)透明质酸,这也使得其具有更广泛的用途。首先ChSase ABC I能将不同种类的高分子质量的CS降解成低分子质量的CS,低分子质量的CS具有更为明显的药用及保健效果。其次ChSase ABC I能够做为检测CS的有效工具,因其降解CS的产物为不饱和的二糖,此二糖在波长232 nm有强烈的光吸收,可被快速有效的检测到[5]。ChSase ABC I除去这些降解和检测功能外,还具有明显的药理活性,尤其是对于脊椎损伤后的修复,许多报道都已证明ChSase ABC I能够降解脊椎损伤后沉积的硫酸软骨素蛋白多糖中的CS链,从而治疗脊柱损伤,促进轴突再生,使受体恢复运动和感知功能[6-8]。
ChSase ABC根据其作用方式的不同,分为ChSase ABC I和ChSase ABC II,ChSase ABC I是内切酶,从CS的内部进行切割形成不饱和二糖,ChSase ABC II是外切酶,从CS的末端进行切割形成不饱和二糖,由于ChSase ABC I的高活力和用途更为广泛,所以本研究重点是ChSase ABC I。HAMAI A等[9]从普通变性杆菌中分离纯化得到了ChSase ABC I测定了它对不同底物的比活力。HUANG W等[10-11]解析了ChSase ABC I晶体的结构。许多学者也对ChSase ABC I进行了表达研究[12-14]。目前也有许多关于ChSase ABC的固定化和稳定性的研究,但是这些酶大多都是从菌株中分离得到,分离步骤繁琐,且得到的酶活较低,酶的主要来源为多行拟杆菌(Bacteroides thetaiotaomicron)和温和气单胞菌(Aeromonas sobria)[15]。
本研究将来源于普通变形杆菌(Proteus vulgaris)KCTC 2579的ChSase ABC I与MBP融合表达,构建了pMAL-c2x-ChSase ABC I重组载体,并成功在大肠杆菌(Escherichia coli)BL21(DE3)高效表达,并且利用直链淀粉柱实现了一步纯化。酶生物传感器是将酶作为生物敏感基元,通过各种物理、化学信号转换器捕捉目标物与敏感基元之间的反应所产生的与目标物浓度成比例关系的可测信号,实现对目标物定量测定的分析仪器。酶生物传感器在生化分析,临床测定和环境探测方面都具有很广泛的应用。本研究将麦芽糖结合蛋白-硫酸软骨素酶(MBP-ChSase)ABC I酶固定在聚苯胺载体上,通过自组装设备聚苯胺修饰电极,研究其对ChSase ABC I的响应,制备生物传感器,并利用循环伏安法对其进行检测。
1 材料与方法
1.1 材料与试剂
普通变形杆菌(Proteusvulgaris)KCTC2579:韩国KCTC保藏中心;E.coli DH5α、E.coli BL21(DE3)感受态细胞:北京博迈德生物技术有限公司;pMAL-c2x:本实验室保存;Q5TM High-Fidelity 2×Master Mix、T4脱氧核糖核酸(deoxyribonucleic acid,DNA)连接酶和所有的限制性内切酶:New England Biolabs公司;硫酸软骨素A(分子质量为50 000 Da):南京奥多福尼生物科技有限公司;细菌全基因组提取试剂盒、质粒提取试剂盒、胶回收试剂盒和柱回收试剂盒:美国OMEGA公司;酶固定化材料苯胺、戊二醛、盐酸、过硫酸胺、戊二醛(glutaraldehyde,GA)(均为分析纯):美国Sigma公司。
Proteus vulgaris KCTC 2579采用牛肉膏蛋白胨培养基:牛肉膏提取物0.3%,蛋白胨0.5%,pH值自然,115 ℃灭菌30 min。
大肠杆菌培养采用LB培养基:胰蛋白胨1%,酵母提取物0.5%,NaCl 1%,pH值自然,115 ℃灭菌30 min。
1.2 仪器与设备
1-14K高速冷冻离心机:美国Sigma公司;MBPTrap HP亲和柱(1mL):美国GE Healthcare公司;电化学工作站(CHI 660,CH instruments from South Korea)及丝网印刷电极(PANI型):美国CH instruments公司。
1.3 方法
1.3.1 重组质粒pMAL-c2x-ChSase ABC I的构建
将Proteus vulgaris KCTC 2579从安培管中接入到相应的培养基,37 ℃培养72 h,菌体12 000 r/min离心1 min,收集菌体,用细菌全基因组提取试剂盒提取基因组,以此为模板,并采用Q5TM High-Fidelity 2×Master Mix对ChSase ABC I进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。根据已知的ChSase ABC I序列(GenBank:GQ996964.1)设计PCR 引 物,ChSase ABC I-F:5'-CGGGATCCATGGCCACCAGCAATC CTGCATT-3',ChSase ABC I-R:5'-AACTGCAGTTATCAA GGGAGTGGCGAGAGTTTG-3'。
将扩增得到的ChSase ABC和pMAL-c2x均用BamH I/Pst I酶切,酶切后进行胶回收。然后用T4DNA连接酶进行连接,连接后转化到E.coli DH5α,并进行菌落PCR,酶切和测序验证。
1.3.2 重组酶MBP-ChSase ABC I的表达和宿主优化
将重组质粒pMAL-c2xChSaseABC I转化到E.coliDH5α,E.coli BL21,E.coli BL21(DE3),E.coli JM109,E.coli Top10和E.coli TB-1中,用接种环挑取一环菌体接种到预先灭菌的装有4 mL LB培养基和100 μg/mL氨苄青霉素的试管中,37 ℃、180 r/min培养12 h后,作为种子液。按1%的接种量将种子液接到装液量为50 mL/250 mL含100 μg/mL氨苄青霉素的LB培养基中,37 ℃培养至对数生长中期(OD600nm值为0.6左右)。加入异丙基β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactoside,IPTG)至浓度为0.5 mmol/L,16 ℃、180 r/min诱导表达20 h。
1.3.3 重组酶MBP-ChSase ABC I的SDS-PAGE分析
将诱导表达20 h后的发酵液收集菌体,6 000 r/min离心6 min,并用适量的水清洗菌体。加入适量的Tris-HCl,pH 7.4缓冲液重悬菌体,超声破碎菌体,超声条件为:超声5 s,间歇6 s,超声功率0.3 kW,破碎总时间为15 min。破碎时要保证低温破碎。破碎液离心后收集上清,并用0.22 μm滤膜过滤上清,过滤后置于冰上备用,并用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)验证蛋白表达量和分子质量。
1.3.4 酶活及比酶活的测定
重组酶MBP-ChSase ABC I可裂解底物硫酸软骨素A为4,5-不饱和糖醛酸产物,此产物在232 nm波长处有强烈吸收。因此采用波长为232 nm的吸光度值来测定重组酶MBP-ChSase ABC I的酶活[16],具体测定方法见HE W等[17-18]报道的方法,扫描波长为232 nm,时间为5 min,摩尔消光系数ε=3 800 L/(mol·cm)。蛋白浓度测定采用Bradford法。
1.3.5 酶的固定化
将重组MBP-ChSase ABC I酶直接固定在已被聚苯胺修饰的电极之上,由于电极表面的聚苯胺载体数量较少,故在固定化时相应减少酶溶液及交联剂的量,具体方法如下:用pH 6.5的磷酸盐缓冲溶液(phosphate buffered solution,PBS)润洗电极表面,取10 μL酶溶液涂在电极的中心处,并将电极至于平皿中放置,以防溶液的快速蒸发,放置1 h后向其中加入10 μL含量为1%的GA溶液,混匀后再静置2 h,然后用20 μL的PBS缓冲液(pH6.5)清洗电极表面固定区域,以去除未参与反应的残留溶液,随后用20 μL的Tris缓冲液(pH7.9)进行帽化,最后用PBS溶液清洗,4 ℃条件下保存备用。
1.3.6 MBP-ChSase ABC I生物传感器电化学性能检测
利用电化学工作站对已制备好的MBP-ChSase ABC I酶生物传感器进行检测。此反应中使用了PANI型丝网印刷电极,其工作电极为聚苯胺,通过上面固定化步骤在此电极上固定了重组MBP-ChSase ABC I酶;对电极为Ag/AgCl;参照电极为聚苯胺电极。主要利用循环伏安法(cyclic voltammetry,CV)进行测试。循环伏安法是一种常用的电化学研究方法,通过改变电位来得到氧化还原电流。主要是通过施加一个循环电位来进行扫描,从起始电位以一个固定的速率扫描直至终点电位,再以相同速率扫描回起始电位,如此计为一个循环[19-20]。本实验中的酶解反应虽然不是氧化还原反应,但是由于化学反应的存在,会导致在电位扫描过程中出现离子形成离子峰,利用循环伏安图判断出生离子时的电位。
1.3.7 底物硫酸软骨素A对传感器的影响
将底物直接作用于电极表面的反应区,总反应体系为50 μL,通过调节底物和缓冲溶液的体积来变换底物的浓度。利用循环伏安法,首先确定电位扫描范围为-2~+2 V,测定不同底物浓度时生物传感器在该循环内的电流变化,找到发生化学反应时的电流峰值。
1.3.8 生物传感器灵敏度测定
通过电化学工作站利用安培曲线法对生物传感器进行灵敏度检测。起始反应段为空白对照,无底物CS A,之后每间隔1 min加入5 μL浓度为1 μmol/L的CS A底物进行反应,第4分钟时加5 μL浓度为10 μmol/L的CS A底物。利用安培曲线法,观察加入底物的瞬间电流的变化,以此判断该传感器对底物的反应灵敏性。
2 结果与分析
2.1 PCR结果验证及序列分析
PCR扩增得到ChSase ABC I 见图1。由图1可知,退火温度为60 ℃时,PCR效果最佳,非特异条带较少。同时,将PCR产物通过测序验证,结果表明已通过PCR成功获得ChSase ABC I。将扩增得到的ChSase ABC I和pMAL-c2x均用Bam H I/Pst I酶切,连接转化后获得阳性转化子,提取质粒后,测序验证重组质粒,表明已成功获得重组质粒pMAL-c2x-ChSase ABC I。
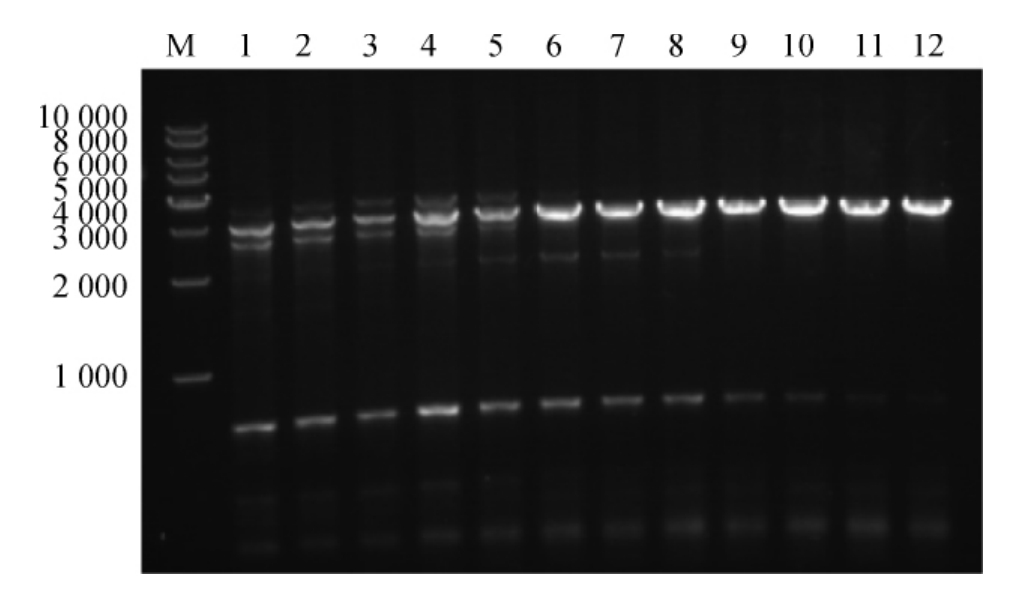
图1 琼脂糖凝胶电泳验证PCR结果
Fig.1 PCR verification results by agarose gel electrophoresis
M:10 000 bp DNA Marker;1~12为40~60 ℃退火温度下得到的PCR片段。
2.2 重组酶MBP-ChSase ABC I的表达及宿主优化
将成功构建的重组质粒pMAL-c2x-ChSase ABC I分别转化到E.coli DH5α、E.coli BL21、E.coli BL21(DE3)、E.coli JM109、E.coli Top10和E.coli TB-1中,在相同的条件下诱导表达,分别测定蛋白浓度、酶活和比酶活。结果显示在E.coli BL21中酶活和比酶活都是最优的[21]。
重组酶MBP-ChSase ABC I可裂解底物硫酸软骨素A成为4,5-不饱和糖醛酸产物,此产物在232 nm波长处有强烈吸收。图2表明重组酶MBP-ChSase ABC I已成功表达。
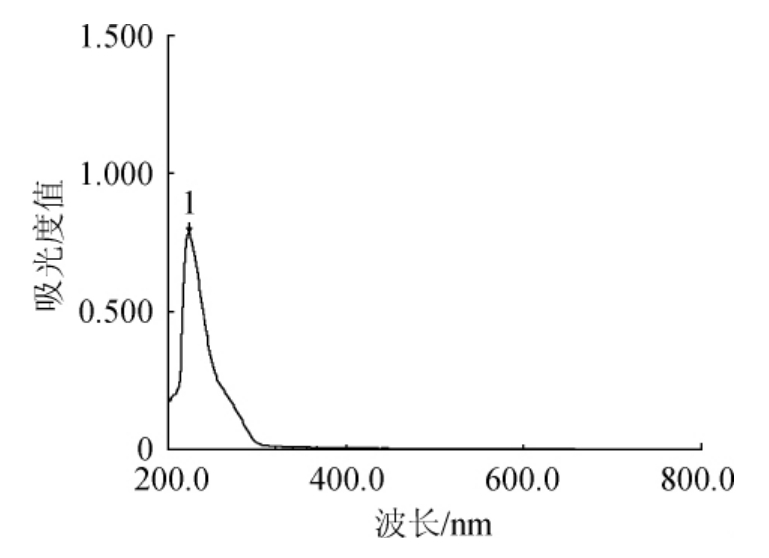
图2 重组酶MBP-ChSase ABC I裂解底物硫酸软骨素A后的全扫描图
Fig.2 Full scan of the recombinant enzyme MBP-ChSase ABC I after cleaving the substrate chondroitin sulfate A
峰1为降解产物4,5-不饱和糖醛酸在波长232 nm下的吸收峰。
SDS-PAGE验证表明重组酶MBP-ChSase ABC I已在BL21(DE3)中成功表达,并且获得了可溶性的重组酶MBPChSaseABC I,破碎后上清基本包含了80%以上的总蛋白,基本无包涵体存在。重组酶MBP-ChSase ABC I的分子质量约为130 kDa[21]。
2.3 循环伏安图
由图3可知,在0.3~1.0 V区间有一个离子峰,这个离子峰根据底物浓度的变化而变化,浓度越高,离子峰的峰值也越高。没有底物的缓冲液中传感器的电流信号不是很高,跟底物的信号相比可以近似看为直线。这说明本实验中的聚苯胺-MBP-ChSase ABC I酶固定化电极对底物的敏感度很强,受缓冲液影响很小。
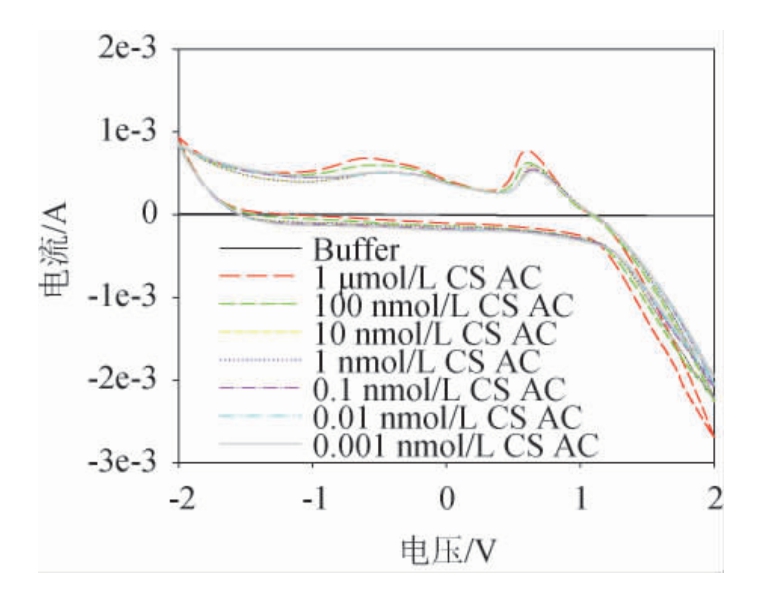
图3 不同浓度的CS AC在PANI固定化酶电极中的循环伏安图
Fig.3 Cyclic voltammetry diagram of different concentrations of CS AC in PANI immobilized enzyme electrode
2.4 底物CS A浓度对生物传感器的影响
为了进一步证实作为传感器的可行性。硫酸软骨素酶的水解反应液中按照底物浓度的变化产生离子,对这些离子峰部分进行了针对性分析,结果见图4。由图4可知,在电压为0.553 V时,底物浓度在0.1 nmol/L~0.1 μmol/L的范围内,底物浓度与电流成直线关系。这说明聚苯胺-MBP-ChSase ABCI酶固定化电极对底物CS A作为生物传感器有良好的检测效果。
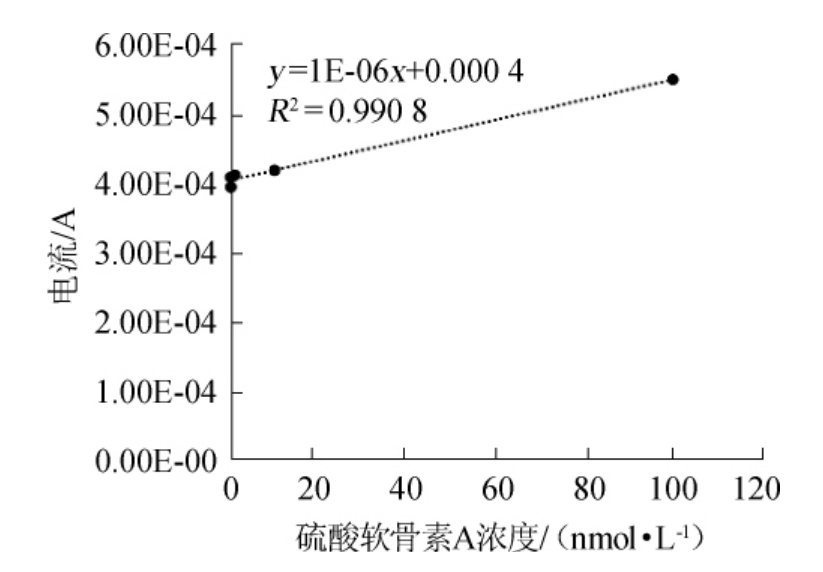
图4 硫酸软骨素A的标准曲线
Fig.4 Standard curve of chondroitin sulfate A
2.5 生物传感器灵敏度
为了检测聚苯胺-MBP-ChSase ABC I酶固定化电极的检测特性绘制i-T曲线,结果见图5。由图5可知,电极反应体系为50 μL,每隔1 min加5 μL的1 μmol/L的CS A底物,第4分钟时加5 μL的10 μmol/L CS A底物。60 s、120 s、180 s、240 s时电流脉冲式增加,随后马上进入稳定区。第4分钟时加入高浓度底物时电流脉冲也随着升高,并进入稳定区。这说明本实验中制备的聚苯胺-MBP-ChSase ABC I固定化电极的敏感度比较高,作为底物测定的生物传感器是一个良好的选择。
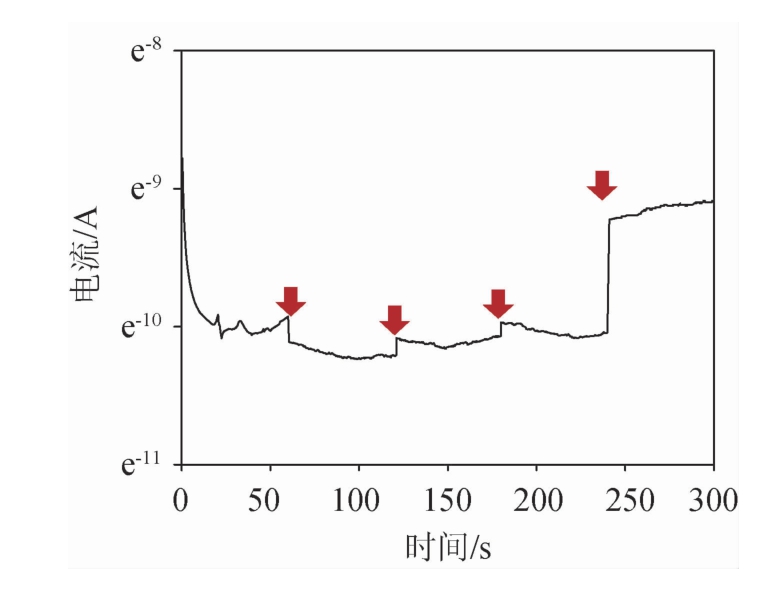
图5 硫酸软骨素固定化电极的i-T曲线
Fig.5 i-T curve of chondroitin sulfate immobilized electrode
3 讨论
目前重组菌构建越来越受到关注,ChSase ABC重组菌也越来越多,但是仍然面临着许多的困难:一方面通过菌体表达得到的重组酶,表达量不高,活性较低,大多数都以包涵体形式表达,再经过后续的包涵体分离纯化及复性,得到的酶量有限,活性也有损失。另一方面ChSase ABC的分离纯化,常用的是硫酸铵沉淀法,这种方法的成本很高,是制约酶工业化生产的主要瓶颈。另外,ChSase ABC酶的不稳定性也制约了该酶在诸如医药领域的应用。本研究通过融合表达方法成功获得重组酶MBP-ChSase ABC I,包涵体较少,80%以上蛋白均为可溶性蛋白。利用电化学工作站循环伏安法来探索底物CS A的浓度对生物传感器的影响,利用安培曲线法检测该传感器的灵敏度。结果表明,随着底物CS A浓度的增加,水解反应速率加快,反应液中产生离子变多电流峰值呈线性增加,CS A浓度在0.1 nmol/L~0.1 μmol/L范围内时,底物浓度与峰值电流有很好的线性关系。在此浓度范围内,该生物传感器能够对CS A有效检测。安培曲线法证明了重组MBP-ChSase ABC I酶在电极上发生水解反应时,随着CS A浓度的升高,对电极能检测到电流瞬时突变,表明了该生物传感器对底物反应迅速,具有较高的灵敏度。
4 结论
ChSase ABC I是一类能够将硫酸软骨素、软骨素、透明质酸等糖胺多糖降解为寡糖及不饱和二糖的裂解酶。本研究所用的ChSase ABC I来源于Proteus vulgaris KCTC 2579,首次将ChSase ABC I与MBP连接克隆到pMAL-c2x载体上,成功在E.coli BL21(DE3)高效表达。
表达后重组酶MBP-ChSase ABC I的酶活和比酶活分别为3180 IU/L发酵液和76 IU/mg蛋白,其最佳表达宿主为E.coli BL21(DE3)。SDS-PAGE表明重组酶MBP-ChSase ABC I的分子质量约为130 kDa,可溶性蛋白占80%。在对MBP-ChSaseABC I酶固定在聚苯胺载体上进行研究的基础上,考察了MBP-ChSase ABC I酶生物传感器特性。利用循环伏安法对其进行检测,选择CS A作为酶的反应底物,在最适反应条件下,反应的峰值电流与CS A在浓度0.1 nmol/L~0.1 μmol/L范围内呈良好线性关系,可以进行有效检测。利用安培曲线法证明了该生物传感器对底物反应迅速,具有较高的灵敏度。
[1]SASISEKHARAN R,RAMAN R,PRABHAKAR V.Glycomics approach to structure-function relationships of glycosaminoglycans[J]. Annu Rev Biomed Eng,2006,8(1):181-231.
[2]PRABHAKAR V,CAPILA I,SOUNDARARAJAN V,et al.Recombinant expression,purification,and biochemical characterization of chondroitinase ABC II from Proteus vulgaris[J].J Biol Chem,2009,284(2):974-982.
[3]GRUMET M,FLACCUS A,MARGOLIS R U.Functional characterization of chondroitin sulfate proteoglycans of brain:Interactions with neurons and neural cell adhesion molecules[J].J Cell Biol,1993,120:815-824.
[4]SINGH J A,NOORBALOOCHI S,MACDONALD R,et al.Chondroitin for osteoarthritis[J].Cochrane Database Syst Rev,2016,26:1-264.
[5]HE W,FU L,LI G,et al.Production of chondroitin in metabolically engineered E.coli[J].Metab Eng,2015,27:92-100.
[6]CHO S Y,SIM J S,JEONG C S,et al.Effects of low molecular weight chondroitin sulfate on type II collagen-induced arthritis in DBA/1J mice[J].Biol Pharm Bull,2004,27(1):47-51.
[7]BRADBURY E J,CARTER L M.Manipulating the glial scar:chondroitinase ABC as a therapy for spinal cord injury[J].Brain Res Bull,2011,84(4-5):306-316.
[8]CAFFERTY W B,BRADBURY E J,LIDIERTH M,et al.Chondroitinase ABC-mediated plasticity of spinal sensory function[J]. J Neurosci,2008,28:11998-12009.
[9]HAMAI A,HASHIMOTO N,MOCHIZUKI H,et al.Two distinct chondroitin sulfate ABC lyases an endoeliminase yielding tetrasaccharides and an exoeliminase preferentially acting on oligosaccharides[J].J Biol Chem,1997,272:9123-9130.
[10]HUANG W,MATTE A,SUZUKI S,et al.Crystallization and preliminary X-ray analysis of chondroitin sulfate ABC lyases I and II from Proteus vulgaris[J].Acta Crystallogr D,2000,56:904-906.
[11]HUANG W,LUNIN V,LI Y,et al.Crystal structure of Proteus vulgaris chondroitin sulfate ABC lyase I at 1.9 Å resolution[J].J Mol Biol,2003,328(3):623-634.
[12]PRABHAKAR V,CAPILA I,RAMAN R,et al.The catalytic machinery of chondroitinase ABC I utilizes a calcium coordination strategy to optimally process dermatan sulfate[J].Biochemistry,2006,45:11130-11139.
[13]NAZARI-ROBATI M,KHAJEH K,AMINIAN M,et al.Enhancement of thermal stability of chondroitinase ABC i by site-directed mutagenesis:an insight from Ramachandran plot[J].Biochim Biophys Acta,2013,1834(2):479-486.
[14]PRABHAKAR V,CAPILA I,CARLOS J,et al.Chondroitinase ABC I from Proteus vulgaris:cloning,recombinant expression and active site identification[J].Biochem J,2005,386(Pt1):103-112.
[15]SHAYA D,HAHN B S,PARK N Y,et al.Characterization of chondroitin sulfate lyase ABC from Bacteroides thetaiotaomicron WAL2926[J].Biochemistry,2008,47:6650-6661.
[16]GU K,LINHARDT R,LALIBERTE M,et al.Purification,characterization and specificity of chondroitin lyases and glycuronidase from Flavobacterium heparinum[J]. Biochem J,1995,312(2):569-577.
[17]HE W,FU L,LI G,et al.Production of chondroitin in metabolically engineered E.coli[J].Metab Eng,2015,27:92-100.
[18]YE F,KUANG Y,CHEN S,et al.Characteristics of low molecular weight heparin production by an ultrafiltration membrane bioreactor using maltose binding protein fused heparinase I[J].Biochem Eng J,2009,46(2):193-198.
[19]KESIK M,EKIZ KANIK F,TURAN J,et al.An acetylcholinesterase biosensor based on a conducting polymer using multiwalled carbon nanotubes for amperometric detection of organophosphorous pesticides[J].Sensor Actuat B-Chem,2014,205:39-49.
[20]APETREI I M,APETREI C.The biocomposite screen-printed biosensor based on immobilization of tyrosinase onto the carboxyl functionalised carbon nanotube for assaying tyramine in fish products[J].J Food Eng,2015,149:1-8.
[21]CHEN Z,LI Y,YUAN Q.Expression,purification and thermostability of MBP-chondroitinase ABC I from Proteus vulgaris[J].Int J Biol Macromol,2015,72:6-10.