蓝靛果(Lonicera caerulea)作为一种北方适应性极强的野生浆果,在我国东北的大、小兴安岭和长白山地区蓝靛的贮存量最为丰富,其果实外观呈蓝紫色,含有多种的营养元素,如多种维生素、氨基酸、矿物质等,蓝靛果中还特别富含花青素[1]。这种花青素可作为天然的抗氧化剂,具有清除体内自由基、降血压、抗衰老、提高人体免疫力等诸多生理功能[2]。花青素又称花色素,属于水溶性天然色素,是多元酚的衍生物酚类色素[3]。近年来,对多酚抑菌的研究日益广泛,植物多酚主要通过与细胞膜结合或与金属离子反应影响微生物的正常代谢和抑制细胞酶活性等来抑菌[4-5]。国内对蓝靛果花青素的抑菌研究还不够全面,多以大肠杆菌(Escherichia coli)和金黄色葡萄球菌(Staphylococcus aureus)等有害菌为主。包怡红等[6]研究发现,不同提取条件对不同菌株的抑菌作用也不相同,采用微生物浊度法研究发现蓝靛果花色苷对大肠杆菌和金黄色葡萄球菌均起到一定的抑制作用。酸奶中活的乳酸菌菌体能够在发酵结束后,低温(0~5 ℃)贮藏、销售过程中继续生长繁殖分解乳糖产生乳酸,使酸奶的pH继续下降,出现酸奶过酸的后酸化现象,后酸化现象使酸奶酸度升高,影响了酸奶的风味及益生菌的存活,减弱了其保健功能,严重降低了消费者的购买欲[7]。本研究以东北野生蓝靛果为原料,以生长曲线、抑菌圈直径、最小抑菌浓度为评价指标,研究其花青素对嗜热链球菌(Streptococcus thermophilus)、保加利亚乳杆菌(Lactobacillus bulgaricus)生长及酸奶后酸化的影响,分析其抑菌效果、抑菌机理及保质期21 d内酸度、pH值、还原糖的变化。以期在降低酸奶后酸化现象的同时增加酸奶的营养保健价值,并扩展蓝靛果的应用范围。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
野生蓝靛果:产于黑龙江省勃利县;脱脂乳(蛋白质3.2 g/100 mL;非脂乳固体≥8.5%):内蒙古伊利实业集团股份有限公司;直投式冻干菌粉(嗜热链球菌(Streptococcus thermophilus),保加利亚乳杆菌(Lactobacillus bulgaricus)):帝斯曼(中国)有限公司。
1.1.2 化学试剂
结晶乙酸钠草酸铵、乳糖、半乳糖、葡萄糖:天津市科密欧化学试剂有限公司;十二烷基磺酸钠、甘氨酸:天津市光复精细化工研究所;三羟甲基氨基甲烷、丙烯酰胺、琼脂粉:上海山浦化工有限公司;D101-大孔树脂:上海维他化学试剂有限公司。实验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
MRS固体培养基、MRS肉汤培养基、M17琼脂:北京奥博星生物技术有限责任公司。
1.2 仪器与设备
MDF-U53V医用低温箱:日本三洋电机株式会社;H1650-W台式微量高速离心机:长沙湘仪器有限公司;UV-1200型紫外-可见分光光度计:上海美谱达仪器有限公司;RE-52系列旋转蒸发仪、RE-205升降恒温水油浴锅:上海予华仪器设备有限公司;DYY-10型电泳仪:北京市六一仪器厂;1260 Infinity II高效液相色谱仪、UV-1200 型紫外检测器:美国安捷伦科技有限公司;FE28-Standard台式pH计:梅特勒-托利多仪器(上海)有限公司。
1.3 实验方法
1.3.1 蓝靛果花青素的提取
将蓝靛果于60 ℃烘干并粉碎,过40目筛,4 ℃储存备用。称取定量蓝靛果粉于锥形瓶中,按照1∶10(g∶mL)的料液比,在50 ℃恒温水浴锅中提取1 h,冷却后4 500 r/min离心10 min。沉淀重复操作,合并两次上清液,待测。
pH示差法测定花青素的含量:准确量取稀释适当的2份1.0 mL待测液,分别加入pH 1.0和pH 4.5的缓冲溶液9 mL。摇匀后静置20 min,分别测定波长510 nm、710 nm条件下的吸光度值,根据如下公式计算花青素的含量[8]:
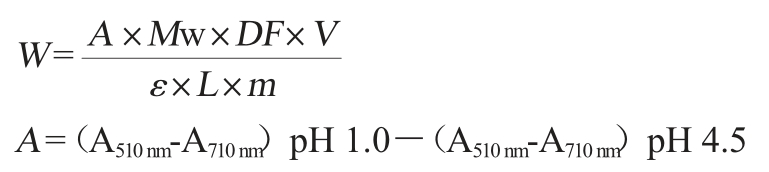
式中:W为花青素的含量,mg/g;Mw为矢车菊素-3-葡萄糖苷的摩尔质量,449.2 g/mol;A为花青素吸光度值;DF为稀释倍数;V为定容的体积,mL;ε为矢车菊素-3-葡萄糖苷的摩尔消光系数,26 900 L/(mol·cm);L为比色皿的宽度,1 cm;m为样品质量,g。
1.3.2 蓝靛果花青素的纯化
D101大孔树脂使用前预处理[9-11]:乙醇浸泡24 h,使之充分溶胀→蒸馏水洗至无醇味→5%盐酸浸泡12 h→蒸馏水洗至中性→5%氢氧化钠浸泡12 h→蒸馏水洗至中性→滤出树脂备用。
洗脱剂乙醇体积分数30%,洗脱流速30 r/min,解吸后所得溶液旋转蒸发仪浓缩、真空冷冻干燥,4 ℃储存备用。
1.3.3 乳酸菌生长曲线的测定
向液体培养基中加入已活化的乳酸菌(约107CFU/mL),终质量浓度为0.5 mg/mL,菌株添加量1%(约107 CFU/mL)。放入37 ℃培养箱对微生物24 h内的生长进行监测。设定波长600 nm条件下每2 h比色测定一次,以吸光度值表示菌体浓度。根据吸光度值(OD600nm值)和培养时间(t)作图,绘制乳酸菌的生长曲线。以不添加花青素时乳酸菌的生长曲线为对照组。
1.3.4 抑菌直径的测定
将已灭菌的MRS固体培养基冷却至40~50 ℃左右倒入平板中摇匀,冷却后吸取已活化的乳酸菌(S.thermophilus和L.bulgaricus,混合菌比例为1∶1)悬液200 μL,接种到MRS固体培养基中,涂布后静置,灼烧灭菌,冷却后放入平板中央位置,打入100 μL花青素到牛津杯(直径Φ8 mm)中,37 ℃恒温培养24 h。以无菌生理盐水为对照组,试验重复3次[12]。抑菌效果判定标准:抑菌圈直径≤8 mm,即为无抑菌效果;抑菌圈直径在9~14 mm,即为有抑菌效果;抑菌圈直径在15~19 mm,即为较强抑菌效果;抑菌圈直径≥20 mm,即为超强抑菌效果。
1.3.5 蓝靛果花青素最小抑菌浓度的测定
最小抑菌浓度(minimum inhibitory concentration,MIC),即能够抑制细菌生长、繁殖的最低药物浓度。将第一支灭菌试管中加入1 mL纯化后的花青素提取液、1 mL MRS肉汤液体培养基,采用二倍稀释法配制成不同浓度,得到质量浓度分别为500.0 μg/mL、250.0 μg/mL、125.0 μg/mL、62.5 μg/mL、31.25 μg/mL、15.625 μg/mL、7.812 5 μg/mL的花青素溶液,分别加入活化后的乳酸菌悬液100 μL。37 ℃恒温培养24 h,观察菌液生长情况,菌液透明澄清时所对应的最低花青素浓度即为MIC,试验重复3次。
1.3.6 不同处理条件对蓝靛果花青素抑菌作用的影响
将花青素提取液中加入适量的蔗糖,分别制成1%、3%、5%、7%、9%的糖溶液;将花青素提取液分别于处理温度20 ℃、40 ℃、60 ℃、80 ℃、100 ℃的水浴条件下处理30 min,冷却后待用。分别用酸(HCl)碱(NaOH)溶液调节MRS固体培养基pH,制成pH为5、6、7、8、9的培养基,以抑菌圈直径为评价指标,待MRS培养基凝固后,向每皿加入200 μL菌液,涂布均匀,放置晾干后,将灭菌牛津杯置于MRS培养基中,向牛津杯中加入100 μL经不同温度处理、不同糖度的花青素提取液。在37 ℃条件下培养24 h,测量其抑菌圈直径,无菌水为空白对照组,试验重复3次。
1.3.7 蓝靛果花色苷对乳酸菌细胞膜完整性的影响
乳酸菌细胞膜渗透性实验:将乳酸菌接种于MRS肉汤培养基中37 ℃、120 r/min过夜培养至107 CFU/mL,培养液经12 000 r/min离心2 min,弃上清,沉淀用0.5%NaCl溶液洗涤、重悬后,分别加入0.5 MIC、1.0 MIC、2.0 MIC浓度的花青素提取物,空白对照加入等体积的0.5%NaCl,37 ℃培养8 h,12 000 r/min离心2 min,取上清,在波长260 nm条件下测定吸光度值,试验重复3次。
乳酸菌细胞蛋白质损伤及泄露实验:采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)法。以等体积的0.5%NaCl溶液代替花青素为空白对照组,观察菌体及上清蛋白条带变化[13]。
1.3.8 蓝靛果花青素对酸奶后酸化的影响
通过添加不同质量的蓝靛果花青素,以贮藏(保质期)21 d中的酸度、pH值及还原糖含量[14]为评价指标,研究其对酸奶后酸化的影响。酸奶制备工艺流程如下:
脱脂乳→均质→预热(60~65 ℃)→添加花青素→蔗糖调配(5%)→杀菌(72~75 ℃、30 min)→冷却(43~45 ℃)→接种发酵剂→装瓶→发酵(42~43 ℃5 h)→冷却→后熟(4 ℃24 h)→成品
1.3.9 统计分析
数据结果采用SPSS 19.0软件进行方差分析,数值以“平均值±标准差”表示,并用Origin Pro 8.5.1软件制图,不同字母代表差异性显著(P<0.05)。
2 结果与分析
2.1 乳酸菌的生长曲线

图1 嗜热链球菌(A)及保加利亚乳杆菌(B)的生长曲线
Fig.1 Growth curves of Streptococcus thermophiles (A) and Lactobacillus bulgaricus (B)
由图1A可知,对照组0~4 h为迟缓期,4~14 h为对数增长期,14 h之后为稳定期;加样组迟缓期较对照组延长,10 h时为对数期,说明添加花色素能抑制S.thermophilus的生长,随着时间的延长,花青素含量降低,最后基本趋于不变,16 h后进入稳定期。由图1B可知,对照组4 h前为迟缓期,4~16 h为对数增长期,16 h之后进入稳定期;加样组迟缓期较对照组延长,10 h时进入对数期,说明添加花色素能抑制L.bulgaricus的生长,随着时间的延长,花青素含量降低,最后基本趋于稳定,16 h后进入稳定期,这可能是因为乳酸菌对花青素有一定的分解与吸收作用,且不同菌种对其最高分解吸收量也不尽相同,结果表明,花青素对乳酸菌的生长起到一定的抑制作用且程度为L.bulgaricus>S.thermophilus。
2.2 花青素的抑菌圈直径
以蓝靛果花青素提取液的质量浓度0.5 mg/mL,采用牛津杯法研究其对乳酸菌的抑制效果,空白对照组为生理盐水,结果见图2。

图2 嗜热链球菌、保加利亚乳杆菌及其混合菌的抑菌圈
Fig.2 Inhibition zone of Streptococcus thermophiles, Lactobacillus bulgaricus and their mixtures
由图2可知,蓝靛果花青素对两种乳酸菌及其混合菌的平板培养均产生了抑菌圈,且相同的提取条件下,混合菌(1∶1)的抑菌性最强(抑菌圈直径30 mm),其次是保加利亚乳杆菌(抑菌圈直径29 mm),嗜热链球菌(抑菌圈直径18 mm)相对较弱。结果表明,蓝靛果花青素对两种乳酸菌及其混合菌有一定的抑制作用,从强到弱依次是:混合菌>L.bulgaricus>S.thermophilus。
2.3 蓝靛果花青素的最小抑菌浓度
由表1可知,花青素对三种乳酸菌均具有良好的抑菌效果,其中,对L.bulgaricus的抑菌效果最强,为31.25 μg/mL,对S.thermophilus和混合菌的MIC均为62.5 μg/mL。抑菌效果与花青素的浓度具有一定的相关性,随着质量浓度的增长,抑菌效果更加显著。值得注意的是,随着其质量浓度的增加,尽管在使用之前,已经采取膜过滤等预防措施,但加入后在实验检测过程中还会有一定的沉淀现象发生,会对检测结果产生一定的影响,班兆军[15]也报道过类似的情况,花色素加到MRS液体培养基中形成的沉淀,可能是由于环境pH值对花青素的影响造成的。同时,花青素浓度过高,其自身颜色也会影响MIC结果判断。
表1 花青素的最小抑菌浓度测定结果
Fig.1 Determination of the minimum inhibitory concentration of anthocyanin
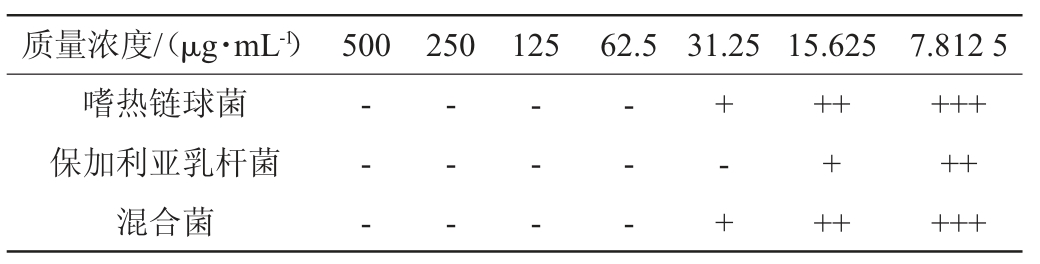
注:“+”表示有菌落生长,“+”越多表示菌越多,“-”表示无菌落生长。
2.4 不同处理条件对蓝靛果花青素抑菌作用的影响
2.4.1 加热预处理对蓝靛果花青素抑菌作用的影响
采用牛津杯法测抑菌圈直径来探讨不同热处理条件下蓝靛果花青素对乳酸菌的抑制作用,结果见图3。

图3 加热处理对蓝靛果花青素抑菌作用的影响
Fig.3 Effect of heat treatment on bacteriostasis of anthocyanin from Lonicera caerulea
由图3可知,蓝靛果花青素经20~80 ℃的热处理后其对乳酸菌的抑菌作用影响较小,当温度>80 ℃时,其对乳酸菌的抑菌活性大幅下降,100 ℃时,花青素已基本无抑菌能力。表明蓝靛果花青素对乳酸菌的抑制作用受温度影响较大。刘敬华等[16]通过研究温度对蓝靛果花青素影响时发现,当温度<70 ℃时花青素的稳定性变化不大,这与本研究结果相似。康彬彬等[17]在研究乌饭树果实花色苷的抑菌特性时发现过高的温度会使某些多酚类化合物发生降解,从而使抑菌活性降低。
2.4.2 培养基pH对蓝靛果花青素抑菌作用的影响
由图4可知,培养基pH对蓝靛果花青素的抑菌效果有一定影响,中性或低pH条件更有利于抑菌,pH值为7条件下抑菌能力最强,偏酸性条件或碱性条件下抑菌能力略有下降,这主要是多酚类物质在偏酸性条件下溶解性更强、更稳定;而碱性条件下抑菌能力明显下降,主要是因为碱会与花青素的某些抑菌成分反应,从而降低活性[18]。表明在酸性条件下更有利于蓝靛果花青素对乳酸菌抑制作用的发挥。

图4 pH值对蓝靛果花青素抑菌作用的影响
Fig.4 Effect of pH value on bacteriostasis of anthocyanin from Lonicera caerulea
2.4.3 糖含量对蓝靛果花青素抑菌作用的影响
由图5可知,在糖含量较低的(1%~5%)条件下,蓝靛果花青素对乳酸菌的抑制作用随糖含量增加而降低,而在较高糖含量(≥5%)下,其对乳酸菌的抑制作用则随含量增加而增大。表明,少量的蔗糖存在会降低花青素对乳酸菌的抑制作用,而由于糖本身也具有明显的抑菌作用[19],因而糖含量较高时蓝靛果花青素对乳酸菌的抑制作用优于较低糖含量环境。
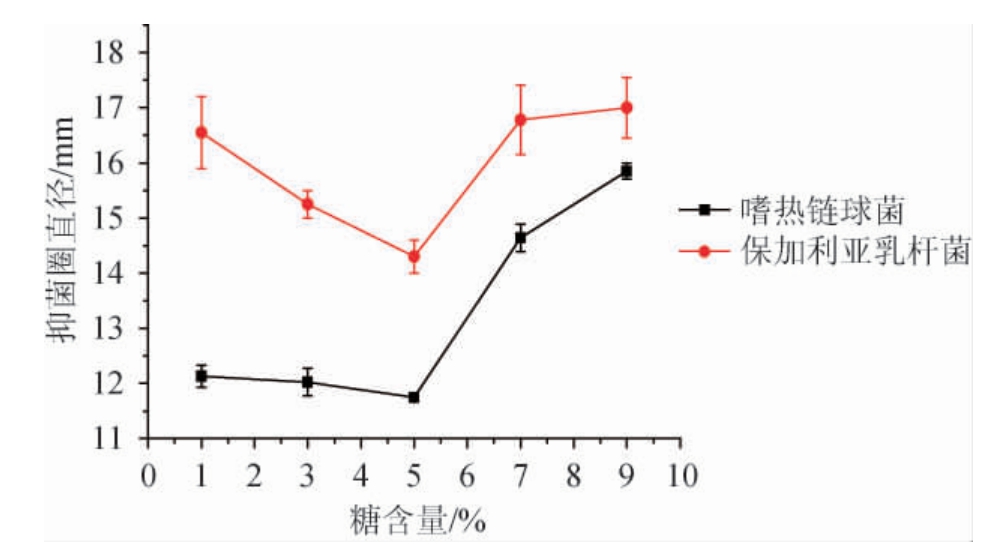
图5 糖含量对蓝靛果花青素抑菌作用的影响
Fig.5 Effect of sugar concentration on bacteriostasis of anthocyanin from Lonicera caerulea
2.5 花青素对乳酸菌细胞膜完整性的影响
2.5.1 花青素对乳酸菌核酸泄露的影响
菌体细胞内核酸中的碱基对均含有共轭双键,具有紫外吸收特性,其最大吸收波长为260 nm[19]。本试验通过测定经蓝靛果花青素处理后的S.thermophilus和L.bulgaricus在波长260 nm处的紫外吸收强度来分析菌体细胞内核酸类物质的泄露情况,结果见图6。由图6可知,与对照组相比,经蓝靛果花青素处理后的S.thermophilus和L.bulgaricus的OD260nm值随花青素浓度的增加均明显升高,且相同花青素浓度下S.thermophilus较L.bulgaricus的OD260nm值升幅较大,表明蓝靛果花青素可明显增大S.thermophilus和L.bulgaricus的细胞膜通透性,使菌体细胞内的核酸泄露,且核酸泄露幅度均随花青素浓度(0.5~2.0 MIC)的增大而明显提高。有研究发现,蓝莓花青素可结合细胞膜的磷脂双分子层,导致细胞膜破坏,从而削弱了细菌与宿主细胞结合的能力,并可抑制了细菌聚集结合形成生物膜,而生物膜的形成与细菌的致病性和耐受性密切相关[10]。因而,推测蓝靛果花青素对乳酸菌的抑菌作用与改变细胞膜通透性具有一定的关联性。
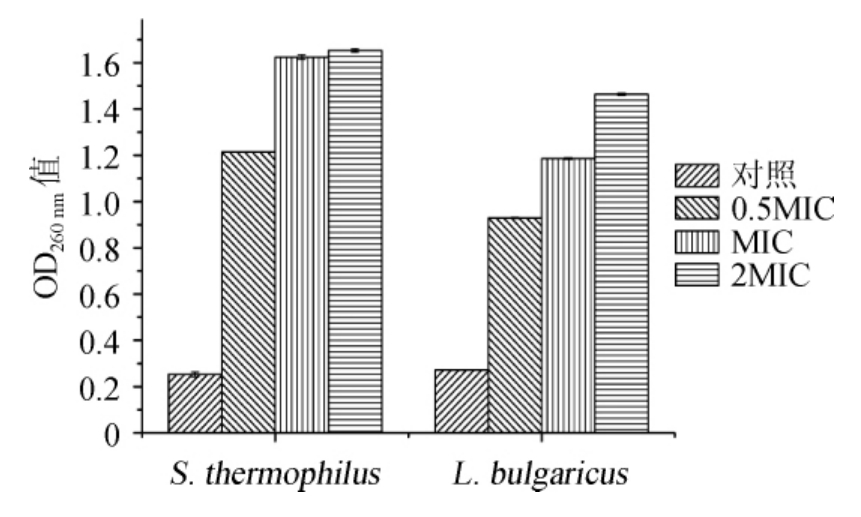
图6 蓝靛果花青素的膜渗透试验
Fig.6 Membrane penetration test of anthocyanin from Lonicera caerulea
2.5.2 蓝靛果花青素对乳酸菌蛋白释放的影响
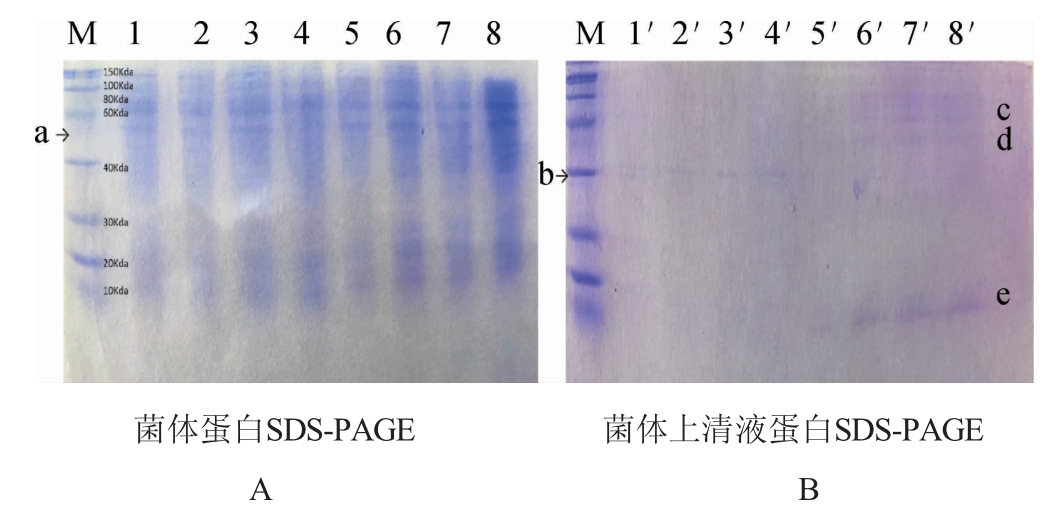
图7 花青素对菌体蛋白损伤(A)及上清蛋白泄露(B)的影响
Fig.7 Effect of anthocyanidin on bacterial protein (A) and supernatant protein leakage (B)
M为蛋白质Marker,1~4与5~8分别为2 MIC、1.0 MIC、0.5 MIC、对照组的保加利亚乳杆菌菌体蛋白和嗜热链球菌菌体蛋白,1′~4′与5′~8′为对照组、0.5 MIC、1.0 MIC、2 MIC的保加利亚乳杆菌和嗜热链球菌对应的上清液蛋白。
由图7可知,选用蓝靛果花青素为研究对象,加入到S.thermophilus和L.bulgaricus中,经培养后,随着花青素浓度的增加,两种菌的菌体蛋白均出现轻微的降解损伤,其中,条带a为大分子功能蛋白,可能对蓝靛果花青素更为敏感,在两种乳酸菌中的表达均有一定下降,且S.thermophilus的下降趋势较L.bulgaricus更明显,表明菌体细胞膜随药物浓度增大逐渐发生损伤,但其损伤程度较弱。对菌体上清液蛋白的观察中发现,随着花青素浓度的增加,L.bulgaricus菌体上清液蛋白的b条带,S.thermophilus菌体上清液蛋白的c条带、d条带与e条带均出现轻微上扬趋势,表明两种菌体蛋白均出现一定程度的泄露,但当花青素浓度达到MIC时,菌体蛋白的泄露程度达到最大,随着浓度增大,蛋白质泄漏不再增加(b、c、d条带)。结果表明,蓝靛果花青素对S.thermophilus和L.bulgaricus菌体蛋白具有一定的损伤作用,引起菌体蛋白的泄露,但其影响较弱,有利于菌体在一定条件下实现自我修复。
2.6 蓝靛果花青素对酸奶后酸化的影响
2.6.1 滴定酸度的变化
滴定酸度可以体现出酸奶后酸化过程中酸度的变化,影响酸奶的品质进而影响其货架期。由图8可知,添加蓝靛果花青素组(浓度范围为0.02%~0.64%)在酸奶后酸化过程中滴定酸度的变化范围均低于对照组,说明蓝靛果花色素对乳酸菌产酸能力起到一定的抑制作用,能够抑制酸奶过量产酸,延缓酸奶的后酸化过程。添加量为0.32%和0.64%浓度的蓝靛果花青素对酸奶后酸化过程中的滴定酸度影响变化范围基本持平,考虑到成本问题,选取添加量为0.32%的蓝靛果花青素即可。
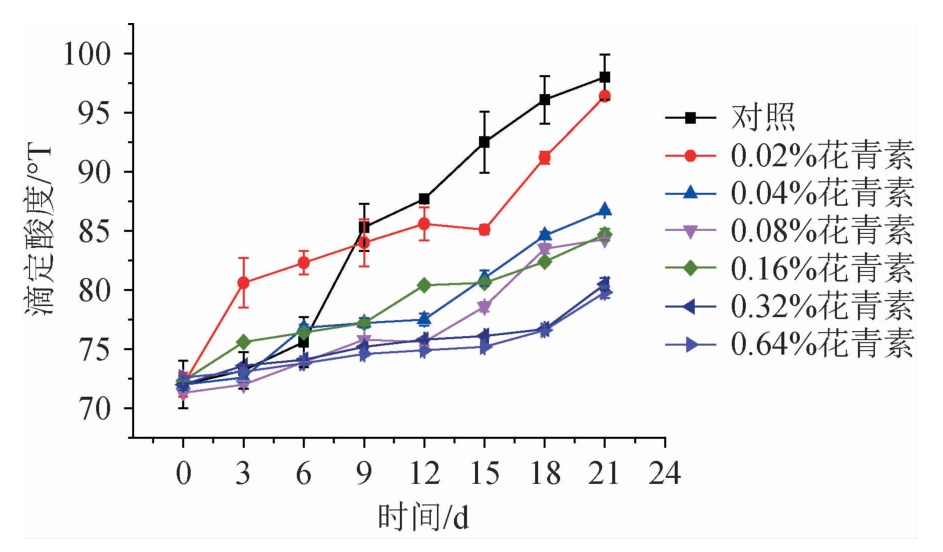
图8 酸奶保质期内滴定酸度的变化
Fig.8 Change of titration acidity of yoghurt during the shelf life
2.6.2 pH值的变化
由图9可知,试验组与对照组pH值随着时间延长与滴定酸度相反。21 d内,试验组的pH值变化范围低于对照组,且随着花青素含量增大,pH值变化范围越小,说明蓝靛果花青素能不同程度地抑制乳酸菌产酸,且在一定范围内,浓度越大,抑菌效果越明显。添加量为0.32%和0.64%浓度的蓝靛果花青素对酸奶后酸化过程中的pH值影响变化范围基本持平,考虑到成本问题,选取添加量为0.32%的蓝靛果花青素。

图9 酸奶保质期内pH值变化
Fig.9 Change of pH value of yoghurt during the shelf life
2.6.3 还原糖的变化
由图10可知,理论上乳糖的吸收量和半乳糖的释放量是在同等摩尔下进行的,但实验结果生成的半乳糖的量并不等于乳糖消耗量的一半,可能由于有一部分半乳糖留在了细胞内未被检测出来。孙懿琳[20]研究发现后酸化强的菌株的乳糖代谢量和半乳糖积累量远远超过了后酸化程度弱的,而后酸化较弱的菌株代谢乳糖量和半乳糖积累量均较低,可见菌株表现出来的后酸化差异与它们的乳糖代谢有直接关系。本试验与对照组相比,试验组的乳糖代谢量和半乳糖积累量均较小,其中蓝靛果花青素添加量为0.32%最小,故选取最佳花青素添加量为0.32%。
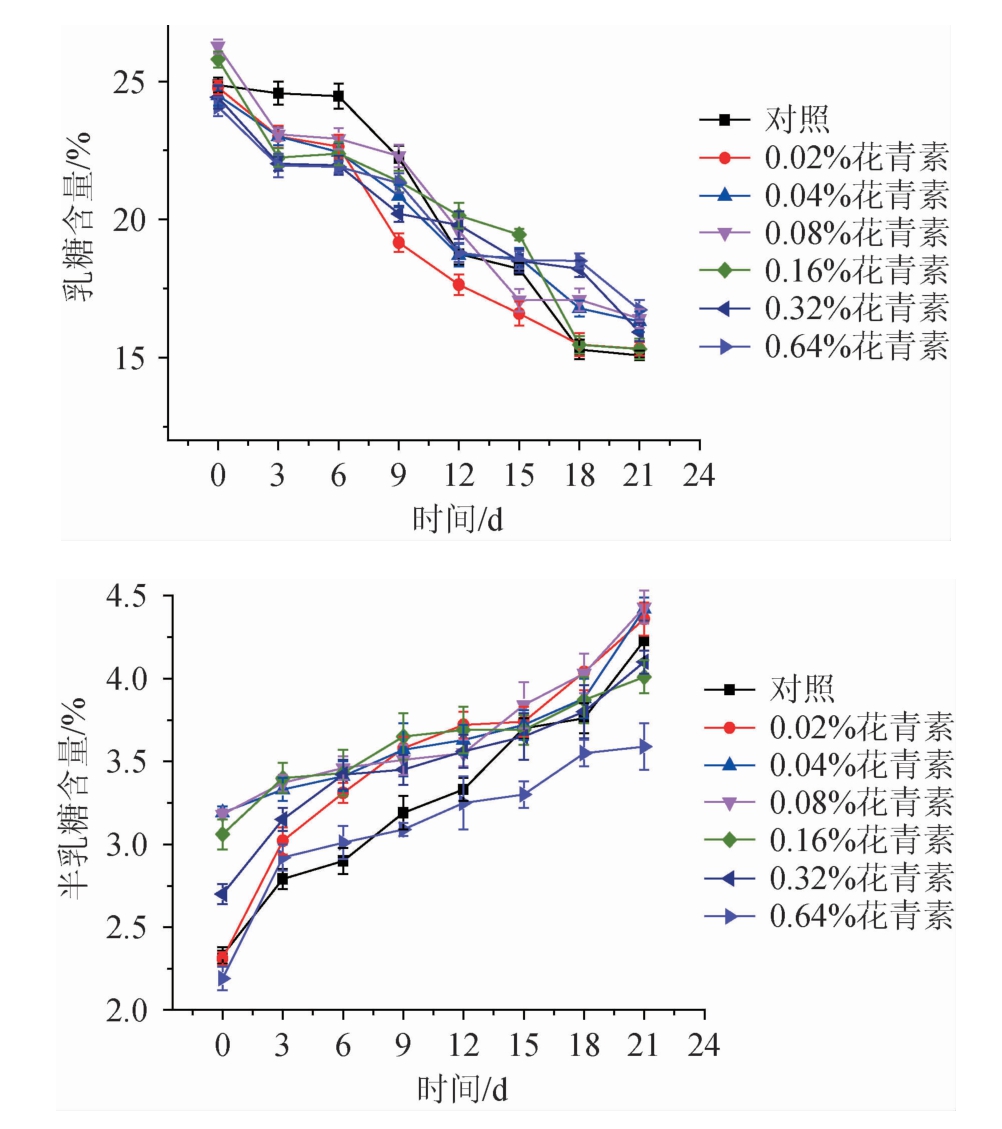
图10 酸奶保质期内乳糖(A)和半乳糖(B)含量变化
Fig.10 Changes of lactose (A) and galactose (B) contents of yoghurt during the shelf life
3 结论
采用水溶剂提取法提取蓝靛果花青素,以抑菌圈直径作为评定标准,蓝靛果花青素对两种乳酸菌及其混合菌均有一定的抑制作用,且从强到弱依次为混合菌>L.bulgaricus>S.thermophilus。二倍稀释法测定对S.thermophilus和混合菌的MIC均为62.5 μg/mL,L.bulgaricus的MIC为31.25 μg/mL。加热预处理、培养基pH以及糖浓度都会对蓝靛果花青素的抑菌作用产生一定影响。花青素抗菌机理是其改变细胞膜通透性,并损伤菌体蛋白质引起蛋白泄露。添加量为0.32%蓝靛果花青素能明显延缓酸奶在贮藏期内的酸度升高现象,且对酸奶发酵进程及品质影响较弱。
[1]GERBRANDT E M,BORS R H,CHIBBAR R N,et al.Blue honeysuckle(Lonicera caerulea L.)vegetative growth cessation and leaf drop phenological adaptation to a temperate climate[J]. Genet Resour Crop Ev,2018,65(5):1471-1484.
[2]赵二劳,闫唯,高子怡,等.紫薯色素提取工艺及其功能活性研究进展[J].食品与机械,2018,34(3):192-195.
[3]ZHAO X,ZHANG X D,TIE S S,et al.Facile synthesis of nano-nanocarriers from chitosan and pectin with improved stability and biocompatibility for anthocyanins delivery:An in vitro and in vivo study[J]. Food Hydrocolloids,2020,109:106114.
[4]FEI P,ASLAM,GONG S Y,et al.Antimi-crobial activity ang mechanism of action of olive oil polyphenols extract against Cronobacter sakazakii[J].Food Control,2018,94:289-294.
[5]CÔTÉ J,CAILLET S,DOYON G,et al.Antimicrobial effect of cranberry juice and extracts[J].Food Control,2011,22(8):1413-1418.
[6]包怡红,于阳阳,彭冬香,等.提取条件对蓝靛果花色苷抑菌作用的影响[J].食品科技,2011,36(10):178-182.
[7]刘艳玲,张媛,赵丽娜,等.抗酸乳后酸化的研究进展[J].食品科技,2018,43(9):104-108.
[8]刘敬华,王振宇.pH 试差法测定蓝靛果花色苷及大孔树脂纯化的研究[J].中国林副特产,2012(5):28-30.
[9]李蕊.野生浆果花色苷提取纯化、结构鉴定及体外抗氧化活性分析[D].哈尔滨:东北林业大学,2011.
[10]魏彩虹,孙晓红,赵勇,等.野生蓝莓抑菌活性物质的分离及对金黄色葡萄球菌的抑制作用[J].天然产物研究与开发,2016,28(8):1256-1261.
[11]米佳,闫亚美,曹有龙,等.花色苷类物质的提取、分离、鉴定[J].宁夏农林科技,2016,57(1):40-47.
[12]LI S,CHEN L,YANG T,et al.Increasing antioxidant activity of procyanidin extracts from the pericarp of Litchi chinensis processing waste by two probiotic bacteria bioconversions[J].Agr Food Chem,2013,61:2506-2512.
[13]牛知慧,高原,周露露,等.三种茶叶中多酚提取物的抑菌活性及其对致病菌膜渗透性的比较分析[J].食品工业科技,2019,40(3):116-119,198.
[14]王柳,吕嘉枥,王笋.柱前衍生-HPLC 法分析酸奶中的还原糖[J].中国乳品工业,2014,42(1):55-58.
[15]班兆军.浆果中天然抗菌成分对食源性致病菌的抑制机理研究[D].乌鲁木齐:新疆农业大学,2015.
[16]刘敬华,王振宇.响应面法优化蓝靛果花色苷分离纯化工艺[J].中国林副特产,2013(3):16-21.
[17]康彬彬,刘龙燕,王祥,等.乌饭果花色苷复合酶法提取工艺优化及其抗氧化活性[J].食品工业科技,2020,41(11):214-220.
[18]LUNA-VITAL D,LI Q,WEST L,et al.Anthocyanin condensed forms do not affect color or chemical stability of purple corn pericarp extracts stored under different pHs[J].Food Chem,2017,232:639-647.
[19]齐炳理,李艳杰,陈世贤,等.唾液乳杆菌的生长特性及抑菌作用[J].乳业科学与技术,2015,38(3):1-4.
[20]孙懿琳.弱后酸化保加利亚乳杆菌菌株的筛选及其后酸化机制[D].哈尔滨:东北农业大学,2013.