酿酒酵母菌(Saccharomyces cerevisiae)为半子囊菌纲(Hemiascomycetes)内孢霉目(Endomycetales)酵母科(Saccharomycetaceae)酵母菌属(Saccharomyces)[1],是一种单细胞真核微生物[2]。酿酒酵母培养物营养成分丰富,富含脂肪、蛋白质、维生素等;特别是蛋白质构成理想,富含亮氨酸、赖氨酸、苏氨酸、苯丙氨酸等必需氨基酸[3-5]。酿酒酵母菌具有安全[6]、繁殖周期快、代谢快等特点;其生产过程容易控制,易于大规模培养生产,来源广,大量应用于酿造、医药、饲料工业等多个领域[7-9]。
碳源、氮源、无机盐、维生素等是酿酒酵母培养体系的重要成分。酿酒酵母培养体系种类多,培养体系的不同成分、不同浓度对酿酒酵母的菌体生长影响差异大[10]。现常用酿酒酵母菌体系为酵母浸出粉胨葡萄糖(yeastextractpeptone dextrose,YPD)培养体系,该体系的碳源与氮源为葡萄糖、蛋白胨、酵母浸粉[6]。在工业生产中,这三种物质需求量大,价格贵,阻碍酿酒酵母菌发酵的工业化生产。因此为了降低酿酒酵母菌工业化生产成本,同时提高其生物量,优化酿酒酵母培养体系十分必要。本研究在酵母浸出粉胨葡萄糖培养体系基础上,对本实验室分离的酿酒酵母菌的培养体系进行优化,以期得出最适于工业生产的最佳培养体系,降低酿酒酵母发酵生产的成本,提高其生物量。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
酿酒酵母(Saccharomyces cerevisiae)BR-01:本实验室分离及保藏。
1.1.2 试剂
淀粉糖、玉米浆(均为生化试剂):长春大成实业集团有限公司;蛋白胨、酵母浸粉(均为生化试剂):北京奥博星生物技术有限责任公司;维生素B1(vitamin B1,VB1)、维生素B2(vitamin B2,VB2)、维生素B3(vitamin B3,VB3)、维生素B8(vitamin B8,VB8)、维生素B6(vitamin B6,VB6)(均为分析纯):北京索莱宝科技有限公司;葡萄糖、尿素、磷酸氢二钾(K2HPO4)、硫酸镁(MgSO4)(均为分析纯):北京化学试剂公司。
1.1.3 培养基
YPD培养基:葡萄糖2%、蛋白胨2%、酵母浸粉1%,120 ℃灭菌20 min[11]。
1.2 仪器与设备
pHS-2C型数字式酸度计:上海SANXIN公司;SW-CJ-IF型洁净工作台:苏净集团苏州安泰空气技术有限公司;UVmini-1280紫外分光光度计:日本岛津公司;HT-211B型培养摇床:上海赫田科学仪器有限公司。
1.3 方法
1.3.1 菌种活化及发酵培养
将酿酒酵母菌种接入YPD液体培养体系中,以30 ℃、150 r/min 条件培养16 h,将酿酒酵母菌活化3次,备用。
将活化后酿酒酵母菌种,按照5%的接种量,接入各培养基中,于30 ℃、150 r/min条件下,培养16 h,采用紫外分光光度计在波长560 nm处测定OD560nm值,检测菌体生物量,其计算公式如下:
生物量=(试验培养体系OD560nm值-对应空白培养体系OD560nm值)×各试验组稀释倍数
1.3.2 生长曲线
活化好的种子液,按5%的接种量,接种于装液量为100 mL/250 mL的YPD培养体系,以30 ℃、150 r/min条件进行培养,空白YPD培养体系进行OD560nm值校正。将菌液与YPD培养体系用蒸馏水稀释相同倍数(确保OD560nm值在0.2~0.8范围),在波长560 nm处测定所对应的吸光度值(OD560nm值),每隔2 h测定一次,培养26 h,以培养时间(h)为横坐标,OD560nm值为纵坐标,绘制菌株生长曲线。
1.3.3 发酵培养体系优化单因素试验
各试验组培养体系初始pH值为5.0,装液量为40%,接种量5%,每组培养体系6个平行,一个空白体系不接入菌种,进行OD560nm值校正,30 ℃、150 r/min 培养16 h 后,波长560 nm处测定OD560nm值。
以YPD培养基为标准,测定OD560nm值。碳源选择4 g/mL糖蜜、3 g/mL 淀粉糖替代YPD中的葡萄糖(2 g/mL);氮源选择尿素(0.1 g/100 mL)、硫酸铵((NH4)2SO4)(0.22 g/100 mL)、玉米浆(2 g/100 mL)替代YPD中的蛋白胨(0.33 g/100 mL);磷酸盐选择磷酸氢二钾(K2HPO4)、磷酸二氢钾(KH2PO4)、磷酸氢二钠(Na2HPO4)、磷酸二氢钠(NaH2PO4)、磷酸二氢铵(NH4H2PO4),分别添加0.1 g/100 mL;硫酸盐选择硫酸镁、硫酸铜(CuSO4)、硫酸亚铁(FeSO4)、硫酸锰(MnSO4),分别添加0.1 g/100 mL;B族维生素选择VB1、VB2、VB3、VB6、VB8,分别添加0.000 1 g/100 mL(由于B族维生素只是作为一种营养物质,添加微量即可有正向效果,考虑工业化生产成本,故不作浓度梯度筛选)。筛选出改良酿酒酵母培养体系的最佳碳源、氮源、磷酸盐、硫酸盐、B族维生素,进一步筛选出最佳添加量。
1.3.4 响应面法优化发酵培养体系
(1)Plackett-Burman 试验设计
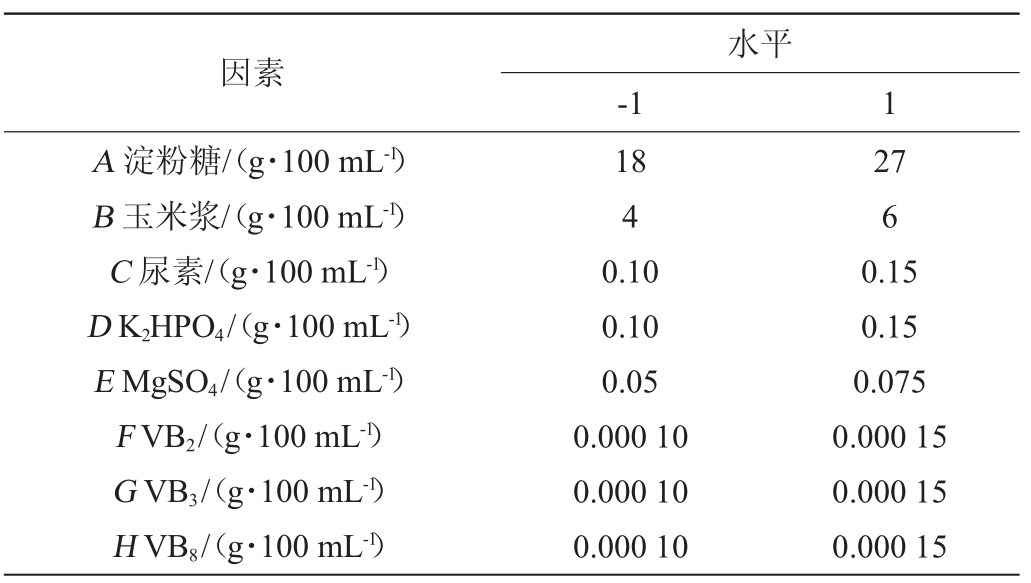
根据单因素试验,筛选出的最适碳源、氮源、无机盐、B族维生素(VB2、VB3、VB8)进行Plackett-Burman(PB)试验。选用8因素、N=12的Plackett-Burman设计(其中四组为空白试验组,作为误差分析项),每个因素分别取高、低2 个水平,高水平是低水平1.5倍,以筛选影响酿酒酵母发酵活菌数的主要组分因素。PB试验因素与水平见表1。
表1 Plackett-Burma试验设计因素及水平
Table 1 Factors and levels of Plackett-Burman experiments design
(2)最陡爬坡试验
依据Plackett-Burman 试验结果,以各个显著影响因素效应的大小设定变化步长[12];依据变化的梯度方向确定爬坡方向,快速逼近最佳值区域[13];确定主要影响因素为淀粉糖、玉米浆、尿素,将此3个因素进行最陡爬坡试验。
(3)Box-Behnken 试验设计
根据Box-Behnken 试验的中心组合试验设计原理,每个显著影响因素取3个水平,进行3因素3水平15个试验组的响应面分析试验,分析每个因素主效应与交互效应,绘制响应曲面,求出最佳值,获得最佳酿酒酵母培养体系。利用Box-Behnken 试验设计,对酿酒酵母菌培养体系进行3因素3水平响应面分析,优化淀粉糖(A)、玉米浆(B)、尿素(C)的浓度,响应值为酿酒酵母菌生物量[12]。Box-Behnken试验因素与水平见表2。
表2 Box-Benhnken试验设计因素与水平
Table 2 Factors and levels of Box-Benhnken experiments design

1.3.5 统计与分析
试验结果以“平均数±标准偏差”形式表示。利用SPSS 23.0软件,进行单因素范畴方差分析(analysis of variance,ANOVA)检验,P≤0.05为差异显著,P≤0.01为差异极显著。应用Design Expert 8.0.6软件,拟合试验结果,对拟合方程做显著性检验及方差分析。
2 结果与分析
2.1 酿酒酵母菌生长曲线的绘制
所测得的酿酒酵母菌生长曲线见图1。由图1可知,在0~6 h,酿酒酵母菌浓度上升缓慢,属于适应新环境的阶段,为延滞期;在6~14 h,酿酒酵母菌浓度迅速升高,为快速生长期;14 h后随着时间增长,吸光度值呈现微增长趋势,培养体系养分逐渐减少,缺乏酿酒酵母菌生长所需养分,菌体逐渐死亡,由于无法分离死亡菌体与活菌体,导致无法在生长曲线上看到衰退期,所以在14~26 h的前段为稳定期,后段为衰退期。在同样培养条件下制备酿酒酵母菌种子液,16 h 左右即可满足试验要求。

图1 酿酒酵母菌BR-01生长曲线
Fig.1 Growth curve of Saccharomyces cerevisiae BR-01
2.2 发酵培养体系优化单因素试验
不同碳源、氮源、无机盐、B族维生素对酿酒酵母生物量的影响结果分别见表3和表4。由表3可知,淀粉糖做碳源时,酿酒酵母菌生物量最高,当其添加量为18 g/100 mL时,酿酒酵母菌生物量显著高于其他各组,确定最佳添加量为18 g/100 mL。玉米浆组与尿素组的酿酒酵母菌生物量显著高于其他氮源组,由于玉米浆属于有机氮源,为持续利用氮源;尿素属于无机氮源,为快速利用氮源,考虑应用有机氮源和无机氮源进行复配,找出最佳氮源配方。当培养体系氮源复配比例在玉米浆4 g/100 mL+尿素0.1 g/100 mL时,酿酒酵母菌生物量显著高于其他各组,所以氮源的最佳复配比例为玉米浆4 g/100 mL+尿素0.1 g/100 mL。由表4可知,K2HPO4组酿酒酵母菌生物量显著高于其他各磷酸盐组,且其最适添加量为0.1 g/100 mL;MgSO4组酿酒酵母菌生物量显著高于其他各硫酸盐组,且最适添加量为0.05 g/100 mL。选择VB2、VB3、VB8作为最佳B族维生素源,且添加量为0.000 1 g/100 mL。
表3 不同碳源、氮源对酿酒酵母菌生物量的影响
Table 3 Effect of different carbon sources and nitrogen sources on the cell biomass of Saccharomyces cerevisiae
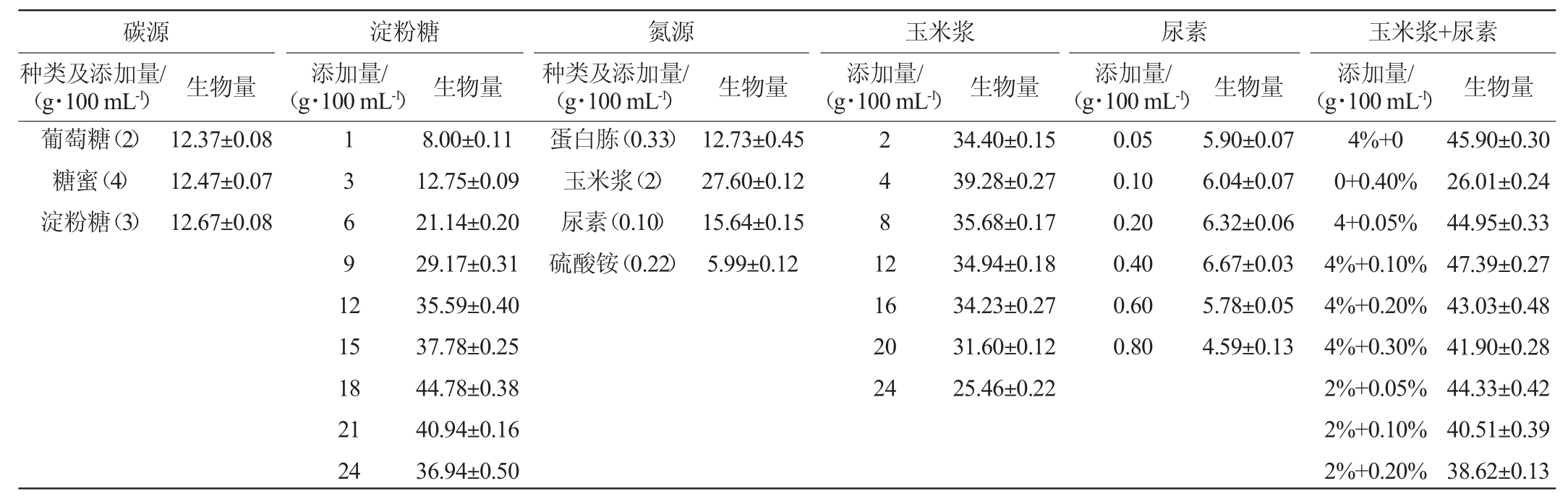
表4 不同无机盐、B族维生素对酿酒酵母菌生物量的影响
Table 4 Effect of different inorganic salt and vitamin B group on the cell biomass of Saccharomyces cerevisiae

2.3 发酵培养体系优化Plackett-Burman试验
根据单因素试验筛选结果,所得最佳酿酒酵母菌培养体系为:淀粉糖18 g/100 mL、玉米浆4 g/100 mL、尿素0.1 g/100 mL、K2HPO4 0.1 g/100 mL、MgSO4 0.05 g/100 mL、VB20.0001g/100mL、VB30.0001g/100mL、VB80.0001g/100mL。Plackett-Burman 试验选用8因素(淀粉糖、玉米浆、尿素、K2HPO4、MgSO4、VB2、VB3、VB8),N=12次的试验表格,各因子取高低2个水平。为估计试验误差,另设3个虚拟变量,响应值为酿酒酵母菌生物量,影响因子及编码见表5。利用Design Expert 8.0.6 软件分析试验结果,比较各因素对酿酒酵母菌生物量的影响,筛选主要影响因素[14-15]。
表5 PB试验设计结果
Table 5 Results of Plackett-Burman experimental design
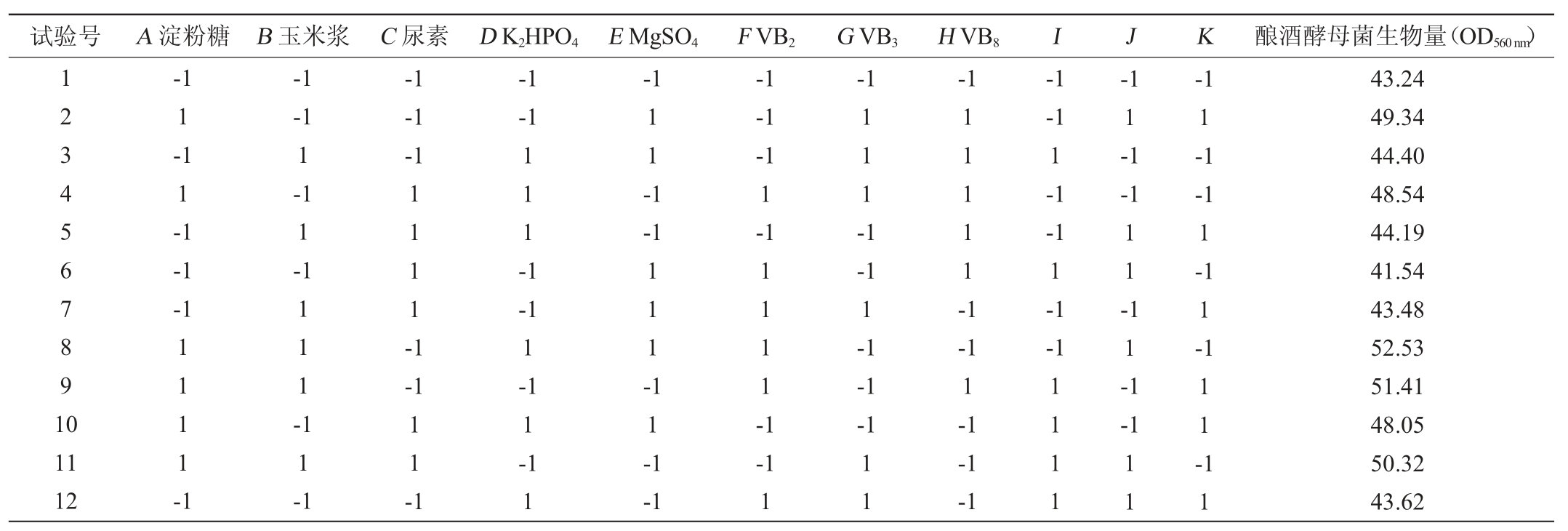
表6 PB试验结果方差分析
Table 6 Variance analysis of Plackett-Burman experiments results
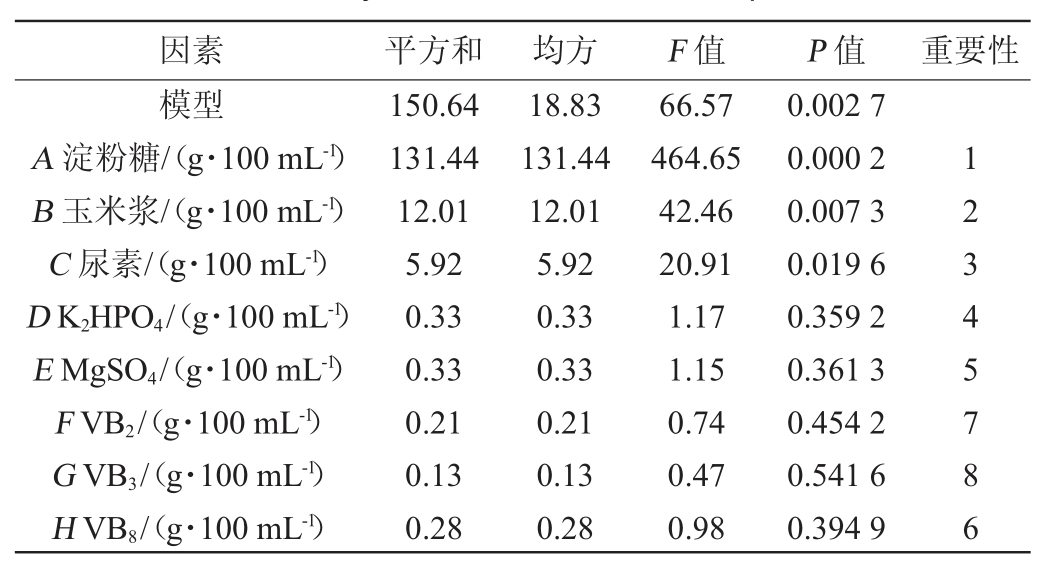
PB试验各影响因素主效应分析结果见表6。由表6可知,此模型P=0.002 7<0.05,说明回归方程显著;该模型决定系数R2=99.44%,校正决定系数R2adj=97.95%,证明该模型数据拟合度较好,能对Plackett-Burman试验进行模拟和解释。酿酒酵母菌培养过程中,在α=0.05显著水平上,淀粉糖、玉米浆、尿素对酿酒酵母菌生物量影响显著(P<0.05),淀粉糖和玉米浆为正效应,尿素为负效应;K2HPO4、MgSO4、VB2、VB3、VB8影响不显著(P>0.05)。因此选择淀粉糖、玉米浆、尿素3个因素做主要因素,根据这3个因素的响应值选择步长和方向,进行最陡爬坡试验。
2.4 最陡爬坡试验
根据Plackett-Burman试验结果确定的的3个主要显著因素进行最陡爬坡试验,以获取酿酒酵母菌最大生物量区域,根据各因素的变化方向及步长,设置5个试验梯度,试验设计及结果见表7。由表7可知,由于淀粉糖(A)、玉米浆(B)、尿素(C)三个主要显著因素浓度不同变化,酿酒酵母菌生物量先升高后降低,第三组培养体系的酿酒酵母菌生物量达到最高值,故采用淀粉糖30 g/100 mL、玉米浆6 g/100 mL、尿素0.1 g/100 mL为中心点进行响应面试验。
表7 最陡爬坡试验结果
Table 7 Results of the steepest accent experiments

2.5 发酵培养体系优化响应面试验设计与结果
利用Box-Behnken 的旋转中心组合试验设计,对酿酒酵母菌培养体系进行3因素3水平响应面分析,优化淀粉糖、玉米浆、尿素的浓度,响应值为酿酒酵母菌生物量[16]。各响应面试验设计与结果见表8。
表8 Ben-Behnken试验设计结果
Table 8 Results of Ben-Behnken experiments design
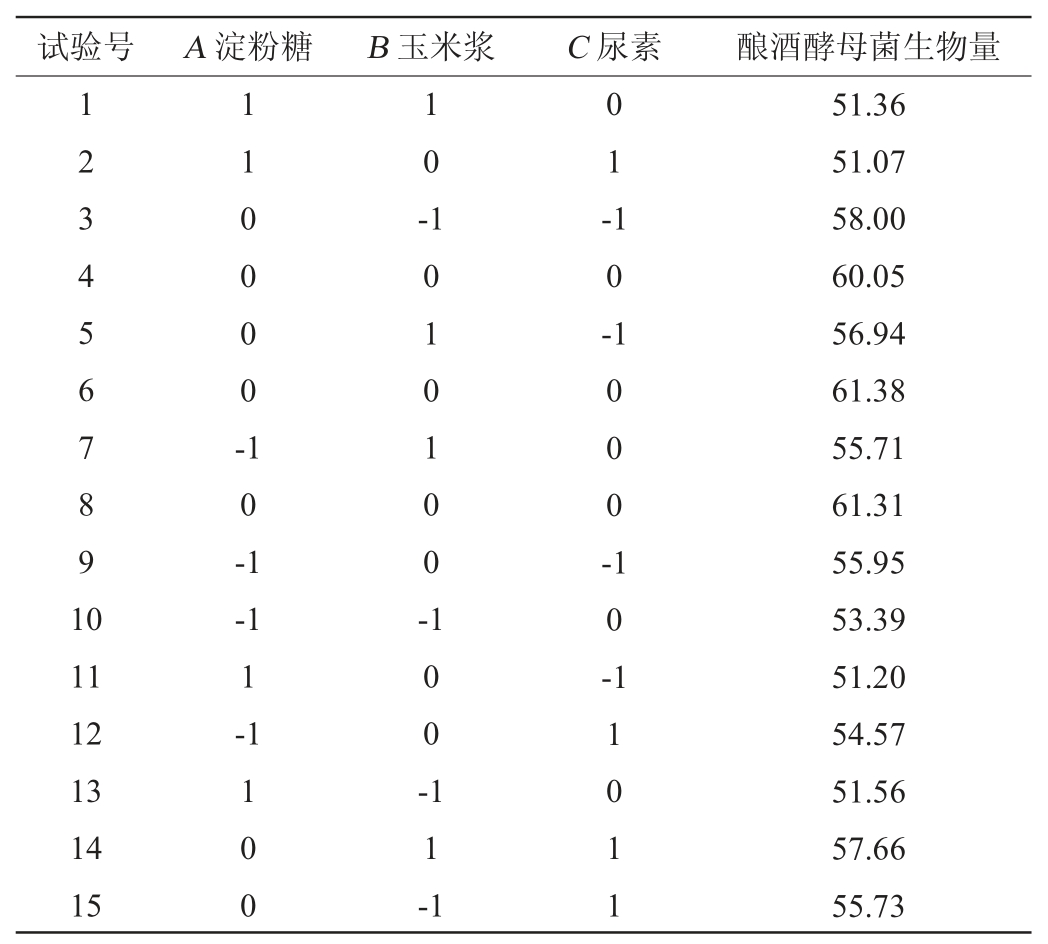
根据Box-Behnken 的试验结果,应用Design Expert 8.0.6软件对数据进行分析拟合[17],得到淀粉糖、玉米浆、尿素3个因素对酿酒酵母菌生物量(Y)影响的回归方程:Y=+60.91-1.80A+0.37B-0.38C-0.63AB+0.31AC+0.75BC-5.90A2-2.01B2-1.82C 2。对回归方程进行方差分析检验,结果见表9。由表9可知,模型P值为0.000 2,回归项极显著(P<0.01),说明本模型有效;失拟项P值为0.751 5,失拟项不显著(P>0.05),说明该模型自变量与因变量之间函数关系极显著,几乎不存在失拟现象[18];本模型的决定系数R2为98.96%,调整决定系数R2adj为97.08%,变异系数(coefficient of variation,CV)为1.09%,说明此模型显著,拟合度好[19],可以用于酿酒酵母培养体系优化与生物量预测。根据各因素P值大小,一次项A对酿酒酵母菌生物量影响极显著(P<0.01),二次项A2、B2、C2对酿酒酵母菌生物量影响极显著(P<0.01)。依据F值,将3个因素对酿酒酵母菌生物量影响大小进行排序,影响顺序为淀粉糖>尿素>玉米浆。
表9 回归模型方差分析
Table 9 Variance analysis of regression model
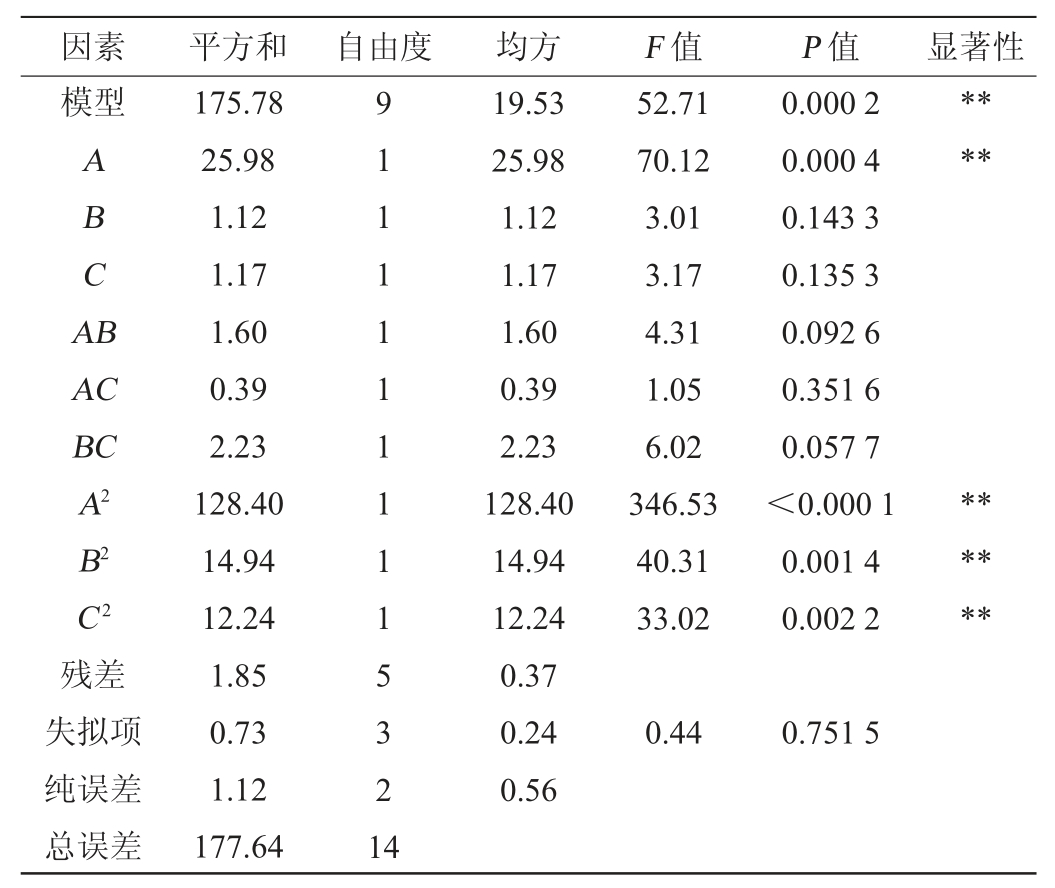
注:“**”表示差异极显著(P<0.01)。
淀粉糖、玉米浆、尿素的交互效应三维分析响应面及等高线见图2。

图2 各因素交互作用对酿酒酵母生物量影响的响应面及等高线
Fig.2 Response surface plots and contour lines of effects of interaction between each factors on the biomass of Saccharomyces cerevisiae
响应面坡面越陡峭,说明在固定一个因素不变时,其余两个因素的交互作用对酿酒酵母菌生物量影响大;响应面坡面越平滑,说明对酿酒酵母菌生物量影响越小。由图2可知,淀粉糖、玉米浆、尿素三个因素之间互有交互作用,应用Design Expert 8.0.6软件优化模块,对响应值(酿酒酵母菌生物量)求极值,分析得到A=-0.16、B=0.1、C=-0.1,对应淀粉糖、玉米浆、尿素的添加量分别为28.8 g/100 mL、6.1 g/100 mL、0.097 5 g/100 mL。此模型预测的酿酒酵母菌生物量理论值为61.10。
2.6 响应面验证试验
为了验证该模型预测的可靠性与准确性,进行验证试验。通过单因素试验与响应面试验,得到酿酒酵母菌最优培养体系为:淀粉糖28.8 g/100 mL、玉米浆6.1 g/100 mL、尿素0.0975 g/100 mL、K2HPO40.1 g/100 mL、MgSO40.05 g/100 mL、VB20.0001g/100mL、VB30.0001g/100mL、VB80.0001g/100mL。将优化后的培养体系与优化前YPD培养体系进行对比分析(装液量100 mL/250 mL、5%接种量、30 ℃、150 r/min条件下培养16 h),每组6 个平行。结果表明,酿酒酵母菌优化后的培养体系平均生物量实际值为60.60,与理论值(61.10)相对误差为0.82%,试验结果表明,应用响应面回归方程拟合得出的理论值与实际值偏差较小,说明模型有效,具有一定实践指导意义,可以较好预测酿酒酵母菌生物量[20]。优化后的酿酒酵母生物量是优化前的5.27倍。
3 结论
本研究通过单因素试验及响应面试验优化后得到的最优酿酒酵母培养体系为:淀粉糖28.8 g/100 mL、玉米浆6.1 g/100 mL、尿素0.0975 g/100 mL、K2HPO4 0.1 g/100 mL、MgSO4 0.05 g/100 mL、VB2 0.000 1 g/100 mL、VB3 0.000 1 g/100 mL、VB8 0.000 1 g/100 mL。在此培养体系下,酿酒酵母生物量为60.60,是YPD培养体系的5.27 倍。优化后的酿酒酵母培养体系以淀粉糖为碳源,以玉米浆和尿素为氮源。与YPD培养体系相比,优化后的培养体系显著提高酿酒酵母菌生物量,降低酿酒酵母培养体系成本,为酿酒酵母菌工业化生产提供一定理论依据。
[1]胡瑛.啤酒酵母的简单介绍及其在食品中的应用与开发[J].现代测量与实验室管理,2007,4(5):55-57.
[2]丁斌,邢爽,刘露,等.酿酒酵母在动物生产中的应用研究进展[J].饲料研究,2019,42(7):114-116.
[3]GARCIA F A,MIZUBUTI Y,KANASHIRO Y,et al.Intermediate moisture meat product:biological evaluation of charqui meat protein quality[J].Food Chem,2001,45(4):405-409.
[4]JANCZYK P,FRANKE H,SOUFFRANT W B.Nutritional value of Chlorella vulgaris:effects of ultrasonication and electroporation on digestibility in rats[J].Animal Feed Sci Technol,2006,132(1-2):163-169.
[5]贺淼,周安国,王之盛,等.复合酵母的营养价值评定[J].动物营养学报,2013,25(8):1904-1910.
[6]付肖蒙,王鹏飞,郝爱丽,等.高耐性酿酒酵母的筛选及其耐受性研究[J].中国酿造,2017,36(10):23-26.
[7]JESPERSEN L.Occurrence and taxonomic characteristics of strains of Saccharomyces cerevisiae predominant in African indigenous fermented foods and beverages[J].FEMS Yeast Res,2003,3(2):191-200.
[8]PALMA M L,ZAMITH-MIRANDA D,MARTINS F S,et al.Probiotic Saccharomyces cerevisiae strains as biotherapeutic tools:is there room for improvement?[J].Appl Microbiol Biotechn,2015,99(16):6563-6570.
[9]周向荣,夏延斌,周跃斌,等.S.cerevisiae 在食品工业发酵中的研究进展[J].中国酿造,2008,27(2):1-4.
[10]岳晓安,季小莉,赵国群,等.培养条件对酿酒酵母细胞甘露聚糖含量的影响[J].食品研究与开发,2016,37(23):165-169.
[11]王犁烨,王浩臣,马珊,等.常压室温等离子体选育高产酒精及酸的酿酒酵母[J].食品与机械,2019,35(5):26-31.
[12]XU S,SUN L B,ZHAO Q X,et al.Optimization of solid-state fermentation process on antibiotic alternative Bacillus subtilis probiotics[J]. J Chinese Inst Food Sci Technol,2016,16(8):132-139.
[13]MONTGOMERY D C.Design and analysis of experiments[M].3nd ed.New York:John Wiley&Sons,1991:25.
[14]褚金磊,李欣,王志,等.富含巯基化合物酿酒酵母的筛选及发酵培养基优化[J].湖北工业大学学报,2019,34(5):32-36.
[15]CELLI G B,GHANEM A,BROOKS M S L.Optimization of ultrasoundassisted extraction of anthocyanins from haskap berries(Lonicera caerulea L.)using response surface methodology[J].Ultrasonic Sonochem,2015,27(6):449-455.
[16]汤二将,邓朝霞,张晓敏,等.响应面法优化酿酒酵母产孢培养基及单倍体的鉴定[J].酿酒科技,2012,6,89(6):36-40.
[17]WANG D H,WEI L L,ZHANG S Y,et al.Optimization of fermentation medium for producing strain of natamycin using response surface methodology[J].Fine Chem,2017,34(11):1233-1238.
[18]KOWALSKI J.Optimal estimation in rotation patterns[J].J Statal Plan Infer,2009,139(4):1405-1420.
[19]李莉,张赛,何强,等.响应面法在试验设计与优化中的应用[J].实验室研究与探索,2015,34(8):41-45.
[20]窦冰然,郭会明,骆海燕,等.耐高糖面包酵母发酵工艺优化[J].食品工业科技,2016,37(18):208-212.