随着生活水平的提高,以多酚为原料的健康产品的研发越来越受到重视。目前国内外多酚产品主要源于绿色植物,其强大的抗氧化活性在疾病预防和治疗方面有良好的表现。我国是食用菌生产大国,对食用菌天然活性物质如多酚类物质的提取纯化和生物活性分析,有助于食用菌在功能性食品和医药保健品的应用和开发。桦褐孔菌(Inonotus obliquus)是生长在桦树上的一种食药用真菌,其子实体中含有200多种活性物质,具有抗癌、抗炎、抗氧化、降血脂、降血糖、延缓衰老、提高免疫力、调节内分泌系统、抑菌等多种生理功能[1-2]。目前关于桦褐孔菌活性物质报道较多的是其多糖和三萜类物质,关于桦褐孔菌多酚抗细菌活性较少报道[3-4]。研究表明,多酚中如鞣酸、黄酮类等成分具有抗菌性能[5]。酚类物质对多种细菌都有抑制作用,如对霍乱菌、金黄色葡萄球菌和大肠杆菌等常见致病菌抑制能力更强,同时多酚类并不影响生物体本身的生长发育[6]。SHIN Y S等[7]研究发现,多酚可以有效的抑制一些微生物的毒性,比如说致病性的病毒、真菌和细菌等。麝香葡萄(Vitis rotundifolia)含有的儿茶素和表儿茶素、槲皮素、山奈酚和反式白藜芦醇已被证明有很好的抑菌活性[8]。张慧丽等[9]研究花生红衣提取物黄酮酚类、单宁类等多酚类物质,并证明其对大肠杆菌、葡萄球菌等均有一定的抑制活性。钟秀宏等[10]报道了苹果中多酚类物质对细菌具有一定的抑制作用,且多酚浓度与抑菌活性呈量效关系。本研究通过抑菌圈试验确定桦褐孔菌(Inonotusobliquus)多酚的抑菌谱,探究pH、温度、紫外照射、盐浓度对桦褐孔菌多酚抑菌活性的影响,通过细菌生长抑制试验、紫外吸收、电导率及细胞形态变化研究桦褐孔菌多酚的抑菌活性。
目前关于桦褐孔活性物质报道较多的是多糖和三萜类物质,关于桦褐孔菌多酚的提取纯化及生物活性分析较少报道。本研究以桦褐孔菌子实体为原材料,提取桦褐孔菌多酚类物质,对其抗细菌活性进行了初步探索。为桦褐孔菌多酚在生物医药产品食品防腐剂等领域的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
桦褐孔菌(Inonotus obliquus)子实体:哈尔滨贝加尔泰生物工程有限公司;无水、正丁醇、三氯甲烷、乙酸乙酯、铁氰化钾、抗坏血酸(均为分析纯):上海生物化学试剂公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、Tris(均为分析纯):美国Sigma公司。
牛肉膏蛋白胨培养固体培养基:10 g 胰蛋白胨,5 g 牛肉膏,10 g NaCl,15 g琼脂,1 L蒸馏水,pH 7.0;牛肉膏蛋白胨培养液体培养基:10 g 胰蛋白胨,5 g 牛肉膏,10 g NaCl,1 L蒸馏水,pH 7.0。121.3 ℃高压蒸汽灭菌20 min后,自然冷却备用。
1.2 仪器与设备
SU1510扫描电镜:日本日立高新技术公司;TP-2000E电子天平:湘仪天平仪器设备有限公司;AUTOCLAVEMLS-3020不锈钢灭菌锅:日本三洋公司;SG-81电热恒温干燥箱:日本雅玛拓公司;M-CENTRIFUGE小型离心机:杭州柏恒科技有限公司;RE-52AA旋转蒸发仪:上海亚荣仪器厂;EZ550Q冷冻干燥仪:美国FTSSystems公司。
1.3 方法
1.3.1 桦褐孔菌多酚的提取
桦褐孔菌子实体于65 ℃烘箱中烘干至恒质量后,粉碎至粉末状,准确称取一定质量的桦褐孔菌子实体粉末放入一定体积的乙醇溶液中,提取条件为料液比1∶20(g∶mL)、乙醇体积分数50%、提取温度60 ℃、提取时间90 min。浸提处理得上清液,经无水乙醇醇沉、旋转蒸发仪蒸发、有机溶剂萃取、离心及冷冻干燥后测定多酚提取率。采用经过部分修改的福林酚(Folin-Ciocalteu)法测定桦褐孔菌中多酚的含量[11]。
1.3.2 菌悬液的制备
需要检测的菌株首先使用牛肉膏蛋白胨培养基进行培养,培养条件为220 r/min、37 ℃、12 h过夜,然后再将需要检测的菌株重新接种在牛肉膏蛋白胨培养基中,培养条件为220 r/min、37 ℃、2~4 h,使得菌株增长至对数期,OD600nm值校正到0.3~0.5之间。待检测的微生物数量级调整为约105 CFU/mL[12]。
1.3.3 抑菌圈的测定
首先把提前准备好的滤纸制作成直径为15 mm的圆形纸片,放入培养皿内。然后在超净台上,使用牛肉膏蛋白胨培养基将枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌、沙门氏菌、单增李斯特菌进行培养。然后在培养皿中加入5 mL过膜后的10 mg/mL、5 mg/mL、2.5 mg/mL的多酚溶液,充分浸泡2 h后,用无菌镊子贴在培养基上,滤纸片一贴就不能再拿起,于37 ℃培养24 h。以无菌水做空白对照,观察抑菌圈直径大小,平行三次试验,取平均值。当抑菌圈直径大于6 mm时表示其具有抑菌活性。
1.3.4 最低抑菌浓度的测定
用试管二倍稀释法确定待测样品的最低抑菌浓度(minmum inhibitory concentration,MIC)[13]:培养液含菌量105CFU/mL,待测样品用无菌水连续稀释最终质量浓度为0、0.1562mg/mL、0.3150mg/mL、0.625 0mg/mL、1.250 0mg/mL、2.500 0 mg/mL、5.000 0 mg/mL、10.000 0 mg/mL。在37 ℃培育18~24 h后,150 r/min摇床培养,每个浓度平行做三次测试,以试管中无菌生长的最低浓度作为最小抑制浓度。以无菌水作为空白对照。
1.3.5 桦褐孔菌多酚抑菌活性的影响因素
(1)pH值对桦褐孔菌多酚抑菌活性的影响
用1 mol/L的NaOH溶液和1 mol/L的HCl溶液,调节5 mg/mL质量浓度下的桦褐孔菌多酚溶液的pH值分别为3、4、5、6、7、8、9共7个梯度进行抑菌试验,以金黄葡萄球菌为指示菌,按照滤纸片法观察pH对多酚抑菌活性的影响,以无菌水作空白对照,重复3个平板。
(2)温度对桦褐孔菌多酚抑菌活性的影响
将5 mg/mL质量浓度下的桦褐孔菌多酚溶液分别在40 ℃、60 ℃、80 ℃、100 ℃、121 ℃5个温度下处理一定时间,以金黄葡萄球菌为指示菌,同样采用滤纸片法观察温度对多酚抑菌活性的影响,以无菌水作空白对照,重复3个平板。
(3)盐浓度对桦褐孔菌多酚抑菌活性的影响
配制质量分数分别为0、0.2%、0.4%、0.6%、0.8%氯化钠溶液。以金黄葡萄球菌为指示菌,按照滤纸片法观察盐浓度对多酚抑菌活性的影响,以含同等浓度氯化钠的无菌水作空白对照组,重复3个平板。
(4)紫外辐射对桦褐孔菌多酚抑菌活性的影响
桦褐孔菌多酚溶液使用紫外光灭菌,灭菌时间分别为0、10 min、20 min、30 min、40 min、50 min、60 min,以金黄色葡萄球菌为指示菌,同样采用滤纸片法观察紫外辐射对多酚抑菌活性的影响,以无菌水作空白对照,重复3个平板。1.3.6 桦褐孔菌多酚抑菌机制
(1)细菌生长的抑制
在制备细菌菌悬液中分别加入2.5 mg/mL和5.0 mg/mL桦褐孔菌多酚溶液,于30 ℃、160 r/min 摇床振荡培养。在0、1 h、2 h、3 h、4 h、5 h、6 h、7 h 分别取样,以金黄葡萄球菌为指示菌,在波长630 nm处测定其吸光度值。然后绘制生长曲线,另外以不加桦褐孔菌多酚溶液的为对照组。
(2)桦褐孔菌对多酚细胞膜通透性的影响
根据PARK Y K等[14]的方法,将金黄葡萄球菌、枯草芽孢杆菌、大肠杆菌、单增李斯特菌、沙门氏菌分别接入液体培养基中,按照上述菌悬液的制备方法,使细菌数调整为大约105 CFU/mL左右。将质量浓度为5.0 mg/mL桦褐孔菌多酚溶液等体积加入悬菌液,在37 ℃、150 r/min条件下摇床培养。用蒸馏水代替供试菌种作为对照组,分别于0、1 h、2 h、3 h、4 h、5 h、6 h、7 h 测定悬菌液的电导率值,每样重复3次。
(3)桦褐孔菌多酚对细胞泄漏的影响
具体检测参照崔鹤松等[15]方法。
(4)桦褐孔菌多酚对细胞完整性的影响
将0.2 mL细菌菌悬液加入到牛肉膏蛋白栋固体培养基中,5 mg/mL桦褐孔菌多酚溶液处理滤纸片,按照滤纸片进行抑菌实验,培养观察至出现明显的抑菌圈,取抑菌圈部位和没有抑菌圈部位。用双面刀片切成2 mm×5 mm的小条,按照扫描电镜生物样品制备方法,固定、冲洗、脱水、置换、干燥、粘样、镀膜于扫描电镜下观察菌体形态和结构变化,以没有抑菌圈部位的固体培养基作为对照。
2 结果与分析
2.1 桦褐孔菌多酚抑菌谱的测定
桦褐孔菌多酚抑菌效果的定性试验结果见表1。由表1可知,桦褐孔菌多酚对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、单增李斯特菌、沙门氏菌均具有一定的抑制活性,且对革兰氏阳性菌的抑菌效果强于革兰氏阴性菌。桦褐孔菌多酚的浓度和抑菌圈大小具有正相关的剂量关系,当多酚质量浓度从2.5 mg/mL升高到5 mg/mL时,抑菌圈直径增加11.9%~28.3%,而多酚质量浓度进一步升高至10 mg/mL时,抑菌直径增加34.5%~51.0%。在本实验的质量浓度范围内,随着桦褐孔菌多酚质量浓度的增大抑菌圈越大,抑制效果越明显。通过比较每个抑制圈的大小,发现桦褐孔菌多酚对金黄色葡萄球菌抑制效果最好,10 mg/mL时最大抑菌圈直径为(19.5±0.15)mm,比同浓度下枯草芽孢杆菌、单增李斯特菌、大肠杆菌和沙门氏菌分别高23.4%、8.9%、18.2%和40.2%,因此选用金黄色葡萄球菌为后续试验的指示菌。
表1 桦褐孔菌多酚抑菌活性定性试验结果
Table 1 Qualitative test results of the antimicrobial activity of Inonotus obliquus polyphenols
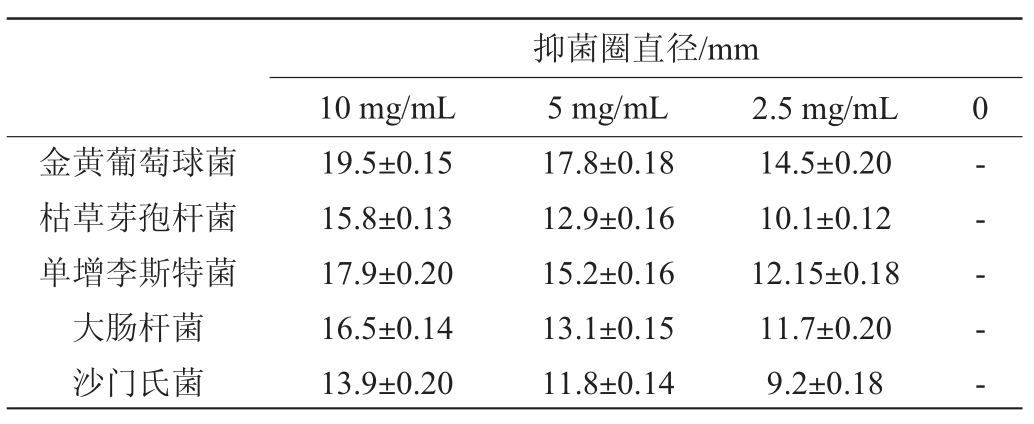
注:“-”表示无抑菌作用。
2.2 最低抑菌浓度的测定
由表2可知,桦褐孔菌多酚对金黄葡萄球菌、大肠杆菌、枯草芽孢杆菌、沙门氏菌、单增李斯特菌均具有抑制生长的作用,但抑菌能力因浓度不同而不同,对金黄色葡萄球菌的MIC最低,MIC为1.25 mg/mL,MIC越小说明抑菌效果越好,对单增李斯特菌和大肠杆菌的MIC 低于2.5 mg/mL,对枯草芽孢杆菌和沙门氏菌的MIC低于5 mg/mL,桦褐孔菌多酚对枯草芽孢杆菌和沙门氏菌的抑制活性低于其他几种供试菌。进一步说明了在供试菌中,桦褐孔菌多酚对金黄葡萄球菌的抑菌效果最好。实验结果表明,样品对细菌的抑制能力具有选择性,对金黄色葡萄球菌、单增李斯特菌和枯草芽孢杆菌(革兰氏阳性菌)的抑制能力优于大肠杆菌和沙门氏菌(革兰氏阴性菌)。对照样品对大肠杆菌、金黄色葡萄球菌、单增李斯特菌和沙门氏菌没有抑菌性。
表2 桦褐孔菌多酚抑菌的最低抑菌浓度的测定结果
Table 2 Determination results of minimum inhibitory concentration of Inonotus obliquus polyphenols

注:“-”表示无菌生长,“+”表示有少量菌生长,“++”表示有大量菌生长。
2.3 不同因素对桦褐孔菌多酚抑菌活性的影响
2.3.1 pH对桦褐孔菌多酚抑菌的影响
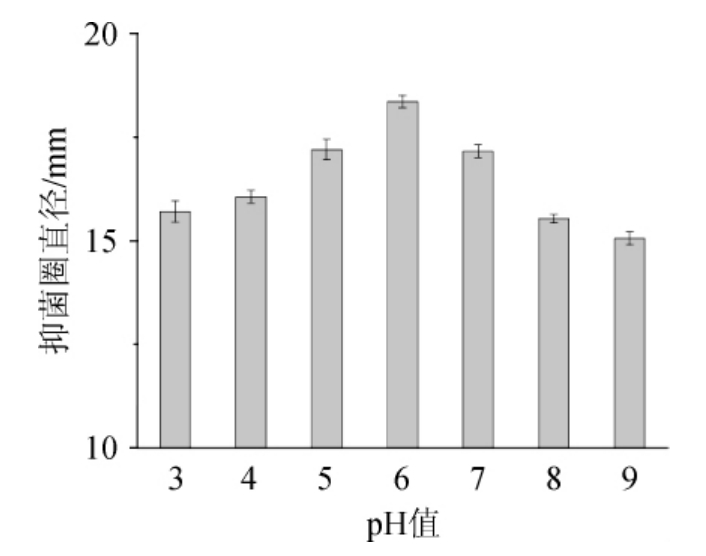
图1 pH值对桦褐孔菌多酚抑菌活性的影响
Fig.1 Effect of pH value on the antimicrobial activity of Inonotus obliquus polyphenols
由图1可知,不同pH值桦褐孔菌多酚溶液的抑菌活性有一定改变。随着pH升高,抑菌圈直径呈先升高后降低的趋势,在pH值为3~6范围处理后,抑菌圈直径随着pH升高而增大,在pH值为6时,抑菌圈直径达到最大值为18.36 mm,当pH值>6处理后,抑菌圈直径降低较明显,抑菌效果变弱。这说明桦褐孔菌多酚在强酸强碱下具有显著的抑菌效果,而且酸性条件下的抑菌效果要显著强于碱性条件。
2.3.2 温度对桦褐孔菌多酚抑菌的影响
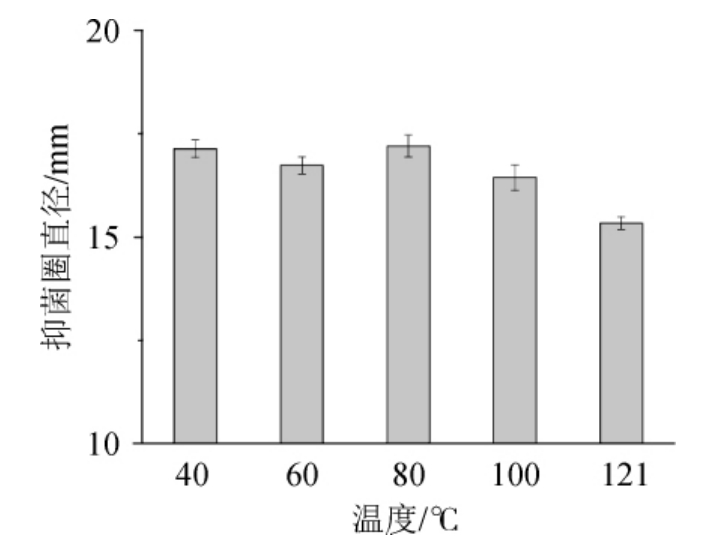
图2 温度对桦褐孔菌多酚抑菌活性的影响
Fig.2 Effect of temperature on the antibacterial activity of Inonotus obliquus polyphenols
由图2可知,多酚提取液在40~121 ℃范围处理后,抑菌圈直径大小变化不明显,说明桦褐孔菌多酚抑菌热稳定性较好,当温度>80 ℃处理后,其抑菌圈直径虽有变小但减小不明显,仍有很好的抑菌效果。可能原因是高温使提取液中的抑菌物质发生了化学变化,致使其在高温高压条件下仍然具有一定的抑菌效果。
2.3.3 氯化钠溶液质量分数对桦褐孔菌多酚抑菌的影响
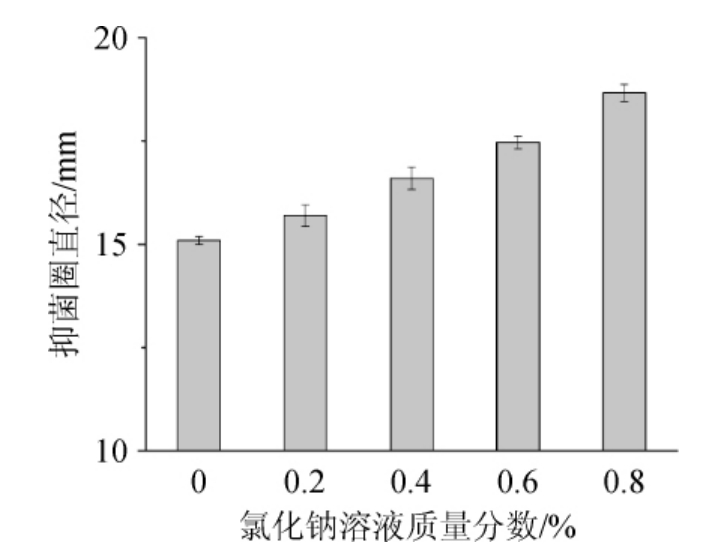
图3 氯化钠溶液质量分数对桦褐孔菌多酚抑菌活性的影响
Fig.3 Effect of NaCl concentration on the antibacterial activity of Inonotus obliquus polyphenols
由图3可知,随着氯化钠溶液质量分数的升高,抑菌圈直径逐渐增大,当盐质量分数为0.8%时,抑菌圈直径最大为18.66 mm,与未添加盐的抑菌圈直径相比增加显著,低浓度的盐对桦褐孔菌多酚的抑菌效果具有一定的促进作用,抑菌圈大小随着氯化钠质量分数的增加呈正相关。
2.3.4 紫外辐射时间对桦褐孔菌多酚抑菌的影响
由图4可知,随着紫外辐射时间增加,抑菌圈直径变化不明显,说明紫外辐射在试验条件下,多酚对金黄葡萄球菌抑菌效果不明显。当紫外辐射后抑菌圈直径较未经紫外辐射的抑菌圈变化微弱。说明紫外照射没有对桦褐孔菌多酚对金黄色葡萄球菌的抑制活性产生影响。
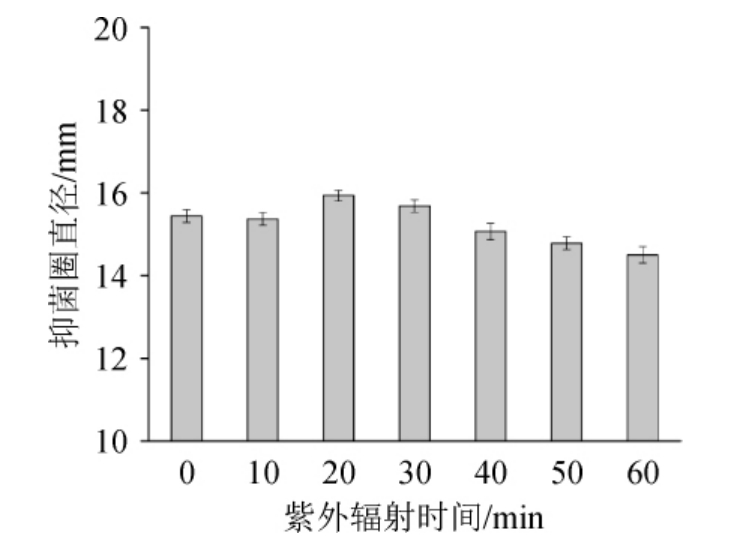
图4 紫外辐射对桦褐孔菌多酚抑菌活性的影响
Fig.4 Effect of UV radiation on the antibacterial activity of Inonotus obliquus polyphenols
2.4 桦褐孔菌多酚抑菌机制
2.4.1 桦褐孔菌多酚对细菌生长的抑制
采用生长曲线法[16]鉴定抑菌效果,结果见图5。由图5可知,经桦褐孔菌多酚处理的实验组的细菌生长曲线与正常培养的对照组存在明显的变化。未添加桦褐孔菌多酚处理的金黄葡萄球菌随着培养时间的增加具有典型的生长特征,生长状况较好。对照组中,金黄葡萄球菌在0~5 h内呈对数增长,5 h之后开始进入稳定期;桦褐孔菌多酚处理组均随着作用时间的延长,OD600nm值初始增殖缓慢,在4 h到达增殖顶点,4 h后趋于稳定,之后出现小幅度下降,且多酚质量浓度为5 mg/mL处理组较2.5 mg/mL处理组OD600nm值小。说明经多酚处理后的金黄葡萄球菌的生长受到抑制,对数生长期缩短、甚至无对数生长期,且抑制效果与多酚浓度呈正相关趋势。
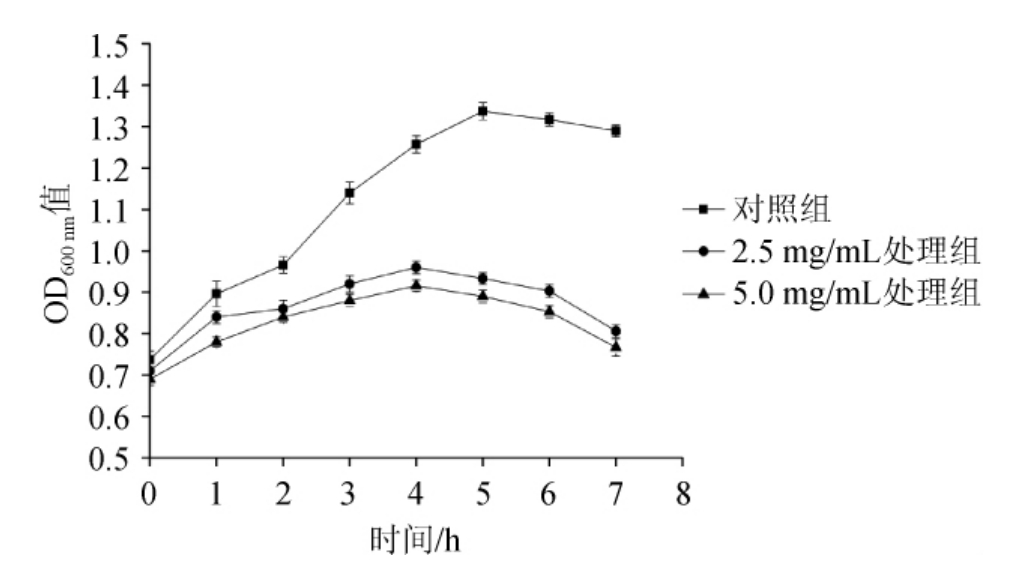
图5 桦褐孔菌多酚对金黄葡萄球菌生长曲线的影响
Fig.5 Effect of Inonotus obliquus polyphenols on growth curve of Staphylococcus aureus
可能原因是多酚抑菌物质没有起到明显作用,经过一段时间处理后,细菌生长开始受到抑制,但是并没有完全杀死细菌,表明其进入衰亡期。并且细菌生长情况随着桦褐孔菌多酚质量浓度的增加变得缓慢,但是整体变化趋势相同。
2.4.2 桦褐孔菌多酚对细胞膜通透性的影响
细胞膜是细菌的保护屏障,当细菌遇到强抑菌剂,细胞膜遭到破坏时,菌体的保护屏障被打破,使其内部电解质外泄至培养液中,进而使培养液的电导率上升。因此,菌液电导率的变化反映了细菌细胞膜通透性的变化[17]。

图6 桦褐孔菌多酚处理对细菌电导率的影响
Fig.6 Effect of treatment of Inonotus obliquus polyphenols on conductivity of bacteria
由图6可知,将1 mg/mL的桦褐孔菌多酚提取液作用于大肠杆菌、金黄色葡萄球菌、单增李斯特菌、沙门氏菌、枯草芽孢杆菌的培养液,电导率较未经处理的对照组存在明显的变化,多酚作用细菌组的电导率明显高于未处理组电导率。随着作用时间的延长,金黄色葡萄球菌、单增李斯特菌、大肠杆菌培养液的电导率高于枯草芽孢杆菌、沙门氏菌,且均呈持续上升趋势。处理1 h后金黄色葡萄球菌、单增李斯特菌、大肠杆菌、枯草芽孢杆菌、沙门氏菌的电导率值分别为6.79 mS/cm、6.53 mS/cm、6.39 mS/cm、6.04 mS/cm、5.77 mS/cm,处理4 h后分别增加到7.134 mS/cm、6.79 mS/cm、6.653 mS/cm、6.35 mS/cm、5.97 mS/cm。处理4 h后金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、单增李斯特菌、沙门氏菌与对照相比电导率分别变大。作用4 h后,所有样品的电导率值变化不明显。这说明经过桦褐孔菌多酚溶液处理的菌体细胞细胞膜发生破坏而失去其选择渗透性功能,使电解质的渗出量不断增大,因此导致菌液中电导率增加,可能原因是首先破坏细胞膜的完整性,增加了细胞膜的通透性,促使内容物快速渗出,细胞内环境稳定性被破坏,从而起到抑菌作用。对照组的电导率开始0~1 h 内略微上升,可能是由于测量时环境温度的变化引起的,1 h后基本无变化。
2.4.3 桦褐孔菌多酚对细胞泄漏的影响
细胞膜是细胞完整的主要组成部分,可以使得细胞行使正常的生理活性。细菌细胞壁的口径很小,只能够通过1 nm大小的分子,大分子物质就无法通过细胞壁[18]。一旦细菌遭受到破坏,例如遭受到抑菌物质的影响后,细胞膜的功能会破坏,导致细菌结构不稳定,使细胞的功能丧失[19]。由于核酸在波长260 nm处的释放有强吸收,因此OD260nm值被广泛用作评价细胞膜完整性的指标[20]。
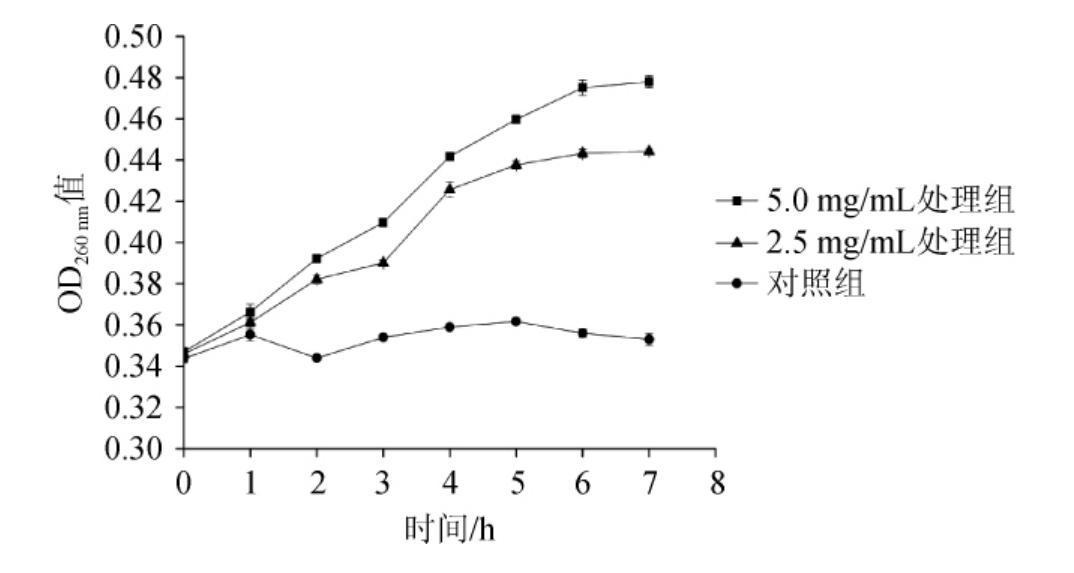
图7 桦褐孔菌多酚处理对金黄葡萄球菌紫外吸收的影响
Fig.7 Effects of treatment of Inonotus obliquus polyphenols on ultraviolet absorption of Staphylococcus aureus
由图7可知,桦褐孔菌多酚对金黄葡萄球菌的抑制率具有显著影响。未经多酚处理组的OD260nm值随着培养时间的增加变化不明显,说明细菌处于稳定的生长情况。经多酚处理组的OD260nm值随着作用时间的增加呈显著上升趋势。0~4 h范围内OD260nm值随着多酚作用时间增加显著增大,作用4~6 h后OD260nm值缓慢增加。当作用6 h后OD260nm值呈稳定趋势。且OD260nm值与多酚作用浓度呈正相关。说明桦褐孔菌多酚可是细菌细胞内的核酸大量渗出,且桦褐孔菌多酚的浓度越大核酸泄露越明显。
2.5 桦褐孔菌多酚对细胞完整性的影响
大肠杆菌经桦褐孔菌多酚作用后,其扫描电镜图(scanningelectron microscopy,SEM)结果见图8。

图8 桦褐孔菌多酚处理大肠杆菌的扫描电镜图
Fig.8 Scanning electron microscopy image of Escherichia coli treated with Inonotus obliquus polyphenols
由图8A可知,正常的大肠杆菌菌体保持完整的细胞结构,细胞表面光滑均匀、饱满完整;由图8B可知,经过多酚抑菌处理后的部分菌体形态受到损坏,有不规则的突起,有轻微褶皱,个别菌体的形状发生改变;放大倍数后可以清晰地看出菌体形态的扭曲、变形,个别甚至出现有黑色孔洞。多酚类是亲水的物质,可以通过大肠杆菌细胞产生的形态学变化证明了桦褐孔菌多酚破坏了细菌细胞膜表面的光滑结构,使细胞膜出现孔隙,导致菌体自身裂解,细胞中的物质渗出,代谢功能不平衡,从而对抗菌抑菌效果起到重要的作用。SEM 从形态学角度验证了桦褐孔菌多酚的抑菌机制,与以上微生物生长曲线、电导率变化及紫外吸收推测的结果吻合一致。
3 讨论
抑菌活性研究结果表明,桦褐孔菌多酚提取物对供试菌具有广谱抑菌效果。对革兰氏阳性菌的抑菌效果强于革兰氏阴性菌的抑菌效果。可能是由于两种细菌细胞壁的成分和结构的差异。研究发现,革兰氏阳性菌细胞壁含有大量的肽聚糖,因此,多酚能与肽聚糖作用可以自由进出细胞。与革兰阳性菌相比,革兰氏阴性菌由于其细胞壁有外膜覆盖,不利于酚类物质与肽聚糖脂多糖作用,渗透进细胞壁[21]。陈岗[22]研究发现,桦褐孔菌核提取物可以抑制某些革兰氏阴性菌和革兰氏阳性菌的数量和活性。曲词等[23]在对海黍子多酚的抑菌活性研究时证明多酚对革兰氏阴性、阳性菌均有很好的抑制作用,且对金黄葡萄球菌抑菌效果最好。最低抑菌浓度与抑菌活性的测定同时证明以金黄葡萄球菌为指示菌,进行抑菌因素的影响是可行的。与文献[24]描述相一致,在对桦褐孔菌多酚抑菌活性影响因素试验可知,桦褐孔菌多酚在pH为6时抑菌活性达到最大。多酚类在自然条件下处于酸性物质,物质极其不稳定,当外界环境处于碱性条件下易发生反应,多酚提取物中的抑菌物质被破坏,所以导致其抑菌能力变弱。这与沈梦薇[25]报道相一致,桦褐孔菌多酚经低盐浓度处理后,其抑菌活性增加,可能是由于低盐本身是细菌生长的有利条件,低盐浓度对桦褐孔菌多酚提取物没有影响。与董周永等[26]关于石榴提取物中多酚类物质的存在结果相一致,仪淑敏[27]关于茶多酚对鱼糜制品的冷藏保鲜作用及抑菌机理的研究也表明细菌在低盐浓度条件下生长良好。桦褐孔菌多酚提取物经升温和紫外照射后,其抑菌圈变化不明显,仍然存在很强的抑菌能力,说明桦褐孔菌多酚对加热和紫外照射具有很好的稳定性,可能原因与桦褐孔菌多酚结构有关,经鉴定桦褐孔菌多酚具有苯环结构,在紫外区具有强吸收峰,结构的稳定不至于受影响,从而保证了抑菌活性的稳定。
目前对多酚抑菌机理有有以下几点[28],多酚通过作用于细菌的内外细胞膜,来破坏细胞膜的流动性及半透性功能致使细胞膜破裂促使胞内内溶物外泄。多酚通过作用于细菌的细胞壁而发挥其抑菌作用;多酚通过影响细菌的生物大分子合成,如脱氧核糖核酸(deoxyribonucleosides,DNA)、核糖核酸(ribonucleic acid,RNA)、蛋白质等,从而影响细菌遗传表达,导致细菌形态改变。桦褐孔菌多酚对金黄葡萄球菌生长曲线的具有一定的抑制作用,且与浓度呈剂量关系。此研究与胡公义等[29]对茶多酚对空肠弯曲菌抑菌机理研究相符合,紫外吸收和DNA条带的变化表明桦褐孔菌多酚可能影响细菌DNA而完成抑菌作用,这与唐正伟[30]对广藿香酮及其衍生物对抗菌机理的研究相符合。桦褐孔菌多酚作用细菌电导率的变化与高愿军等[31]研究的结果趋势一致。说明桦褐孔菌多酚影响了细胞膜的通透性。扫描电镜观察桦褐孔菌多酚处理过的大肠杆菌的形态变化与赵艳霞等[32]用扫描电镜观察得到相同的结论。说明桦褐孔菌多酚可改变细菌细胞膜的完整性。桦褐孔菌多酚其本身无毒性,可以使其作为一种天然抑菌剂,可作为防腐剂应用于食品生产中。
4 结论
桦褐孔菌多酚具有广谱抑菌效果,且对革兰氏阳性菌的抑制能力优于革兰氏阴性菌,对大肠杆菌(G-)、金黄色葡萄球菌(G+)、单增李斯特菌(G+)、沙门氏菌(G-)和枯草芽孢杆菌(G+)最小抑菌浓度分别为2.50 mg/mL、1.25 mg/mL、2.50 mg/mL、5.00 mg/mL和5.00 mg/mL。在pH值为6、盐浓度为0.8%时,对金黄色葡萄球菌的抑菌圈直径达到最大值,分别为18.36 mm、18.66 mm。桦褐孔菌多酚抑菌在40~121 ℃热稳定性较好,并且对金黄色葡萄球菌的抑制效果最好,10 mg/mL时最大抑菌圈直径为(19.5±0.15)mm,比同浓度下枯草芽孢杆菌、单增李斯特菌、大肠杆菌和沙门氏菌分别高23.4%、8.9%、18.2%和40.2%。
[1]黄纪国,余雄涛,谢意珍,等.桦褐孔菌提取物抗氧化活性研究[J].广西植物,2014(4):515-519.
[2]陈艳秋,李玉.桦褐孔菌的研究进展[J].微生物学通报,2005,32(2):124-126.
[3]NAZ S,AHMAD S,AJAZ R S,et al.Antibacterial activity directed isolation of compounds from Onosma hispidum[J].Microbiol Res,2006,161(1):43-48.
[4]XU C,YAGIZ Y,HSU W Y,et al.Antioxidant,antibacterial,and antibiofilm properties of polyphenols from muscadine grape(Vitis rotundifolia Michx.)pomace against selected foodborne pathogens[J].J Agr Food Chem,2014,62:6640-6649.
[5]林碧贤,李哗,毛景华,等.药用真菌白桦茸-桦褐孔菌[J].海峡药学,2004,16(6):74-76.
[6]钟秀宏,杨淑艳,孙东植.桦褐孔菌的药理作用研究进展[J].中国药房,2007,25:1983-1984.
[7]SHIN Y S,TAMAI Y,TERAZAWA M.Chemical constituents of Inonotus obliquus Ⅱ.A new triterpene,21,24-cyclopentalanosta-3β,21,25 triene from scretium[J].J Wood Sci,2001,47(4):313.
[8]何坚,冯孝章.桦褐孔菌化学成分的研究[J].中草药,2001,32(1):4-6.
[9]张慧丽,杨松,寇巍,等.超声提取桦褐孔菌子实体多糖及多糖对癌细胞作用的研究[J].食用菌学报,2007,14(4):5-54.
[10]钟秀宏,孙东植.桦褐孔菌的研究进展[J].延边大学医学学报,2004,27(4):319-320.
[11]李碗珍,胡风林,万水霞.桦褐孔菌发酵及其提取物清除自由基活性的研究[J].生物学杂志,2006,23(24):22-25
[12]高雪丽,高愿军,李建光,等.桦褐孔菌多酚对食用油脂的抗氧化效应研究[J].食品工业科技,2008,29(l):135-137.
[13]梁丽雅,张泽生,孙玮,等.桦褐孔菌醇提物的萃取分离及其抗氧化活性研究[J].中北大学学报(自然科学版),2009,30(2):153-155.
[14]PARK Y K,LEE H B,JEON E J.Chaga mushroom extract inhibits oxidative DNA damage in human lymphocytes as assessed by comet assay[J]. Biofactors,2004,21(5):109-112.
[15]崔鹤松,金光.桦褐孔菌多糖对实验性高脂血症模型大鼠血脂的影响[J].延边大学医学学报,2007,30(3):173-174.
[16]张慧丽,杨松,宋雅娜,等.桦褐孔菌不同提取成分对小鼠免疫功能比较研究[J].微生物学杂志,2007,27(6):20-23.
[17]HYUN K W,JEONG S C.Isolation and characterization of a novel platelet aggregation inhibitory peptide from the medicinal mushroom Inonotus obliquus[J].Peptides,2006,27(6):1173-1178.
[18]李东芹,金丹.桦褐孔菌的作用研究进展[J].延边人学医学学报,2011,34(2):154-156.
[19]李佳佳,鞠玉琳,李杨,等.桦褐孔歯不同提取物抗弓形虫效果的比较[J].河南农业科学,2010(1):119-121.
[20]谷妲.栽培与野生桦褐孔菌(Inonotus obliquus)菌核生药学及抑菌活性的研究[D].长春:吉林农业大学,2010.
[21]延光海,金光玉,李良昌,等.桦褐孔菌乙醇提取物在小鼠哮喘模型中对p38MAPK 信号通路的影响[J].中国中药杂志,2011,36(8):1067-1070.
[22]陈岗.橄榄中多酚类物质的分离纯化及功能性研究[D].重庆:西南大学,2009.
[23]曲词,任丹丹,任先见,等.海黍子多酚提取工艺的优化及抑菌活性研究[J].食品工业,2016(11):169-172.
[24]ZHENG W F,ZHANG M M,ZHAO Y X,et al.Accumulation of antioxidant phenolic constituents in submerged cultures of Inonotus obliquus[J].Bioresource Technol,2009,100(3):1327-1335.
[25]沈梦薇.促进剂对桦褐孔菌液体深层发酵多酚的产生、活性和组成的影响[D].杭州:浙江理工大学,2015.
[26]董周永,郭松年,赵国建,等.石榴果皮提取物抑菌活性研究[J].西北植物学报,2008,28(3):582-587.
[27]仪淑敏.茶多酚对鱼糜制品的冷藏保鲜作用及抑菌机理[D].杭州:浙江工商大学,2011.
[28]钱丽红,陶妍,谢晶.茶多酚对金黄色葡萄球菌和铜绿假单胞菌的抑菌机理[J].微生物学通报,2010,37(11):1628-1633.
[29]胡公义,龚裕强,王飞海,等.茶多酚对肠缺血-再灌注后大鼠肺损伤的影响[J].医药导报,2009,28(5):560-562.
[30]唐正伟.广藿香酮及其衍生物的合成与抗菌机理研究[D].成都:成都中医药大学,2016.
[31]高愿军,王娟娟,龙娇妍,等.桦褐孔菌多酚在小鼠血清中的抗氧化作用研究[J].食品工业科技,2010(9):331-333.
[32]赵艳霞,缪康杰,魏志文,等.真菌多糖激发子对桦褐孔菌多酚积累影响的研究[J].中草药,2010(12):2079-2082.