益生菌是一类能够促进肠内菌群生态平衡,对宿主有益的活性微生物[1]。自它被提出以来,益生菌就被广泛地应用于各个领域[2]。目前研究表明,益生菌具有调节肠道菌群、改善乳糖不耐症、提高人体免疫力[3]、降低胆固醇[4]、抗癌[5-6]、抗氧化[7]等众多益生功能。然而,适应胃肠道的低pH环境、高渗透压的胆盐环境是益生菌成功定植并发挥益生功能的前提[8]。因此,筛选高耐酸、耐胆盐的优良益生菌株具有重要的研究意义和应用价值。
近年来,国内外对优良益生菌菌株的筛选及益生菌益生特性的研究比较活跃。张振宇等[3]从11株乳酸菌中筛选出1株在pH3.0的人工胃液中存活率为119.53%且在0.3%的胆盐中生长率为41.64%的耐酸、耐胆盐的优良菌株;姚杰玢等[7]从8株乳酸菌中筛选出2株自由基清除能力较强的菌株R36和R39,它们对1,1-二苯基-2-三硝基(1,1-diphenyl-2-picrylhydrazyl,DPPH)、羟自由基(·OH)和超氧阴离子(O2-·)3种自由基的清除能力分别为51.09%、67.86%、72.02%和50.26%、67.67%、72.16%;贺珊珊等[8]从5株益生菌中筛选出1株胆固醇去除率为20.03%、能够长时间耐受pH为2.5的高酸性环境、胆盐浓度为0.5%的高胆盐环境的菌株。但是,目前所筛选到的菌株的优良特性往往仅表现在抗性或者益生特性方面,同时具有抗性和多种优良益生特性的菌株还很少[9-10]。
本研究以13份农用益生菌剂、土法发酵制备的酵素液及表层菌膜样品为原料,通过初筛及耐酸、耐胆盐能力的复筛获得了4株性能优良的益生菌株,并对它们进行了进一步的产酶、自由基清除、产酸等益生特性的研究,旨在为后续益生菌益生功能的研究及应用提供理论基础及优质的菌种支持。
1 材料与方法
1.1 材料与试剂
农用益生菌剂(市售有机农业安全卫士):北京餐厨宝生物科技有限公司;酵素液:以生姜、枸杞、大枣、罗汉果、菊花、杨梅、樱桃、香蕉、柚子、甜瓜等水果的不同组合为材料,采用土法发酵一年以上的酵素液及表层菌膜,样品均采集自当地民间;氢氧化钠、浓盐酸(均为分析纯):国药集团化学试剂有限公司;DPPH、牛胆盐、猪胆盐(均为分析纯):北京索莱宝科技有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒(离心柱型):北京百泰克生物技术有限公司。
乳酸细菌培养基(MRS液体培养基):牛肉膏10.0 g,胰蛋白胨10.0 g,酵母浸粉5.0 g,磷酸氢二钾2.0 g,柠檬酸钠5.0 g,无水乙酸钠5.0 g,七水硫酸镁0.05 g,无水硫酸锰0.05 g,吐温80 1.0 mL,葡萄糖20.0 g,蒸馏水1 000 mL。MRS固体培养基:在MRS液体培养基中加入15.0 g琼脂。葡萄糖单独灭菌,115 ℃灭菌30 min,其余培养基121 ℃灭菌20 min,灭菌完成后混匀使用。
淀粉培养基:酵母浸粉5.0 g,可溶性淀粉2.0 g,胰蛋白胨10.0 g,氯化钠5.0 g,琼脂15.0 g,蒸馏水1 000 mL。121 ℃灭菌20 min。
干酪素培养基:氯化钠5.0 g,干酪素10.0 g,琼脂15.0 g,加蒸馏水至1 000 mL,干酪素用0.1 mol/L稀碱溶液溶解后单独灭菌,其他组分一起灭菌,灭菌完成后混匀使用,均为121 ℃灭菌20 min。
1.2 仪器与设备
LE303E型精密电子天平:深圳市恒科达检测仪器有限公司;SX-500型全自动高压灭菌器:日本Tomy Digital Biology公司;MN-KJ型电热恒温水浴锅:海南海森林公波仪器公司;PRG-84465型恒温培养箱:浙江森林控股有限公司;MNVB-78K型恒温摇床培养箱:上海智城仪器有限公司;DM750型生物显微镜:德国徕卡LEICA公司。
1.3 方法
1.3.1 菌株的初筛与形态学鉴定
将农用益生菌剂、土法发酵制备的酵素液及表层菌膜等共13份样品进行梯度稀释,梯度稀释至10-7,选取适宜的浓度分别涂布于MRS固体培养基上,37 ℃恒温过夜培养。根据菌落的形态差异挑取不同的单菌落于新的MRS固体培养基上进行恒温过夜培养。对分离纯化获得的单菌株保藏,并进行革兰氏染色与镜检。
1.3.2 菌株的分子生物学鉴定
利用细菌基因组DNA提取试剂盒提取菌株的基因组DNA,并以其为模板进行16S rDNA的聚合酶链式反应(polymerase chain reaction,PCR)扩增。采用细菌通用引物27F:5'-AGAGTTTGATCCTGGCTCA-3'和1492R:5'-GGTTACCTTGTTACGACTT-3',PCR扩增程序:95 ℃预变性5 min;98 ℃变性10 s,54 ℃退火45 s,72 ℃延伸90 s,30个循环;72 ℃再延伸10 min。PCR产物送至测序公司进行基因测序,利用美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库对测序结果进行BLAST比对,从而确定菌株的种属。
1.3.3 菌株的耐酸能力
取100 μL活化后的菌液接种至5 mL MRS液体培养基中,37℃静置培养,直至OD600nm值=1.0,8000 r/min离心10 min弃上清,收集菌体。将菌体悬浮于等体积、pH分别为1.0、1.5、2.0、3.0、4.0的MRS液体培养基中,37 ℃恒温静置培养,于0 h和4 h分别取样,用美蓝染色法染色后使用血细胞计数法进行活菌计数,以培养0 h的活菌数为对照,计算存活率公式如下:
存活率=![]()
式中:A1为在不同pH的MRS液体培养基中培养0 h的活菌数,CFU/mL;A2为在不同pH的MRS液体培养基中培养4 h的活菌数,CFU/mL。
1.3.4 菌株的耐胆盐能力
取100 μL活化后的菌液接种至5 mL MRS液体培养基中,37 ℃静置培养,直至OD600nm值=1.0,8 000 r/min离心10 min弃上清,收集菌体。将菌体悬浮于等体积、胆盐浓度为0.3%、0.5%、1.0%、1.5%的MRS液体培养基中,37 ℃恒温静置培养,于0 h和4 h分别取样,用美蓝染色法染色后使用血细胞计数法进行活菌计数,以培养0 h的活菌数为对照,计算存活率公式如下:
存活率=![]()
式中:A1为在不同胆盐浓度的MRS液体培养基中培养0 h的活菌数,CFU/mL;A2为在不同胆盐浓度的MRS液体培养基中培养4 h的活菌数,CFU/mL。
1.3.5 菌株的产酶能力
取100μL活化后的菌液接种至5mLMRS液体培养基中,37 ℃静置培养,直至OD600nm值=1.0,8 000 r/min离心10 min收集上清。将牛津杯分别放置在淀粉培养基和干酪素培养基平板上,吸取上清液0.2mL加入牛津杯中,37 ℃培养24 h后观察牛津杯周围是否有明显的酶解圈出现,并测量酶解圈直径。
1.3.6 菌株的DPPH自由基清除能力
取100 μL活化后的菌液接种至5 mL MRS液体培养基中,37 ℃静置培养,直至OD600nm值=1.0。DPPH自由基清除率的测定方法在文献已报道的方法[11]上做了修改,取1 mL菌液,加入2 mL 0.5 mmol/L的DPPH乙醇溶液,混匀后避光反应30 min,8 000 r/min离心10 min,取上清,于波长517 nm处测定吸光度值。空白组以等体积无水乙醇代替DPPH乙醇溶液,对照组以等体积无水乙醇代替菌液。
清除率=![]()
式中:AS为样品组的吸光度值;A为空白组的吸光度值;A0为对照组的吸光度值。
1.3.7 菌株的产酸能力
取100 μL活化后的菌液接种至5 mL MRS液体培养基中,37 ℃静置培养24 h、48 h后分别取样,8 000 r/min离心10 min收集上清。加入酚酞作为指示剂,用0.1 mol/L NaOH滴定直至出现浅红色,且30 s内不褪色,分别记录NaOH的消耗体积,并计算产酸量(以乳酸计)。计算公式如下:
式中:C1为NaOH溶液浓度,mol/L;C2为产酸量,g/L;K为酸换算系数,用乳酸表示,K=0.090;F为测试样品稀释倍数;V1为NaOH滴定48 h发酵液消耗的体积,mL;V2为NaOH滴定24 h发酵液消耗的体积,mL;V3为待测发酵液的体积[12],mL。
1.3.8 数据处理
每个实验重复三次,采用SPSS 16.0进行数据处理,并用GraphPad Prism 5软件作图。
2 结果与分析
2.1 菌株的初筛与鉴定
从MRS培养基上挑取形态不同的单菌落于新的固体培养基上,共分离得到形态不同的9株菌株。革兰氏染色结果显示,9株菌株均为革兰氏阳性菌,其形态特征及分子生物学鉴定结果见表1。由表1可知,在9株菌中,菌株B4、B6、B7菌落较小,其余菌落较大;菌株B4、B5、B7、B8表面有突起,其余均无突起;从菌落颜色看,菌株B1、B2、B3、B4为白色,菌株B5、B9为乳白色,菌株B6、B7、B8为淡黄色。将9株菌株的16S rDNA序列提交至NCBI GenBank数据库进行BLAST比对,初步判定菌株B1、B2、B3为鲁梅利杆菌属苏旺氏杆菌(Rummeliibacillus suwonensis)、菌株B4和B7为干酪乳杆菌(Lactobacillus casei)、菌株B5为芽孢杆菌属(Bacillus)、菌株B6为副干酪乳杆菌(L.paracasei)、菌株B8为巴氏醋杆菌(Acetobacter pasteurianus)、菌株B9为植物乳杆菌(L.plantarum)。
表1 9株菌株菌落形态特征及分子生物学鉴定结果
Table 1 Colony morphological characteristics and molecular biological identification results of 9 strains

根据文献报道,鲁梅利杆菌属(Rummeliibacillus)是2009年定义的菌属,目前关于该菌属菌株的研究还很少[13]。已报道的研究表明,Rummeliibacillus stabekisii可作为饲料添加剂提高罗非鱼的生长和健康状况[14];干酪乳杆菌(Lactobacillus casei)被广泛应用于酸奶、芝士、乳制品的生产中[15],且具有调节肠道菌群数量[16]、预防肿瘤[17]等益生功能;芽孢杆菌属(Bacillus)的菌株在新型微生态制剂产品的研发[18]和净化养殖水体[19]中起到重要作用;副干酪乳杆菌(L.paracasei)广泛应用于奶酪、泡菜等发酵食品的生产中,能增加干酪产品中游离氨基酸的数量,提高产品质量[20],还具有抑菌[21-22]、抗肿瘤[23-24]等功能;巴氏醋杆菌(A.pasteurianus)被广泛应用于醋酸发酵[25],是多国食醋酿造的主要菌株之一[26];植物乳杆菌(L.plantarum)被大量应用于发酵产品中,并具有降低胆固醇[27]、降血糖[28]、抗菌消炎[29]、提高人体免疫力[30]等益生功能。鉴于以上菌株潜在的生理功能和应用潜能,后续对它们开展了一系列性质研究。
2.2 菌株的耐酸能力分析
益生菌必须进入人体的胃肠道才能发挥其益生功能,在从口腔到人体肠道的过程中益生菌需要耐受胃部的低pH环境[31],所以,对酸的耐受是衡量优良益生菌的重要指标。根据食物在胃中的停留时间[32],把菌株在不同pH下的MRS培养基中培养4 h,随后进行活菌计数以计算其存活率。9株益生菌在pH为2、3、4条件下的存活率结果见图1。

图1 9株菌株在pH 2、3、4条件下的活菌存活率
Fig.1 Survival rates of nine strains under pH 2,3 and 4
由图1可知,除菌株B1、B2以外,其余菌株的存活率均随着pH的降低而降低。但是,在pH为2、3、4的酸度下孵育4 h后,菌株B1、B2、B3、B4、B6、B7、B9的存活率仍均>60%,其中菌株B1、B2、B4、B6、B9在pH=2时的存活率>70%,耐酸能力较强。其中,菌株B1尤为突出,在pH=2时的存活率为100%。综合看来,菌株B1、B2、B4、B9的耐酸性能较好。为进一步探究耐酸能力较好的菌株B1、B2、B4、B9的耐酸性能,将pH降低到1.0和1.5,再次进行了耐酸实验,结果见图2。
由图2可知,菌株B2和B4在pH=1.0、pH=1.5的酸度下孵育4 h后,仍然表现出了50%以上的存活率。而菌株B1、B9则表现出了更好的耐酸性能,在pH=1.0、pH=1.5的酸度下孵育4 h后,菌株B1的存活率分别为(93.69±2.25)%和(95.57±3.07)%、菌株B9的存活率分别为(87.83±2.00)%和(88.28±0.83)%。目前已报道了大量关于菌株耐酸能力的研究,但这些研究所选取的酸胁迫条件主要集中在pH=2.0及以上,对于菌株在pH=2.0以下的耐酸能力的研究还很少。在已有的报道中,耐酸能力较强的益生菌为韩墨等[30]从内蒙古传统酸奶中分离出的鼠李糖乳杆菌217-3,该菌在pH=1.5的酸度下孵育4 h后的存活率为72%,仍低于本研究中菌株B1、B9在相同实验条件下的存活率。因此,综合来说,菌株B1、B9具有更高的耐酸能力,可以作为具有潜在益生特性的耐酸菌株丰富菌株库。

图2 菌株B1、B2、B4及B9在pH 1.0、1.5条件下的活菌存活率
Fig.2 Survival rates of strain B1,B2,B4 and B9 under conditions of pH 1.0 and 1.5
2.3 菌株的耐胆盐能力分析
胆盐具有抑菌功能,适应人体小肠中的胆盐胁迫是益生菌发挥益生功能的重要前提[31],所以,对胆盐的耐受也是衡量优良益生菌的重要指标。根据食物在胃中的停留时间[32],把菌株在不同胆盐浓度的MRS培养基中培养4h,随后,通过计算菌株的存活率表征它们的耐胆盐能力。9株益生菌在胆盐浓度0.3%和0.5%下的耐胆盐能力测试结果见图3。
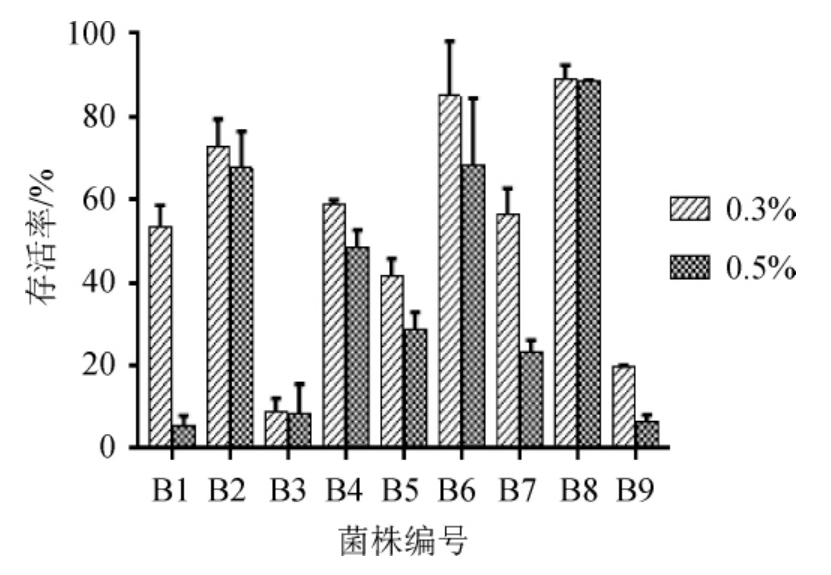
图3 9株菌株在胆盐浓度为0.3%、0.5%条件下的活菌存活率
Fig.3 Survival rates of nine strains with bile salt concentration of 0.3%and 0.5%
由图3可知,与胆盐浓度0.3%相比,在0.5%的胆盐浓度下菌株的存活率有所下降。在胆盐浓度为0.5%的条件下孵育4 h后,菌株B2、B6、B8的活菌存活率仍>65%,分别为(67.59±8.82)%、(68.33±16.07)%、(88.56±0.33)%,表明菌株B2、B6、B8的胆盐耐受能力相对较好。
为进一步探究耐胆盐能力较好的菌株B2、B6、B8的耐胆盐性能,将胆盐浓度增加至1.0%、1.5%,再次进行了耐胆盐实验,结果见图4。由图4可知,菌株B2 在胆盐浓度为1.0%和1.5%的条件下孵育4 h后,仍表现出50%以上的存活率,而菌株B6、B8仍具有65%以上的存活率。其中,在胆盐浓度为1.0%、1.5%的条件下孵育4 h后,菌株B6和B8的存活率分别为(67.22±7.51)%、(72.22±4.81)%和(82.91±1.91)%、(81.74±1.52)%。因此,菌株B8表现出最强的胆盐耐受能力。
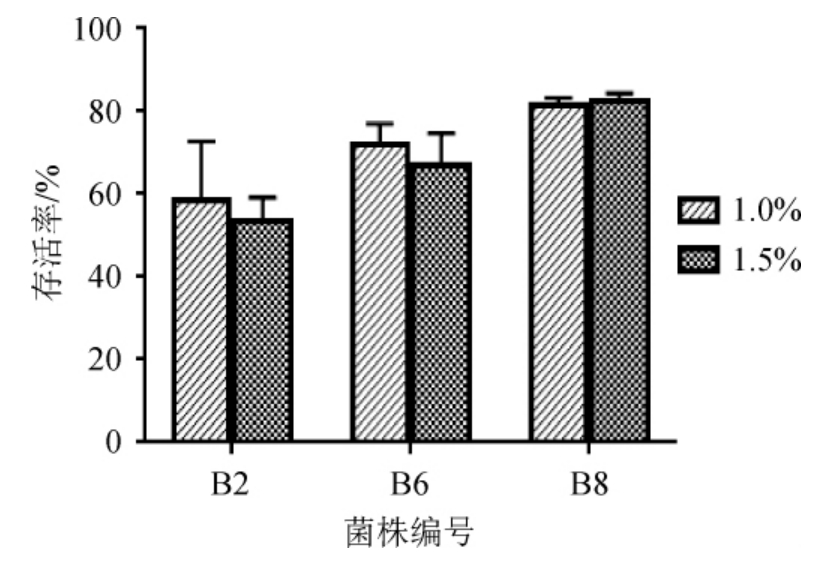
图4 菌株B2、B6及B8在胆盐浓度为1.0%、1.5%条件下的活菌存活率
Fig.4 Survival rates of the strain B2,B6 and B8 with bile salt concentration of 1.0% and 1.5%
综合以上结果,菌株B1、B2、B4和B9的耐酸能力为菌株B1>B9>B4>B2,菌株B2、B6和B8的耐胆盐能力为B8>B6>B2。考虑到菌株B2呈现出相对较好的耐酸及耐胆盐能力,而菌株B8的耐酸能力远远低于其他菌株(图1),因此,选取菌株B1、B2、B6、B9这4株菌株作为后续益生特性研究的出发菌株。
2.4 益生特性研究
2.4.1 产酶能力分析
产淀粉酶、蛋白酶的益生菌,以一定的活性进入到肠道,无疑可以起到帮助动物消化的作用,因此,以筛选出来的耐酸耐胆盐能力较好的4株菌株作为出发菌株,测定了其产酶能力,结果见表2。由表2可知,4株菌株均具有产淀粉酶的能力,但是均不能产生蛋白酶。4株菌株的产淀粉酶能力为菌株B6>B2>B9>B1。
表2 4株菌分别在淀粉及干酪素培养基上产生酶解圈直径大小比较
Table 2 Comparison of diameters of enzymatic hydrolysis bands of four strains produced on starch and casein medium

2.4.2 DPPH自由基清除能力分析
DPPH自由基是一种很稳定的自由基,测定益生菌对DPPH自由基的清除率,可以反映益生菌的抗氧化能力[9]。以筛选出来的4株菌株作为出发菌株,测定其DPPH自由基的清除率,结果见图5。由图5可知,4株菌株均具有较强的DPPH自由基清除能力,除菌株B2外,菌株B1、B6、B9的DPPH自由基清除率均>80%。根据文献报道,现有的乳酸菌DPPH自由基清除率最大值在50%左右[9-11],姚杰玢等[7]对8株乳酸菌进行DPPH自由基清除特性研究,发现乳酸菌R36的DPPH自由基清除率达(51.09±0.11)%;黄玉军等[9]对分离自江苏如皋长寿村人群肠道的6株乳酸菌进行DPPH自由基清除特性研究,发现乳酸菌E2的DPPH自由基清除率达(58.63±0.01)%,均低于本研究中菌株B1、B6、B9的清除率。所以菌株B1、B6、B9在DPPH自由基清除能力方面具有很高的应用与研究价值。
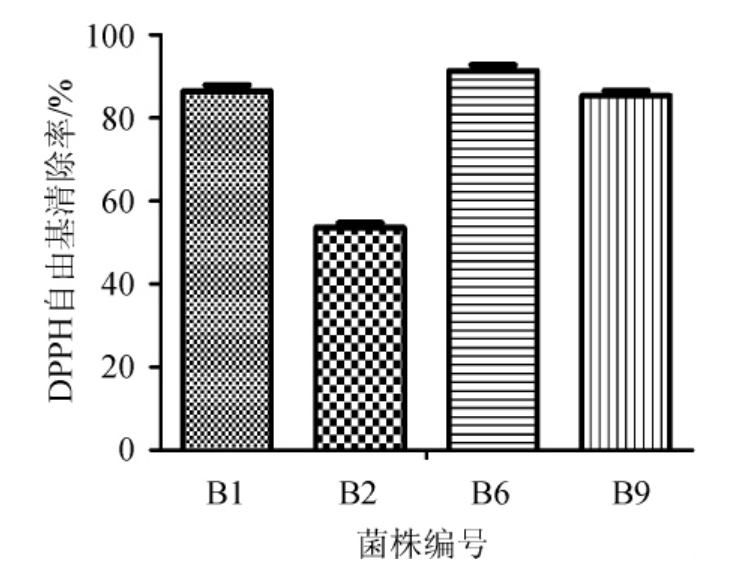
图5 4株菌株对DPPH自由基清除率的比较
Fig.5 Comparison of scavenging rates of DPPH free radicals by four strains
2.4.3 产酸能力分析
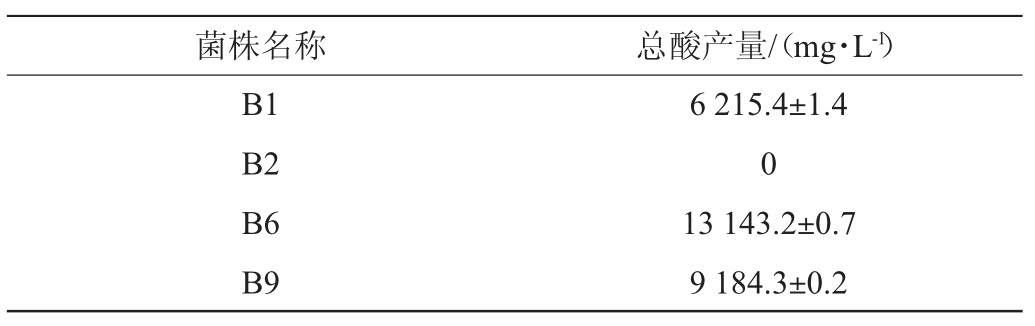
产酸能力是菌株活力的重要体现[31],以筛选出来的4株菌株作为出发菌株,测定其24 h内的总酸(以乳酸计)产量,结果见表3。由表3可知,在4株菌株中,菌株B1、B6、B9在发酵过程中均可产酸,且24 h内菌株B6的产酸能力最强,达13 143.2 mg/L,菌株B2不产酸。其中植物乳杆菌B9的总酸(以乳酸计)产量高于宫路路等[32]筛选出的乳酸产量为4 752.51 mg/L的植物乳杆菌。
表3 4株菌株的产酸量
Table 3 Acid production of four strains
综合4株菌株的产酶、DPPH自由基清除率及产酸能力,认为副干酪乳杆菌B6在这3个方面均优于其他3株菌株,所以副干酪乳杆菌B6是该研究范围内在益生特性研究方面确定的最佳益生菌株。
3 结论
本研究从13 份农用益生菌剂、土法发酵制备的酵素液及表层菌膜样品中分离筛选出9株益生菌,并对其耐酸、耐胆盐能力进行了比较分析。菌株B1对酸性环境的耐受能力最强,在pH为1.0、1.5条件下孵育4 h后的存活率分别为(93.69±2.25)%、(95.57±3.07)%,是目前报道的最高水平;菌株B8对胆盐环境的耐受能力最强,在胆盐浓度为1.0%、1.5%的条件下孵育4 h后的存活率分别为(82.91±1.91)%、(81.74±1.52)%。通过耐酸、耐胆盐能力的综合分析筛选出了菌株B1、B2、B6、B9四株优良菌株进行进一步的益生特性研究,主要包括:产酶能力、DPPH自由基清除能力及产酸能力。结果显示,副干酪乳杆菌B6在产酶、DPPH自由基清除及产酸三个方面均优于其他三株菌株,是确定的最佳益生菌株。副干酪乳杆菌B6具有较好的耐酸耐胆盐能力和优良的益生特性,有良好的应用和研究价值,可作为优良菌株进行下一步的研究与开发。
[1]谢明勇,熊涛,关倩倩.益生菌发酵果蔬关键技术研究进展[J].中国食品学报,2014,14(10):1-9.
[2]郭夏蕾,张健,杨贞耐.植物乳杆菌耐受口腔不良环境及其抑菌特性研究[J].食品工业科技,2017,38(2):215-220.
[3]张振宇,杨海英,詹梦涛,等.云南传统腌制食品可培养乳酸菌多样性及其发酵特性研究[J].中国酿造,2020,39(4):53-55.
[4]MANN G V.A factor in yogurt which lowers cholesteremia in man[J].Atherosclerosis,1977,26(3):335-340.
[5]刘宇,孟祥晨.乳酸菌胞外多糖及其抗肿瘤活性[J].中国乳品工业,2008(1):39-43.
[6]王豪,郭本恒,王荫榆,等.益生菌潜在的抗衰老作用[J].中国微生态学杂志,2009,21(4):374-379.
[7]姚杰玢,郭云霞,郝庆红,等.8 株乳酸菌的体外抗氧化能力[J].江苏农业科学,2015,43(5):295-297.
[8]贺珊珊,鲍志宁,林伟锋,等.降胆固醇和耐酸耐胆盐益生菌的筛选研究[J].现代食品科技,2019,35(8):198-206.
[9]黄玉军,刘冬,赵兰凤,等.6 株人源乳酸菌体外抗氧化活性的比较[J].现代食品科技,2013,29(7):1518-1522,1532.
[10]佟梓沂,孙秀宇,王冰,等.自然发酵酸浆中一株高产酸菌的分离与鉴定[J].食品工业科技,2019,40(9):105-108,114.
[11]李敏.夏冬两季食醋微生物群落演替特征及其特征微生物研究[D].太原:太原理工大学,2019.
[12]TAN H Y,CHEN S W,HU S Y.Improvements in the growth performance,immunity,disease resistance,and gut microbiota by the probiotic Rummeliibacillus stabekisii in Nile tilapia(Oreochromis niloticus)[J].Fish Shellfish Immunol,2019,92:265-275.
[13]赵雪婷.人源干酪乳杆菌的筛选及其益生性能的研究[D].南昌:南昌大学,2019.
[14]刘媛媛,解林奇,吴栋,等.壳寡糖与干酪乳杆菌对断奶仔猪生长性能、血清抗氧化酶活性及肠道微生物菌群结构的影响[J].饲料工业,2019,40(24):25-31.
[15]TAKAHASHI T,KUSHIRO A,NOMOTO K,et al.Antitumor effects of the intravesical instillation of heat killed cells of the Lactobacillus casei strain shirota on the murine orthotopic bladder tumor MBT-2[J].J Urology,2001,166(6):2506-2511.
[16]姚峻,张文举,刘孟健,等.高活性抗菌、抗逆芽孢杆菌的筛选及其紫外诱变育种[J].饲料工业,2019,40(23):51-56.
[17]吴星.益生菌的筛选及其对水质的影响[D].大连:大连工业大学,2015.
[18]GARDINER G,ROSS R,COLLINS J,et al.Development of a probiotic cheddar cheese containing human-derived Lactobacillus paracasei strains[J].Appl Environ Microbiol,1998,64(6):2192-2199.
[19]DENG K,CHEN T,WU Q,et al.In vitro and in vivo examination of anticolonization of pathogens by Lactobacillus paracasei FJ861111.1[J]. J Dairy Sci,2015,98(10):6759-6766.
[20]DANZA A,LUCERA A,LAVERMICOCCA P,et al.Tuna burgers preserved by the selected Lactobacillus paracasei IMPC 4.1 strain[J]. Food Bioproc Technol,2018,11(9):1651-1661.
[21]RAJOKA M S R,ZHAO H,LU Y,et al.Anticancer potential against cervix cancer(HeLa)cell line of probiotic Lactobacillus casei and Lactobacillus paracasei strains isolated from human breast milk[J].Food Funct,2018,9(5):2705-2715.
[22]CHONDROU P,KARAPETSAS A,KIOUSI D,et al.Lactobacillus paracasei K5 displays adhesion,antiproliferative activity and apoptotic effects in human colon cancer cells[J].Benefl Microb,2018,9(6):975-983.
[23]殷海松,张仁宽,常燕钢,等.巴氏醋杆菌TCA 循环代谢对醋酸发酵的影响[J].食品科学,2017,38(2):82-86.
[24]姚洪礼.醋酸高产菌株选育及其代谢调控研究[D].合肥:合肥工业大学,2018.
[25]LIU D M,GUO J,ZENG X A,et al.The probiotic role of Lactobaci plantarum in reducing risks associated with cardiovascular disease[J]. Int J Food Sci Technol,2017,52(1):127-136.
[26]WAN Y J,SHI H F,XU R,et al.Origin of hypoglycemic benefits of probiotic-fermented carrot pulp[J].J Agr Food Chem,2019,67(3):895-904.
[27]GHEZEL C,RUSSO P,ARENA M P,et al.Evaluating the probiotic potential of Lactobacillus plantarum strains from algerian infant feces:towards the design of probiotic starter cultures tailored for developing countries[J]. Probiot Antimicrob Prot,2019,11(1):113-123.
[28]VAN BAARLEN P,TROOST F J,VAN HEMERT S,et al.Differential NF-κB pathways induction by Lactobacillus plantarum in the duodenum of healthy humans correlating with immune tolerance[J]. P Natl Acad Sci,2009,106(7):2371-2376.
[29]彭灯水,颜正财,汤春梅,等.泡菜优良发酵乳酸菌耐受特性研究[J].食品与发酵科技,2010,46(4):50-52,55.
[30]韩墨,王燕,杨志鹏,等.内蒙古传统酸奶乳酸菌的筛选及体外益生效果评价[J].食品研究与开发,2018,39(1):152-156.
[31]蒙月月,陆婧婧,占萌,等.植物乳杆菌KLDS 1.0318 产酸、耐酸、耐胆盐能力及其免疫特性研究[J].食品工业科技,2018,39(15):70-76.
[32]宫路路,龚福明,李晓然,等.豆豉中高产乳酸乳酸菌的筛选及其产酸条件的优化研究[J].中国微生态学杂志,2013,25(5):516-520.