酿酒酵母(Saccharomyces cerevisiae)因其具有易于培养、安全可靠、代谢产物的经济价值和使用附加值高等优点,长期以来一直是生物工业发展的主力军[1-2]。它在工业上的能源开发、医药研究、食品生产以及环境保护等领域为人类做出了许多突出的贡献[3-5]。通常情况下,S.cerevisiae单倍体菌株是二倍体菌株在缺乏碳源和氮源的环境中,通过减数分裂形成的[6]。
S.cerevisiae单倍体与二倍体菌株相比,具有以下4个方面的优势:一是它们的基因组简单并且稳定,利于学科研究及工业化生产运用[7];二是它们的比表面积大,代谢效率更高;三是它们普遍具有明显的代谢特征,多被用于一些特殊产物的工业发酵生产[8-9];四是它们的环境耐受能力极强,在一些营养不良或一些极端的环境中较二倍体菌株享有优势[10-11]。所以近年来,单倍体菌株的制备及代谢潜能开发,成为了工业生产上的一个热门研究领域[12-13]。与此同时,根据S.cerevisiae自身交配型位点MAT基因座携带信息的不同,单倍体菌株又被分为MAT-a和MAT-α两种不同的细胞配型[14]。作为S.cerevisiae一种原始的性别分化现象,两种不同细胞配型也经常被用作细胞谱系、基因沉默和基因组重排分析研究的重要模型[15]。由于在减数分裂过程中非同源染色体会重新组合,同源染色体间会发生部分交换,所以也就导致同一母细胞分裂出的单倍体个体间出现基因型及表型的差异[16-17]。目前对于单倍体酿酒酵母菌株的制备主要分为两种,一种是通过基因工程手段对二倍体S.cerevisiae进行HO基因(调控交配型位点MAT基因座的信息表达)的修饰,从而间接获得单倍体菌株[18-19],另一种是对二倍体S.cerevisiae的产孢条件进行优化,通过诱导二倍体菌株进行减数分裂产孢,从而制备单倍体菌株。与第一种方法制备的单倍体菌株不同的是,第二种方法获得的单倍体菌株能够与S.cerevisiae标准单倍体菌株W303(MAT-α)一样,进入一种保护性的并且不分裂的静止状态[20],使其能够在非逆境状态下以单倍体的形式稳定的进行繁殖,并且由于它们的HO基因未被修饰,所以也有利于其代谢潜能的开发及利用。
本研究通过随机孢子分离[21]、MAT-聚合酶链式反应(polymerase chain reaction,PCR)[22]、倍型杂交实验[23]和连续传代培养[24]等方法对二倍体S.cerevisiae W5(MATa/α)进行单倍体菌株的分离鉴定和制备。并通过实验分析其代谢水平上的产物变化及代谢产物关键酶的酶活力特性。最终获得一株遗传稳定性高且代谢特征明显的单倍体S.cerevisiae Z5(MAT-α),为实验室S.cerevisiae W5菌株的单倍体制备提供了研究经验,并且也对该菌株的代谢潜能开发提供了新的研究思路。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
酿酒酵母(Saccharomyces cerevisiae)W5(MATa/α):由黑龙江大学微生物重点实验室保藏,用于单倍体菌株的分离制备;S.cerevisiae W303-1A(MAT-α):由暨南大学刘寰宇教授和江南大学张梁教授馈赠,用于单倍体菌株的鉴定[23];S.cerevisiae Z5(MAT-α):由实验自行筛选,并由黑龙江大学微生物重点实验室保藏。
1.1.2 化学试剂
葡萄糖、蛋白胨、酵母提取物、琼脂粉(均为生化试剂)、(NH4)2SO4、K2HPO4、ZnSO4·7H2O(均为分析纯):北京索莱宝科技有限公司;蜗牛酶(3 000 U):上海蓝季科技有限公司;Tris-HCl、β-巯基乙醇(β-mercaptoethanol)、TritonX-100、二硫苏糖醇:上海北诺生物科技有限公司;孔雀石绿、番红O、生物素(biotin)、肌醇(inositol)、琥珀酸(succinic acid):天津市光复精细化工研究所;Taq脱氧核糖核酸(deoxyribonucleic acid,DNA)polymerase和脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)Mixture:日 本TaKaRa公司;丙酮酸脱羧酶(pyruvate decarboxylase,PDC)、乙醇脱氢酶(alcohol dehydrogenase,ADH)、α-乙酰乳酸脱羧酶(α-acetolactate synthase,ILV2)、2,3-丁二醇脱氢酶(2,3-butanediol dehydrogenase,BDH1)的酶活力试剂盒和二喹啉甲酸(bicinchoninic acid,BCA)蛋白法含量测试盒:苏州(科铭)生物技术有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)琼脂培养基[18]:蛋白胨20 g/L,酵母提取物10 g/L,葡萄糖20 g/L,琼脂粉20 g/L,蒸馏水定容至1 L,用于S.cerevisiae W5的培养。
改良YPD培养基:葡萄糖100 g/L,蛋白胨3 g/L,酵母提取物8 g/L,ZnSO4·7H2O 25 mg/L,琼脂粉20 g/L,蒸馏水定容至1 L,用于产孢前S.cerevisiae W5的培养。
改良SPM产孢培养基[25]:酵母粉2.5 g/L,KAc 10 g/L,KH2PO4 1 g/L,琼脂粉20 g/L,琥珀酸23.6 g/L,生物素2 μg/L,ZnSO4·7H2O 0.125 g/L,肌醇100 μg/L,蒸馏水定容至1 L,pH 6.0,用于S.cerevisiae W5的产孢。
葡萄糖发酵培养基:葡萄糖80 g/L,蛋白胨20 g/L,无氨基酵母氮源(yeast nitrogen base without amino acid,YNB)3.4 g/L,KH2PO4 11.8 g/L,K2HPO4 3 g/L,(NH4)2SO4 10 g/L,蒸馏水定容至1 L,pH 5.0,用于S.cerevisiae W5和Z5的葡萄糖摇瓶发酵。
以上培养基均采用108 ℃高温湿热灭菌20 min,除产孢培养基与发酵培养基外,其余培养基的pH值均自然。
1.2 仪器与设备
LC-20A型高效液相色谱(high performance liquid chromatography,HPLC):岛津国际贸易上海有限公司;BX43型OLYMPUS的正置荧光显微镜:奥林巴斯(中国)有限公司;DHP-9272型电热恒温培养箱:上海一恒科学仪器有限公司;BACKMAN台式离心机:美国Beckman Coulter公司;DK-S24型电热恒温水浴锅:上海精宏实验设备有限公司;SANYO蒸汽压力灭菌锅:日本三洋电子有限公司;Alphal mager型凝胶成像系统:美国Protein Simple 公司;SW-CJ型生物安全柜:苏州安泰空气技术有限公司。
1.3 方法
1.3.1 单倍体菌株的制备
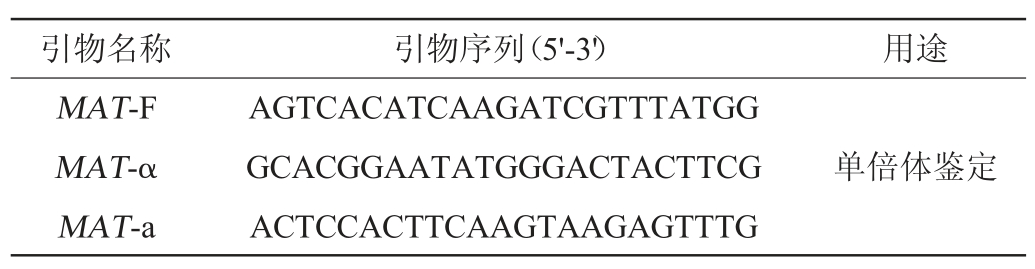
实验室前期已经摸索出了一套行之有效的单倍体菌株的制备方法[26],但为满足本次实验的需要,在先前实验方法的基础上做了进一步的优化:将产孢培养周期优化为8 d,以7 000 r/min对处理后的孢子菌悬液进行离心处理,在破壁结束后改用12 000 r/min离心1 min收集菌体,加入500 μL 0.5% TritonX-100和5 μL 30%二硫苏糖醇(dithiothreitol,DTT)重悬菌液,60 ℃水浴10 min。单倍体菌株鉴定和命名主要利用MAT-PCR法[23],PCR扩增体系:2.5 μL Mg2+10×TaqBuffer,2μL2.5mmol/LdNTP,1.0μL的各引物(表1),1.0 μL模板DNA,16 μL双蒸水(ddH2O),0.5 μL 2.5 U/μL Taq DNA polymerase。PCR扩增程序:94 ℃变性5 min;然后94 ℃、30 s,55 ℃、30 s,72 ℃、30 s进行30个循环;72 ℃再延伸10 min。鉴定完毕的单倍体菌株通过连续传代培养5代的方式进行遗传稳定性分析,最终通过与标准单倍体菌株W303-1A(MAT-α)以1∶1的比例在YPD培养基上进行杂交实验,并通过菌株的形态学观察再次验证其配型是否发生改变[24]。
表1 验证单倍体的引物
Table 1 PCR primers used to identify haploid
1.3.2 单倍体菌株的代谢水平分析
将S.cerevisiae Z5与W5分别接种到液体YPD培养基中,30 ℃、140 r/min培养至对数生长期,以10%(V/V)接种量分别转接至葡萄糖发酵培养基中,30 ℃、150 r/min培养72 h,每12 h取3 mL菌液测OD600nm值和pH值。另外取样1 mL菌液稀释100倍后12 000 r/min离心10 min,使用HPX-87H色谱柱,以0.005 mol/L硫酸为流动相,在示差检测器温度为40 ℃,色谱柱温65 ℃条件下,控制流速为0.8 mL/min,检出时间为20 min,利用高效液相色谱(HPLC)检测葡萄糖、乙醇、甘油、乙酸和乙偶姻的质量浓度,并通过各物质的标准曲线计算出二者代谢产物的数据,最后对所得数据进行对比分析。
1.3.3 单倍体菌株的关键酶活性检测
由于样品的可溶性蛋白含量常用于关键酶活性测定,实验首先采用二喹啉甲酸(BCA)法[27],每隔12 h取样进行两菌株胞内胞外的总蛋白含量(extracellular extracellular protein content,Cpr)的测定,具体方法参照BCA法蛋白含量测试盒说明书。其次再利用丙酮酸脱羧酶、乙醇脱氢酶、α-乙酰乳酸脱羧酶和2,3-丁二醇脱氢酶测试盒,参照说明书分别测定两菌株代谢过程中PDC、ADH、ILV2和BDH1四个关键酶活力的变化情况。
2 结果与分析
2.1 单倍体菌株制备
S.cerevisiae W5(MATa/α)在改良SPM产孢培养基上培养8 d后,此时有大量的孢子产生(图1A)。用30 mg/mL蜗牛酶液对产生孢子的菌体破壁处理2 h,稀释涂布在YPD固体培养基上,培养3 d即可得到大量的单菌落(图1B)。随后利用随机孢子分析法挑取单菌落进行纯化培养,并运用MAT-PCR(图1C),对实验获得的单倍体菌株进行PCR验证(404 bp处有条带的为MAT-α型,544 bp处有条带的为MAT-a型),最终通过连续5代的传代培养后,得到一株代谢及遗传稳定性较高的MAT-α型单倍体菌株,将其命名为S.cerevisiae Z5(MAT-α)。由于该菌株与标准单倍体菌株W303-1A(MAT-α)属于同一种细胞配型的单倍体菌株,所以二者不会产生交配形成异宗配合的二倍体细胞(图1D),随后将该菌株与二倍体S.cerevisiae W5(MATa/α)进行显微镜下的形态观察(图1E1-2/F1-2):S.cerevisiae Z5(MAT-α)细胞呈圆球形、细胞小(3~6 μm)、菌落直径为0.2~0.3 cm、易聚集成团、沿着轴向方式出芽、母细胞与出芽紧密相连;而二倍体S.cerevisiae W5(MATa/α)细胞呈椭圆形、较大(5~10 μm)、菌落直径为0.4~0.6 cm、分散生长快、沿极向方式连续出芽、且出芽在母细胞的任意一端;但二者菌落都为乳白色、呈隆起状、湿润、边缘光滑。该观测结果与KASSIR Y等[17]观察到的二倍体S.cerevisiae比单倍体菌株个体更大,更呈椭圆形这一实验结果一致。
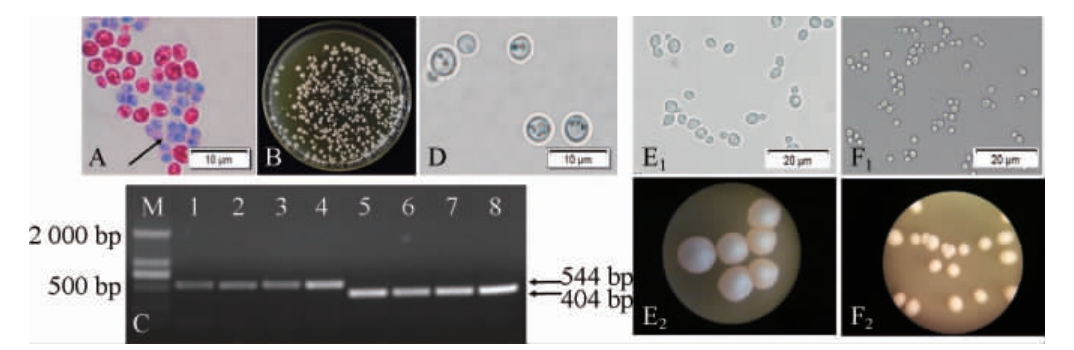
图1 酿酒酵母W5单倍体的制备结果
Fig.1 Preparation results of Saccharomyces cerevisiae W5 haploid
A:菌株W5在产孢培养基上的孔雀石绿-番红产孢染色结果(1 600×),箭头指向为子囊孢子;B:菌株W5子囊孢子破壁后菌落形态;C:菌株W5单倍体PCR鉴定结果(M:DL2000 DNA Marker;1~4:MAT-a型单倍体菌株;5~8:MAT-α型单倍体菌株);D:单倍体Z5(MAT-α)与W303-1A(MAT-α)杂交形态观察结果(1 600×);E1/F1:W5和Z5的显微形态观察(640×);E2/F2:菌株W5和菌株Z5的菌落形态(10×)。
2.2 单倍体菌株代谢水平分析结果
将S.cerevisiae Z5(MAT-α)与S.cerevisiae W5(MATa/α)分别按5%接种量接种到摇瓶葡萄糖发酵培养基中进行发酵,每12 h取一次样进行HPLC测定,结果见图2。由图2可知,随着菌体的大量繁殖,二者的葡萄糖消耗量均不断增加,菌株Z5生长速率略低于W5,但二者差异不显著(P>0.05)。与此同时,菌株Z5的乙醇含量在36 h时达到最大值为(37.66±1.34)g/L,较菌株W5在24 h时达到的最大值(48.65±2.39)g/L下降了22.59%(图2A)。其他支路产物的变化却有所不同(图2B):在发酵前24 h这段期间,菌株Z5的甘油质量浓度均较菌株W5低,但是在发酵第36小时时,菌株Z5的甘油含量为(4.44±0.06)g/L较菌株W5[(2.64±0.07)g/L]提高了40.54%(P<0.05),随后二者的甘油质量浓度又趋于一致。与此同时,菌株Z5的乙酸和乙偶姻质量浓度也均在36 h时达到最大值,分别为(5.10±0.10)g/L和(0.30±0.01)g/L,较菌株W5在24 h时达到的最大值(3.23±0.15)g/L和(0.18±0.01)g/L分别提高了57.89%和66.67%(P<0.05),而二者的OD600nm值差异却不显著(P>0.05)。
理论上在发酵24 h时S.cerevisiae的乙酸产量显著升高,必定会造成发酵液中的pH值迅速下降,但在整个发酵过程中二者的pH值变化并不显著(P>0.05)。原因在于S.cerevisiae在生长代谢过程中,有维持细胞酸碱平衡的物质产生,如2,3-丁二醇(2,3-butanediol,2,3-BD),而实验中并未检测到2,3-BD的产生,但却检测到了2,3-BD的前体物质乙偶姻的变化,分析可能是由于菌株中积累的2,3-BD被用来中和酸性物质,从而维持了细胞内的酸碱平衡,但由于积累量不高致使HPLC并未检测到。而甘油的浓度变化可能是由于菌株的乙酸代谢能力的上升所造成的,此时甘油被用于维持细胞内外的渗透压的平衡,由于菌株Z5的生长速率较菌株W5慢,所以造成了到第36小时时,菌株Z5的甘油浓度较菌株W5提高了40.54%。与此同时,将该菌株的发酵代谢特性与实验室先前获得的MAT-a型单倍体菌株H14进行了比较:在相同的发酵条件下,菌株Z5在发酵第36小时时,才达到最大乙醇代谢质量浓度(37.66±1.34)g/L与菌株H14在发酵第30小时时最大乙醇代谢质量浓度(40.46±1.06)g/L相比,差异显著(P<0.05),且时间上有明显的延迟。但是菌株Z5的乙酸和乙偶姻的代谢强度明显比菌株H14高,存在着较大的代谢差异性[26]。分析这一结果可能是由于S.cerevisiae二倍体在减数分裂过程中,同源染色体间会发生部分交换后,导致基因的表达量不同所造成的。

图2 酿酒酵母W5和Z5的代谢产物测定结果
Fig.2 Metabolite measurement results of Saccharomyces cerevisiae W5 and Z5
A:葡萄糖、总蛋白、乙醇含量和OD600nm的关系曲线;B:pH、甘油、乙偶姻和乙酸的关系曲线。
2.3 代谢关键酶活性的检测结果
样品的可溶性蛋白含量常用于关键酶活性测定,利用BCA法每隔12 h对两株S.cerevisiae的Cpr进行测定。发现二者的Cpr均呈现出先升高后降低的趋势(图2A),并且在12 h时二者的Cpr均达到最高分别为:菌株W5的(4.76±0.14)g/L和菌株Z5的(4.48±0.02)g/L,最后在36h时菌株W5的Cpr降至(0.82±0.03)g/L,而菌株Z5则在48 h时降至(0.36±0.01)g/L。
由图3可知,S.cerevisiae Z5(MAT-α)与S.cerevisiae W5(MATa/α)的PDC酶活力、ADH酶活力、ILV2酶活力和BDH1酶活力,均呈现先上升后下降的变化趋势。在发酵第36小时时,菌株Z5的PDC酶活力和ADH酶活力达到最大值分别为(0.52±0.01)U/mg和(0.29±0.01)U/mg,与菌株W5[(0.51±0.01)U/mg和(0.33±0.01)U/mg,24 h]相比,PDC酶活力差异不显著(P>0.05),但ADH酶活力明显下调了12.12%(P<0.05)。在发酵60h时,菌株Z5的ILV2酶活力和BDH1酶活力均达到最大值分别为(0.05±0.01)U/mg和(0.04±0.01)U/mg,与菌株W5[(0.04±0.01)U/mg和(0.03±0.01)U/mg]相比,ILV2酶活力显著上调25.0%(P<0.05),BDH1酶活力则显著上调33.33%(P<0.05)。

图3 酿酒酵母W5和Z5的代谢关键酶活性测定结果
Fig.3 Determination results of key enzyme activities of Saccharomyces cerevisiae W5 and Z5
A:丙酮酸脱羧酶酶活力和乙醇脱氢酶酶活力与时间变化曲线;B:α-乙酰乳酸脱羧酶和2,3-丁二醇脱氢酶酶活力与时间变化曲线。
由于S.cerevisiae Z5(MAT-α)的生长速率较S.cerevisiae W5(MATa/α)慢,所以也就造成了二者代谢产物的关键酶酶活力之间存在时间差。菌株Z5的PDC酶活力较W5没有很大的差异,但ADH酶活力却明显下调了12.12%,这一结果为HPLC检测到的菌株Z5乙醇代谢产量较W5低,而乙酸产量却明显上升,提供了有力证据。与此同时,菌株Z5的ILV2酶活力与BDH1酶活力较菌株W5显著上调了25.0%和33.33%,进一步佐证了菌株Z5的乙偶姻产量较菌株W5上升了66.67%这一检测结果,也为2,3-BD存在的可能,提供了数据支撑。分析造成以上结果的原因:由于细胞配型的改变,造成了菌株Z5的发酵性能较原始菌株W5发生了较大的改变,乙醇代谢能力降低,而乙偶姻和乙酸等代谢副产物的合成途径却明显增强,这些代谢副产物的产生,也才使得单倍体菌株较二倍体菌株能够耐受更加严苛的发酵环境[10]。
3 结论
本实验采用随机孢子分析法、MAT-PCR法及连续传代培养等方法,获得了一株理想的,遗传稳定性高且代谢特征明显的单倍体S.cerevisiae Z5(MAT-α)。利用HPLC检测其代谢产物的变化情况,发现S.cerevisiae Z5较二倍体S.cerevisiae W5乙醇最大质量浓度下降了22.59%(P<0.05),而乙酸和乙偶姻的产量却分别提高了57.89%、66.67%(P<0.05)。此外,对其四个代谢产物的关键酶酶活力的检测也进一步佐证了HPLC的检测结果。间接证明了S.cerevisiae倍性的改变在一定程度上对其代谢流向产生了影响,使得菌株Z5乙醇最大质量浓度较W5下降,而使丙酮酸流向乙偶姻(或2,3-BD前体物质)的代谢流向变强。与此同时,由菌株W5分化产生的MAT-α和MAT-a型的单倍体菌株,他们的各自的代谢特征有着很大的不同。
[1]PRADHAN P,SONI N,CHAUDHARY L,et al.Reuse and recycle for the production of bioethanol:"The Green Gold of Future" [J].Minerva Biotecnol,2016,28(3):164-174.
[2]PULIGUNDLA P,SMOGROVICOVA D,MOK C,et al.A review of recent advances in high gravity ethanol fermentation[J].Renew Energ,2019,133:1366-1379.
[3]HAMILTON S R,ZHA D.Progress in yeast glycosylation engineering[J].Methods Mol Biol,2015,1321:73-90.
[4]VERDUYCKT M,VIGNAUD H,BYNENS T,et al.Yeast as a model for Alzheimer's disease:latest studies and advanced strategies[J].Methods Mol Biol,2016,1303:197-215.
[5]YANG L,LAI F,HE L,et al.LI1035,a putative effector secreted by Lawsonia intracellularis,targets the MAPK pathway and regulates actin organization in yeast and mammalian cells[J]. Vet Microbiol,2019,235:127-135.
[6]BOYNTON P J,GREIG D.The ecology and evolution of non-domesticated Saccharomyces species[J].Yeast,2015,31(12):449-462.
[7]JANSEN T,HOFF J W,JOLLY N,et al.Mating of natural Saccharomyces cerevisiae strains for improved glucose fermentation and lignocellulosic inhibitor tolerance[J].Folia Microbiol,2017,63(2):1-14.
[8]TOMITAKA M,TAGUCHI H,FUKUDA K,et al.Isolation and characterization of a mutant recombinant Saccharomyces cerevisiae strain with high efficiency xylose utilization[J].J Biosci Bioeng,2013,116(6):706-715.
[9]BERNARDES J P,STELKENS R B,GREIG D.Heterosis in hybrids within and between yeast species[J].J Evolution Biol,2017,30(3):538-548.
[10]BESSHO K,IWASA Y,DAY T.The evolutionary advantage of haploid versus diploid microbes in nutrient-poor environments[J]. J Theor Biol,2015,383:116-129.
[11]KAHAR P,RIYANTI E I,OTSUKA H,et al.Challenges of non-flocculating Saccharomyces cerevisiae haploid strain against inhibitory chemical complex for ethanol production[J]. Bioresource Technol,2017,245:1436-1446.
[12]LOPANDIC K,PFLIEGLER W P,TIEFENBRUNNER W,et al.Genotypic and phenotypic evolution of yeast interspecies hybrids during highsugar fermentation[J].Appl Microbiol Biot,2016,100(14):6331-6343.
[13]NIKULIN J,KROGERUS K,GIBSON B.Alternative Saccharomyces interspecies hybrid combinations and their potential for low-temperature wort fermentation[J].Yeast,2018,35(1):113-127.
[14]LI H,SHEN Y,WU M,et al.Engineering a wild-type diploid Saccharomyces cerevisiae strain for second-generation bioethanol production[J].Bioresources Bioprocess,2016,3(1):51.
[15]XIE Z X,MITCHELL L A,LIU H M,et al.Rapid and efficient CRISPR/Cas9-based mating-type switching of Saccharomyces cerevisiae[J]. G3-Genes Genom Genet,2018,8(1):173-183.
[16]HANSON S J,WOLFE K H.An evolutionary perspective on yeast matingtype switching[J].Genetics,2017,206(1):9-32.
[17]KASSIR Y,STUART D T.Genetic approaches to study meiosis and meiosis-specific gene expression in Saccharomyces cerevisiae[J]. Meth Mol Biol,2017,1471:1-23.
[18]COI A L,LEGRAS J L,ZARA G,et al.A set of haploid strains available for genetic studies of Saccharomyces cerevisiae flor yeasts[J].Fems Yeast Res,2016,16(6):9.
[19]ALEXANDER W G,PERIS D,PFANNENSTIEL B T,et al.Efficient engineering of marker-free synthetic allotetraploids of Saccharomyces[J].Fungal Genet Biol,2016,89:10-17.
[20]MILES S,LI L H,MELVILLE Z,et al.Ssd1 and the cell wall integrity pathway promote entry,maintenance,and recovery from quiescence in budding yeast[J].Mol Biol Cell,2019,30(17):2205-2217.
[21]TOMITAKA M,TAGUCHI H,MATSUOKA M,et al.Potent L-lactic acid assimilation of the fermentative and heterothallic haploid yeast Saccharomyces cerevisiae NAM34-4C[J].J Biosci Bioeng,2014,117(1):65-70.
[22]HUXLEY C,GREEN E D,DUNHAM I.Rapid assessment of S.cerevisiae mating type by PCR[J].Trends Genet,1990,6(8):236.
[23]AVRAHAMI-MOYAL L,ENGELBERG D,WENGER J W,et al.Turbidostat culture of Saccharomyces cerevisiae W303-1A under selective pressure elicited by ethanol selects for mutations in SSD1 and UTH1[J].Fems Yeast Res,2012,12(5):521-533.
[24]王犁烨,陈新军,卢丕超,等.紫外诱变选育高产酒精及酸的酿酒酵母[J].中国酿造,2019,38(1):104-108.
[25]XU W,WANG J,LI Q.Induction,separation and identification of haploid strains from industrial brewer's yeast[J].Acta Microbiologica Sinica,2015,55(1):22-32.
[26]王长丽,佟天奇,刘文娟,等.酿酒酵母W5 单倍体的制备及其代谢水平分析[J].食品科学,2018,39(8):57-63.