环糊精(cyclodextrin,CD)是由D-吡喃葡萄糖通过α-1,4-糖苷键首尾相连而成的环状低聚糖的总称[1],通常含有6~12个葡萄糖基单元,其中研究得较多的是含有6~8个葡萄糖单元的分子,分别为α-环糊精、β-环糊精、γ-环糊精[2]。其中β-环糊精具有独特分子囊结构[3],该性质近年来在食品领域中得到广泛的开拓与应用,如转化食品的形态、控制食品中香料及香味的挥发释放速度、改善食品的口感等[4]。
在酱油发酵体系中β-环糊精是由β-环糊精葡萄糖基转移酶(β-cyclodextringlycosyltransferase,β-CGTase)作用于原料中的淀粉、糖原等物质产生的。酱油中风味化合物有300多种,大多数成分挥发性高且稳定性差[5-6],β-环糊精能与酱油中的香气成分、维生素、色素等形成相对稳定的复合物,在一定程度上减少其挥发和氧化[7-8],还能够掩盖酱油发酵过程中产生的不快气味,改善酱油的品质,此外它同其他糖类共同构成了酱油的体态和甜味,在一定程度上提高了产品的质量[9]。目前,研究较多的产β-CGTase微生物为芽孢杆菌,如地衣芽孢杆菌(Bacillus licheniformis)[10]、嗜碱芽孢杆菌(Bacillus alcalophilus)、嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)、凝结芽孢杆菌(Bacillus coagulans)[11],而霉菌在这方面的研究较少。米曲霉是酱油生产过程中的重要菌株,该菌生长快较粗放,产酶种类丰富,目前对其的研究也主要集中在果胶酶[12-13]、脂肪酶[14]、蛋白酶[15]、淀粉酶[16]等,鲜有文献报道其产β-CGTase。
本研究从酱醪中筛选出一株产β-CGTase的霉菌,通过形态观察及分子生物学技术对其菌种鉴定,采用单因素及响应面法对其产酶培养条件进行优化,并对其所产β-CGTase的酶学性质进行研究,以此为米曲霉产β-环糊精葡萄糖基转移酶及其在酱油中的应用提供理论基础和科学的指导。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
酱醪样品:山东巧媳妇食品集团有限公司。
1.1.2 培养基
分离培养基[17]:牛肉膏3.0 g/L、蛋白胨5.0 g/L、葡萄糖2.5 g/L、琼脂20 g/L,自然pH,115 ℃灭菌20 min。
筛选培养基[18]:可溶性淀粉10 g/L、蛋白胨5 g/L,酵母膏5 g/L、K2HPO40.2 g/L、MgSO4·7H2O 0.2 g/L、Na2CO30.2 g/L、酚酞0.3 g/L、甲基橙0.1 g/L、琼脂20 g/L,115 ℃灭菌20 min。
种子培养基为马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[19]:200 g马铃薯洗净去皮切碎,加1 000 mL蒸馏水煮沸20 min,纱布过滤,加入20 g葡萄糖充分溶解,115 ℃灭菌20 min。
基础发酵培养基[2]:蛋白胨10 g/L、葡萄糖20 g/L,K2HPO4 0.2 g/L,MgSO4·7H2O 0.2 g/L,自然pH,115 ℃灭菌20 min。
1.1.3 试剂
甲基橙、酚酞、Na2CO3、K2HPO3、MgSO4、淀粉、葡萄糖、环糊精、蔗糖、NH4Cl、(NH4)2SO4、酵母膏、蛋白胨等(均为分析纯):国药集团化学试剂有限公司;2×Taq聚合酶链式反应(polymerase chain reaction,PCR)预混试剂Ⅱ、脱氧核糖核酸(desoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司。
1.2 仪器与设备
MJ-54A高压蒸汽灭菌锅:世得凯仪器设备(上海)有限公司;HH-BLL-600电热恒温培养箱:上海跃进医疗机械厂;HDB-03HD生物显微镜:上海汉德检测技术有限公司;JD200-3电子分析天平:沈阳龙腾电子有限公司;SW-CJ-2FD超净工作台:江苏苏靖集团有限公司;NSK-2102C恒温培养箱:上海苏坤实业有限公司;A200朗基全触屏PCR仪:广州飞迪生物科技有限公司。
1.3 方法
1.3.1 产β-环糊精葡萄糖基转移酶菌株的分离
无菌条件下称取10 g酱醪于100 mL无菌水中,30 ℃振荡培养1 h,梯度稀释后涂布于分离培养基,30 ℃培养72 h,挑选不同形态的霉菌菌落进行划线,直至形成单菌落,将其划线于斜面培养基,4 ℃保存。
1.3.2 产β-环糊精葡萄糖基转移酶菌株的筛选[20]
初筛:将分离得到的菌株接种于筛选培养基上,30 ℃培养2~3 d,观察是否出现淡黄色接近无色的斑点,挑选出产透明圈的菌株。
复筛:将初筛得到的菌株接种到种子培养基中,30 ℃、150 r/min培养24 h,按照1%(V/V)的接种量将种子液接种到基础发酵培养基中,装液量100 mL/250 mL,30 ℃、150 r/min条件下培养72 h,3 000 r/min离心10 min,制取粗酶液,参照文献[11]测定酶活。
1.3.3 高产β-环糊精葡萄糖基转移酶菌株的鉴定
形态观察:将筛选得到的菌株接种于分离培养基,30 ℃培养72 h,观察菌落形态的大小,菌丝的高矮,孢子颜色等状况,同时制水浸片观察菌丝体有无横隔、分生孢子梗、顶囊及分生孢子着生状况等。
分子生物学鉴定:采用DNA提取试剂盒对筛选菌株的DNA进行提取,以其为模板,通过引物ITS4(5'-TCCTCCGCTTATTGATATGC-3')和ITS5(5'-GGAAGTAAAAGTCG TAACAAGG-3')对筛选菌株的5.8 ITS rDNA基因序列进行PCR扩增。PCR扩增体系:模板2 μg,引物ITS4(10 μmol/L)2 μL,引物ITS5(10 μmol/L)2 μL,2×Taq Mix 25 μL,加双蒸水(ddH2O)补充至50 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性50 s,55 ℃退火50 s,72 ℃延伸50 s,共32个循环;72 ℃再延伸10 min。PCR扩增产物经纯化后委托铂尚生物技术(上海)有限公司进行测序,测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行BLAST同源性搜索,选同源性较高的模式菌株的5.8 ITS rDNA基因序列,使用MEGA 7.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.4 菌株D5产β-环糊精葡萄糖基转移酶培养基组成优化
(1)单因素试验
在基础发酵培养基的基础上,采用单因素轮换法,依次考察碳源种类(淀粉、环糊精、葡萄糖、蔗糖)及添加量(0.1%、0.5%、1.0%、1.5%、2.0%、2.5%)、氮源种类(蛋白胨、酵母膏、硫酸铵、氯化铵)及添加量(0.25%、0.50%、0.75%、1.00%、1.25%、1.50%、1.75%、2.00%)、Na2CO3添加量(0.05%、0.15%、0.25%、0.35%、0.45%、0.55%、0.65%)对菌株D5产β-环糊精葡萄糖基转移酶的影响。
(2)响应面试验
在单因素试验的基础上进行响应面优化试验,以β-环糊精葡萄糖基转移酶活力(Y)为响应值,以淀粉添加量(A)、酵母膏添加量(B)及Na2CO3添加量(C)为考察指标,根据Box-Behnken试验设计原理,采用3因素3水平响应面分析法对菌株D5产β-环糊精葡萄糖基转移酶的培养基组成进行优化,响应面试验因素与水平见表1。
表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken tests design

1.3.5 菌株D5产β-环糊精葡萄糖基转移酶发酵条件优化
在最佳培养基组成的基础上,依次考察培养温度(20℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃)及时间(12 h、24 h、36 h、48 h、60 h、72 h、84 h、96 h)对菌株D5产β-环糊精葡萄糖基转移酶的影响。
1.3.6 菌株D5产β-环糊精葡萄糖基转移酶酶学性质的研究
(1)不同pH值对酶活性的影响
β-环糊精葡萄糖基转移酶在不同pH值(3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、10.0)的反应体系中进行酶促反应,测定β-环糊精葡萄糖基转移酶的活性,以最高酶活力为100%,计算相对酶活,确定其最适反应pH值。
(2)不同温度对酶活性的影响
在最适pH条件下,设置反应体系温度为25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃、75 ℃,测定β-环糊精葡萄糖基转移酶的活性,以最高酶活力为100%,计算相对酶活,确定其最适反应温度。
(3)不同离子对酶活性的影响
在最适pH及温度条件下,添加Mn2+、Fe2+、Cu2+、Zn2+、Ca2+5种离子溶液,调节离子的浓度为2.5 mmol/L,测定β-环糊精葡萄糖基转移酶的活性,以空白对照的酶活力为100%,计算相对酶活,确定其对酶促反应的影响。
2 结果与分析
2.1 产β-环糊精葡萄糖基转移酶菌株分离及筛选结果

图1 菌株D5的初筛结果
Fig.1 Primary screen results of strain D5

图2 3株菌所产β-环糊精葡萄糖基转移酶活力的测定结果
Fig.2 Determination results of activity of β-CGTase produced by 3 strains
从酱醪中共分离得到5株霉菌,通过初筛得到3株产透明圈的菌株,编号分别为D1、D2、D5,其中菌株D5产生的透明圈见图1。发酵后测定3株菌株的β-环糊精葡萄糖基转移酶活力,结果见图2。由图2可知,3株菌株中,菌株D5所产β-环糊精葡萄糖基转移酶活力最高,为1 814 U/mL,因此,选取β-环糊精葡萄糖基转移酶活力最高的菌株D5为目标菌株。
2.2 高产β-环糊精葡萄糖基转移酶菌株的鉴定
2.2.1 形态观察
菌株D5的菌落形态及菌体形态见图3。由图3可知,菌株D5在分离培养基上生长迅速,30 ℃培养72 h,菌落直径为2~3 cm。菌落初期呈白色、黄色,后期变为淡绿褐色,分生孢子头呈放射状,孢子呈黄绿色球形,大小均匀。

图3 菌株D5的菌落(a)及菌体(b)形态
Fig.3 Colony (a) and mycelium (b) morphology of strain D5
2.2.2 分子生物学鉴定
基于菌株D5的5.8 ITS rDNA基因序列,使用MEGA 7.0软件中的NJ法构建系统发育树,结果见图4。

图4 基于5.8 ITS rDNA基因序列菌株D5的系统发育树
Fig.4 Phylogenetic tree of strain D5 based on 5.8 ITS rDNA gene sequences
由图4可知,菌株D5与米曲霉(Aspergillus oryzae)(MH793844.1)聚于一支,亲缘关系最近,相似度为98%,结合形态观察结果,最终鉴定菌株D5为米曲霉(Aspergillus oryzae)。
2.3 菌株D5产β-环糊精葡萄糖基转移酶发酵培养基组成优化单因素试验结果
2.3.1 碳源对菌株D5产β-环糊精葡萄糖基转移酶的影响
在基础发酵培养基的基础上,4种碳源对菌株D5产β-环糊精葡萄糖基转移酶的影响见图5。由图5可知,以淀粉为碳源时,β-环糊精葡萄糖基转移酶活力最高,为2059.01U/mL,因此选取淀粉为最佳碳源。这与曹新志等[21]对嗜碱芽孢杆菌产环糊精糖基转移酶最优发酵碳源结果一致。淀粉添加量对菌株D5产β-环糊精葡萄糖基转移酶的影响见图6。由图6可知,随着淀粉添加量的增加,β-环糊精葡萄糖基转移酶活力呈先升高后下降的趋势。当淀粉添加量为1.5%时,β-环糊精葡萄糖基转移酶活力最高,为2 319 U/mL,因此确定最佳淀粉添加量为1.5%。
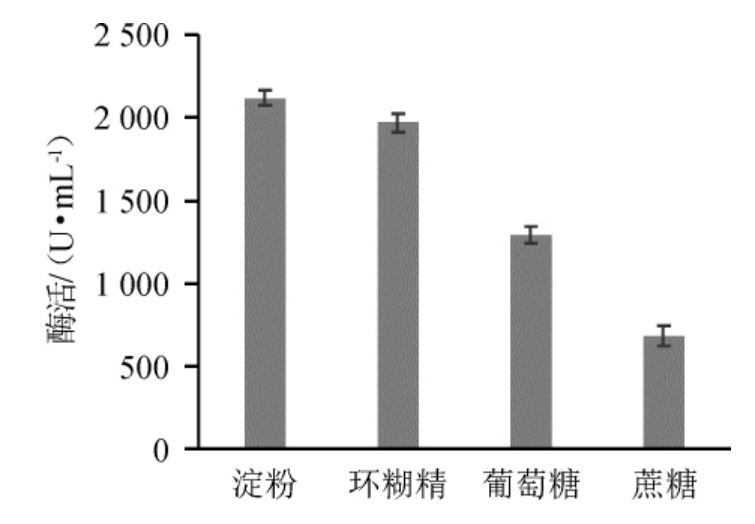
图5 不同碳源对菌株D5产β-环糊精葡萄糖基转移酶活力的影响
Fig.5 Effect of different carbon sources on the activity of β-CGTase produced by strain D5
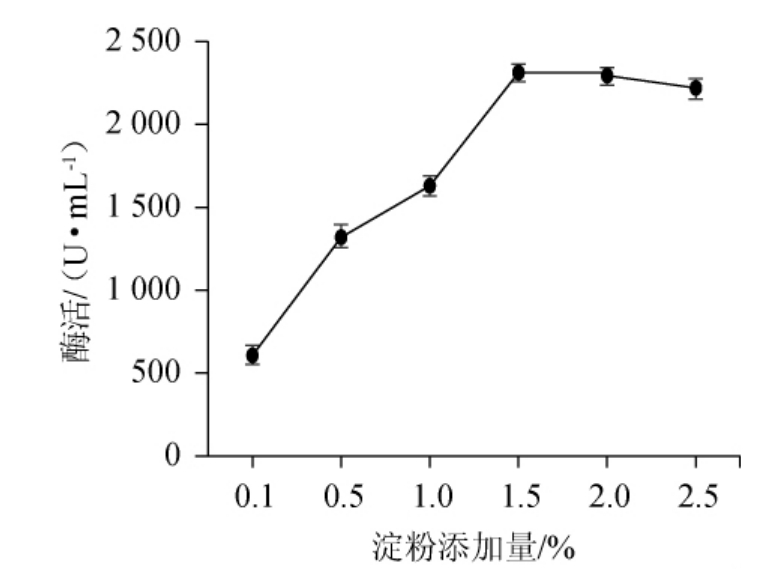
图6 淀粉添加量对菌株D5产β-环糊精葡萄糖基转移酶活力的影响
Fig.6 Effect of starch addition on the activity of β-CGTase produced by strain D5
2.3.2 氮源对菌株D5产β-环糊精葡萄糖基转移酶的影响
在最佳碳源的基础上,考察氮源种类对菌株D5产β-环糊精葡萄糖基转移酶的影响,结果见图7。由图7可知,菌株D5能利用无机氮源,但是在添加无机氮源的条件下β-环糊精葡萄糖基转移酶活力较低,而添加酵母膏的培养基发酵后,β-环糊精葡萄糖基转移酶活力最高为2 161.03 U/mL,分析原因可能是酵母膏中富含多种需氨基酸、维生素、核甘酸、多肽及微量元素更适合菌株的生长与产酶。因此选取酵母膏为最适氮源。酵母膏添加量对菌株D5产β-环糊精葡萄糖基转移酶的影响见图8。由图8可知,随着酵母膏添加量的增加,β-环糊精葡萄糖基转移酶活力呈先升高后下降的趋势。当酵母膏添加量为1.75%时,β-环糊精葡萄糖基转移酶活力最高,为2537U/mL,因此确定最佳酵母膏添加量为1.75%。
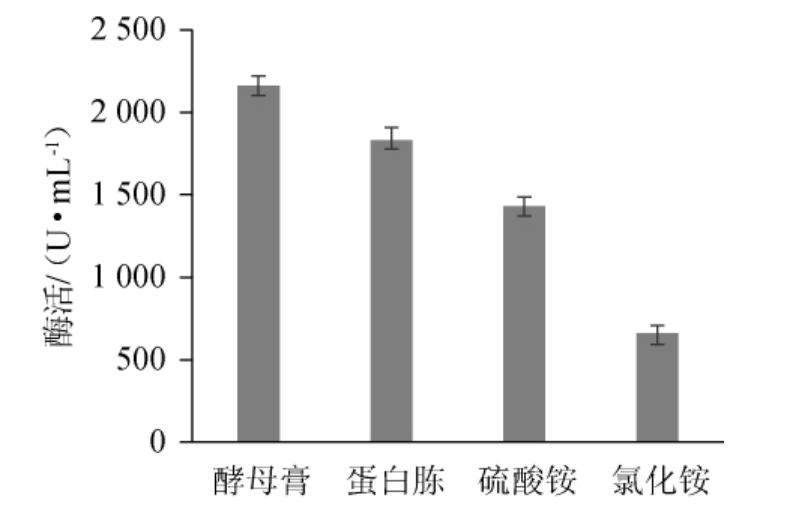
图7 不同氮源对菌株D5产β-环糊精葡萄糖基转移酶活力的影响
Fig.7 Effect of different nitrogen sources on the activity of β-CGTase produced by strain D5
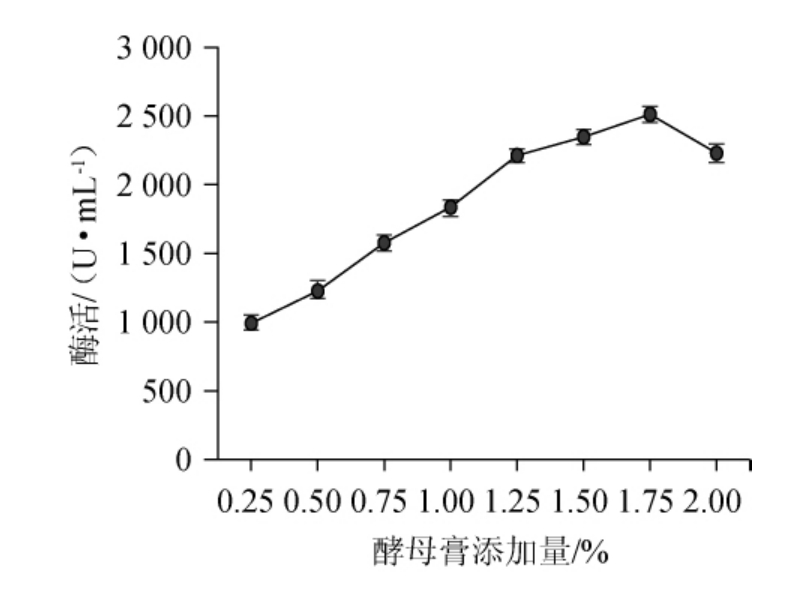
图8 不同酵母膏添加量对菌株D5产β-环糊精葡萄糖基转移酶活力的影响
Fig.8 Effect of yeast extract addition on the activity of β-CGTase produced by strain D5
2.3.3 Na2CO3添加量对菌株D5产β-环糊精葡萄糖基转移酶的影响
在最优氮源和碳源的基础上,考察不同的Na2CO3添加量对菌株D5产β-环糊精葡萄糖基转移酶的影响,结果见图9。

图9 Na2CO3添加量对菌株D5产β-环糊精葡萄糖基转移酶的影响
Fig.9 Effect of Na2CO3 addition on the activity of β-CGTase produced by strain D5
由图9可知,随着Na2CO3添加量的增加,β-环糊精葡萄糖基转移酶活力呈先升高后下降的趋势。当Na2CO3添加量为0.35%时,β-环糊精葡萄糖基转移酶活力最高,为2788U/mL,因此确定最佳Na2CO3添加量为0.35%。
2.4 菌株D5产β-环糊精葡萄糖基转移酶发酵培养基组成优化响应面试验结果
在单因素试验的基础上,以β-环糊精葡萄糖基转移酶活力(Y)为响应值,淀粉添加量(A)、酵母膏添加量(B)及Na2CO3添加量(C)为自变量,根据Box-Behnken试验设计原理,采用3因素3水平响应面分析法对菌株D5产β-环糊精葡萄糖基转移酶的培养基组成进行优化,试验设计与结果见表2,方差分析结果见表3。
表2 菌株D5产β-环糊精葡萄糖基转移酶发酵培养基组成优化Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken tests for fermentation medium component optimization of β-CGTase production by strain D5

表3 响应面试验结果方差分析
Table 3 Analysis of variance of response surface test results
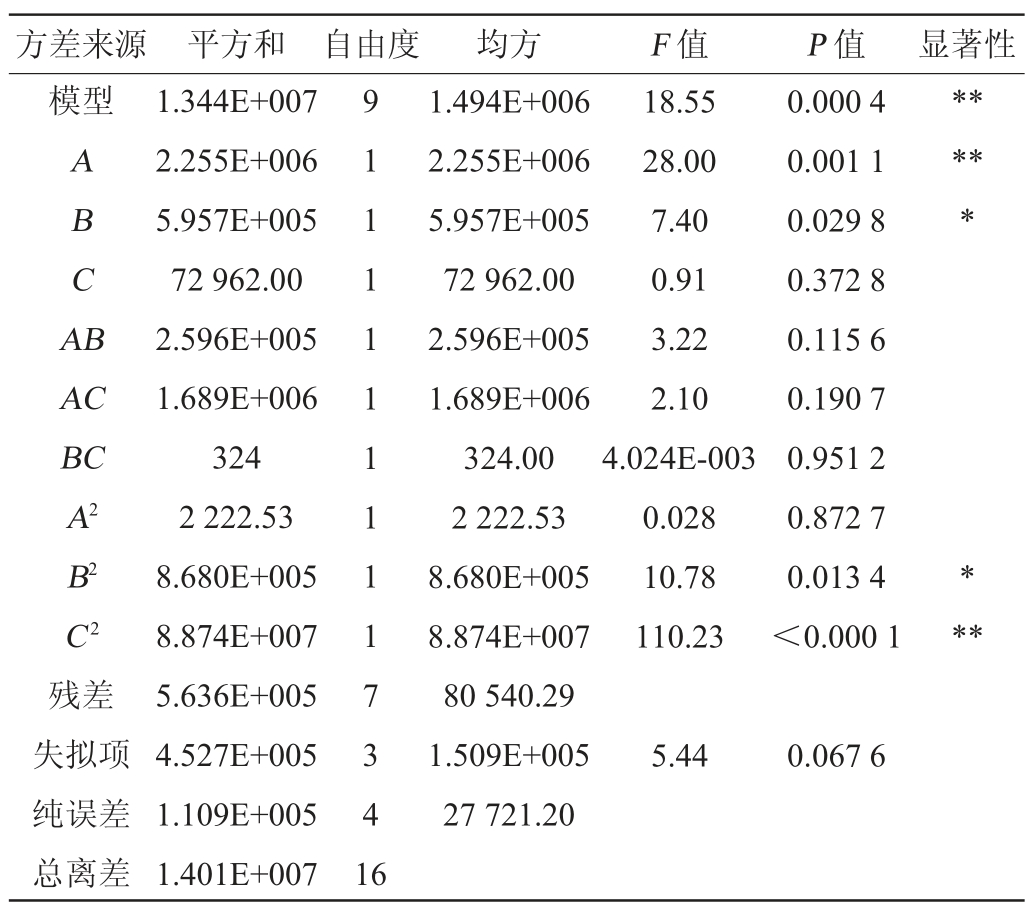
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
采用Design-Expert V8.0.6软件对表2的结果进行回归性分析,以酶活(Y)为因变量,淀粉添加量(A)、酵母膏添加量(B)、Na2CO3添加量(C)为自变量,建立回归方程:
由表3可知,模型的P<0.05,显著,失拟值P>0.05,不显著,说明该模型较为适合,试验点均可用模型描述。此外,决定系数R2为0.991 5,表明该模型有较好的可信度,即该模型能够很好的解释发酵培养基组成对菌株D5产β-环糊精葡萄糖基转移酶活力的影响。由表3亦可知,一次项A及二次项C 2对结果影响极显著(P<0.01),一次项B及二次项B2对结果影响显著(P<0.05),其他因素对结果影响不显著(P>0.05)。根据离散分析,3个因素的影响显著性排序为A>B>C,即淀粉添加量>酵母膏添加量>碳酸钠添加量。
根据试验结果建立响应面分析图,结果见图10。
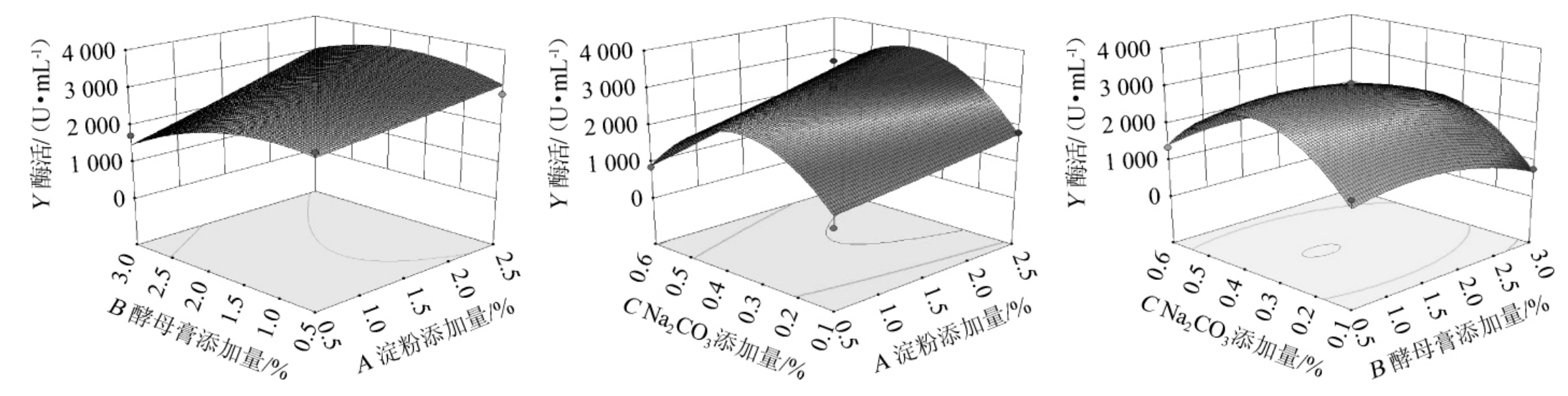
图10 各因素交互作用对菌株D5产β-环糊精葡萄糖基转移酶活力影响的响应面及等高线
Fig.10 Response surface plots and contour lines of effects of interaction between each factors on the activity of β-CGTase produced by strain D5
由图10可知,淀粉与酵母膏添加量之间的交互作用对β-环糊精葡萄糖基转移酶活力的影响最大,其次是淀粉添加量与Na2CO3添加量的交互作用,酵母膏添加量与Na2CO3添加量的交互作用最小,与方差分析结果一致。
由模型计算得到最佳培养基组成为淀粉添加量2.5%,酵母膏添加量1.85%,Na2CO3添加量0.35%,在此优化条件下,菌株D5产β-环糊精葡萄糖基转移酶的酶活为3017.10U/mL。
2.5 菌株D5产β-环糊精葡萄糖基转移酶发酵条件的研究
2.5.1 发酵温度对菌株D5产β-环糊精葡萄糖基转移酶的影响
发酵温度对菌株D5产β-环糊精葡萄糖基转移酶活力的影响见图11。由图11可知,随着发酵温度的升高,β-环糊精葡萄糖基转移酶活力呈先升高后下降的趋势,温度对米曲霉的生长状态有重要影响,温度较低或较高都会对其生长有抑制作用,其产酶过程也相应的受到抑制。当发酵温度为30 ℃时,β-环糊精葡萄糖基转移酶活力最高,为3 099.17 U/mL。因此,确定最优发酵温度为30 ℃,这与朱德艳[22]的研究结果一致。

图11 不同发酵温度对菌株D5产β-环糊精葡萄糖基转移酶活力的影响
Fig.11 Effect of different fermentation temperature on the activity of β-CGTase produced by strain D5
2.5.2 发酵时间对菌株D5产β-环糊精葡萄糖基转移酶的影响

图12 不同发酵时间对菌株D5产β-环糊精葡萄糖基转移酶活力的影响
Fig.12 Effect of different fermentation time on the activity of β-CGTase produced by strain D5
发酵时间对菌株D5产β-环糊精葡萄糖基转移酶酶活的影响见图12。由图12可知,随着发酵时间的延长β-环糊精葡萄糖基转移酶活力逐渐升高;当发酵时间为72 h时,酶活最高为3 208.01 U/mL;随着发酵时间的延长,营养物质逐渐消耗不利于产酶,因此确定最优的发酵时间为72 h。
2.6 菌株D5产β-环糊精葡萄糖基转移酶酶学性质研究结果
2.6.1 pH对β-环糊精葡萄糖基转移酶活力的影响
pH对β-环糊精葡萄糖基转移酶活力的影响见图13。由图13可知,随着反应体系pH值在3.0~8.5范围内升高,β-环糊精葡萄糖基转移酶的活力呈上升趋势。当反应体系的pH值>8.5之后酶活开始下降,这表明反应液的pH值太高不利于β-环糊精葡萄糖基转移酶的催化降解反应,因此确定其酶解的最适反应pH值为8.5,可见该酶是一种碱性β-CGTase。在不同pH条件下底物分子和酶分子的带电状态不同,从而影响酶和底物的结合,影响酶的稳定性。孟艳芬等[23]在对芽孢杆菌产生的β-CGTase酶学性质的研究中得出其最适pH值为9.0,同为碱性β-CGTase。
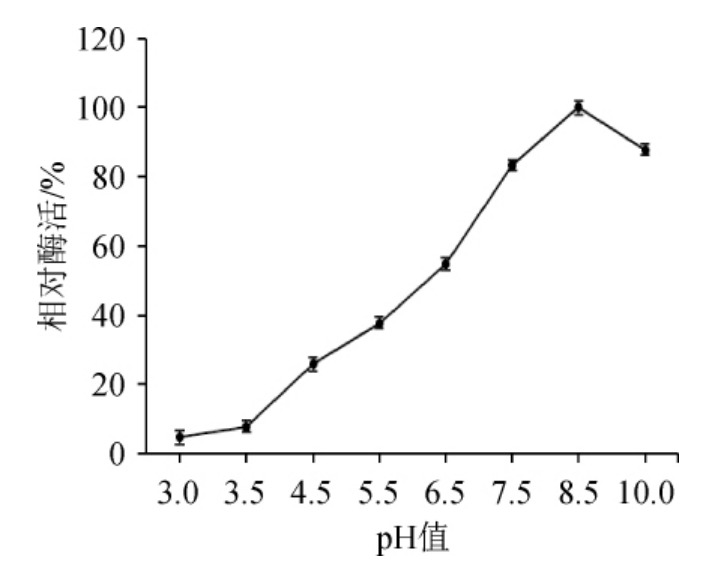
图13 不同pH值对β-环糊精葡萄糖基转移酶活力的影响
Fig.13 Effect of different pH on the activity of β-CGTase
2.6.2 温度对β-环糊精葡萄糖基转移酶活力的影响

图14 不同温度对β-环糊精葡萄糖基转移酶活力的影响
Fig.14 Effect of different temperature on the activity of β-CGTase
在最适pH 8.5的条件下,温度对β-环糊精葡萄糖基转移酶活力的影响见图14。由图14可知,随着反应体系温度在25~50 ℃范围内升高,β-环糊精葡萄糖基转移酶的相对酶活呈上升趋势,当反应体系的温度>50 ℃之后,β-环糊精葡萄糖基转移酶的相对酶活开始下降,这表明温度太高不利于β-环糊精葡萄糖基转移酶的催化降解反应,因此确定该酶的最适反应温度为50 ℃。
2.6.3 金属离子对β-环糊精葡萄糖基转移酶活力的影响
金属离子对β-环糊精葡萄糖基转移酶的影响见图15。由图15可知,Mn2+、Fe2+、Cu2+、Zn2+、Ca2+对β-CGTase的活力有一定影响,Ca2+对酶活的影响较小,其他离子均对该酶的活力有抑制作用,其抑制程度的大小分别为Zn2+>Mn2+>Cu2+>Fe2+,与孟艳芬等[23]的研究结果一致。
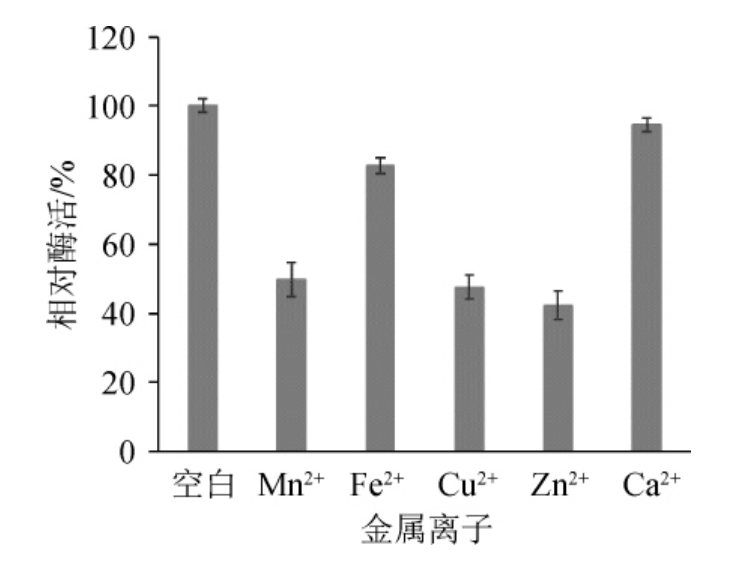
图15 不同金属离子对β-环糊精葡萄糖基转移酶活力的影响
Fig.15 Effect of different metal ions on the activity of β-CGTase
3 结论
本研究从酱醪中筛选得到一株高产β-环糊精葡萄糖基转移酶(β-CGTase)菌株D5,通过形态观察及分子生物学鉴定其为米曲霉(Aspergillus oryzae),采用单因素轮换法和响应面法对该菌产酶培养基组成进行优化,得出最佳培养基组成为淀粉2.5%、酵母膏1.85%、Na2CO3 0.35%、K2HPO4 0.02%、MgSO4·7H2O0.02%,最佳发酵温度为30℃,发酵时间为72 h,在此最优发酵条件下,β-CGTase活力为3 208.01 U/mL。β-CGTase的最适反应温度为50 ℃、最适反应pH值为8.5,除Ca2+外,Mn2+、Fe2+、Cu2+、Zn2+对该酶的活力有抑制作用,其抑制程度大小为Zn2+>Mn2+>Cu2+>Fe2+。β-CGTase是酱油发酵体系中研究较少的一种酶类,米曲霉产β-CGTase的研究能够指导酱油的酿造过程,对改善酱油的品质有重要意义。
[1]张晓磊,郝建华,郑鸿飞,等.1 株产α-环糊精葡萄糖基转移酶菌株的产酶条件优化[J].中国海洋药物,2015,34(5):63-70.
[2]孙涛,江波,潘蓓蕾,等.产环糊精葡萄糖基转移酶菌株的筛选、鉴定与应用研究[J].食品工业科技,2010,31(10):210-212,215.
[3]曹冬梅,胡耀辉.产β-环糊精葡萄糖基转移酶高温菌株HY15 发酵条件优化[J].中国酿造,2013,32(10):40-43.
[4]KOH D W,PARK M O,CHOI S W,et al.Efficient biocatalytic production of cyclodextrins by combined action of amylosucrase and cyclodextrin glucanotransferase[J].J Agr Food Chem,2016,64(21):4371-4375.
[5]侯丽华,宋茜,曹小红.酱油风味研究进展[J].中国酿造,2009,28(7):1-3.
[6]王鲁峰,张韵,徐晓云,等.食品风味物质分离分析技术进展[J].安徽农业学,2009,37(2):463-465,468.
[7]YOUNG O A,GUPTA R B,SADOOGHY-SARABY S.Effects of cyclodextrins on the flavor of goat milk and its yogurt[J].J Food Sci,2012,77(1-3):S122-S127.
[8]李杨,李明达,刘军,等.酱油酿造过程中风味物质的形成与鉴定[J].食品工业科技,2019,40(4):251-256.
[9]纪凤娣,鲁绯,程永强.中国传统酱油生产用米曲霉菌种研究进展[J].北京工商大学学报(自然科学版),2012,30(4):41-43,49.
[10]陈晓彤.α-环糊精葡萄糖基转移酶中试制备工艺优化及酶的应用评价[D].上海:上海海洋大学,2017.
[11]张新武.常压室温等离子诱变选育β-环糊精葡萄糖基转移酶高产菌株及发酵工艺研究[J].食品安全质量检测学报,2016,7(12):4930-4938.
[12]童佳,赵国忠,赵建新,等.米曲霉发酵高盐稀态酱油过程中典型挥发性风味物质的形成[J].中国酿造,2017,36(5):22-29.
[13]ASTRAY G,MEJUTO J C,SIMAL-GANDARA J.Latest developments in the application of cyclodextrin host-guest complexes in beverage technology processes[J].Food Hydrocolloid,2020,106:Doi:10.1016/j.foodhyd.2020.105882.
[14]蓝星.米曲霉脂肪酶的基因表达、酶学性质及分子改造研究[D].杭州:浙江工业大学,2019.
[15]殷怡云.米曲霉耐盐蛋白酶的分离、纯化及其耐盐机制初步研究[D].镇江:江苏大学,2019.
[16]贾瑞博,胡荣康,周文斌,等.米曲霉(Aspergillus oryzae FAFU)淀粉酶的分离纯化及其酶学性质研究[J].食品与发酵工业,2016,42(11):71-76.
[17]杨文博.微生物学实验[M].北京:化学工业出版社,2004:214-226.
[18]李蕊,王然,郭艳琼,等.酱醪中产HDMF 酵母的分离、筛选及鉴定[J].食品与机械,2011,27(5):11-14
[19]郭利伟,王卫卫,陈兴都,等. β-环糊精葡萄糖基转移酶高产菌株MS-UD2 的选育及产酶条件的研究[J].食品科学,2008,29(12):439-443.
[20]廖威,华慧颖,莫于旺.一株β-环状糊精葡萄糖基转移酶产生菌的筛选与发酵条件研究[J].广西轻工业,2011,27(2):1-3.
[21]曹新志,金征宇.嗜碱芽孢杆菌产环糊精葡萄糖基转移酶发酵条件的优化[J].食品科学,2005,26(2):122-126.
[22]朱德艳.产环糊精葡萄糖基转移酶菌株发酵条件的优化[J].湖北农业科学,2013,52(1):171-173,185.
[23]孟艳芬,许波,高润池,等.产β-环状糊精葡萄糖基转移酶高产菌株XW-6-66 发酵条件和酶学性质的研究[J].酿酒科技,2008(9):30-35.