豆豉是一类深受消费者喜爱的发酵豆制品,其发酵过程中产生了活性肽、大豆低聚糖、大豆异黄酮、类黑精等一系列的活性物质[1-4],使豆豉具有抗癌、抗氧化及促进免疫调节等一系列的生理活性[5-8],同时也赋予其独特的风味和药用价值[9-11]。豆豉按照其优势发酵菌群的不同可分为毛霉型、曲霉型、根霉型、细菌型4种[12-13],且均有各自的代表产品,如永川豆豉、浏阳豆豉以及印尼丹贝和日本纳豆等。纳豆和丹贝均属于单菌种发酵豆豉[14-15],这类豆豉产品具有质量稳定、发酵过程容易控制等优点,但在我国食用与生产较少。我国豆豉以曲霉型豆豉及毛霉型豆豉为主,均为自然发酵,发酵期间菌群复杂多样、具有独特风味,但形成机理不明确,且产品质量不稳定且难以调控。
高通量测序技术是现在较为先进的技术之一,在发酵食品微生物组成分析中应用广泛。LIANG J J等[16]研究发现,泡菜的微生物群落处于优势地位由三个属的成员组成:白串珠菌属、乳酸菌属和威塞拉属。腐乳发酵中亦鉴定出50种细菌和99种真菌,涉及的细菌群落主要是不动杆菌属,肠球菌和链球菌;而真菌(曲霉和红曲霉),在发酵后阶段约占整个菌群的95%[17]。MIN J K等[18]对共14种韩国豆豉样品进行菌群分析,得出关键的微生物有乳酸杆菌、肠球菌、芽孢杆菌。HE B等[19]则发现毛霉型豆豉在第一天时以曲霉属(97.98%)和链球菌属(1.11%)为主,而曲霉豆豉在发酵第一天时曲霉属(67.34%)和念珠菌(28.23%)占主导地位;而随着发酵时间的增加,曲霉型豆豉中曲霉菌的占比增加,而毛霉型豆豉中曲霉属的占比下降。
浏阳豆豉是典型的曲霉型淡豆豉,因其独特的风味广受人们喜爱,是湘菜中不可或缺的一种调味料。其以泥豆或小黑豆为原料,制作方法为黑豆清洗、蒸煮、冷却、自然制曲、洗霉、堆积发酵、发酵后熟、成品。不同于大多数曲霉豆豉,浏阳豆豉发酵过程中不加入食盐,属于药食两用的淡豆豉。且由于发酵过程中主要的微生物来源于环境,因此不同生产厂家的产品的微生物的组成和种类存在一定差异。为明确浏阳豆豉中主要的优势微生物,本试验通过内转录间隔区(internal transcribed spacer,ITS)序列分析技术对4种不同品牌的浏阳豆豉进行分析,以阐明不同品牌的浏阳豆豉的真菌群落情况,为浏阳豆豉工业生产提供理论基础和技术指导。
1 材料与方法
1.1 材料与试剂
脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技有限公司。
浏阳梁嘉豆豉(LJ):湖南梁嘉食品有限公司;浏阳太平桥豆豉(TPQ):浏阳市太平桥食品豆豉厂;浏阳天马山豆豉(TMS):浏阳市天马山豆豉厂;浏阳一品香豆豉(YPX):湖南省浏阳市一品香豆豉总厂。所有样品均来源于同一个季节各品牌企业发酵成熟曲料,在整个制作场地的四个角和中心位置取样后混合(一式三份)共1 kg左右,冷链运输带回实验室,分别置于-80 ℃保存待测。
1.2 仪器与设备
SW-CJ净化工作台:上海新苗医疗器械制造有限公司;DHP120恒温培养箱:上海实验仪器厂有限公司;TP-620A型电子天平:湘仪天平仪器设备有限公司;LGJ-10真空冷冻冷冻干燥机:北京松源华兴科技发展有限公司。
1.3 试验方法
1.3.1 基因组DNA提取
在同一品牌样品的3份取样袋中各取5 g豆豉混合,放入研钵中,倒入适当的液氮,立即研末成粉末状,取0.1~0.3 g作为待测样本按照土壤和粪便基因组DNA提取试剂盒说明书进行基因组DNA抽提,再利用1%琼脂糖凝胶电泳检测DNA的完整性和纯度,同时利用NanoDropOne检测DNA的浓度和纯度。
1.3.2 聚合酶链式反应扩增
聚合酶链式反应(polymerase chain reaction,PCR)扩增及产物电泳检测则以基因组DNA为模版,根据测序区域的选择,使用带barcode的引物及PremixTaq(TaKaRa)进行PCR扩增。利用GeneToolsAnalysisSoftware(Version4.03.05.0,SynGene)对PCR产物进行浓度对比后,按照等质量原则计算个样品所需体积,将各PCR产物进行混合。对真菌ITS2区域进行扩增,选用引物fITS7(GTGARTCATCGAATCTTTG)和ITS4(TCCTCCGCTTATTGATATGCPCR)。PCR反应成分:Phusion Hot start flex 2X Master Mix 12.5 μL,正向引物2.5 μL,反向引物2.5 μL,模版DNA 50 ng,最后向反应液中加入ddH2O 至总体积25 μL;反应条件:(循环次数)35×(95 ℃、30 s;退火温度54 ℃、30 s;延伸温度72 ℃、45 s)72 ℃、10 s,维持4 ℃直到结束。
1.3.3 Illumina Miseq测序和数据处理
使用E.Z.N.A.® Gel Extraction Kit凝胶回收试剂盒回收PCR混合产物,TE缓冲液洗脱回收目标DNA片段。后续建库按照NEBNext ®UltraTM DNA Library Preo Kit for Illumina ®标准流程进行建库操作,完成后以高通量测序平台Hiseq或Miseq对其进行上机测序(广东美格基因科技有限公司),测序得到的原始图像数据文件,经碱基识别(Base Calling)分析转化为原始测序序列(Raw Reads),结果以FASTQ(简称为fq)文件格式储存,其中包含测序序列(Reads)的序列信息以及其对应的测序质量信息。
1.3.4 数据处理
采用PEAR软件对双端序列进行拼接,嵌合体序列过滤采用Vsearch(v2.3.4,Vsearch)软件。去除reads的引物序列(非高变区),将每一对paired-end reads拼接合并成一条更长的tag。对测序reads进行窗口法质量扫描,扫描窗口默认为100 bp,当窗口内平均质量值低于20时,将read从窗口起始到3'终止的部分截掉,去除截短后长度小于100 bp的序列,且去除截短后N(不确定模糊碱基)的含量在5%以上的序列以及嵌合体序列。
1.3.5 数据分析
物种注释、丰富度等数据分析结果均采用GraphPad Prism 5 软件统计及绘图。
2 结果与分析
2.1 样品中真菌群落共享和独有的操作分类单元和韦恩图分析

图1 豆豉样品韦恩图
Fig.1 Venn diagram of Douchi samples
通过对真菌ITS1和ITS2区进行测序,从12个样本中得到1 234 222条序列,累计496个操作分类单元(operational taxonomic units,OTUs)。由图1可得,样品种真菌OTUs总数分别为LJ(347)、TPQ(377)、YPX(361)、TMS(350),其中有146个OTUs是4种豆豉共有的。
2.2 豆豉中真菌多样性分析
2.2.1 Alpha多样性分析
Alpha多样性是指一个特定区域或者生态系统内的多样性,常用的度量标准包括反应群落丰度的:Sobs、Chao、Chao1、Ace、Richness和用来反应群落多样性的Shannon指数、Simpson指数等[20]。据表1可得,YPX的Shannon指数最高(2.32)而样品TMS则最低(1.24)。Chao1与Richness指数的变化趋势一致,均显示TPQ最高,分别为209.77、207.00,说明TPQ样品的真菌丰度最大,其次是YPX,而TMS则是最低的样品(分别为184.13、180.33)。
表1 真菌Alpha多样性指数
Table 1 Alpha diversity indexes of fungi
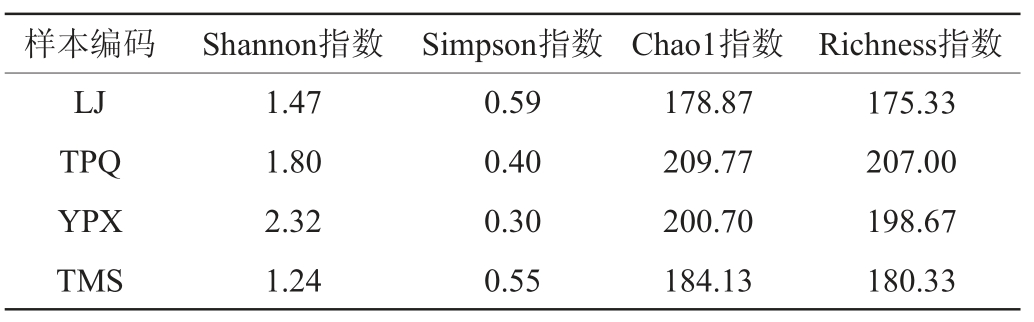
注:以上数据均为3组平行试验的平均数。
基于Kruskal-Wallis秩和检验的真菌多组间差异结果见图2。据图2可知,TPQ的上边缘与下边缘距离最大,表明其平行组间差异较大,这可能与其在发酵期间受到外界杂菌侵染有关。YPX、TMS以及LJ上下边缘差距较小,说明样品中真菌分布较均匀。综上所述,虽然TPQ真菌丰度最大,但平行样品间存在较大差异,TMS的真菌丰度最低,真菌种类较为单一。为进一步了解4种样品豆豉中真菌情况,对其进行物种群落进行了进一步分析,以明确各样本中的真菌群落分布。
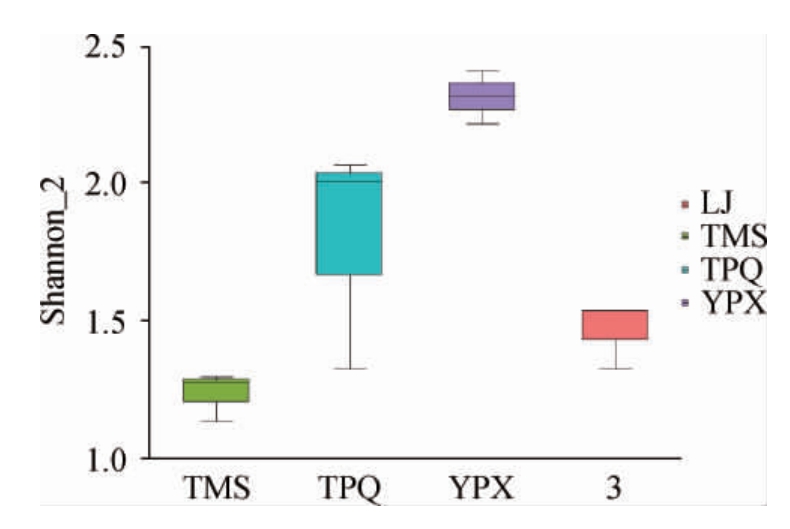
图2 基于Kruskal-Wallis秩和检验的真菌多组间差异
Fig.2 Differences among multiple groups of fungi based on Kruskal-Wallis rank sum test
2.2.2 豆豉中真菌的群落情况
由图3(a)可知,真菌的门水平上的丰度情况,除未能鉴别的序列以外,4种豆豉样本均是以子囊菌门(Ascomycota)、毛霉亚门(Mucoromycota)为主,其中TPQ、YPX及LJ子囊菌门相对丰度均超过80%。说明虽然发酵环境场地不同,非同种品牌的浏阳豆豉在门水平上具有较高的相似性。此外,TMS的子囊门属的相对丰度相对较低(29.9%),Unassigned(69.5%)是TMS样品种的优势真菌,此样品中大部分的菌未能鉴定,还有待进一步研究。
由图3(b)可知,除未能鉴别的序列以外,各豆豉样品在真菌的属水平上的分布差异较大:TMS优势菌属主要包括曲霉属(Aspergillus);而TPQ中以曲霉属(Aspergillus)和嗜热菌属(Thermomyces)为主要菌属,其次是小囊菌属(Microascus),其中嗜热菌属相对丰度最高(49.2%);此外,YPX中的菌属数量较其他样品更丰富,主要有曲霉属、小囊菌属、青霉属(Penicillium)、横梗霉属(Lichtheimia)、单端孢属(Trichothecium);LJ中曲霉属为相对丰度最高,为91.4%,其次是小囊菌属。石聪等[21]对浏阳豆豉中微生物进行试验后,发现在前期发酵过程中,属水平大量出现了曲霉、青霉、根霉和酵母菌等,后续还出现了横梗霉属、嗜热菌属等,其中真菌部分与本实验相符。此外,浏阳豆豉发酵过程中真菌种类既有需要的曲霉、根霉等有益微生物,但也出现了部分青霉属等可能影响产品质量和安全的微生物,这些微生物对浏阳豆豉风味形成的贡献还有待进一步研究。

图3 真菌群落在门水平(a)和属水平(b)上的相对丰度比较
Fig.3 Comparison of relative abundance of fungal communities at the phylum level (a) and genus level (b)
2.2.3 豆豉中真菌数量的聚类情况
热图可以通过板块颜色的相似性及差异性来反应多个样本在各分类水平上群落的组成情况,从物种和样品两个层面进行聚类,可以观察到平行样品之间会存在差别,不同种之间又存在相同点。据图4的聚类结果可知,TPQ的平行组之间存在较大差异与图1的结果相符合,另外YPX与LJ的真菌组成相似,而与其TMS、TPQ则相差较大。
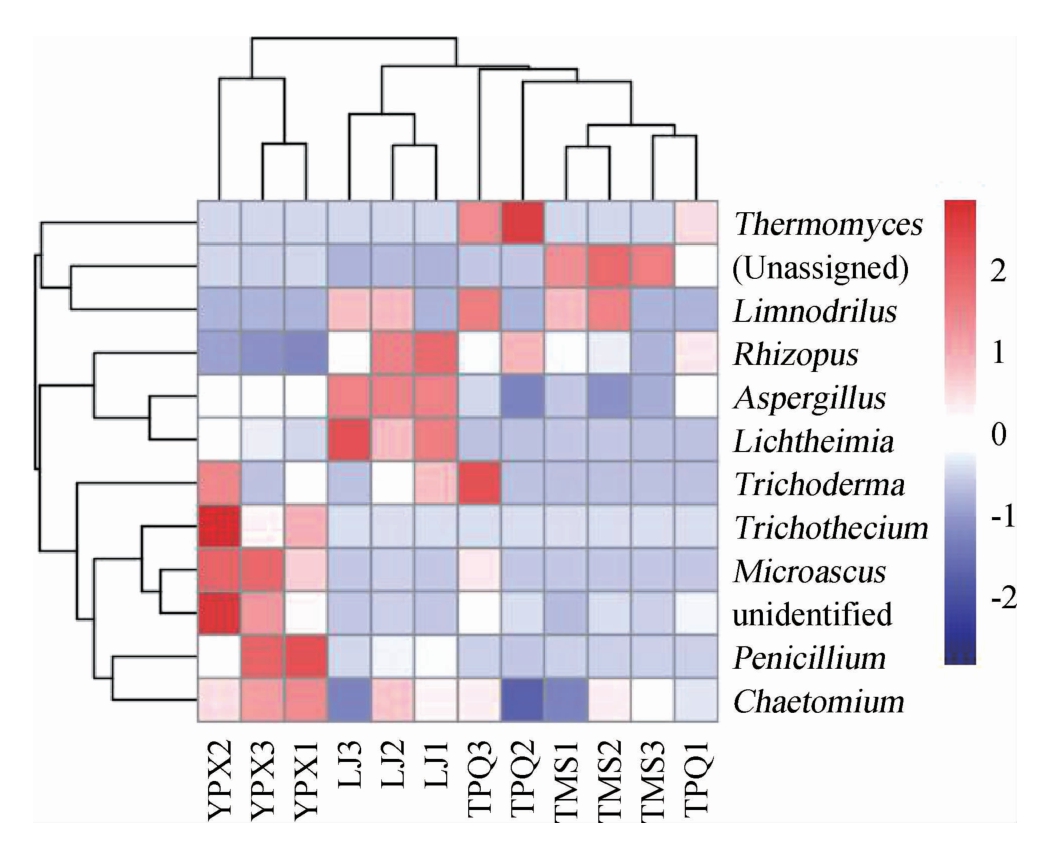
图4 真菌在属水平上的聚类热图
Fig.4 Cluster heatmap of fungus at genus level
横坐标反映的是不同菌属在不同样品中的存在情况,如嗜热菌属(Thermomyces)在TPQ样品中含量最高,横梗霉属(Lichtheimia)则主要存在于TMS与LJ中,曲霉属(Aspergillus)、单端孢属(Trichothecium)和根霉属(Rizopus)均在LJ中含量较高,木霉属(Trichoderma)、单端孢属(Tri chothecium)、青霉属(Penicillium)、毛壳菌属(Chaetomium)是YPX的特征菌属。
2.2.4 主坐标分析
主坐标分析(principal coordinates analysis,PCoA)是一种研究数据相似性或差异性的可视化方法,通过一系列的特征值和特征向量进行排序后,选择主要排在前几位的特征值,将其表现在坐标里。因此PCo1表示尽可能最大解释数据变化的主坐标成分,PCoA2则解释余下的变化度中占比例最大的主坐标成分,根据图5可知,PCoA 1解释了数据集中总方差的56.9%,而PCoA 2解释了29.9%。图5中不同颜色的点属于不同样本组,PCoA中横纵坐标的刻度线表示样品之间的距离,除开LJ与YPX相靠较近,其他都集中在不同的区域,说明这4种浏阳豆豉中LJ与YPX的菌群分布较为靠近,且与其它品牌豆豉的差异很大,这与图4的热图聚类情况相符。由图5还可知,LJ、YPX的三组平行之间差异较小,而TPQ与TMS组间差异则较大,这说明LJ与YPX样品中真菌分布较为均匀,后两者真菌组成情况则不统一,尤其是TPQ组间差异最大,此结果与图1的箱型图结果相符。
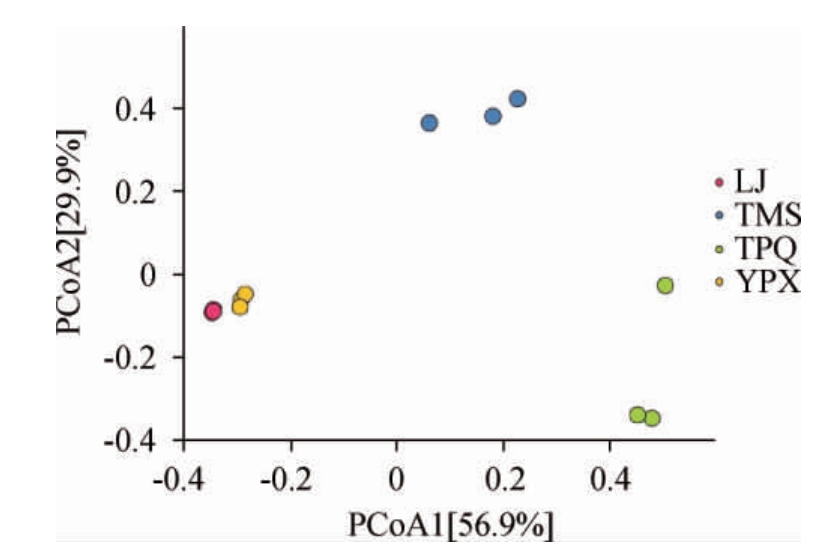
图5 豆豉样品的主坐标分析
Fig.5 PCoA analysis of Douchi samples
3 结论
本研究探索了不同品牌浏阳豆豉的真菌组成情况,结果表明:TPQ样品的真菌相对丰度最大,LJ则较低,YPX样本中真菌的多样性高,种类丰富;4种浏阳豆豉均以子囊菌门、毛霉亚门为主要菌群门类,LJ和YPX中曲霉属相对丰度最大,分别为91.4%、65.5%,TPQ则以小囊菌属(49.1%)含量最高。TMS中除未能鉴别的,其次是曲霉属(29.47%)的相对丰度最高。横梗霉属(Lichtheimia)主要存在TMS与LJ中,嗜热菌属(Thermomyces)在TPQ样品中含量最高,曲霉属(Aspergillus)、单端孢属(Trichothecium)和根霉属(Rizopus)均在LJ中含量较高,木霉属(Trichoderma)、单端孢属(Trichothecium)、青霉属(Penicillium)、毛壳菌属(Chaetomium)则在YPX含量最高;PCoA的结果反映出4种不同品牌的浏阳豆豉YPX与LJ菌群相似以外,其余样本相差较大。本研究全面解析了不同品牌浏阳豆豉中的真菌组成,明确了其中的优势微生物,但浏阳豆豉生产中微生物影响因素及其对浏阳豆豉品质的贡献还有待进一步研究。
[1]AMAROWICZ R,SHAHIDI F.Antioxidant activity of broad bean seed extract and its phenolic composition[J].J Funct Food,2017,38(2):656-662.
[2]LEE M J,CHUNG I M,KIM H,et al.High resolution LC-ESI-TOF-mass spectrometry method for fast separation,identification,and quantification of 12 isoflavones in soybeans and soybean products[J].Food Chem,2015,176(6):254-262.
[3]MUTHUKUMARAN J,XU B J.An insight into the health benefits of fermented soy products[J].Food Chem,2019,271(15):368-371.
[4]BROUNS F.Soya isoflavones:A new and promising ingredient for the health foods sector[J].Food Res Int,2002,35(2):187-193.
[5]XU L,DU B,XU B J.A systematic,comparative study on the beneficial health components and antioxidant activities of commercially fermented soy products marketed in China[J].Food Chem,2015,174(1):202-213.
[6]XIA X D,LING W H,MA J,et al An anthocyanin-rich extract from black rice enhances atherosclerotic plaque stabilization in apolipoprotein E-deficient mice[J].J Nutr,2006,136(8):2220-2225.
[7]DEJAN Z O,NEDA M M D,MARINA M F,et al.Antioxidant activity relationship of phenolic compounds in Hypericum perforatum L.[J]. Chem Cent J,2011,5(1):34-40.
[8]孙丽颖,李占海,张方.微生物的发酵作用对传统酿造食品安全性的影响[J].食品安全导刊,2019(24):83.
[9]WANG L J,MU H L,LIU H J,et al.Volatile components in three commercial douchies,a Chinese traditional salt-fermented soybean food[J].Int J Food Prop,2010,13(5):1117-1133.
[10]牛广财,贾亭亭,魏文毅,等.淡豆豉的研究进展[J].中国酿造,2013,32(9):1-5.
[11]JELEN H,MAJCHER M,GINJA A,et al.Determination of compounds responsible for tempeh aroma[J].Food Chem,2013,141(1):459-465.
[12]ZHANG J H,EIZO T,DING C H,et al.Angiotensin I-converting enzyme inhibitory peptides in douchi,a Chinese traditional fermented soybean product[J].Food Chem,2005,98(3):551-557.
[13]张鹏飞,乌日娜,武俊瑞.传统发酵大豆制品挥发性成分和微生物多样性的研究进展[J].中国酿造,2018,37(12):1-6.
[14]陈丽花,陈有容,齐凤兰.纳豆芽孢杆菌的功能及其应用[J].食品工业,2001(4):37-39.
[15]周思静,李淑荣,王志东,等.丹贝营养成分的研究[J].食品工业科技,2013,34(2):336-342.
[16]LIANG J J,LI D W,SHI R Q,et al.Effects of microbial community succession on volatile profiles and biogenic amine during sufu fermentation[J].LWT,2019,114:108379.
[17]徐琼,刘洋,曲勤凤,等.高通量测序分析不同地区红腐乳细菌多样性[J].食品科学,2020,41(10):110-116.
[18]MIN J K,HAN S K,HEE Y J,et al.Microbial communities related to sensory attributes in Korean fermented soy bean paste(doenjang)[J].Food Res Int,2016,89(1):724-732.
[19]HE B,LI H R,HU Z H,et al.Difference in microbial community and taste compounds between Mucor-type and Aspergillus-type Douchi during koji-making[J].Food Res Int,2019,121:136-143.
[20]陶康,吴凌伟,金晓芳,等.基于高通量基因测序分析腐乳微生物多样性[J/OL].食品科学:1-11[2020-05-08].http://kns.cnki.net/kcms/detail/11.2206.TS.20200302.1754.050.html.
[21]石聪,李世瑞,李跑,等.基于高通量测序浏阳豆豉不同发酵阶段微生物多样性分析[J].食品与发酵工业,2018,44(2):27-39.