葡萄糖氧化酶(glucose oxidase,GOD)系统命名为β-D-葡萄糖氧化还原酶,能利用氧分子作为电子受体催化β-D-葡萄糖氧化成为D-葡萄糖酸-δ-内酯和H2O2[1-2]。GOD是一种重要的商业用酶,广泛应用于医药、纺织、食品、饲料、生物能源等多个领域[3-8]。GOD对多种病原菌如沙门氏菌(Salmonellainfantis)、金黄葡萄球菌(Staphylococcusaureus)、产气荚膜梭菌(Clostridium perfringens)、蜡样芽孢杆菌(Bacillus cereus)、空肠弯杆菌(Campylobacter jejuni)、单增李斯特菌(Listeria monocytogens)、铜绿假单胞菌(Pseudomonas aeruginosa)等有很好的拮抗作用[9],可作为防腐剂和抗氧化剂,其杀菌效果比化学抑菌剂更具备安全性。
GOD广泛存在于动植物、微生物体内,但动植物组织中含量有限。微生物具有来源广、生长周期短等优点,是GOD工业化生产的主要方式。目前用于生产的菌株主要有曲霉属(Aspergillus)和青霉属(Penicillium)[10]真菌,此外,研究发现拟青霉属、胶霉属、帚霉属以及一些酵母菌和细菌也具有产葡萄糖氧化酶的能力[11-13]。GOD目前存在着分离纯化成本高、稳定性及酶活性较差等问题[14]。黑曲霉和青霉因其产酶能力强,易于规模化而被广泛用于生产。但发酵过程中,有大量杂蛋白生成,且产品温度稳定性在20~50 ℃[15],导致质量和价格差异较大。因此,需要进一步筛选性能优良菌株,来提升国内葡萄糖氧化酶酶制剂质量和市场竞争力[16]。
土壤中微生物资源丰富,本研究从土壤和果皮样品中筛选产葡萄糖氧化酶菌株,通过形态观察及分子生物学技术对其进行鉴定,并对其所产葡萄糖氧化酶酶学性质进行初步研究,以期得到产胞外葡萄糖氧化酶酶活力高且热稳定性较好的优良菌株,为进一步构建新型产葡萄糖氧化酶工程菌株提供研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
土壤样品:分别采集于内蒙古甜菜地、河南长垣黄河滩地葡萄根际、云南昆阳磷矿土壤;葡萄样品:采自市售葡萄。采用多点混合采样的方法[17],土壤采集深度3~10 cm,混合均匀后将其装入无菌袋中,0~4 ℃保存。
1.1.2 培养基
初筛培养基[18]:蛋白胨3.0 g,葡萄糖80.0 g,脱氧胆酸钠0.2 g,KH2PO4 0.2 g,CaCO3 3.5 g,(NH4)2HPO4 0.4 g,可溶性淀粉10.0 g,MgSO4·7H2O 0.2 g,KI 1.7 g,琼脂18.0 g,蒸馏水1 000 mL,pH值自然。在115 ℃条件下高压蒸汽灭菌25 min。
发酵培养基[19]:蛋白胨3.0 g,葡萄糖80.0 g,KH2PO42.0 g,MgSO4·7H2O 0.5 g,KC1 0.5 g,蒸馏水1 000 mL,pH值自然。在115 ℃条件下高压蒸汽灭菌25 min。
马铃薯葡萄糖琼脂(potatodextroseagar,PDA)培养基[19]:马铃薯200.0 g,葡萄糖20.0 g,琼脂18.0 g,蒸馏水1 000 mL,pH值自然。在115 ℃条件下高压蒸汽灭菌25 min。
1.1.3 主要试剂
脱氧胆酸钠(分析纯):上海索莱宝生物科技有限公司;靛蓝胭脂红:上海源叶生物有限公司;2×Es Taq Master Mix:北京康为世纪生物科技有限公司;真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国Omega Bio-Tek公司;菌株18S rDNA基因聚合酶链式反应(polymerase chain reaction,PCR)扩增通用引物NS1、NS8:北京六合华大基因科技有限公司;DM2000 DNA Marker:北京康为世纪生物科技有限公司;蛋白胨、酵母粉(均为生化试剂):英国Oxoid公司;琼脂糖生化试剂:上海贝晶生物技术有限公司;其他试剂为国产分析纯。
1.2 仪器与设备
Axio Image M2全电动正置荧光显微镜:德国zeiss公司;德国Thermo公司;DYY-6C电泳仪:北京六一生物科技有限公司;DRP-9052型电热恒温培养箱:上海森信实验仪器有限公司;ChemiDoc XRS+化学发光成像分析系统:美国Bio-Rad公司;Vortex-Genie2可调速漩涡混合器:美国SI公司;QYC-2012C恒温摇床:上海福玛实验设备有限公司;Varioskan Flash全波长扫描式多功能读数仪、Multifuge X1R离心机:美国THERMO公司;DK-8D恒温水浴锅:上海精宏实验设备有限公司;SX-500立式压力蒸汽灭菌锅:日本TOMY公司;Thermoblock梯度PCR仪:德国Biometra公司。
1.3 方法
1.3.1 产葡萄糖氧化酶菌株的筛选
初筛:称取10 g样品,加入装有8颗玻璃珠及90 mL生理盐水的250 mL三角瓶中,30 ℃、180 r/min条件下振荡培养30 min。采用梯度稀释法,分别取200 μL不同梯度的样品稀释液涂布到初筛培养基,在28 ℃条件下培养至菌落长出,放置4 ℃冰箱,观察显色。挑取初筛培养基上呈现蓝色的菌株在PDA培养基上进行分离纯化,得到单菌落。
复筛:将初筛得到的菌株接种到液体发酵培养基中,在25 ℃、180 r/min条件下培养3~7 d,取适量发酵液离心,上清即为粗酶液,采用靛蓝胭脂红褪色分光光度计法[20]测定葡萄糖氧化酶活力。
葡萄糖氧化酶活力定义:在50 ℃、pH 6.0条件下,每分钟催化氧化产生1 μg过氧化氢所需要的酶量定义为一个酶活力单位(U/mL)。
1.3.2 高产葡萄糖氧化酶菌株的鉴定
形态观察:将高产葡萄糖氧化酶的菌株接种于PDA培养基上,在28 ℃条件下培养48~72 h,观察其菌落形态、边缘、颜色、菌丝长度等;显微镜下观察孢子及菌丝形态。
分子生物学鉴定:采用Omega真菌基因组提取试剂盒提取菌株的基因组DNA,以其为模板,采取通用引物NS1(5'-GTAGTCATATGCTTGTCTC-3')、NS8(5'-TCCGCAGGTTCACCTACGGA-3')PCR扩增18S rDNA序列。PCR扩增体系(25 μL):Es Taq Master Mix 12.5 μL,模板DNA 1 μL,NS1、NS8上下游引物各1 μL,超纯水9.5 μL。PCR扩增条件:95 ℃预变性4 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,共30个循环;72 ℃再延伸10 min。将PCR扩增产物经过1%的琼脂糖凝胶电泳检测,送去北京六合华大基因科技有限公司进行测序。测序结果提交至美国国立生物技术信息中心进行BLAST比对搜索,选取同源性较高的模式菌株的18S rDNA序列,利用MEGA6软件中的邻接法构建系统发育树。
1.3.3 葡萄糖氧化酶酶学性质研究
最适温度及其温度稳定性:分别设置30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃温度梯度,测定粗酶液在不同温度下的酶活性,并测定粗酶液分别在不同温度下保温30 min后的剩余酶活力。设定最大酶活为100%,其他酶活值与之比值,计算相对酶活。确定酶的最适反应温度及温度稳定性。
最适pH及pH稳定性:配制pH分别为3.0、4.0、5.0、6.0、7.0的缓冲液,绘制不同pH条件下过氧化氢标准曲线。测定不同pH缓冲液稀释粗酶液酶活力值,并且在4 ℃条件下不同pH缓冲液体系放置24 h后测定剩余酶活。计算相对酶活值。
金属离子对酶活性的影响:在反应体系中分别加入2 μmol/mL的Na+、Mn2+、Zn2+、Cu2+、Mg2+、Ca2+、Co2+、Fe2+、K+、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),测定酶活,以未加金属离子的酶活为100%,计算相对酶活值。
2 结果与分析
2.1 产葡萄糖氧化酶菌株的筛选
通过初筛培养基分离筛选得到3株产葡萄糖氧化酶的菌株(图1),命名为CY-12、KY-16、PT-22。
将初筛得到的3株菌株接种于液体发酵培养基进行复筛,结果见表1。由表1可知,3株菌均有产葡萄糖氧化酶活性,且在培养初期随着培养时间的延长,其葡萄糖氧化酶活性升高,至发酵第3天进入产酶高峰期,第4天后随着培养基中营养物质的消耗,产酶活性都有不同程度的下降。其中菌株CY-12葡萄糖氧化酶活性最高,发酵第3天达到194.69 U/mL,并且产酶活性较稳定,在发酵第6天仍然保持32.14%的酶活,因此,选择菌株CY-12为出发菌株。

图1 产葡萄糖氧化酶菌株的初筛结果
Fig.1 Results of preliminary screening of glucose oxidase-producing strain
表1 产葡萄糖氧化酶菌株的复筛
Table 1 Secondary screening of glucose oxidase-producing strain

2.2 产葡萄糖氧化酶菌株的鉴定
2.1.1 形态观察
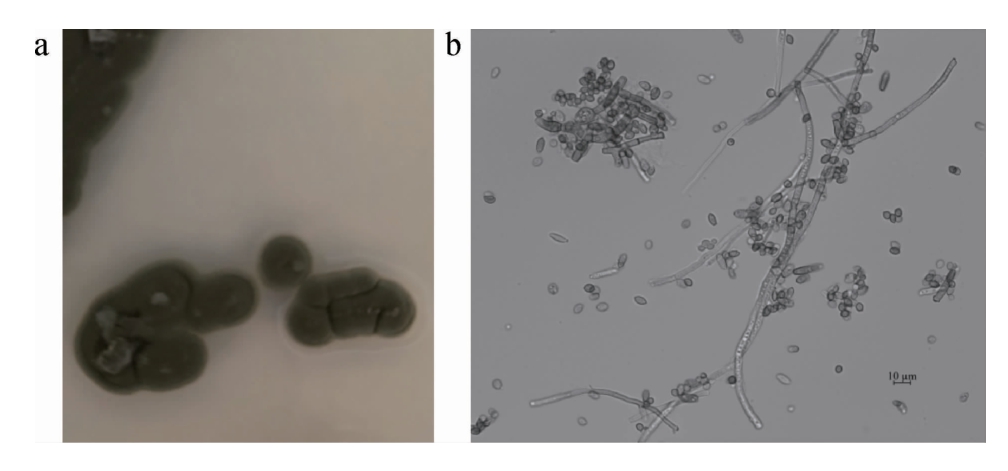
图2 高产葡萄糖氧化酶菌株CY-12的菌落(a)及细胞(b)形态
Fig.2 Colony (a) and cell (b) morphology of high glucose oxidase producing strain CY-12
由图2可知,产葡萄糖氧化酶菌株CY-12在PDA平板上菌落正面灰绿色,背面墨绿色,圆形、干燥、表面平坦,中心突起,边缘绒毛状,没有分泌物。在显微镜下观察菌丝少分支。分生孢子梗长,暗色,直立,顶部常形成分枝,单生或簇生。分生孢子暗色,1或2个细胞,形状、大小不一,有些呈典型的柠檬状。根据菌落和形态特征,初步鉴定该菌株属于枝孢属(Cladosporium sp.)。
2.1.2 分子生物学鉴定
以提取的菌株CY-12的DNA为模板,以NS1、NS8为引物PCR扩增18S rDNA序列,PCR扩增产物经1%琼脂糖凝胶电泳检测,结果见图3。
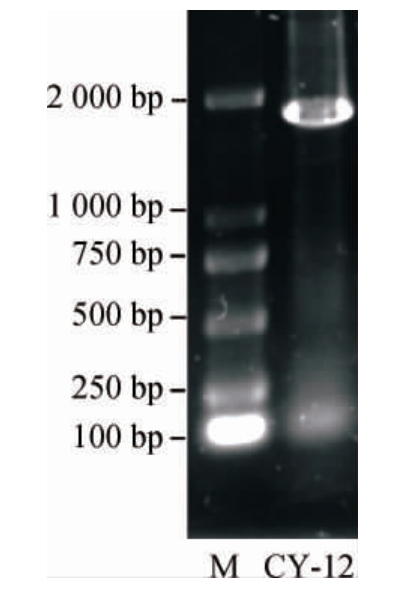
图3 PCR扩增产物琼脂糖凝胶电泳结果
Fig.3 Agarose gel electrophoresis results of PCR amplified products
M为DNA Marker。
由图3可知,PCR扩增产物碱基长度为1 700 bp左右,与预期结果相符。PCR扩增产物经过纯化后委托北京六合华大基因科技有限公司进行测序,利用MEGA6软件中的NJ法构建系统发育树,基于18S rDNA基因序列菌株CY-12的系统发育树见图4。
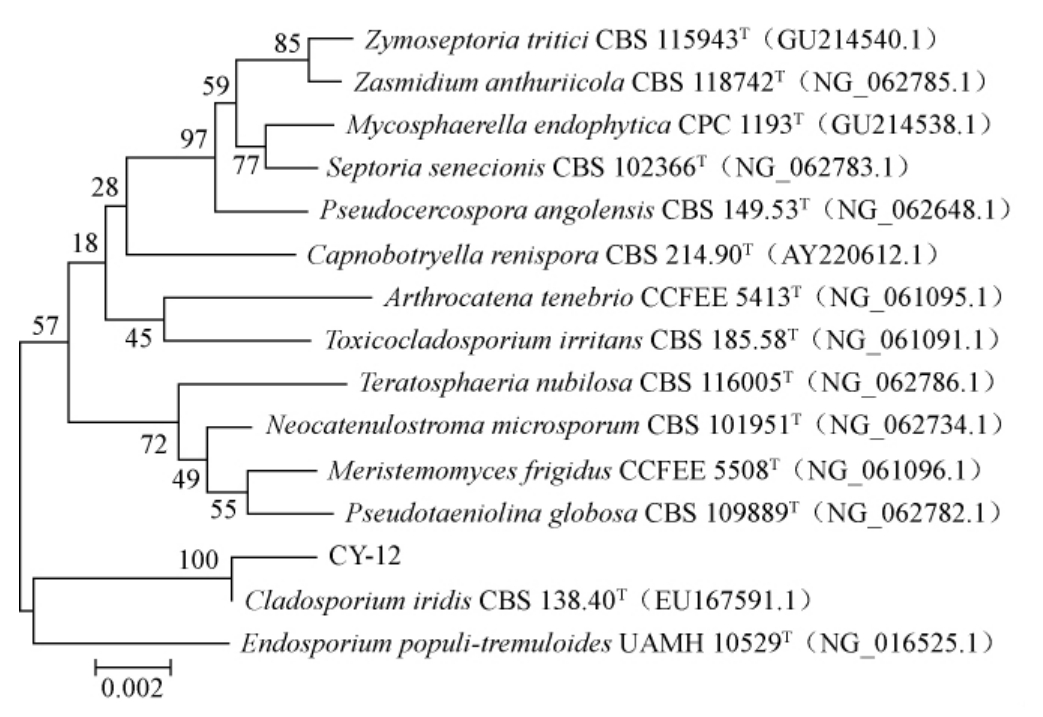
图4 基于18S rDNA基因序列菌株CY-12的系统发育树
Fig.4 Phylogenetic tree of strain CY-12 based on 18S rDNA gene sequences
由图4可知,菌株CY-12与Cladosporiumiridis CBS138.40T聚于同一分支,相似性最高。结合形态观察结果,确定菌株CY-12为枝孢属(Cladosporium sp.)。
2.3 菌株CY-2产葡萄糖氧化酶酶学性质研究
2.3.1 不同温度对葡萄糖氧化酶活性的影响
由图5可知,随着反应温度的升高,酶活性呈先升高后下降的趋势,当反应温度为60 ℃时,酶活力最高,因此确定该酶的最适反应温度为60 ℃。
由图5可知,菌株CY-12所产的葡萄糖氧化酶在50~60 ℃保温30 min,剩余酶活力均能保持在90%以上;70 ℃保温30 min有85.97%的剩余酶活;80 ℃保温30 min仍有72.93%的剩余酶活。证明该酶有较强的耐高温性能且在30~80 ℃能保持较好的温度稳定性。
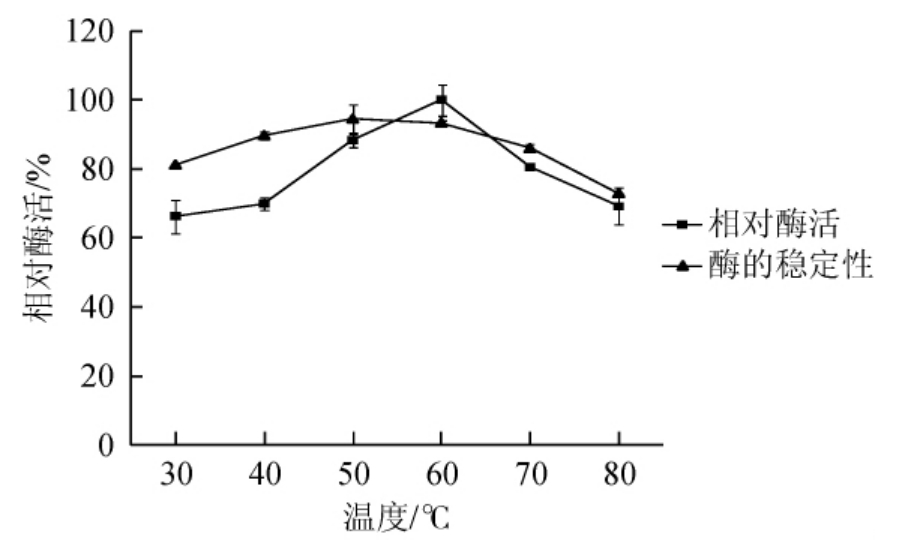
图5 温度对菌株CY-12所产葡萄糖氧化酶活力及稳定性的影响
Fig.5 Effect of temperature on the activity and stability of glucose oxidase produced by strain CY-12
2.3.2 不同pH值对葡萄糖氧化酶活性的影响
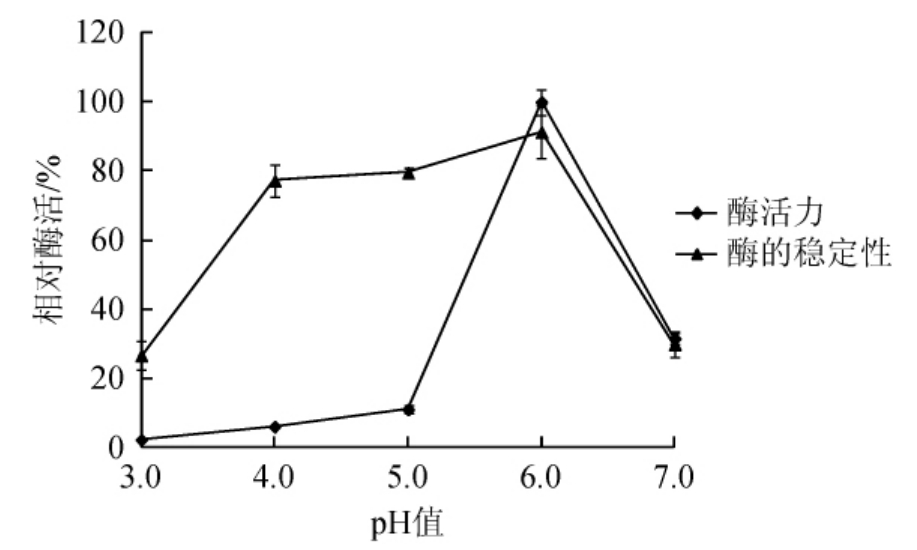
图6 pH值对菌株CY-12所产葡萄糖氧化酶活力及稳定性的影响
Fig.6 Effect of pH value on the activity and stability of glucose oxidase produced by strain CY-12
由图6可知,菌株CY-12所产的葡萄糖氧化酶在pH值<5.0条件下相对酶活力低于10%,pH值>5.0以后迅速升高,pH值为6.0时酶活力最高,随着pH值的继续升高酶活迅速降低,当pH值为7.0时,相对酶活仅剩31.44%。因此,确定该酶的最适反应pH值为6.0。
由图6可知,在pH值为3.0和7.0条件下处理24 h后,相对酶活分别为26.57%、29.79%;在pH值4.0~6.0条件处理24h后,相对酶活力均能保持在75%以上;在pH值6.0条件处理24h后,相对酶活>90%。证明该酶在中性偏酸条件下较为稳定。
2.3.3 不同金属离子对葡萄糖氧化酶活性的影响
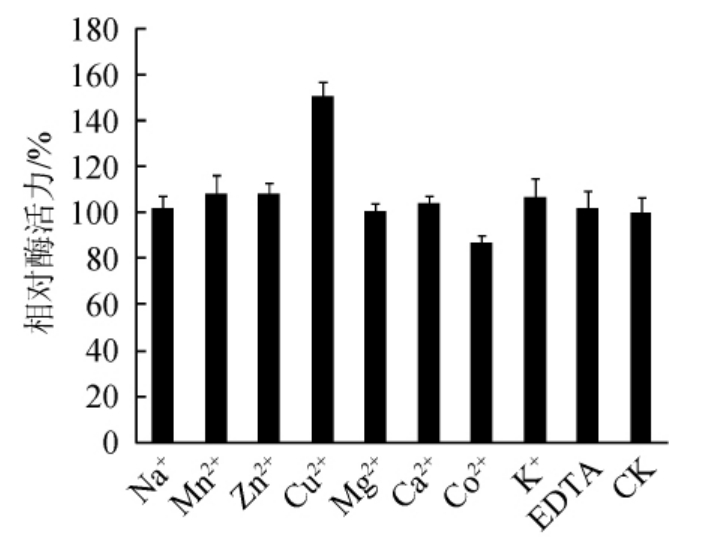
图7 金属离子对菌株CY-12所产葡萄糖氧化酶活力的影响
Fig.7 Effect of metal ions on the activity of glucose oxidase produced by strain CY-12
由图7可知,Cu2+对酶活有明显的激活作用,相对酶活达到151.13%;Co2+对酶活有明显的抑制作用,相对酶活降至86.66%;其他离子对酶活作用不明显。
3 结论
经过初筛、复筛,从河南长垣黄河滩地葡萄根际土壤中筛选得到1株高产胞外葡萄糖氧化酶的菌株CY-12,其葡萄糖氧化酶活力最高可达194.69 U/mL。通过形态观察和分子生物学技术鉴定,鉴定菌株CY-12为枝孢属(Cladosporium sp.)。该葡萄糖氧化酶酶促反应的最适反应温度为60 ℃,在30~80 ℃范围内温度稳定性较好;最适反应pH值为6.0,在pH 4.0~6.0范围内稳定性较好。Cu2+对酶活有明显的激活作用;Co2+对酶活有明显的抑制作用。
[1]郭贺楠,杨勇智,董冰.葡萄糖氧化酶研究进展[J].中国畜牧杂志,2018,54(4):10-14.
[2]GOLIKOVA E P,LAKINA N V,GREBENNIKOVA O V,et al.A study of biocatalysts based on glucose oxidase[J].Faraday Discuss,2017,202(9):303-314.
[3]BAYKAL E,VARDAR G,ATTAR A,et al.Complexes of glucose oxidase with chitosan and dextran possessing enhanced stability[J].Prep Biochem Biotech,2020,50(6):572-577.
[4]NING X,ZHANG Y,YUAN T,et al.Enhanced thermostability of glucose oxidase through computer-aided molecular design[J].Int J Mol Sci,2018,19(2):425-436.
[5]MANO N.Engineering glucose oxidase for bioelectrochemical applications[J].Bioelectrochemistry,2019,128(3):218-240.
[6]郭卢云,罗彤.葡萄糖氧化酶的催化机理及其在食品中的应用现状[J].现代食品,2018,24(6):15-22.
[7]侯瑾,李迎秋.葡萄糖氧化酶的研究进展及其在饲料工业中的应用[J].江苏调味副食品,2016,146(3):9-12.
[8]宋荣斌,朱俊杰.酶生物燃料电池自供能传感器的研究现状及应用[J].分析科学学报,2017(5):101-105.
[9]CICHELLO S A.Oxygen absorbers in food preservation:a review[J]. J Food Sci Tech,2015,52(4):1889-1895.
[10]李蓉,张庆芳,迟乃玉.微生物葡萄糖氧化酶的研究进展[J].中国酿造,2018,37(3):1-5.
[11]方军成,宋聪,尤瑞祺,等.葡萄糖氧化酶的生产及其在动物生产中的应用[J].畜牧与兽医,2016,48(10):125-129.
[12]叶日英,徐德峰,孙力军,等.海洋源高产葡萄糖氧化酶细菌的筛选和主要酶学性质[J].浙江农业学报,2018,30(4):672-678.
[13]刘春莹,王一茜,迟乃玉,等.海洋低温葡萄糖氧化酶的菌种选育及发酵条件优化[J].中国酿造,2019,38(4):110-115.
[14]辛国芹,董佩佩,汪祥燕,等.产葡萄糖氧化酶菌株的诱变筛选及遗传稳定性研究[J].中国酿造,2016,35(11):69-72.
[15]WONG C M,WONG K H,CHEN X D.Glucose oxidase:natural occurrence,function,properties and industrial applications[J].Appl Microbiol Biot,2008,78(6):927-938.
[16]高庆华,胡美荣,吴芳彤,等.点青霉葡萄糖氧化酶基因的克隆及其酶学性质研究[J].生物技术通报,2016,32(7):152-159.
[17]鲍士旦.土壤农化分析[M].第三版.北京:中国农业出版社,2000:14-15.
[18]刘峰,刘鹭强,林颖,等.从土壤中快速筛选葡萄糖氧化酶产生菌及发酵工艺的优化[J].生物技术,2007,17(3):64-68.
[19]朱运平,褚文丹,李秀婷,等.1 株产胞外葡萄糖氧化酶黑曲霉的液体发酵条件优化[J].中国食品学报,2014,14(5):90-97.
[20]周建芹,陈韶华,王剑文.测定葡萄糖氧化酶活力的一种简便方法[J].实验技术与管理,2008,25(12):58-60.