红腐乳是我国北方最具代表性的腐乳产品,以其独特的气味、鲜美的滋味、细腻的口感而深受国内外广大消费者的喜爱[1-2]。与其他类腐乳相比,红腐乳因其汤料中添加红曲,颜色通常呈诱人的鲜红色或枣红色[3]。红曲(Monascus)又称红曲米、丹曲,是以大米为原料,经红曲霉(Monascus sp.)发酵制成,其颜色呈赤红色,具有性温、味甘等特点[4]。红曲霉是我国重要的传统食用和药用微生物,其在发酵过程中能产生红曲色素及多种有机酸、酯和醇等芳香物质[5]、分泌多种酶如淀粉酶、脂肪酶、蛋白酶等[6],同时能代谢产生洛伐他汀[7]、γ-氨基丁酸[8]等具有生理活性的次级代谢产物[9-11]。洛伐他汀是Monacolin K的闭环形式(内酯型),具有抑制胆固醇合成、保护肾脏、抗动脉粥样硬化、预防癌症等功能[12-17],但部分红曲霉在代谢产生多种具有生理活性的化合物的同时,也能产生对人体具有致癌致畸作用的肾毒性真菌毒素——桔霉素[18],这极大地限制了红曲以及红曲发酵产品的开发和应用。因此,筛选出高产功效因子、低产桔霉素等毒性化合物的生产菌株,是生产高品质红曲霉发酵产品的关键。
由于红曲具有降血压的功效,并带有甘味及抑制杂菌的作用,加上红曲的发酵作用,可将其用于含盐或低盐的发酵食品,为高血压患者提供健康美食。如在红腐乳发酵过程中,添加高产洛伐他汀的红曲菌,增强腐乳降血压保健功效。目前的研究主要集中于红曲霉产洛伐他汀工艺条件的优化及诱变选育,鲜有高产洛伐他汀红曲霉在腐乳中的应用。
本研究通过对红曲菌株进行形态观察、生理生化试验及分子生物学技术,采用超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)法分析红曲菌株发酵液中桔霉素和洛伐他汀的含量,选育高产洛伐他汀低产桔霉素的红曲霉优良功能菌株,并将其用于功能红腐乳的制备,分析其产品感官、理化及微生物指标,以期为功能性红腐乳的产业化生产提供一定的科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
红曲菌株M1、M2:武汉佳成生物制品有限公司;红曲菌株M3:北京王致和食品集团有限公司;红曲菌株M4、M5:福建省古田县生华红曲有限公司;红曲菌株M6、雅致放射毛霉(Actinomucor elegans):北京市食品酿造研究所。
1.1.2 试剂
洛伐他汀(纯度>99.5%)、桔霉素(纯度>99.5%):中国食品药品检定所;甲醇(色谱纯):德国Merck公司;真菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国OMEGA公司;ExTaq酶:美国NEB公司;引物的合成由北京奥克鼎盛生物科技有限公司完成;大豆、食盐、香辛料、白砂糖、食用酒精、某品牌红腐乳:市售;面黄:北京二商王致和食品有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[19]:去皮马铃薯200 g切成小块,加1 L蒸馏水煮30 min,双层纱布过滤,滤液中加入20 g葡萄糖,蒸馏水补充至1 L,固体培养基中加入2%琼脂,121 ℃高压蒸汽灭菌30 min。
察氏琼脂(Czapek-dox agar,CA)培养基[19]:葡萄糖30 g、NaNO3 3 g、K2HPO4 1 g、KCl 0.5 g、MgSO4·7H2O 0.5 g、FeSO4 0.01 g、琼脂20 g,蒸馏水补充至1 L,pH自然,121 ℃高压蒸汽灭菌30 min。
麦芽汁琼脂(malt extract agar,MEA)培养基[20]:10°Bx麦芽汁100 mL,琼脂2 g,121 ℃高压蒸汽灭菌30 min。
发酵培养基:14.4°Bx饴糖溶液100 mL,蛋白胨5 g,可溶性淀粉5 g,冰醋酸0.2 mL,pH 4.5~5.0,蒸馏水补充至1 L,121 ℃高压蒸汽灭菌30 min。
1.2 仪器与设备
1290 infinity II超高效液相色谱仪-6470串联四级杆质谱:美国Agilent公司;5810/5810R高速冷冻离心机:德国Eppendorf公司;BX53MRF-S显微镜:日本奥林巴斯公司;BT25S电子天平:Sartorius科学仪器(北京)有限公司;Milli-Q纯水仪:美国Millipore公司;SW-CJ系列超净工作台:苏州安泰空气技术有限公司;CH-4103摇床:瑞士Infors生物技术有限公司;DHG-9051A电热恒温干燥箱、DHP-9051B微生物培养箱:上海一恒科学仪器有限公司;T100梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:伯乐生命医学产品(上海)有限公司。
1.3 试验方法
1.3.1 红曲菌株的鉴定[21-22]
形态观察:采用点种法将5株菌株(M1~M5)分别接种于PDA、MEA及CA培养基,于30 ℃条件下培养7 d进行观察记录。观察菌落大小、正背面颜色、形状、菌丝体形态等。采用粘片法对菌株的个体形态进行观察。
生理生化试验:以察氏培养基为基础培养基,测定5株菌株对不同碳源(果糖、麦芽糖、葡萄糖、蔗糖、乳糖、山梨糖)及氮源(硫酸铵、氯化铵、硝酸钠、亚硝酸钠、牛肉膏、酵母膏、大豆蛋白)的利用能力,并进行明胶水解试验。
分子生物学鉴定:采用真菌基因组提取试剂盒提取5株菌株的DNA,以其为模板,采用18S rDNA通用引物对NS1(5'-GTAGTCATATGCTTGTCTC-3')和NS8(5'-TCCGCAGGTTCACCTACGGA-3')对5株菌株的18S rDNA区基因序列进行PCR扩增。PCR扩增体系(50 μL):10×Ex Buffer 5 μL、ExTaq酶0.5 μL、脱氧核糖核苷三磷酸(deoxy-ribonu cleoside triphosphate,dNTP)8 μL、引物1 μL、模板1 μL,用无菌水补充至50 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃再延伸10 min。PCR扩增产物经1%琼脂糖凝胶检测合格后委托北京华大基因测序公司进行测序,测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)搜索比对,选取同源性较高的模式菌株的18S rDNA序列,采用MEGA 6.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.2 高产洛伐他汀低产桔霉素红曲霉菌株的筛选
将5株红曲霉菌株分别接种于发酵培养基中,在30 ℃、180 r/min条件下振荡培养5 d,取30 mL发酵液,采用UPLCMS/MS测定洛伐他汀和桔霉素含量,试验重复3次。
1.3.3 功能红腐乳加工工艺流程及操作要点[23-24]
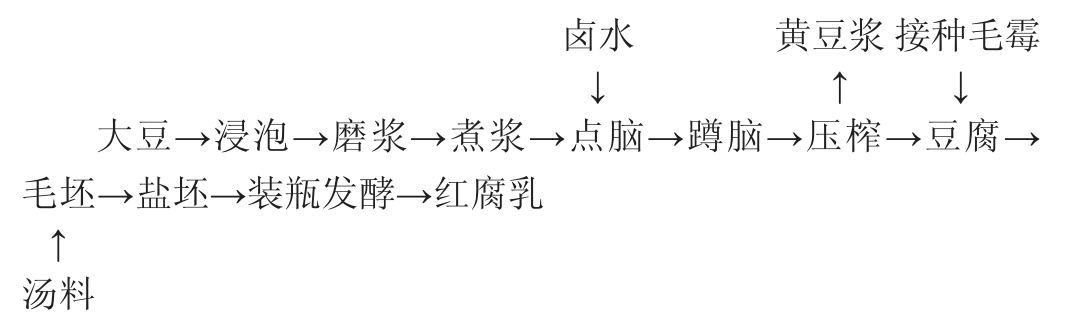
操作要点:
大豆、浸泡:挑选颗粒饱满、硕大的黄豆,去除杂质,清洗浸泡,加入大豆质量3倍左右的水,室温下浸泡18 h。
磨浆、煮浆:将浸泡好的大豆沥净水,加入浸泡大豆质量2.5倍左右的水,采用豆腐机磨浆,将豆浆抽入常压煮浆罐中,通过蒸汽将豆浆加热至95 ℃,保持3 min。
点脑、蹲脑:豆浆温度在室温下自然降至90 ℃时,边搅动边缓慢加入10%左右的氯化镁溶液,待液体逐渐澄清时停止加入,添加量一般为大豆质量的2%,点脑的豆浆静置20 min左右。
压榨、切块:将豆腐脑倒入压榨机中压榨,保证豆腐水分含量在70%左右,将豆腐切成2.0 cm×1.5 cm的豆腐块,即为豆腐白坯。
接种雅致放射毛霉:将前期筛选的高产蛋白酶的雅致放射毛霉配制成107 CFU/mL的菌悬液,待豆腐白坯温度降至30 ℃左右,在豆腐白坯的六个面均匀接种。
毛坯:室温发酵72 h。雅致放射毛霉发酵过程中,要随时检查菌丝的生长情况。
盐坯:毛坯经搓毛之后,排码平整,均匀撒盐,从下往上码一层坯子,撒一层盐,盐量逐渐加大,装满后撒上一层封顶盐,腌制5 d左右。盐量为1 000块毛坯用盐10~12 kg。
添加汤料:汤料主要包括红曲(利用高产洛伐他汀低产桔霉素丛毛红曲霉M2)、面黄、香辛料、白砂糖、酒精和水。将45 g红曲米和285 g面黄与香辛料的混合物加入900 mL酒精(28%vol)后浸泡过夜,次日加入360 g白糖、360 mL水和300 mL酒精(45%vol)后研磨均匀即成红方汤料。将汤料均匀撒入盐坯,使每块盐坯的各面都沾上汤料。
装瓶发酵:将沾有汤料的盐坯立即装入坛内,灌满汤料,35~38 ℃条件下发酵70~90 d,成熟后即得成品功能性红腐乳。
1.3.4 功能红腐乳产品品质的测定
感官指标及理化指标(水分含量、氨基酸态氮、水溶性蛋白质、总酸和食盐含量):参照商业标准SB/T 10170—2007《腐乳》测定[25];微生物指标(大肠菌群、金黄色葡萄球菌、沙门氏菌):参照国家标准GB 29921—2013《食品安全国家标准食品中致病菌限量》测定[26]。
1.3.5 洛伐他汀及桔霉素含量的测定
采用UPLC-MS/MS法测定洛伐他汀和桔霉素含量。
标准溶液的制备:分别准确称取洛伐他汀和桔霉素标准品各1.00 mg,用体积分数90%甲醇溶解并定容至10 mL,配制成质量浓度为0.1 mg/mL的标准溶液储备液。
样品前处理:取适量的红腐乳块样品,淋干汤汁,均质并混合均匀。准确称取0.1 g(精确至0.01 g)样品,加入体积分数90%的甲醇定容至10 mL,摇匀后12 000 r/min离心5 min,取上清液。
UPLC条件:Eclipse Plus C18色谱柱(50 mm×3.0 mm,1.8 μm);柱温40 ℃;流动相:A为0.1%甲酸溶液,B为乙腈;流速0.4 mL/min;流动相梯度洗脱程序:0~2 min,0.1%甲酸溶液80%;2~4 min,0.1%甲酸溶液20%;4 min之后0.1%甲酸溶液80%;进样量1.0 μL。
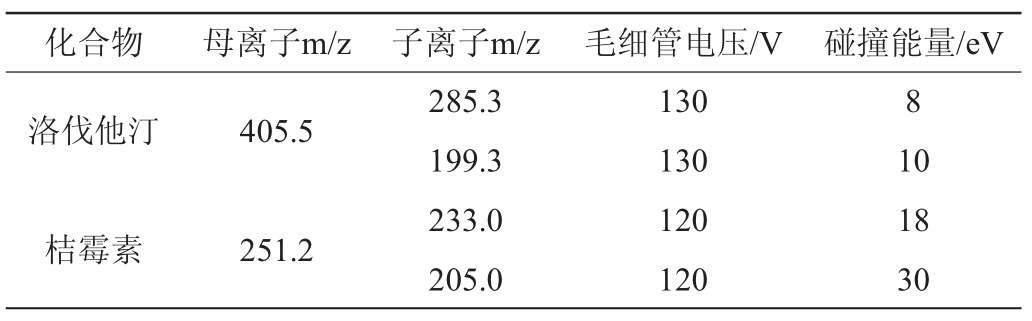
MS条件:电喷雾离子(electron spray ionization,ESI)源,喷雾电压3000V,辅助气气化温度200℃,鞘气流速11mL/min,鞘气温度325 ℃。多反应监测(multiple reaction monitoring,MRM)质谱参数见表1。
定性定量方法:配制质量浓度分别为1.0μg/mL、2.5μg/mL、5.0 μg/mL、10.0 μg/mL、25.0 μg/mL、50 μg/mL的混合标准品溶液,在选定的仪器条件下进行测定,分别以洛伐他汀和桔霉素的质量浓度(X)为横坐标,对应的峰面积(Y)为纵坐标,绘制洛伐他汀和桔霉素标准曲线,按照标准曲线回归方程计算样品中目标化合物质量浓度。
表1 目标化合物多反应监测质谱参数
Table 1 Mass spectrum parameters of multiple reaction monitoring of target compounds
2 结果与分析
2.1 洛伐他汀及桔霉素的测定
洛伐他汀和桔霉素标准品溶液及菌株M2发酵液的UPLC-MS/MS色谱图见图1。由图1可知,洛伐他汀和桔霉素标准品的出峰时间分别为1.622 min和2.334 min,发酵液中的洛伐他汀和桔霉素的出峰时间分别为1.619 min和2.351 min。结果表明,样品与标准品洛伐他汀和桔霉素保留时间一致,标准品、样品峰型良好。

图1 洛伐他汀和桔霉素标准溶液(A)和菌株M2发酵液(B)色谱图
Fig.1 Chromatograms of lovastatin and citrinin standard solution (A)and fermentation liquid of strain M2 (B)
以洛伐他汀和桔霉素含量(X)为横坐标,峰面积(Y)为纵坐标,绘制洛伐他汀和桔霉素标准曲线,得到洛伐他汀和桔霉素标准曲线回归方程分别为Y=43.557 110X+42.910 902、Y=843.573 305X-17.908 294,相关系数分别为R2=0.999 0、R2=0.999 9,说明在0.1~50 ng/mL的质量浓度范围内,峰面积与洛伐他汀和桔霉素含量之间的线性关系良好,可用于菌株发酵液中洛伐他汀及桔霉素产量的测定。
2.2 菌株的鉴定
2.2.1 形态观察
将5株红曲菌株(M1~M5)分别在PDA培养基、麦芽汁培养基及察氏培养基上培养7 d后,观察菌落及细胞形态,其代表菌株M2的菌落形态见图2,显微形态见图3。
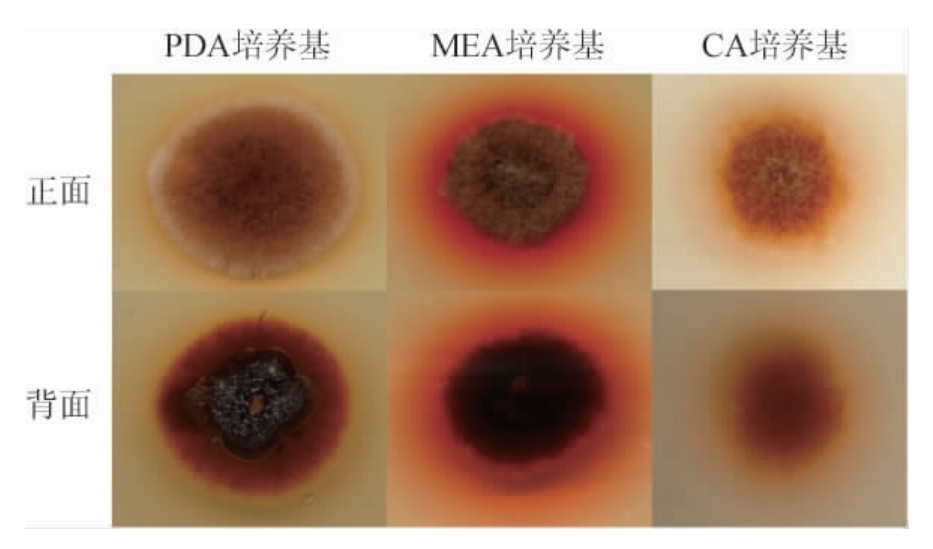
图2 不同培养基上菌株M2的菌落形态
Fig.2 Colonial morphology of strain M2 on different media
由图2可知,菌株M2在PDA培养基上生长最好,MEA培养基次之,CA培养基最差,且均在PDA培养基上菌丝呈绒状,正面颜色由橙色到白色,背面颜色由葡萄酱紫色到橙色,褶皱不明显,边缘整齐,隆起并裂开;在MEA培养基上菌丝呈绒毡状,正面颜色由橙色到白色,背面为葡萄酱紫色,有明显褶皱,边缘不整齐;在CA培养基上菌丝呈从卷毛状,正面颜色由橘色到橙色,背面颜色由橘色到橙色,无明显褶皱,边缘不整齐。

图3 菌株M2的显微形态
Fig.3 Microscopic morphology of strain M2
a为细胞横隔;b为分杈菌丝;c为分生孢子;d为闭囊壳。
由图3可知,菌株M2的菌丝具有细胞横隔,分支甚繁,且不规律,分生孢子呈球形或梨形,着生在菌丝及其分支的顶端,单生或2~6个,呈链状;闭囊壳呈球形,有柄,柄长短不一,闭囊壳内散生十多个子囊,子囊呈球形,含子囊孢子,成熟后子囊壁解体,孢子剩留在薄壁的闭囊壳内。
2.2.2 生理生化试验
5株菌株的生理生化试验结果见表2。
表2 5株菌株的生理生化试验结果
Table 2 Results of physiological and biochemical tests of 5 strains
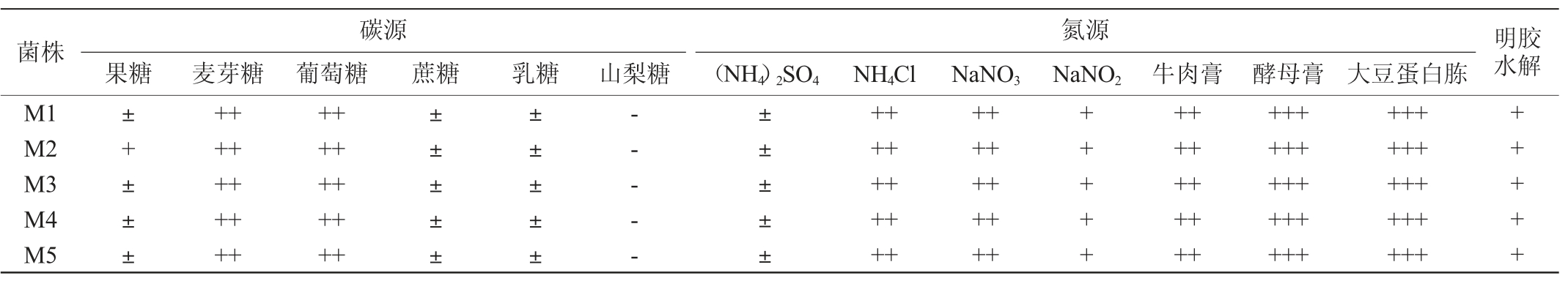
注:“+++”表示生长良好,“++”表示生长较好,“+”表示生长一般或结果呈阳性,“±”表示略有生长,“-”表示不能生长。
由表2可知,5株菌株均可以很好地利用麦芽糖、葡萄糖,微弱利用果糖、蔗糖、乳糖,但不能利用山梨糖,可以很好地利用硝酸钠、牛肉膏、酵母膏及大豆蛋白胨,但对其他无机氮源的利用能力较差。5株菌株均能使明胶液化。结合形态观察,参照《红曲菌的形态与分类学》[27],发现该菌株各项特征与曲霉科(Aspergillaceae)红曲霉属(Monascus sp.)的特征基本一致,初步鉴定5株菌株均为红曲霉属(Monascus sp.)。
2.2.3 分子生物学鉴定
基于18S rDNA基因序列5株菌株的系统发育树见图4。由图4可知,菌株M1、M3、M4、M5均与紫色红曲霉(Monascus purpureus)strain ATCC 16358(AB477243.1)聚于一支,亲缘关系最近;菌株M2与丛毛红曲霉(Monascus pilosus)strainCBS 286.34(KY635852.1)聚于一支,亲缘关系最近。

图4 基于18S rDNA基因序列5株菌株的系统发育树
Fig.4 Phylogenetic tree of 5 strains based on 18S rDNA gene sequences
结合形态观察、生理生化试验结果,最终鉴定菌株M1、M3、M4、M5均为紫色红曲霉(Monascus purpureus),菌株M2为丛毛红曲霉(Monascus pilosus)。
2.3 高产洛伐他汀低产桔霉素红曲霉菌株的筛选
采用UPLC-MS/MS法测定5株红曲霉菌株发酵液中的洛伐他汀及桔霉素产量,结果见表3。
表3 5株红曲霉菌株的洛伐他汀及桔霉素检测结果
Table 3 Determination results of lovastatin and citrinin of 5 strains of Monascus sp.
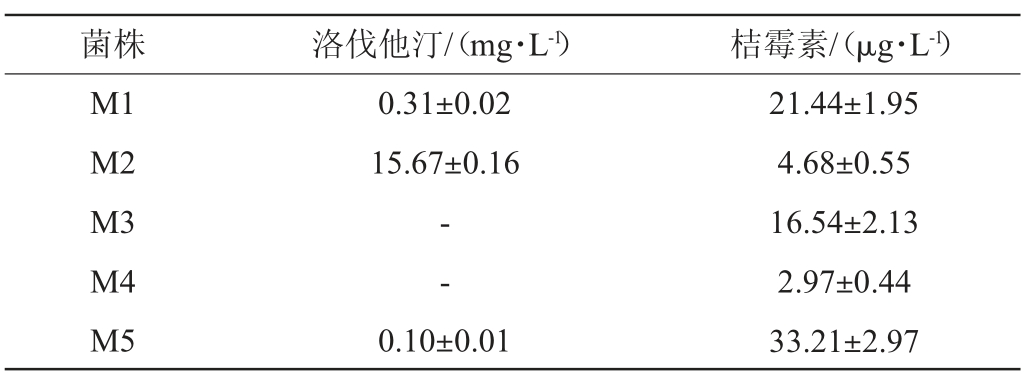
注:“-”表示未检出。
由表3可知,红曲菌株M2发酵液中的洛伐他汀产量最高,为15.67 mg/L,红曲菌株M1和M5洛伐他汀产量分别为0.31 mg/L、0.10 mg/L,红曲菌株M3、M4发酵液中均未检出洛伐他汀。5株红曲霉菌株的培养液中均检出桔霉素,含量在2.97~33.21 μg/L。因此,筛选出丛毛红曲霉M2为高产洛伐他汀低产桔霉素的菌株。黑利生等[28]从红曲米中筛选并鉴定得到一株洛伐他汀产量较高的紫色红曲霉MPT13;唐旭等[29]通过发酵罐补料液体发酵紫色红曲霉,洛伐他汀产量最高达79.83 mg/L;游玟娟等[30]对高产洛伐他汀突变株Monascus sp.UV-D-9的发酵条件进行了响应曲面优化,在最优发酵条件下,洛伐他汀产量达到(0.32±0.014)mg/mL。
2.4 红腐乳的品质分析
2.4.1 感官指标
将丛毛红曲霉M2用于功能红腐乳的制备,并以市售某品牌红腐乳为对照,测定红腐乳的感官指标并进行比较,结果见表4。
表4 两种红腐乳感官指标的测定结果
Table 4 Determination results of sensory indexes of two kinds of red sufu

由表4可知,功能红腐乳色泽枣红、滋味鲜美、咸淡适宜、具有红腐乳特有的气味、质地细腻、块形整齐、无外来可见杂质,其感官指标满足商业标准SB/T 10170—2007《腐乳》[25]要求。
2.4.2 理化指标
以市售某品牌红腐乳为对照,测定功能红腐乳的理化指标并进行比较,结果见表5。
表5 两种红腐乳理化指标的测定结果
Table 5 Determination results of physiochemical indexes of two kinds of red sufu

注:“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。
由表5可知,功能红腐乳中水分、氨基酸态氮、水溶性蛋白质、总酸和食盐含量分别为70.7%、0.74g/100g、7.10g/100g、0.91 g/100 g、8.17 g/100 g,理化指标均满足商业标准SB/T 10170—2007《腐乳》的要求,且氨基酸态氮、水溶性蛋白质以及总酸含量均极显著高于某品牌红腐乳(P<0.01)。
2.4.3 微生物指标
以市售某品牌红腐乳为对照,测定功能红腐乳的微生物指标并进行比较,结果见表6。
表6 两种红腐乳微生物指标的测定结果
Table 6 Determination results of microbial indexes of two kinds of red sufu

注:n为同一批次产品应采集的样品件数;c为最大可允许超出m值的样品数;m为微生物指标可接受水平的限量值;M为微生物指标的最高安全限量值。
由表6可知,两种红腐乳中大肠菌群和金黄色葡萄球菌群均<10 CFU/g,致病菌沙门氏菌均未检出。结果表明,功能红腐乳微生物指标满足GB/T 2712—2014《食品安全国家标准豆制品》[31]、GB 29921—2013《食品安全国家标准食品中致病菌限量》[26]要求。
2.5 功能红腐乳中洛伐他汀和桔霉素含量的测定
采用UPLC-MS/MS对功能红腐乳产品中洛伐他汀和桔霉素含量进行分析,并与某品牌红腐乳进行比较,结果见图5。

图5 功能红腐乳与某品牌红腐乳洛伐他汀和桔霉素含量的比较
Fig.5 Comparison of lovastatin and citrinin contents between functional red sufu and a red sufu
由图5可知,功能红腐乳中洛伐他汀含量为17.08 mg/kg,远高于市售某品牌红腐乳,功能红腐乳中桔霉素含量为105.77 μg/kg,低于市售某品牌红腐乳,说明功能红腐乳具有良好的开发应用前景。
3 结论
通过形态观察、生理生化试验及分子生物学技术鉴定5株红曲霉菌株中菌株M1、M3、M4、M5均为紫色红曲霉(Monascus purpureus),菌株M2为丛毛红曲霉(Monascus pilosus)。其中,丛毛红曲霉M2发酵液中洛伐他汀产量最高为15.67 mg/L,桔霉素产量为4.68 μg/L。将高产洛伐他汀低产桔霉素的菌株M2应用于功能红腐乳的开发,其感官指标、理化指标及微生物指标均符合相关标准要求,与市售某品牌红腐乳相比,其洛伐他汀含量(17.08 mg/kg)较高,桔霉素含量(105.77 μg/kg)较低,为功能红腐乳的深入研究奠定了基础。
[1]蒋丽婷,李理.HS-SPME 结合GC-MS 测定白腐乳中挥发性风味成分[J].中国酿造,2011,30(3):150-155.
[2]马勇,韩北忠,王家槐.腐乳生产过程中食盐对蛋白质、脂肪水解的影响[J].中国酿造,2002,21(1):15-18.
[3]杨琪娜.腐乳的研究概括[J].当代化工研究,2018(12):49-50.
[4]沈士秀.红曲的研究、生产及应用[J].食品工业科技,2001,22(1):85-87.
[5]ERKAYA S,ARSLAN N P,ORAK T,et al.Evaluation of tyrosol and farnesol as inducer in pigment production by Monascus purpureus ATCC16365[J].J Basic Microb,2020,60(8):Doi:10.1002/jobm.202000037.
[6]罗佳,李涛,吴纯洁,等.固态发酵红曲发酵过程中消化酶的动态变化分析[J].食品科技,2017,42(5):14-18.
[7]何珺珺,时伟,李喆,等.响应面法优化红曲霉发酵酒糟产洛伐他汀工艺[J].中国酿造,2020,39(8):77-81.
[8]陈璨.红曲霉产GABA、桔霉素相关基因的克隆[D].金华:浙江师范大学,2015.
[9]陈景智,王力超,李亮,等.红曲霉洛伐他汀的液态发酵及其分离纯化研究[J].食品与发酵工业,2019,45(2):35-42.
[10]李维.红曲米的抑菌作用和脱腥效果研究[D].广州:华南农业大学,2016.
[11]张郡莹,杨强,张婵,等.4 株红曲霉发酵产生次级代谢产物的分析[J].食品安全质量检测学报,2014(1):148-153.
[12]何录明.红曲霉产洛伐他汀开闭环组分与麦角固醇的研究[D].福州:福建农林大学,2019.
[13]付海平,林亲录,何煜波.红曲霉中Monacolin K 的研究进展[J].中国食品添加剂,2003(6):50-54.
[14]王炎焱,赵征,黄烽,等.红曲抗炎作用的实验研究[J].中国新药杂志,2006(2):96-98.
[15]李浩然,冯雅丽,伍军.降脂红曲研究进展[J].北京农学院学报,2001,16(3):80-85.
[16]赵娜,张红星,谢远红,等.一株高产Monacolin K 紫红曲霉菌株筛选、鉴定及发酵条件优化[J].天然产物研究与开发,2019,31:1326-1331.
[17]李永军,杜明.脑卒中患者血清CHIL1、AnnexinA1 与颈动脉粥样硬化斑块的关系及洛伐他汀干预效果[J].海南医学,2017,28(4):540-543.
[18]吴宏,代文婷,连喜军,等.不同液态发酵基质对红曲霉产红曲色素及桔霉素的影响[J].中国酿造,2018,37(11):91-94.
[19]许春艳,孙宝国,徐友强,等.合成己酸乙酯酯化酶产生菌的鉴定及产酶条件优化[J].中国食品学报,2020,20(5):138-147.
[20]朱敬先,张立欣,高顺强,等.林生地霉培养基形态学观察及生理学实验[J].中国真菌学杂志,2007(5):261-263,288.
[21]郭红珍.山西老陈醋大曲红曲霉分离鉴定及生物学特性研究[D].晋中:山西农业大学,2004.
[22]许楚旋,吕梦霞,王嘉琦,等.5 种高产洛伐他汀曲霉的筛选和鉴定[J].湖南农业科学,2018(3):1-6.
[23]XU D D,WANG P,ZHANG X,et al.High-throughput sequencing approach to characterize dynamic changes of the fungal and bacterial communities during the production of sufu,a traditional Chinese fermented soybean food[J].Food Microbiol,2020,86:103340.
[24]WANG P,MA X R,WANG W P,et al.Characterization of flavor fingerprinting of red sufu during fermentation and the comparison of volatiles of typical products[J].Food Sci Human Wellness,2019,8(4):375-384.
[25]中华人民共和国商务部.SB/T 10170—2007 腐乳[S].北京:中国标准出版社,2007.
[26]中华人民共和国国家卫生和计划生育委员会.GB 29921—2013 食品安全国家标准食品中致病菌限量[S].北京:中国标准出版社,2013.
[27]李钟庆.红曲菌的形态与分类学[M].北京:中国轻工业出版社,2003.
[28]黑利生,周红杰,秘鸣,等.1 株产洛伐他汀红曲菌的筛选和鉴定[J].中国农学通报,2014,30(6):314-320.
[29]唐旭,赵淼,刘洪,等.产洛伐他汀紫红色红曲霉的发酵罐补料液体发酵的研究[J].化学研究与应用,2017,29(8):1207-1210.
[30]游玟娟,温拥军.高产洛伐他汀红曲霉(Monascus sp.UV-D-9)的发酵条件优化[J].食品工业科技,2017,38(7):141-144,150.
[31]中华人民共和国国家卫生和计划生育委员会.GB/T 2712—2014 食品安全国家标准豆制品[S].北京:中国标准出版社,2014.