酵母菌是白酒发酵工业中的核心微生物,与白酒的品质息息相关[1]。一般酵母菌的乙醇发酵温度为28~33 ℃[2],这一条件限制了酵母在较高温度下进行正常的生产作业[3],也大大提高了乙醇生产的成本。白酒的独特风味主要是产香酵母产生的酯类、酸、醇等微量物质[4],这些微量物质决定了白酒的风格与品质[5],如酱香型白酒主要是靠乙酸乙酯和乳酸乙酯形成的主体香[6]。使用耐高温产香酵母不仅能缩短生产周期,提高发酵产率[7],有利于降低生产水耗、电耗[8],保证在夏季高温下正常生产[9-10],而且有利于白酒的香味物质形成及品质的提高[11-12]。
目前,对白酒生产中既耐高温又产香能力强的酵母的研究报道还比较少,如王珍等[13]从凤型大曲中筛选出耐高温高产乙醇酵母,但缺乏对其产香能力进行研究;根据张俊杰等[14]研究报道,筛选出了一株产香性能较好的酵母菌,但其最佳发酵温度是28 ℃,不利于夏季的生产。因此研究白酒生产中的耐高温产香酵母十分必要。
本研究从酱香型白酒窖醅中筛选一株耐高温产香酵母,通过形态观察、生理生化试验及分子生物技术对其进行鉴定,并对其乙醇耐受性和产乙醇能力进行研究,同时运用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)结合气相色谱-质谱联用(gas chromatographymass spectrometer,GC-MS)仪测定该菌株固态发酵产物中的挥发性香气成分,为其在白酒的后期研究和应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酱香型白酒窖醅:四川郎酒股份有限公司;某品牌酵母:市售。
1.1.2 主要试剂
葡萄糖、硫酸镁、无水氯化钙、磷酸二氢钾、硝酸钾、琼脂(均为分析纯):成都科隆化学品有限公司;酵母膏、蛋白胨、牛肉膏(均为生化试剂):北京奥博星生物技术有限责任公司;小麦、高粱:市售。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:蛋白胨10 g,酵母粉10 g,葡萄糖10 g,蒸馏水1 L,自然pH值。固体培养基中加入20 g琼脂。121 ℃高压蒸汽灭菌20 min。
葡萄糖发酵培养基[14]:葡萄糖200 g,尿素5 g,CaCl2 0.55g,蛋白胨10g,KH2PO41g,酵母膏6g,MgSO4·7H2O 1.5 g,蒸馏水1 L。121 ℃高压蒸汽灭菌20 min。
固态产香培养基[15]:高粱整粒与碎粒质量比为3∶1,小麦全粉碎,高粱与小麦质量比为1∶1,混匀,100 g固体培养基中加入60 mL 95 ℃的热水,润粮5 h,121 ℃高压蒸汽灭菌20 min,加入200 U/g淀粉的糖化酶,在60 ℃条件下保温2 h,分装,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
6890N-5975B气质联用仪:安捷伦科技(中国)有限公司;SW-CJ-IFD超净工作台:苏州金净净化设备有限公司;BSC-250恒温恒湿培养箱:韶关市广智科技设备有限公司;T6新世纪紫外分光光度计:北京普析通用仪器有限责任工司;XB-K-25血球板计数器:上海求精生化试剂仪器有限公司。
1.3 试验方法
1.3.1 耐高温产香酵母菌的筛选
(1)耐高温产香温酵母菌的初筛:取15 g酱香型白酒窖醅于135 mL YPD液体培养基中,30 ℃、150 r/min条件下富集培养2 d。富集后用10倍系列梯度稀释法稀释至10-5,取稀释倍数为10-3、10-4、10-5的菌悬液0.2 mL分别涂布于YPD固体培养基,30 ℃条件下恒温培养2 d。采用接种环挑取菌落形态不同的单菌落分别于YPD培养基中进行平板划线,纯化2~3次。纯化完成后将菌种接种于YPD斜面培养基中于28 ℃恒温培养24 h,随后保存于4 ℃冰箱中备用。
(2)耐高温产香酵母菌的复筛:采用平板划线法将纯化的酵母菌株接种于YPD平板上,30 ℃条件下恒温培养48 h,观察酵母菌的生长状况,平行3次。将酵母菌依次放置在温度分别为35 ℃、40 ℃、45 ℃、50 ℃的恒温培养箱中,观察酵母菌的生长状况,筛选出能耐高温且产生香味的菌株。
(3)耐乙醇酵母的选择:利用无菌生理盐水将耐高温酵母制备成1×105 CFU/mL菌悬液,按5%(V/V)的接种量接入含体积分数6%乙醇的YPD液体培养基中,40 ℃、150 r/min条件下培养2 d。用不接种的无菌YPD培养液为对照组,测定各菌悬液的吸光度值(OD600nm值),筛选出耐乙醇能力强的菌株作进一步研究。
1.3.2 耐高温产香酵母菌的鉴定
(1)形态观察:将筛选出的酵母菌接种于YPD固体培养基,30 ℃培养2 d,对其菌落形态进行观察及描述,并在显微镜下对其细胞形态进行观察。
(2)生理生化试验:参照文献[16]对筛选出的酵母菌进行生理生化试验,包括糖发酵试验、脲酶试验、维生素缺失试验、产类淀粉试验、碳源同化试验、氮源同化试验。
(3)分子生物学鉴定:参照文献[17-18]提取筛选出的耐高温产香酵母菌的脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,采用正向引物NL-1和反向NL-4引物PCR扩增26S rDNA序列,送至上海杰李生物技术有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对搜索,选取同源性较高的模式菌株的26S rDNA基因序列,通过Clustalx1.83软件进行序列多重比较,使用Mega6.0软件中的邻接(neighborjoining,NJ)法构建系统发育树[19]。
1.3.3 耐高温产香酵母生长曲线的测定
将筛选出的耐高温产香酵母菌株接种于YPD液体培养基中,28 ℃、150 r/min条件下培养24 h,用血小板计数器对培养液进行计数,确定其菌体浓度为2.5×107 CFU/mL,制成种子液备用。将种子液按5%(V/V)的接种量接种于YPD液体培养基中,装液量250 mL/500 mL,30 ℃、150 r/min条件下培养2 d。每隔2 h在无菌环境下取样,以未接种的发酵培养基作为空白对照,采用紫外分光光度计在波长600 nm处测定吸光度值(OD600nm值)。以培养时间(x)为横坐标,OD600nm值(y)为纵坐标,绘制菌株的生长曲线。
1.3.4 不同温度下耐高温产香酵母的耐乙醇能力
将耐高温产香酵母种子液按5%(V/V)的接种量分别接入含体积分数0%、4%、6%、8%、10%乙醇的葡萄糖发酵培养基中,分别置于35 ℃、40 ℃、45 ℃条件下150 r/min摇瓶培养12 h,在波长600 nm处测定菌液的OD600nm值。
1.3.5 耐高温产香酵母产乙醇能力分析
将耐高温产香酵母种子液按5%(V/V)的接种量接种于葡萄糖发酵培养基中,装液量150 mL/500 mL,先在30 ℃、170 r/min条件下培养6 h,然后于40 ℃条件下静置发酵5 d,每24 h以无菌操作技术将瓶内的CO2排去。以某品牌酵母作为参比对象来评价该耐高温产香酵母菌的产乙醇能力[20]。取发酵液100 mL于蒸馏瓶中,接入冷凝装置,收集100 mL馏出液,蒸馏过程控制在30 min左右,用酒精计测定馏出液酒精度,用温度计测定此时的溶液温度,记录数据,并换算为温度20 ℃时的酒精度[21]。参照国标GB/T 5009.7—2016《食品中还原糖的测定》,利用直接滴定法测定发酵液中的残糖量[22]。
1.3.6 耐高温产香酵母固态产香试验
按5%(V/V)的接种量将耐高温产香酵母种子液接种于固态产香培养基中,28 ℃条件下厌氧发酵5 d,采用HS-SPME结合GC-MS对发酵产物进行分析。
(1)顶空固相微萃取:取3 g固体发酵产物于15 mL萃取瓶中,将50/30 μm DVB/CAR-PDMS萃取针插入萃取瓶中,先60 ℃条件下平衡15 min,后60 ℃萃取40 min。萃取后将萃取针打入气质联用仪,230 ℃解吸5 min[23]。
(2)色谱条件:进样口温度250 ℃;载气为氦气(He),流速1.0 mL/min;HP-5MS 5%Pheny Methyl Siloxance色谱柱(30 m×0.25 mm×0.25 μm);升温程序:柱温50 ℃,保留2 min,以5 ℃/min升温至280 ℃,保持2 min。
(3)质谱条件:离子源为电子电离(electron ionization,EI)源,离子温度230 ℃,电离能量70 eV,倍增器电压380 V,接口温度280 ℃,发射电流34.6 mA,扫描范围10~550 u。
(4)定性定量分析方法
定性:通过计算机检索香味化合物,与美国国家标准技术研究所(nationalinstitute ofstandardsandtechnology,NIST)中谱库的质谱信息相匹配。
定量:按照峰面积归一化法定量分析。
1.3.7 数据处理
试验操作重复3次,每个样品设3个平行,采用Origin 8.5软件进行数据分析。
2 结果与分析
2.1 耐高温产香酵母菌的筛选
从YPD培养基上挑取菌落湿润、光滑、粘稠、乳白色且具有芳香味的单菌落27株,编号为Y1~Y27,经纯化后接种于YPD培养基上,分别在30 ℃、35 ℃、40 ℃、45 ℃、50 ℃条件下培养,结果发现,在45 ℃条件下能够生长的菌株只有Y2、Y12、Y27,而在50 ℃条件下所有菌株均无法正常生长。
2.2 耐高温产香酵母耐乙醇能力的测定
菌株Y2、Y12、Y27对体积分数6%乙醇的耐受性见图1。
由图1可知,菌株Y12在含体积分数6%乙醇的YPD培养基中生长状况最好,OD600nm值最高,为0.936,其次为菌株Y2号(OD600nm值为0.830),菌株Y27最低(OD600nm值为0.735)。因此,选用菌株Y12为试验菌株。
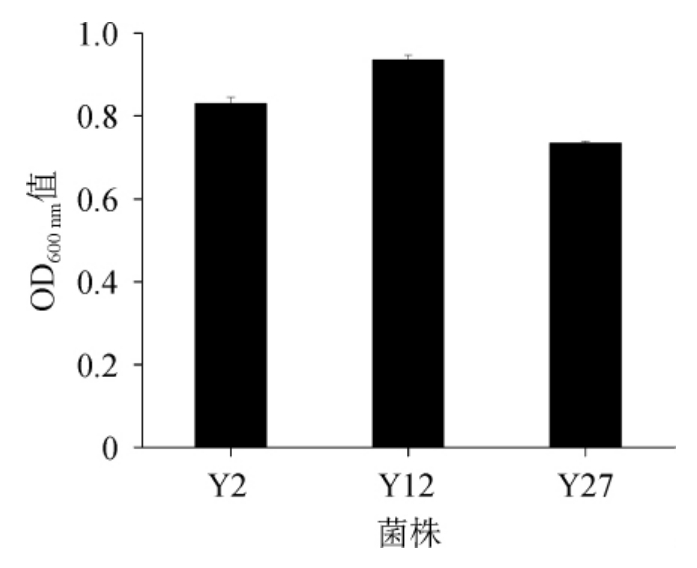
图1 3株酵母的耐乙醇能力
Fig.1 Ethanol tolerance of 3 strains of yeast
2.3 菌株Y12的鉴定
2.3.1 形态观察
菌株Y12的菌落及细胞形态见图2。由图2可知,菌株Y12的菌落表面湿润,凸起,四周平整,直径较小;细胞形态多为椭圆形,直径为1 nm。
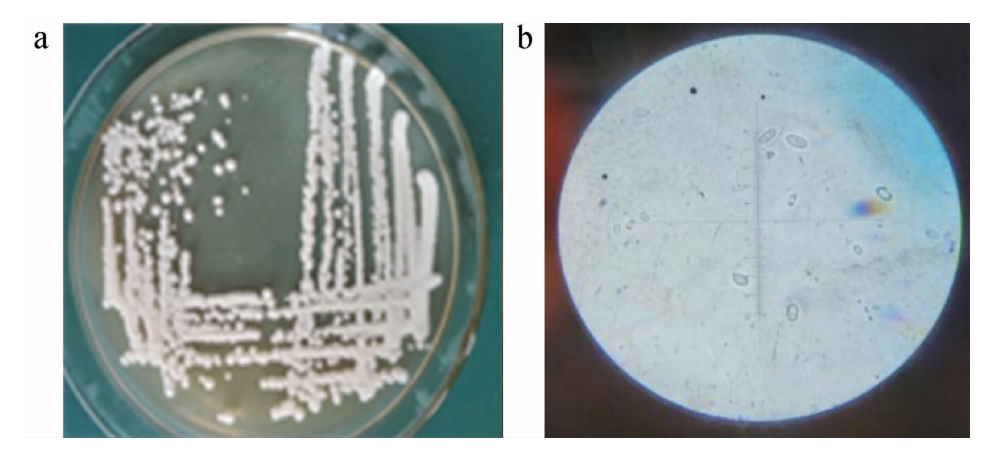
图2 菌株Y12的菌落(a)及细胞(b)形态
Fig.2 Colony (a) and cell (b) morphology of strain Y12
2.3.2 生理生化试验
菌株Y12生理生化试验结果见表1。由表1可知,菌株Y12的糖发酵试验、碳源同化试验结果呈阳性,其他试验结果呈阴性。参照《酵母菌的特征与鉴定手册》[24],结合形态观察结果,初步鉴定菌株Y12为毕赤氏酵母属(Pichia)。
表1 菌株Y12的生理生化试验结果
Table 1 Results of physiological and biochemical tests of strain Y12

注:“+”表示结果呈阳性;“-”表示结果呈阴性。
2.3.3 分子生物学鉴定
菌株Y12的系统发育树见图3。
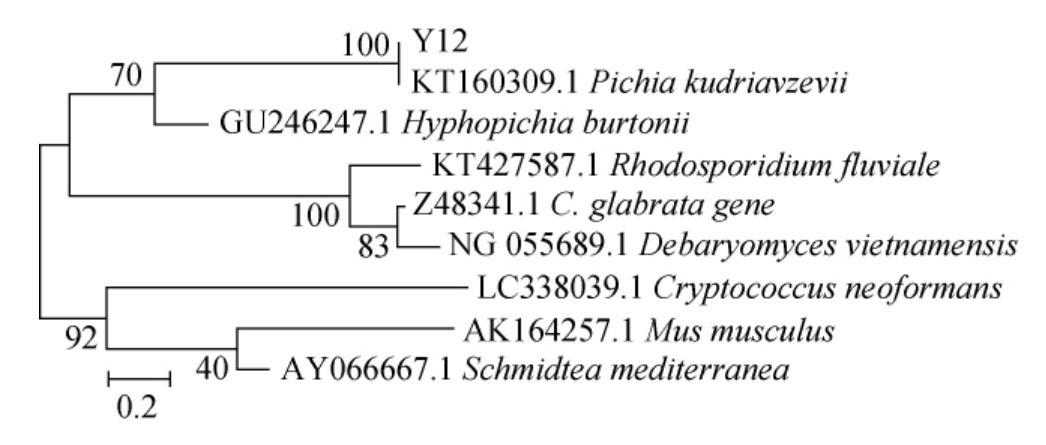
图3 基于26S rDNA基因序列菌株Y12的系统发育树
Fig.3 Phylogenetic tree of strain Y12 based on 26S rDNA gene sequences
由图3可知,菌株Y12与库得毕赤酵母(Pichia kudriavevii)聚于一支,亲缘关系最近,结合其形态观察、生理生化试验,鉴定菌株Y12为库得毕赤酵母(Pichia kudriavevii)。
2.4 菌株Y12生长曲线的测定
菌株Y12的生长曲线见图4。由图4可知,菌株Y12培养0~2 h为迟滞期,培养2~6 h为对数期,6 h后进入平稳期。

图4 菌株Y12的生长曲线
Fig.4 Growth curve of strain Y12
2.5 不同温度下耐高温产香酵母Y12的耐乙醇能力
不同温度下耐高温产香酵母Y12的耐乙醇能力见图5。

图5 不同温度下菌株Y12的乙醇耐受性
Fig.5 Ethanol tolerance of strain Y12 at different temperature
由图5可知,菌株Y12在35 ℃条件下,在含体积分数4%、6%乙醇的YPD培养基中生长状况良好,在含体积分数8%乙醇的培养基中生长被抑制,OD600nm值下降了50%,在含体积分数10%乙醇的培养基中几乎不能生长。菌株Y12在40 ℃条件下,在含体积分数4%乙醇的YPD培养基中生长状况良好,在含体积分数6%乙醇的培养基中生长被抑制,OD600nm值下降了16%,在含体积分数8%、10%乙醇的YPD培养基中基本不生长。菌株Y12在45 ℃条件下,在含体积分数4%、6%、8%、10%乙醇的YPD培养基中均不能生长。说明随着培养温度的升高,菌株Y12的耐乙醇能力逐渐下降。在40 ℃以下随着乙醇含量的增高,酵母菌生长逐渐被抑制,在45 ℃时酵母菌在含乙醇的培养基中基本不生长。
2.6 耐高温产香酵母Y12的产乙醇能力
菌株Y12发酵液中酒精度及残糖量见表2。
表2 菌株Y12的产乙醇能力
Table 2 Ethanol production capacity of strain Y12

由表2可知,与某品牌酵母菌相比,菌株Y12在40 ℃条件下产乙醇能力更强(6.3%vol),残糖量更低(84.43 g/L)。分析原因可能是某品牌酵母的最适生长温度和发酵温度均不能达到40 ℃,导致生长被抑制,产乙醇能力下降。所以酒精度较低(3.9%vol),残糖量较高(146.32 g/L)。
2.7 耐高温产香酵母Y12固态产香试验
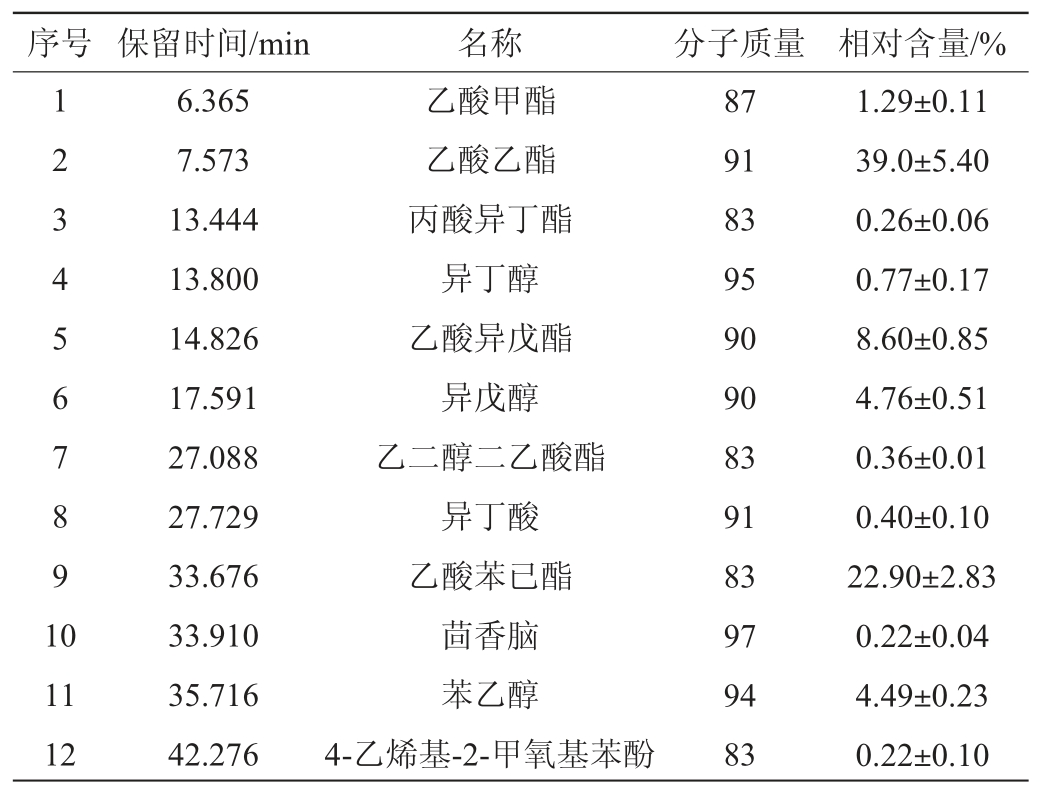
耐高温产香酵母Y12固态发酵后,采用GC-MS检测其发酵产物中的挥发性成分,其GC-MS分析总离子流色谱图见图6,产物中的挥发性成分种类及含量见表3。
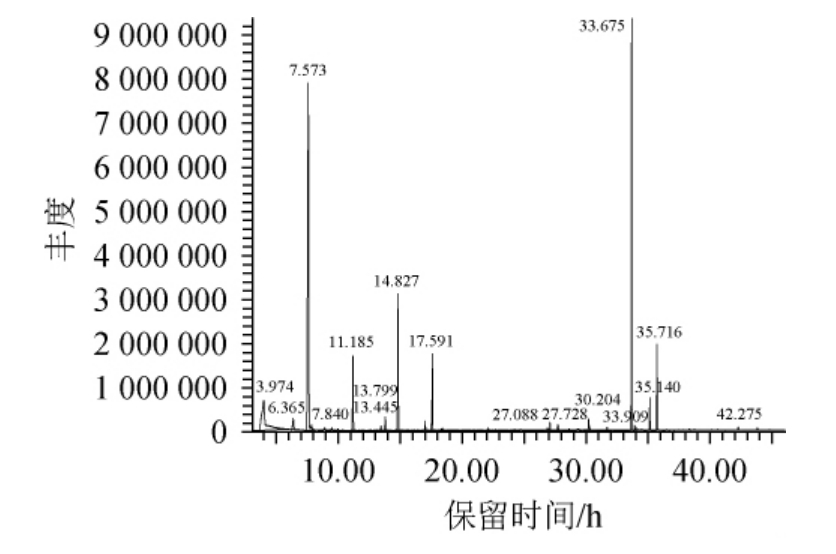
图6 菌株Y12固态发酵产物挥发性成分GC-MS分析总离子流色谱图
Fig.6 Total ion chromatogram of volatile components of solid-state fermentation products of strain Y12 analysis by GC-MS
由表3可知,从菌株Y12的固态发酵产物中共检测到挥发性物质12种,包括酯类6种,相对含量为72.45%,分别是乙酸甲酯、乙酸乙酯、丙酸异丁酯、乙酸异戊酯、乙二醇二乙酸酯、乙酸苯已酯;醇类物质3种,相对含量为10.02%,分别是异丁醇、异戊醇、苯乙醇;酸类物质只有异丁酸,相对含量为0.4%;酚类物质只有4-乙烯基-2-甲氧基苯酚,相对含量为0.22%。其中相对含量最高的是乙酸乙酯,为39.04%,其次是乙酸苯乙酯(22.9%)。酯类和醇类物质是白酒中香气的主要成分,其中乙酸乙酯是酱酒的重要呈香物质。
表3 菌株Y12固态发酵产物挥发性成分GC-MS分析结果
Table 3 Results of volatile components of solid-state fermentation products of strain Y12 analysis by GC-MS
3 结论
从酱香型白酒窖醅中筛选出3株(Y2、Y12、Y27)能在45 ℃条件下正常生长的产香酵母菌,其中菌株Y12的生长周期短,代谢速度快,迟滞期为0~2 h,对数期为2~6 h,6 h就开始进入稳定期。经形态观察、生理生化试验和26S rDNA序列分析鉴定菌株Y12为库得毕赤酵母(Pichia kudriavevii)。在乙醇耐受性试验中,菌株Y12的耐乙醇能力达到6%vol;在产酒精能力试验中,与某品牌酵母相比,在40 ℃条件下,菌株Y12产酒精能力更好(6.3%vol),残糖量更少(84.43 g/L)。在产香试验中,运用顶空固相微萃取和GC-MS从菌株Y12固态发酵产物中共检测出12种挥发性成分,包括酯类、醇类、酸类和酚类,相对含量分别为72.45%、10.02%、0.4%和0.22%,其中,乙酸乙酯相对含量最高(39.04%)。本试验中筛选出的耐高温产香酵母菌,在耐高温同时产香物质丰富,在白酒工业中有良好的应用前景。
[1]申孟林,张超,王玉霞.白酒大曲微生物研究进展[J].中国酿造,2016,35(5):1-5.
[2]费文斌,雍晓雨,徐俊,等.1 株耐热产乙醇酵母的分离、鉴定与性能测试[J].江苏农业科学,2015(3):330-333.
[3]崔海灏,孟姣姣.大曲中耐高温酵母菌的分离及性能测定[J].酿酒,2015,42(3):81-83.
[4]张杰,程伟,潘天全,等.浓香型白酒风味成分研究现状及展望[J].酿酒,2019,46(1):29-32.
[5]梁丽静,李进,吴东梅.基于信息熵理论的浓香型白酒香味成分复杂度分析[J].中国酿造,2016,35(5):154-156.
[6]戴奕杰,李宗军,田志强,等.酱香型白酒的轮次酒以及“二次制曲”过程中的风味物质分析[J].食品研究与开发,2019,40(19):24-32.
[7]卜文静,段秋虹,杜金宇,等.耐高温酿酒酵母菌株的选育[J].河南农业大学学报,2016,50(2):235-240.
[8]ARORA R,BEHERA S,KUMAR S.Bioprospecting thermophilic/thermotolerant microbes for production of lignocellulosic ethanol:A future perspective[J].Renew Sust Energ Rev,2015,51:699-711.
[9]齐显尼,甘雨满,王钦宏.耐高温酿酒酵母的选育及其在乙醇发酵生产中的应用[J].生物产业技术,2018(4):84-89.
[10]毕金丽,刘娅,张殿朋,等.耐高温酵母的筛选鉴定及发酵性能的初步研究[J].中国酿造,2013,32(5):107-110.
[11]崔小亮,邵小兵,钟和平,等.多粮浓香型白酒生产过程中可培养酵母菌多样性分析与优质功能菌筛选[J].中国酿造,2019,38(7):105-110.
[12]李兵,张超,王玉霞,等.白酒大曲功能微生物与酶系研究进展[J].中国酿造,2019,38(6):7-12.
[13]王珍,张永利,孟勤燕,等.耐高温高产酒精酵母的筛选及其大曲生产应用研究[J].酿酒科技,2020(1):107-114.
[14]张俊杰,尚益民,彭姗姗,等.产香酵母的筛选及其苹果酒发酵特性[J].中国酿造,2019,38(8):31-35.
[15]王晓丹,陈美竹,班世栋,等.茅台大曲中酵母的分离、鉴定及其功能初探[J].食品科学,2017,38(4):51-57.
[16]KURTZMAN C P,FELL J W,BOEKHOUT T,et al.Methods for isolation,phenotypic characterization and maintenance of yeasts[J]. Yeasts,2011,1(14):87-110.
[17]WU Q,XU Y,CHEN L Q.Diversity of yeast species during fermentative process contributing to Chinese Maotai-flavour liquor making[J]. Lett Appl Microbiol,2012,55(4):301-307.
[18]AI L I.Isolation of High Temperature Resistant Alcohol Yeast and Its Identification of 26S rDNA Sequence[J].Journal of Tangshan College,2015.
[19]LIU X,GUO K L,ZHANG H X.Determination of microbial diversity in Daqu,a fermentation starter culture of Maotai liquor,using nested PCRdenaturing gradient gel electrophoresis[J].World J Microb Biot,2012,28(6):2375-2381.
[20]刘超帝,缪礼鸿,陈瑾,等.耐高温酵母菌的筛选及其乙醇发酵特性[J].食品科学,2016,37(19):128-134.
[21]范光森,刘朋肖,吴秋华,等.一株有氧条件下高产乙醇酵母的筛选、鉴定及其生物学特性研究[J].食品工业科技,2019,40(14):138-143.
[22]中华人民共和国国家标准化管理委员会.GB/T 5009.7—2016 食品中还原糖的测定[S].北京:中国标准出版社,2016.
[23]赵兴秀,何义国,赵长青,等.产酱香功能菌的筛选及其风味物质研究[J].食品工业科技,2016,37(6):198-202.
[24]BARNETT J A,PENN R W,YARROW D,等.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:36-41.