作为世界著名的六大蒸馏酒之一的中国白酒,在其不断的发展壮大过程中,根据酿造工艺及风格的差异,白酒共分为清香型、浓香型、酱香型和米香型这4个基本香型[1]。贾湖原香型白酒是贾湖酒业集团有限责任公司在浓香型白酒与酱香型白酒的酿酒工艺基础上进行改良,独自研发出的新型香型,具有“口感绵柔,醇香四溢”等风格特点,现已投放市场并已大批量生产。高温堆积发酵是贾湖原香型白酒生产过程中的一个重要环节,又称“二次制曲”,堆积发酵可汇聚空气中的微生物[2],促进酒醅中的淀粉和蛋白质等物质进行分解转化,改善原酒的风格及提高酒体的丰满度[3],还为美拉德反应提供反应条件及前体物质[4-5]。贾湖原香型白酒是利用高温堆积工艺中发生的美拉德反应结合多粮浓香型的泥窖固态发酵[6],可以较好地改良原酒酒体的风味与品质,并且能够丰富原酒的香味物质成分。高温堆积发酵是贾湖原香型白酒生产过程中至关重要的生产过程,为形成贾湖原香型白酒的酒体风格提供香味成分或者积累香味前体物质[7]。因此,对贾湖原香型白酒高温堆积过程中的原核微生物群落结构及其演替规律进行研究,有利于充分解析贾湖原香型白酒发酵机理,提高产品质量。
近几年,国内在酿酒领域方面的报道日益增多,高通量测序技术用于研究各种香型白酒酿造的微生物中[8-11]。对于酱香型和芝麻香型白酒的研究,主要集中在酒醅或大曲发酵过程,而较少研究贾湖原香型白酒酒醅堆积过程中的微生物结构[6,12-13]。随着高通量测序技术[14-17]的快速发展,其对白酒堆积过程的研究也日益增多。黄晓宁等[18]为探究同一酒厂浓香型和酱香型大曲微生物群落组成,采用传统培养和聚合酶链式反应-变性梯度凝胶电泳法(polymerase chain reaction-denaturing gradient gel electrophoresis,PCRDGGE)对其微生物进行分析鉴定,发现细菌组成均是以地衣芽孢杆菌(Bacillus licheniformis)占绝对优势,真菌组成在两种大曲中差异较大。山其木格等[19]采用PCR-DGGE技术对酱香型糟醅堆积过程中的微生物种群变化规律进行研究,得出了糟醅堆积发酵过程中细菌种类多于真菌种类的结论。李小东等[20]通过在实验室小规模模拟芝麻香型白酒堆积发酵及入窖发酵过程,研究不同堆积发酵条件对入窖发酵过程微生物菌群的演替规律及原酒品质的影响,发现堆积温度的高低对酒质的影响较大。该研究对贾湖原香型白酒高温堆积过程原核微生物的消长规律进行研究,旨在为原香型白酒的生产研究提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
贾湖原香型白酒酒醅样品:来自贾湖酒业集团有限责任公司贾湖原香型白酒生产车间,由于自然堆积发酵受环境因素影响较大,每堆堆积为圆形,冬高夏矮,堆积时间需结合季节、气候、收堆温度和发酵程度来确定。
取样过程采用了采样堆平行取样,步骤如下:采样时间为0 h(堆积开始)(A0)、6 h(A6)、12 h(A12)、18 h(A18)、24 h(A24)、31 h(A31)、37 h(A37)及43 h(A43)(堆积结束),取样时糟堆中的定点测定温度分别为25 ℃、25.6 ℃、26 ℃、26.2 ℃、29.2 ℃、32.3 ℃、36.0 ℃和49.0 ℃。每个时间点的样品为糟堆四个面及堆心的混合样(500 g),采用取样袋取样,四个面取样深度离糟堆表面10~15 cm处,堆心离糟堆表面约2 m处,混合样品。每组样品一式三份,一份用于微生物培养,两份用于高通量测序,总计24个样品。
1.1.2 试剂
蛋白胨、酵母提取物:英国OXOID公司;琼脂:北京索莱宝科技有限公司;盐酸、硫酸:重庆市川江化学试剂厂;氯化钠、亚硫酸钠、亚硫酸氢钠:天津市大茂化学试剂厂;无水乙醇、氢氧化钠、五水硫酸铜:天津市鼎盛鑫化工有限公司;硫酸铜、酒石酸钾钠、亚铁氰化钾、磷酸、重铬酸钾、碘化钾、邻苯二甲酸氢钾、无水葡萄糖:天津市科密欧化学试剂有限公司;考马斯亮蓝G-250:上海金穗生物科技有限公司;牛血清白蛋白(bovine serum albumin,BSA):南京迪恩赛尔生物科技有限公司;限制性核酸内切酶、Taq PCR Master Mix、无菌去离子水:BBI生命科学有限公司;细菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:上海生工生物工程有限公司。所有试剂均为分析纯或生化试剂。
1.2 仪器与设备
YP20001电子天平、CP214分析天平:上海奥豪斯仪器有限公司;PX2型PCR仪:德国Veriti公司;UV-1800型紫外分光光度计:上海美谱达仪器有限公司;MWS24型数显恒温水浴锅:北京市科菲发展仪器有限公司;DYY-6C型电泳仪:北京市六一仪器厂;EF2型Syngene G:BOX凝胶成像系统:上海启步生物技术有限公司;GR85DA型蒸汽灭菌锅:济南来宝医疗器械有限公司;SHP-25型恒温培养箱:上海森信实验仪器有限公司;Qubit ® 3.0荧光计:美国Invitrogen公司。
1.3 方法
1.3.1 传统微生物细菌的培养
把用于微生物培养实验的8个样品,无菌状态下各称取1.00 g,放入装有99 mL无菌水的锥形瓶中,37 ℃恒温摇床振荡30 min,每个贾湖原香型白酒酒醅样品做3个平行样,样品摇匀后静置1 h后吸取1 mL稀释液加入装有9 mL无菌水的试管中,依次稀释至10-3、10-4、10-5、10-6、10-7,在每个试管中吸取100 μL菌液涂布于LB固体培养基,37 ℃培养皿倒置培养1~2 d。
1.3.2 主要细菌的形态鉴定及16S rDNA序列分析
在LB固体培养基上观察细菌的生长形态以及菌落大小,挑选出具有典型不同形态和大小的菌落,观察其形态差异。根据细菌DNA提取试剂盒说明书,提取各个细菌的DNA,对提取的细菌基因组进行PCR扩增,扩增方法参照文献[22]进行。采用细菌16S rDNA通用PCR引物27F(5'-AGAGTTTGATCCGGCTCAG-3'),1492R(5'-GGT-TACCTTGTTACGACTT-3')进行扩增,在25.0 μL PCR体系中,上、下游引物1492R和27F各1.0 μL,Taq Master Mix 12.5 μL,细菌DNA 0.5 μL,双蒸水(ddH2O)10.0 μL。PCR扩增条件为初始变性94 ℃、15 min,然后变性94 ℃、30 s,退火55 ℃、30 s,复性72 ℃、90 s,30个循环,最后延伸72 ℃、10 min,反应结束后4 ℃保存。取5 μL PCR产物加1 μL 6×Loading buffer于1%琼脂糖凝胶120 V电泳25~30 min。反应结束后,进行电泳,观察到目的条带则送去测序。
测序由上海生工生物工程有限公司完成,测序结果输入美国国家生物信息技术中心(national center of biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,用邻接(neighbor-joining,NJ)法构建目标菌株的系统发育树。
1.3.3 高通量测序
酒醅样品的DNA提取采用FastDNA® Spin Kit for Soil试剂盒,具体实验步骤参见说明书。采用1.0%琼脂糖凝胶电泳和微量分光光度计检测提取后的DNA纯度和浓度。
采用细菌16S rDNA V3-V4区的PCR引物对提取的细菌基因组进行PCR扩增,PCR扩增体系及条件参照文献[12]的方法进行,后续测序文库构建及Illumina MiSeq双端测序均委托苏州金唯智生物科技有限公司完成。
使用测序的双端序列数据构建MiSeq文库,对测得的数据过滤处理,除去Read尾部质量值<20 bp的碱基。设置50 bp窗口,若平均质量值<20,则从窗口开始截掉后端碱基,过滤质控后50 bp以下的reads;根据PE测序的Overlap关系,将成对的序列拼接(merge)为一条序列。根据序列之间的相似性将序列分成不同的操作分类单元(operational taxonomic units,OTUs),通常在97%的相似水平下的OTU进行生物信息统计分析。将获得的每个OUT的代表序列与核糖体数据库项目(ribosomal database project,RDP)在线数据库进行比对,筛选出OTU序列的最佳比对结果,并对比对结果进行过滤,默认满足相似度>90%且覆盖率>90%的序列被用来后续分类,确定每个OTU的分类水平。
1.3.4 理化指标的测定
参照文献[12]的方法,水分直接用干燥法测定,淀粉用酸水解法测定,酸度用氢氧化钠滴定法测定;根据国家标准,蛋白质用考马斯亮蓝G-250染色法测定,粗乙醇用重铬酸钾-分光光度法测定,总醛用亚硫酸氢钠-碘标准溶液滴定法测定,酸度用氢氧化钠滴定法测定,总酯用酸碱中和-皂化反滴定法测定。
2 结果与分析
2.1 测序结果
利用Illumina MiSeq平台进行测序分析,16个贾湖原香型白酒酒醅样本原核微生物16S rDNA测序共产生83个OTU,其中检测出6个门9个纲25个目35个科46个属。
2.2 原核微生物群落多样性与群落组成
2.2.1 门水平上的原核微生物多样性

图1 堆积发酵过程中门水平优势原核微生物菌群
Fig.1 Dominant prokaryotic microbial communities of the samples at the phylum level during the stacking fermentation process
由图1可知,经高通量测序,结果显示贾湖原香型白酒酒醅样品中的原核微生物种群共6个门。其中有2个门的平均相对丰度大于1%,分别是厚壁菌门(Firmicutes,13.2%~90.7%)和变形菌门(Proteobacteria,3.0%~57.2%),其相对丰度占全部细菌群落的85.9%,其优势菌群为厚壁菌门(Firmicutes)。拟杆菌门(Bacteroidetes,0.01%~1.6%)、放线菌门(Actinobacteria,0.02%~1.9%)和蓝藻菌门(Cyanobacteria,0~0.04%)的相对丰度占所有序列的0.9%。由图1可知,Firmicutes含量呈先上升随后下降的趋势,从0 h的68.9%(各层含量平均值)明显或显著上升至6 h的83.82%,12 d后升至90.75%,随后12~37 h含量下降至13.2%;而Proteobacteria呈下降趋势,由0 h的10.01%,逐渐下降为6 h的3.86%,12 h时降至最低(3.14%),随后上升至57.22%,表明酒醅堆积前期Firmicutes呈急剧上升趋势且成为发酵的唯一优势菌门,而其他优势菌门逐渐下降(6~12 h),堆积后期厚壁菌门的含量下降而变形菌门类的微生物大量增加。
2.2.2 属水平上的原核微生物多样性

图2 堆积发酵过程中属水平优势原核微生物菌群
Fig.2 Dominant prokaryotic microbial communities of the samples at the genera level during the stacking fermentation process
将每个样品中含量≥1%的属定义为优势属,由图2可知,优势菌种主要为枝芽孢杆菌属(Virgibacillus)和醋酸杆菌属(Acetobacter)。随堆积时间的增加,在0~12 h、37~43 h枝芽孢杆菌属含量升高,醋酸杆菌属含量下降。在12~37 h枝芽孢杆菌属含量从83.87%下降至11.5%,醋菌属含量从0.93%升高至53.62%。在堆积12 h前后,微生物的群落结构变化比较明显,如枝芽孢杆菌属比例呈先增加后减少趋势,醋酸杆菌属比例显著先减少后增加。枝芽孢杆菌属可抑制有害菌及病原菌等有害微生物的繁殖进一步筛选出对发酵的有益菌群,还具有较强分泌蛋白酶及其他酶的能力,分解大分子物质形成风味物质,增加白酒的风味[13,23]。明晰酒醅中微生物群落的演替性及空间异质性能为白酒风味物质溯源及揭示其形成规律提供较强的理论指导。以醋酸杆菌属为例,其在比较高的温度下(40 ℃)可以发育,代谢产酸使酒醅中的酸度增大,说明随着堆积的不断进行,醋酸杆菌属为耐酸类优势菌属,对后期蒸馏酒起到了重要的作用,但是过多酸性物质的积累对蒸馏酒的品质会产生损坏。
2.3 理化性质分析
对采集的贾湖原香型白酒酒醅样品进行了理化性质分析,其水分、蛋白质、淀粉含量的测定结果见图3。由图3可知,样品温度在前24 h保持在30 ℃以下,后24 h呈曲线上升,在43 h基本达到50 ℃左右,堆积过程中温度整体呈逐渐上升的趋势。水分含量由开始的48.85%到结束时下降至45%,整体下降3.9%。水分含量逐渐下降,这是由于在高温堆积过程中,微生物繁殖代谢产生的生物热导致糟堆水分有所挥发,同时淀粉含量也由开始的22.63%一直到36 h下降至17.78%左右,整体下降4.85%,总体也呈现下降趋势,这是由于堆积初期酒醅营养丰富,微生物在高温堆积过程中生长、繁殖和代谢活动均多利用大分子物质淀粉作为主要碳源,代谢比较旺盛,淀粉分解速度较快。而高温堆积酒醅中蛋白质含量呈现出较快上升趋势,蛋白质含量由5.4%升高至7.8%,上升了2.4%。这是因为在堆积过程中,微生物生长时间较短以及蛋白酶含量不多,分解蛋白质能力较弱,可以推测贾湖原香型白酒高温堆积初始阶段微生物的代谢活动对氮源需求量不大,蛋白质相对含量的上升很可能与碳源消耗以及水分挥发等条件有关。

图3 水、蛋白质及淀粉含量随堆积时间的变化
Fig.3 Change of water,protein and starch contents with stacking time
总醛、总酸、总酯随堆积时间的变化见图4。由图4可知,总醛含量最终保持在0.53%左右,平均上升0.08%,变化幅度较小。由于醛类具有毒性,而样品总醛含量低说明高温堆积过程中的酒醅新鲜,醛类物质含量较少,对微生物生长抑制作用小。总酸度始终保持在0.87%~1.10%之间,整体趋向稳定。酸度的大小可揭示酒醅中产酸微生物数量的多寡,结果说明贾湖原香型酒醅高温堆积过程中始终处于酸性状态,较为稳定。高温堆积过程中总酸度的升降趋势,侧面反映了微生物的消长及酒醅基质的状态,有利于改良酒醅的原料条件[24]。总酯的含量最终保持在6.15%左右,说明在贾湖原香型白酒高温堆积中,总酯含量趋向平稳,并未呈现大幅变化趋势。以上结果说明高温堆积过程主要是以环境微生物的大量富集为主,为后续的窖池发酵过程提供重要的微生物来源。
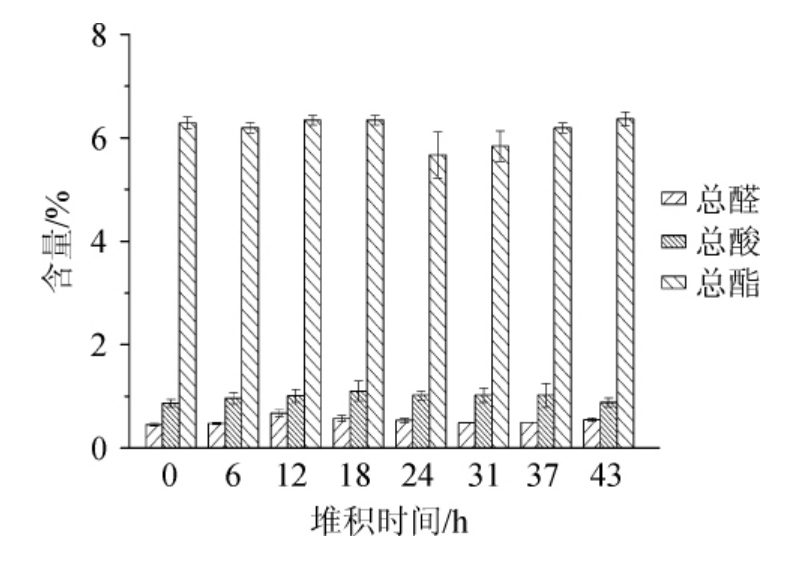
图4 总醛、总酸及总酯含量随堆积时间的变化
Fig.4 Change of total aldehyde,total acid and total ester contents with stacking time
理化性质分析结果表明,在贾湖原香型白酒酒醅高温堆积以及进一步的窖池发酵中,细菌起到了主要作用[25-26]。堆积发酵可以汇集环境中的微生物,而温度偏高使微生物进一步自然筛选,在堆积结束时,优势微生物菌群演替完成,为入窖发酵提供良好的微生物基础[27]。大量乳酸积累降低白酒的品质,明晰酒醅中与降乳酸相关的微生物菌群的多样性,将有助于从贾湖原香型白酒生产源头上解决“增己降乳”的问题[28-29]。
2.4 分离细菌的形态鉴定及16S rDNA序列分析
2.4.1 分离细菌的形态鉴定
在LB固体培养基上观察细菌的生长形态以及菌落大小,从而挑选出具有典型不同形态和大小的菌落,并进一步推测堆积酒醅中不同时段含有的菌种。初步挑选了6个菌落进行形态观察,结果见图5。由图5可知,菌株A18-1菌落呈白色,不定形,较小褶皱,表面不光滑突起,边缘相对不整齐,干燥,菌落较小。菌株A18-2菌落呈乳白色,不定形,有褶皱,突起,边缘不整齐,挑取时十分粘稠,菌落较大。菌株A18-5菌落呈乳白色,不定形,无褶皱,表面光滑突起,边缘整齐,菌落较小。菌株A24-10菌落呈白色,不定形,有褶皱,表面不光滑突起,边缘不整齐,呈蔓延式生长,菌落较大。菌株A31-14菌落呈淡白色,不定形,无褶皱,表面光滑,边缘不整齐,菌落较大,干燥。菌株A31-16菌落呈白色,不定形,较小褶皱,表面不光滑,边缘相对不整齐,干燥,菌落较大。

图5 6株菌株的菌落形态
Fig.5 Colony morphology of 6 strains
2.4.2 分离细菌的分子生物学鉴定
进一步利用分子生物学手段鉴定分离出来的细菌。采用通用引物27F和1492R,PCR扩增获得细菌16S rRNA序列,并进行序列测定。将测得的核苷酸序列通过NCBI-BLAST程序在GenBank数据库中进行比对,选取结果中同源性高的序列。采用MEGA-X软件进行序列比对,NJ法多序列连配分析并构建系统发育树。以菌株A24-10为例,其系统发育树见图6。由图6可知,菌株A18-1、A18-5和A37-16均为粘质沙雷氏菌(Serratia marcescens);菌株A18-2为暹罗芽孢杆菌(Bacillus siamensis);菌株A31-14为线虫沙雷氏菌(Serratia nematodiphila);菌株A24-10为地衣芽孢杆菌(Bacillus licheniformis)。分离菌株为后续的产香微生物的分离和筛选提供了研究基础。

图6 基于16S rDNA基因序列菌株A24-10的系统发育树
Fig.6 Phylogenetic tree of strain A24-10 based on 16S rDNA gene sequences
3 结论
本研究基于高通量测序技术分析了贾湖酒业集团有限责任公司酒醅堆积过程中原核微生物菌群演替规律,结果表明,贾湖原香型白酒高温堆积工序酒醅的原核微生物中共检测出1个界6个门9个纲25个目35个科46个属。检出了其优势细菌门为厚壁菌门(Firmicutes,13.2%~90.7%)和变形菌门(Proteobacteria,3.0%~57.2%),它们的相对丰度占所有序列的85.9%,枝芽孢杆菌属(Virgibacillus)和醋酸菌杆属(Acetobacter)为优势菌属。另一方面,从理化性质分析结果可看出,在贾湖原香型白酒酒醅高温堆积以及进一步的窖池发酵中,细菌起到了主要作用,提供了良好的微生物优势菌群,提高白酒的风味。此外,本研究仅从DNA水平揭示了不具有活性的微生物菌群结构差异,后续需要进一步结合转录组学及代谢组学等方法深入分析不同微生物结构差异。
[1]曾田,胡晓龙,马兆,等.浓香型白酒窖泥中“增己降乳”原核微生物群落多样性解析[J].轻工学报,2017,32(6):12-19.
[2]程伟,吴丽华,徐亚磊,等.浓香型白酒酿造微生物研究进展[J].中国酿造,2014,33(3):1-4.
[3]李宝霞.芝麻香型白酒中功能成分四甲基吡嗪的研究[D].济南:齐鲁工业大学,2015.
[4]张培芳,王兆恩,付文庆,等.浅谈鲁香坊多粮芝麻香白酒生产工艺及风格特点[J].酿酒,2013,40(2):47-52.
[5]戚元民.对芝麻香型白酒生产的认识[J].酿酒科技,2009(8):140-142.
[6]陈泽军,周瑞平,王涛,等.高温堆积发酵在多粮浓香型酒厂的应用[J].酿酒科技,2008(11):80-82.
[7]HERNÁNDEZ-ORTE P,CACHO J F,FERREIRA V.Relationship between varietal amino acid profile of grapes and wine aromatic composition.Experiments with model solutions and chemometric study[J].J Agr Food Chem,2002,50(10):2891-2899.
[8]陶勇,芮俊鹏,李家宝,等.浓香型白酒窖泥中细菌和古菌的组成与多样性[J].化工学报,2014,65(5):1800-1807.
[9]邓杰,黄治国,卫春会,等.基于高通量测序的浓香型白酒窖池细菌群落结构分析[J].现代食品科技,2015,31(7):50-55.
[10]李克亚,文章,邓斌,等.不同窖龄窖泥原核生物多样性的高通量测序研究[J].食品工业,2016,37(6):121-125.
[11]赵东,郑佳,彭志云,等.高通量测序技术解析五粮液窖泥原核微生物群落结构[J].食品与发酵工业,2017,43(9):1-8.
[12]曹润洁,何宏魁,葛向阳,等.芝麻香型酒醅堆积过程中微生物结构变化分析[J].微生物学通报,2019,46(6):1371-1380.
[13]杨国华,邱树毅,黄永光.酱香白酒生产中产香微生物研究[J].中国酿造,2011,30(4):24-27.
[14]LI R Q,ZHU H M,RUAN J,et al. De novo assembly of human genomes with massively parallel short read sequencing[J]. Genome Res,2010,20(2):265-272.
[15]DE PASQUALE I,DI CAGNO R,BUCHIN S,et al.Microbial ecology dynamics reveal a succession in the core microbiota involved in the ripening of pasta filata caciocavallo pugliese cheese[J].Appl Environ Microbiol,2014,80(19):6243-6255.
[16]田地.利用高通量测序对封存CO2 泄漏情景下土壤细菌的研究[J].环境科学,2013,34(10):4096-4104.
[17]SUN J,ZHANG Q,ZHOU J,et al.Illumina amplicon sequencing of 16S rRNA tag reveals bacterial community development in the rhizosphere of apple nurseries at a replant disease site and a new planting site[J].Plos One,2014,9(10):e111744.
[18]黄晓宁,黄晶晶,李兆杰,等.浓香型和酱香型大曲微生物多样性分析[J].中国酿造,2016,35(9):33-37.
[19]山其木格,梁慧珍,张长霞,等.糟醅堆积过程中微生物种群的变化规律[J].食品与生物技术学报,2016,35(3):330-335.
[20]李小东,高大禹,田庆贞,等.芝麻香型白酒堆积发酵对入窖发酵过程及原酒品质的影响[J].食品与发酵工业,2018,44(5):63-69.
[21]MARGULIE M,EGHOLM M,ALTMAN W,et al.Genome sequencing in microfabricated high-density picolitre reactors[J]. Nature,2005,437(7057):376-380.
[22]陈梦圆,李志军,罗爱民.高温大曲中高产四甲基吡嗪菌株的筛选及鉴定[J].酿酒科技,2018(8):24-29.
[23]李习.高产α-淀粉酶地衣芽孢杆菌的筛选及重组质粒的构建[D].武汉:湖北工业大学,2014.
[24]刘殿英.酸在清香型白酒质量中的关系及其工艺控制[J].技术与市场,2008(8):66-67.
[25]张文学,岳元媛,向文良,等.浓香型白酒酒醅中化学物质的变化及其规律性[J].四川大学学报(工程科学版),2005(4):44-48.
[26]胡帮超,汤有宏,唐林,等.影响浓香型酒中高级醇生成因素的研究[J].酿酒,2016,43(6):33-36.
[27]FREY-KLETT P,BURLINSON P,DEVEAU A,et al.Bacterial-fungal interactions:hyphens between agricultural,clinical,environmental,and food microbiologists[J].Microbiol Mol Biol Rev,2011,75(4):583-609.
[28]TAO Y,LI J B,RUI J P,et al.Prokaryotic communities in pit mud from different-aged cellars used for the production of Chinese strong-flavored liquor[J].Appl Environ Microbiol,2014,80(7):2254-2260.
[29]HU X L,DU H,REN C,et al.Illuminating anaerobic microbial community and co-occurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Appl Environ Microbiol,2016,82(8):2506-2515.