红曲米是以稻米为基质在特定生态环境下用成曲作母种培养发酵制成,因其颜色鲜艳也称为丹曲或者赤曲。红曲米中含有较多的淀粉酶、糖化酶及酯化酶,在酿酒过程中起到发酵剂作用,常被用于酿制米酒[1]。以红曲作为发酵剂酿制果酒,可以增强产品色泽,形成独特风味[2],但目前将红曲应用到果酒生产的相关研究较少。柿子中含有丰富的生物活性物质[3],以柿子为原料经多种工艺酿造而成的柿子酒,具有柿子独特的颜色和果香味,同时还具有促进人体消化和生津健脾等多种功能,但柿子由于缺少像葡萄、苹果等常见酿酒果实中所具有的构成果酒品质特性的多种有机酸,对酵母菌的发酵作用不利,并且发酵而成的柿子酒往往风味不佳。将红曲引入柿酒发酵体系,可使柿酒具有独特的风味、绚丽的色彩和更高的营养保健价值三种特色,从而克服柿子酒风味欠佳、营养成分不足的缺点,使生产的果酒具有更好的感官风味和营养保健功能。
红曲米质量的好坏直接决定最终成品酒品质,酒曲富集了曲霉、酵母菌和乳酸菌等多种微生物及其产生的丰富酶系,不同地区的生产环境、制备工艺、气候条件及地理位置等差异形成了酒曲产品的菌群多样性。在发酒酵过程中,丝状真菌可以通过淀粉的糖化作用来产生酸,而酵母可以通过发酵糖类产生,但是它们产生的有机酸含量非常少[4]。一些研究指出细菌在酒发酵产酸过程起到了重要作用,如乳酸菌可通过异源发酵产乳酸、乙酸等有机酸[5],醋酸杆菌能氧化葡萄糖或乙醇生成乙酸[6],直接影响成品酒的口感和风味[7]。目前,大部分研究都集中在红曲各类型酒在发酵过程中微生物群落与风味物质之间的相关性分析[8-9],还鲜有对红曲米菌群结构的对比研究。比较红曲米细菌菌群差异,对深入了解红曲酒酿造机制具有一定的意义。
本研究使用武宣地区三种红曲米作为发酵剂酿造红曲柿酒,对其理化指标和挥发性风味成分进行分析,并应用Illumina MiSeq高通量测序技术分析三种武宣红曲米细菌多样性,为了解发酵剂细菌群落结构对成品酒品质影响提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
WX-1、WX-2、WX-3红曲米:广西来宾市武宣县;恭城月柿:广西桂林恭城。
1.1.2 试剂
安琪SY酿酒酵母(Saccharomyces cerevisiae):安琪酵母有限公司;无水乙醇(分析纯)、重铬酸钾(分析纯)、浓硫酸(纯度98%)、氢氧化钠(分析纯)、3,5-二硝基水杨酸(分析纯):南京化学试剂股份有限公司;Qubit3.0脱氧核糖核酸(deoxyribonucleic acid,DNA)检测试剂盒:美国Life Technologies公司;高纯度耐热DNA聚合酶(8 U/μL)、2×Taq Master Mix:美国Vazyme公司;QuantiFluorTM-ST蓝色荧光定量系统:美国Promega公司;MagicPure Size Selection DNA Beads:法国Transgen公司;E.Z.N.A.Soil DNA试剂盒:美国Omega公司。
1.2 仪器与设备
LRH-800F恒温培养箱:上海一恒科学仪器有限公司;RE-2010旋转蒸发仪:上海亚荣生化仪器厂;UV1800-PC紫外可见分光光度计:上海美谱达仪器有限公司;XMT-F9型电热恒温水浴锅:上海洪记仪器设备有限公司;7890A型安捷伦气相色谱-质谱联用(gaschromatography-mass spectrometer,GC-MS)仪:美国安捷伦科技公司;9700型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;MiSeq高通量测序平台:美国Illumina公司;NanoDrop 2000紫外-可见分光光度计:赛默飞世尔科技(中国)有限公司;PHBJ-260 pH计:上海雷磁仪器厂;198*30手持折光仪:上海力辰仪器科技有限公司。
1.3 方法
1.3.1 红曲柿酒酿造工艺[10]
柿子→清洗→脱涩→去果柄和花盘→果浆调配→主发酵→倒酒→后发酵→倒酒→澄清→低温陈酿→红曲柿酒原酒
操作要点:
(1)选取完整无病害的恭城脆柿,经过清洗、脱涩、去果柄和花盘后打浆处理。
(2)果浆调配:柿果打浆后,调糖度18%~22%,调pH值为4.5~5.5,按原果浆∶水=4∶1比例稀释调配。
(3)主发酵:调配好后,加入原料质量0.03%的活化酿酒酵母和3.5%红曲米粉,发酵8~10 d。
(4)后发酵:主发酵过后,倒酒去除酒脚,进行后发酵15 d。
(5)澄清:后发酵完成后,第二次去除酒脚,加入复合澄清剂(0.02%果胶酶和0.03%可溶性壳聚糖)澄清4~6 d。澄清完毕,过滤除滤渣。
(6)低温陈酿:待澄清后,进行低温陈酿。将红曲柿酒降温为4 ℃继续陈酿2个月,使酒更加协调,得到原酒。
1.3.2 红曲柿酒质量指标测定
理化指标:采用分光光度法测定酒精度[11];采用酸碱滴定法测定总酸、挥发酸含量[12];采用手持糖度仪测定可溶性固形物(残糖量)含量;采用3,5-二硝基水杨酸法测定还原糖含量[13];采用氧化法测定SO2含量[12]。
微生物指标:参照国标GB 4789.2—2016《食品微生物学检验菌落总数测定》测定细菌菌落总数、大肠菌群;参照国标GB 29921—2013《食品中致病菌限量》测定致病菌。
1.3.3 红曲柿酒中挥发性成分的测定
采用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)结合气相色谱-质谱法测定红曲柿酒中的挥发性成分[14]。
GC条件:DB-WAX色谱柱(60 m×0.25 mm×0.5 μm),载气为氦气(He),流速19 mL/min;进样口温度为230 ℃,程序升温:起始温度为60 ℃,保持2 min,5 ℃/min升至160 ℃保持1 min,以10 ℃/min升至230 ℃保持1 min,最后运行31 min。
MS条件:电子电离(electronic ionization,EI)源,电子能量70 eV,离子源温度为230 ℃,连接杆温度150 ℃。采用全扫模式收集信号,扫描范围33~550 m/z。
定性定量:测定结果基于美国国家标准与技术研究院(national institute of standards and technology,NIST)14质谱库检索进行定性分析,面积归一化法进行定量分析,通过匹配度及CAS#号判断可能的物质种类。
1.3.4 红曲米细菌菌群高通量测序
分别称取200mg红曲米样品,放入无菌的2mL离心管中,加入1 mL体积分数70%的乙醇,振荡混匀,10 000 r/min室温离心3 min,弃上层液体。加入磷酸盐缓冲液溶液(0.01 mol/L、pH=7.2),振荡混匀,10 000 r/min室温离心3 min,弃上层液体。按照Power Soil DNA Isolation Kit说明书分别提取3种红曲米菌群的宏基因组DNA,利用Qubit3.0 DNA检测试剂盒对基因组DNA精确定量。以提取的宏基因组DNA为模板,采用引物341F(5'-CCCTACACGACGCTCTTCCGATCTG(barcode)CCTACGGGNGGCWGCAG-3')和805R(5'-GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACTACHVGGGTATCTAATCC-3')对细菌的16S rRNA V3-V4区序列进行PCR扩增。PCR扩增程序:94 ℃预变性3 min;94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,共20个循环;72 ℃再延伸5 min。PCR扩增体系(20 μL):2×Phusion Master Mix 15 μL,正向及反向引物(10 μmol/L)各1 μL,模板DNA 20 ng,补双蒸水(dd H2O)至30 μL。PCR扩增产物经1.8%琼脂糖凝胶电泳检测。
利用Min Eluter PCR Purification Kit对PCR扩增产物进行纯化。利用Tru-SeqRDNA PCR-Free Sample Preparation Kit制备测序文库并添加接头序列,经过Nano Drop 2000测定文库质量后,利用Illumina MiSeq 2500测序平台进行高通量测序[13]。
1.3.5 高通量测序数据处理与分析
使用QIIME软件中的UCLUST将可操作分类单位(opti caltransform unit,OTU)根据97%的相似度进行聚类[15]。根据OTU在不同样本中的丰度分布,采用QIIME进行alpha多样性(Chao1、ACE、Shannon指数)分析。
1.3.6 数据处理
每组试验重复3次,试验结果以“平均值±标准差”表示,采用R语言3.6.1对数据进行分析,采用Origin8.5作图。
2 结果与分析
2.1 不同种红曲米对红曲柿酒发酵品质的影响
2.1.1 不同种红曲米对红曲柿酒理化指标的影响
3种红曲柿酒发酵过程中总酸、挥发酸含量及酒精度的变化见图1。由图1可知,3种红曲柿酒中的总酸和挥发酸含量首先迅速上升,发酵4~6 d时到达峰值,而后下降直至趋于平缓。WX-2组红曲柿酒的总酸和挥发酸含量最高,与其他两组差异显著(P<0.05)。发酵后期总酸和挥发酸含量都呈下降趋势,是由于酸类物质能与醇类物质反应生成相应的酯类物质,从而赋予酒体香味[16]。由图1亦可知,红曲柿酒发酵过程中酒精度与发酵时间呈正相关,且3种红曲发酵剂对酒精度无显著影响(P>0.05)。酒精度的增加一定程度可以抑制酸的生成,因为当酒精度达到一定值,产酸的关键细菌可能不再存活,从而可以抑制总酸、挥发酸含量的增加[17]。

图1 3种红曲柿酒发酵过程中总酸(a)、挥发酸含量(b)及酒精度(c)的变化
Fig.1 Changes in total acid (a),volatile acid content (b) and alcohol content (c) in three kinds of red kojic persimmon wine during fermentation
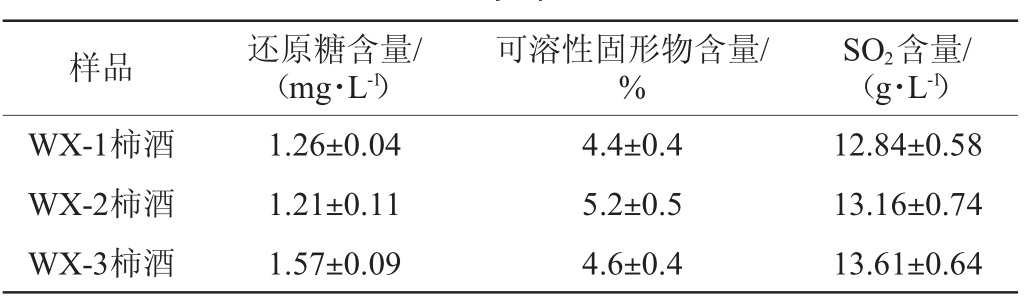
3种红曲柿酒发酵过程中还原糖、可溶性固形物及SO2含量的变化见表1。由表1可知,3种红曲柿酒在可溶性固形、SO2含量上均显著差异(P<0.05)。WX-3柿酒样品的还原糖含量最高,与其他两组差异显著(P<0.05),推测可能与红曲米中糖化酶糖化速率有关。3种红曲柿酒理化指标均达到国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》要求。
表1 3种红曲柿酒理化指标检测结果
Table 1 Determination results of physicochemical indexes of three kinds of red kojic persimmon wine
2.1.2 微生物指标
3种红曲柿酒的微生物指标见表2。由表2可知,3种红曲米制得的红曲柿酒中细菌总数均≤50 CFU/mL,大肠杆菌≤3 MPN/100 mL,致病菌未检出,结果表明3种红曲柿酒微生物指标均符合国标GB 4789.2—2016《食品安全国家标准食品微生物学检验菌落总数测定》、GB 29921—2013《食品安全国家标准食品中致病菌限量》要求。
表2 3种红曲柿酒微生物指标检测结果
Table 2 Detection results of microbial indexes in three kinds of red kojic persimmon wine

注:“\”表示未检出。
2.2 红曲柿酒挥发性成分测定
采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)结合GC-MS对发酵8 d后的红曲柿酒中的主要风味物质进行检测,其相对含量对比结果见图2。
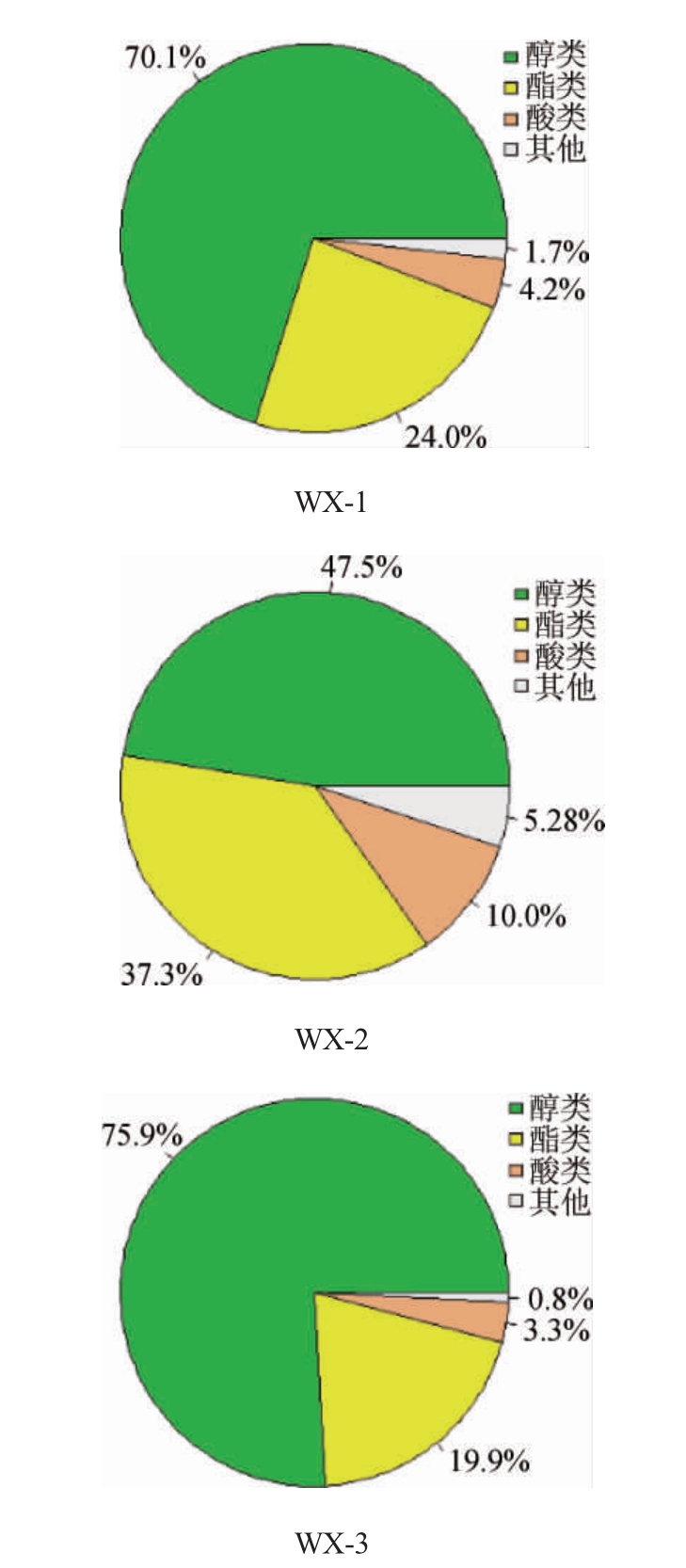
图2 3种红曲柿酒中挥发性成分相对含量
Fig.2 Relative content of volatile components in three kinds of red kojic persimmon wine
使用红曲发酵柿子酒引入了非果酒风味物质,丰富了发酵制品风味。由图2可知,3种红曲米发酵而成的红曲柿酒中酸类物质差异明显,相对含量分别为4.2%、3.3%、10.0%,其中挥发性酸类物质的组成及占比见表3。
由表3可知,辛酸、乙酸为果酒中主要的挥发性酸类物质,WX-2红曲米制成的红曲柿子酒中含有较多的棕榈酸。棕榈酸含量过高具有腐败脂肪气味;乙酸具食醋内酸味及刺激性气味;辛酸少量时有水果香味,大量具有汗臭味。适量的酸类物质能提高酒体的整体协调性,过高或过低都会给酒体呈香带来负面影响,WX-1红曲米制成的红曲柿子酒中含有较多的辛酸,WX-2红曲米制成的红曲柿子酒中还有较多的棕榈酸,这些酸类对果酒风味都会产生不良影响。
表3 3种红曲柿酒中的挥发性酸类物质
Table 3 Volatile acids components in three kinds of red kojic persimmon wine
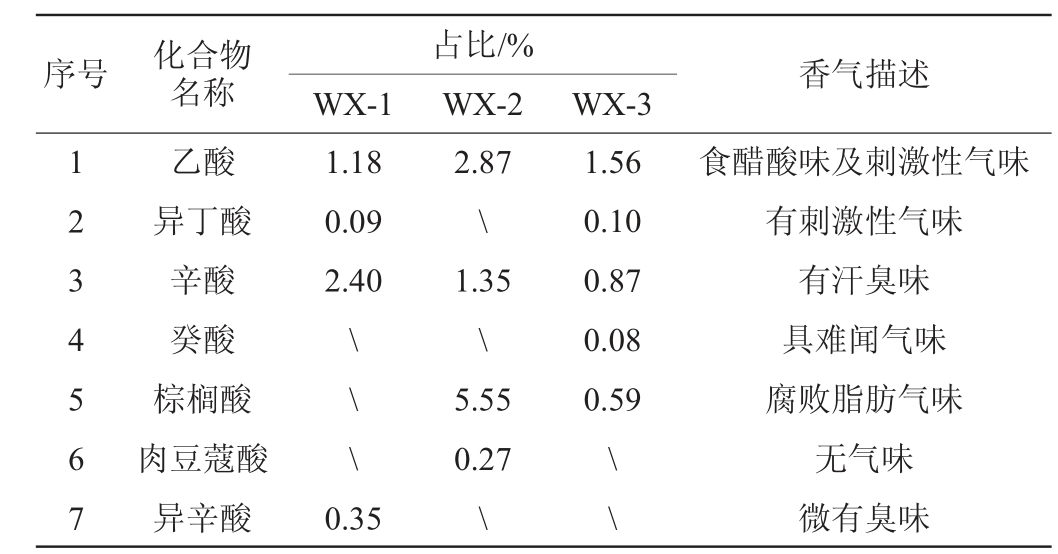
注:“\”表示未检出。
2.3 武宣地区3种红曲米细菌菌群α-多样性分析
武宣地区3种红曲米样品中细菌菌群序列数及α-多样性分析结果见表4,红曲米样品细菌稀释曲线见图3。
表4 武宣地区3种红曲米细菌菌群序列数及α-多样性分析结果
Table 4 Results of sequence numbers and α-diversity analysis of bacterial community of three kinds of red kojic rice samples from Wuxuan areas
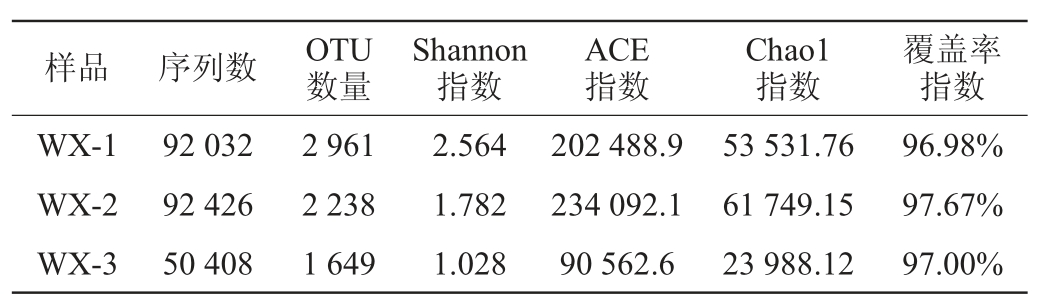
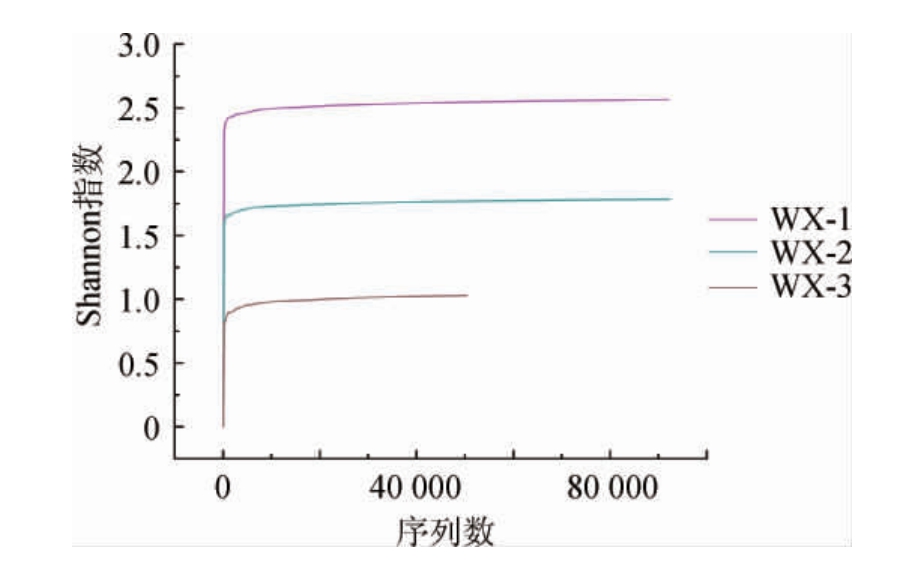
图3 武宣地区3种红曲米样品细菌稀释曲线
Fig.3 Dilution curves of bacteria in three kinds of red kojic rice samples from Wuxuan areas
由表4可知,样本的覆盖率指数平均值为97.2%。由图3可知,当测序量较低时每个红曲米样品的Shannon指数均随着测序量的增加呈显著上升趋势,当测序量>10 000后,稀释曲线与X轴几乎接近平行,Shannon指数几乎达到上限。说明在当前测序水平下,样品中的细菌群落多样性已能够充分覆盖。由表4亦可知,从3种红曲米中共获得234 866条细菌有效序列。序列按97%相似度水平进行OTU聚类划分,3种红曲米样本中共获得6848个OTU,其中红曲米样品WX-1中细菌OTU数量最多,为2 961个,种群多样性指数Shannon指数最高,为2.564;而红曲米样品WX-2中细菌菌群的ACE指数、Chao1指数最高,分别为234 092.1、61 749.15。说明红曲米样品WX-1细菌群落的物种种类最丰富;红曲米样品WX-2细菌群落数目最多。
2.4 武宣地区3种红曲米细菌不同分类水平上的丰度分析
在门分类水平上,从3种红曲米样品共检测出19个细菌门。将相对丰度>1%的菌门定义为优势细菌门,优势细菌门见图4。由图4可知,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)为3种红曲米样品的共有优势菌门。其中变形菌门(Proteobacteria)占比最高(49.3%~97.5%),为最主要的优势菌门。厚壁菌门(Firmicutes)在红曲米样品WX-2中占据较大比例(50.64%),为红曲米样品WX-2中的主要优势菌门。结果表明,3种红曲米样品中所含物种基本相似,但其细菌菌门结构存在一定差异。
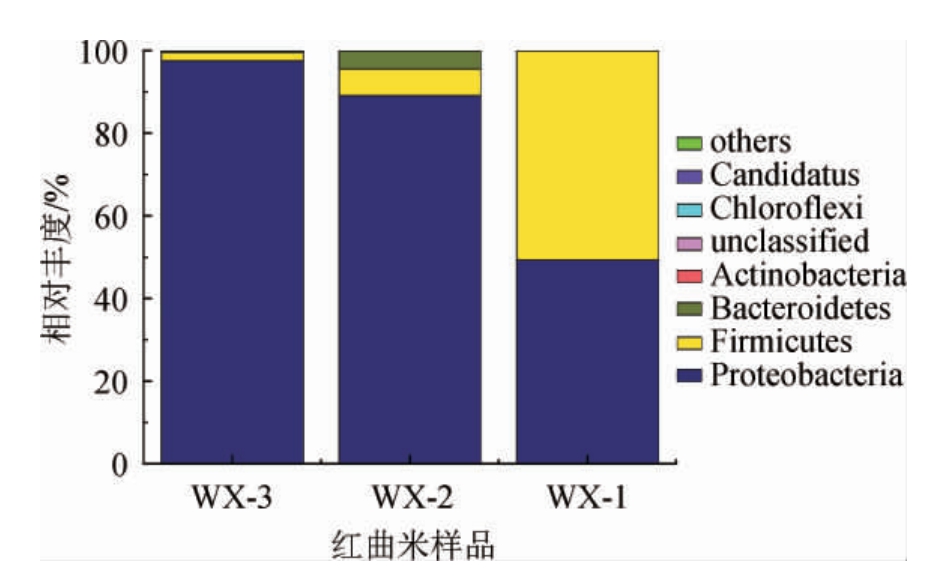
图4 基于门水平武宣地区3种红曲米样品细菌菌群结构分析
Fig.4 Analysis of bacterial community structure of three kinds of red kojic rice samples from Wuxuan area based on phyla level
在属分类水平上,武宣地区3种红曲米样品中共检出239个属,为了展示效果,一般只显示相对丰度前25的物种分类,前25种菌属相对丰度热图见图5。将菌属数量经过lg(n+1)标准化后大于3的菌属定义为优势菌株。
由图5可知,伯克霍尔德菌属(Burkholderia)、克雷伯氏菌属(Klebsiella)、未分类细菌(unclassified)为3种红曲米样品的共有优势菌属。红曲米样品WX-1中优势菌属有13种,说明WX-1样品细菌种群复杂程度高,红曲米样品WX-2中优势菌属有醋菌属(Acetobacter)、小球菌属(Pediococcus)、乳酸杆菌属(Lactobacillus),均为产酸菌株。而红曲米样品WX-3中细菌相对丰度和细菌种群复杂程度都较低。
对红曲米细菌属丰度进行标准化层次聚类后得到相对丰度(0~4),数字越大表示该菌属相对含量越高。
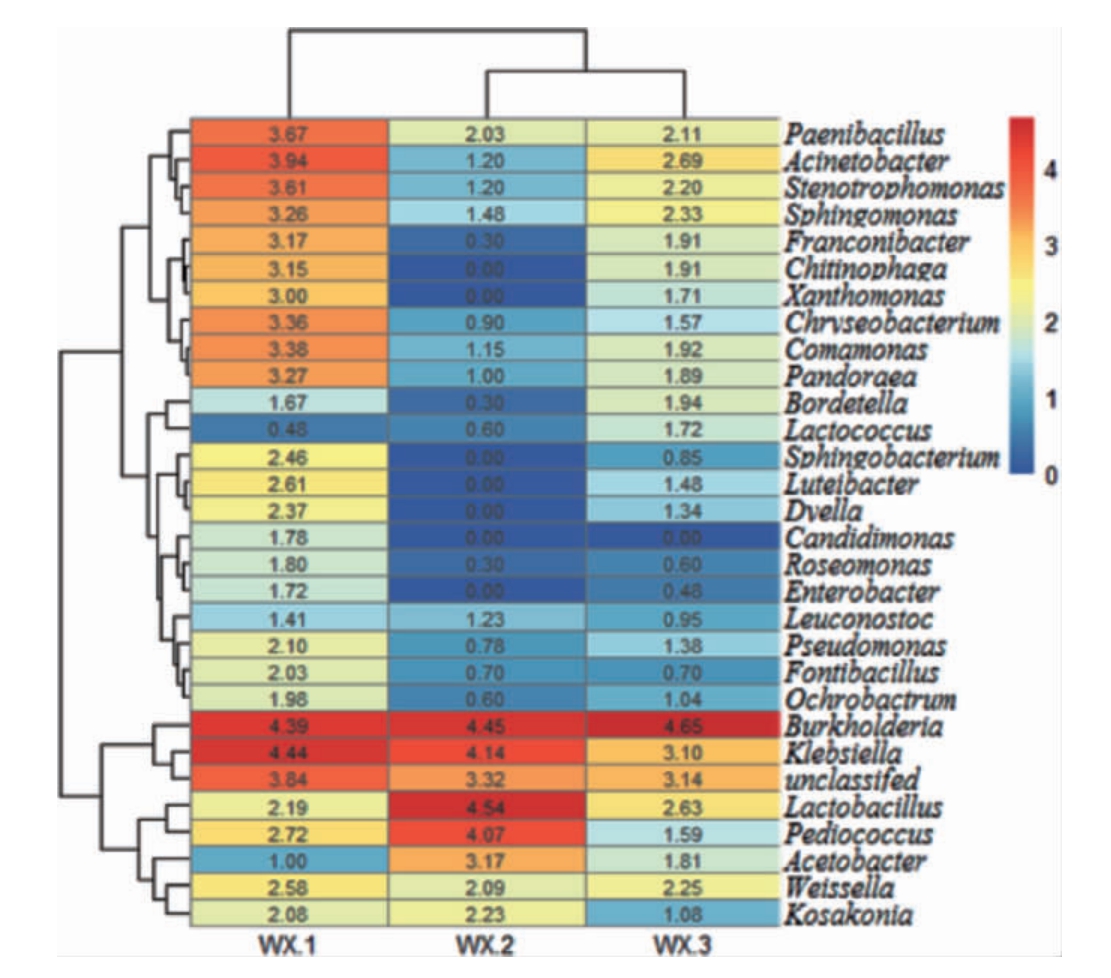
图5 武宣地区3种红曲米细菌属相对丰度热图
Fig.5 Heatmap of relative abundance of bacteria genera of three kinds of red kojic rice samples from Wuxuan area
在属分类水平上,红曲米中主要产酸菌属有克雷伯氏菌属(Klebsiella)、魏斯氏菌属(Weissella)、乳酸杆菌属(Franconibacter)、醋酸杆菌属(Acetobacter)、小球菌属(Pediococcus)、乳酸杆菌属(Lactobacillus),不动杆菌属(Acinetobacter)、类芽孢杆菌属(Paenibacillus)、金黄杆菌属(Chryseobacterium),它们的产酸机理[18-21]见图6。3种红曲米中产酸菌株在种类和相对丰度上均有差异,其中,红曲米样品WX-2产酸菌株种类最多,且菌株对应的相对丰度最高。而红曲米WX-2样品发酵而成的红曲柿酒的总酸、挥发性成分均高于其他两种红曲柿酒,说明红曲细菌群落结构与红曲柿酒中酸类物质的形成紧密相关。

图6 3种红曲米中产酸菌产酸机理
Fig.6 Acid-producing mechanism of acid-producing strains in three kinds of red kojic rice samples
3 结论
该研究以武宣地区3种红曲米作为发酵剂酿造的红曲柿酒总酸和挥发酸含量差异显著(P<0.05),且挥发性酸类物质组成存在较大差异,其中,红曲米样品WX-2制成的红曲柿酒挥发性酸类物质含量最高(10.0%)。应用Illumina MiSeq高通量测序技术检测3种武宣红曲米细菌多样性,研究发现红曲米样品WX-1细菌群落中物种的种类最丰富,红曲米样品WX-2细菌群落中物种数目最多。从3种红曲米样品共检测出19个细菌门,239个细菌属,共有优势菌门为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria);共有优势菌属为伯克霍尔德菌属(Burkholderia)、克雷伯氏菌属(Klebsiella),WX-2样品中优势菌属还有醋菌属(Acetobacter)、小球菌属(Pediococcus)、乳酸杆菌属(Lactobacillus),均为产酸菌株。表明红曲米细菌群落结构与红曲柿酒酸类物质的形成紧密相关。
[1]侯雅琦,刘姣,赵明明,等.红曲产品相关标准的分析研究[J].中国酿造,2020,39(2):1-6.
[2]蒋益虹,郑晓冬.杨梅果酒生产新工艺的研究[J].中国食品学报,2003(2):35-40.
[3]冯娟,张鹏,李江阔,等.柿子加工产品研究进展[J].保鲜与加工,2020,20(3):204-209.
[4]LV X C,HUANG X L,ZHANG W,et al.Yeast diversity of traditional alcohol fermentation starters for Hong Qu glutinous rice wine brewing,revealed by culture-dependent and culture-independent methods[J]. Food Control,2013,34(1):183-190.
[5]LIANG Z C,LIN X Z,HE Z G,et al.Amino acid and microbial community dynamics during the fermentation of Hong Qu glutinous rice wine[J].Food Microbiol,2020,90:103467.
[6]NIU D B,WANG L H,ZENG X A,et al.Effect of ethanol adaption on the inactivation of Acetobacter sp.by pulsed electric fields[J]. Inn Food Sci Emerg Technol,2019,52:25-33.
[7]勾文君,田源,孔小勇,等.洋河酒窖泥细菌群落结构与菌株产酸能力分析[J].微生物学通报,2020,47(6):1651-1661.
[8]吕旭聪,刘志彬,张雯,等.红曲黄酒传统酿造体系中真菌菌群多样性分析方法的构建及其应用[J].中国食品学报,2018,18(8):214-223.
[9]洪家丽,李秋艺,潘雨阳,等.红曲黄酒传统酿造过程挥发性风味组分及微生物菌群多样性分析[J].食品科学,2019,40(12):137-144.
[10]张媛.甜型柿子酒发酵工艺优化及稳定性的研究[D].银川:宁夏大学,2013.
[11]魏冬梅,张艳芳,张予林.利用比色法测定葡萄酒的酒精度[J].食品工业,2001(4):45-46.
[12]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[13]张学英,黄忠意,章发盛,等.两种检测还原糖方法的比较[J].食品与机械,2017,33(2):66-69.
[14]郭伟灵,周文斌,蒋雅君,等.不同类型红曲黄酒中挥发性风味组分比较分析[J].福州大学学报(自然科学版),2018,46(4):586-592
[15]朱治宇,黄永光.基于高通量测序对茅台镇酱香白酒主酿区域霉菌菌群结构多样性的解析[J/OL].食品科学:1-11[2020-06-12].http://kns.cnki.net/kcms/detail/11.2206.TS.20200313.1610.044.html.
[16]王轩,周健,明红梅,等.樱桃果酒酿酒酵母的筛选及香气成分分析[J].食品与发酵工业,2020,46(3):124-130.
[17]熊亚,李敏杰,姜少娟.芒果酒发酵动力学模型及抗氧化性研究[J].食品工业科技,2019,40(19):7,8-11,12.
[18]周小虎,李理.白腐乳发酵过程中细菌群落演替规律研究[J].中国酿造,2020,39(5):168-172.
[19]刘振东,刘怡,李哲,等.新鲜曲拉与干燥曲拉细菌群落结构的比较分析[J].食品研究与开发,2020,41(11):184-190.
[20]邹毅辉,黄红宣,蔡艺敏,等.基于高通量测序分析不同年份闽南腌制萝卜干中细菌多样性[J].中国酿造,2020,39(5):40-43.
[21]孙金凯.代谢工程改造产酸克雷伯氏菌生产D/L-乳酸与丙氨酸[D].济南:山东大学,2018.