辣椒含有丰富的维生素C[1],具有预防心血管疾病、改善消化功能、减肥和促进血液循环等功效[2-6]。辣椒加工产品丰富,如辣椒酱、剁辣椒、盐渍辣椒等[7-8],因其独特的发酵风味和营养价值而深受人们喜爱。其中,剁辣椒是湖南的特色发酵食品,也是湘菜的主要调味品之一,将新鲜辣椒清洗后剁碎,高盐腌制、储存,需要时再经脱盐调味等加工处理后得到的加工产品即为剁辣椒[9]。剁辣椒生产一般是通过自然发酵制成,主要的微生物来源辣椒本身,一般发酵时间为30 d左右[10],因此发酵较为缓慢;此外,剁辣椒加工方式以传统作坊式加工为主,工器具和环境中的微生物侵入则可能导致质量问题。
在自然发酵的剁辣椒中,魏斯氏菌、明串珠菌和乳杆菌是主要的细菌菌属,其中占细菌比例最大的是乳杆菌[12],魏斯氏菌则被认为在发酵前期起主要作用。目前,为了适应剁辣椒工业化转型的需求,针对剁辣椒的微生物领域研究主要集中在菌种选育、纯种发酵、强化发酵等方面,谢靓等[13]通过接种耐盐植物乳杆菌对不同盐渍程度发酵辣椒挥发性成分的研究发现,接种耐盐植物乳杆菌后挥发物质种类、相对含量明显增多,有助于盐渍辣椒香味物质形成。李文青等[14]将肠膜明串珠菌、植物乳杆菌、发酵乳杆菌和嗜酸乳杆菌按照1∶1∶1∶1的配方强化发酵辣椒,最终获得优质剁辣椒。获得风味良好的发酵辣椒则与筛选出适宜其发酵的菌株关系密切,王雪雅等[15]通过对10株乳酸菌进行产酸性、抑菌性等性能的筛选,研究表明发酵乳杆菌和食果糖乳杆菌是辣椒发酵过程中综合品质较好的发酵优良菌株。邓放明等[16]研究发现,Lact.chili 6和Lact.chili 8在低盐发酵过程中具有良好的菌群优势。
剁辣椒生产过程中存在大量的辣椒汁副产物,经过研究发现,辣椒汁具有独特的风味和营养物质[18-20]。目前,大多数企业都把盐渍辣椒汁作为污水排放,这不仅造成大量营养物质流失,还将对环境造成污染。因此,开发利用辣椒汁,提高其附加价值的同时亦能减少污染,具有良好的经济意义和环保价值。本试验选取5株菌株(凝结芽孢杆菌1.3220、植物乳杆菌1.555、植物乳杆菌1.3919、鲁氏接合酵母2.1913、鲁氏接合酵母2.371)为原始菌株,通过测定其产酸能力以及利用全自动微生物生长曲线分析仪对其在正常环境和不同盐度环境下的生长情况进行检测,筛选出的优势菌株接入盐渍辣椒汁作为腌制剂的干辣椒进行发酵,旨在筛选出合适的发酵菌株,设计出风味优良的产品,并为盐渍辣椒汁的利用提供新的途径。
1 材料与方法
1.1 材料与试剂
16%盐渍辣椒水、干辣椒:长沙坛坛香调料食品有限公司;无水乙醇、氢氧化钠:国药集团化学试剂有限公司;酚酞:天津市化学试剂研究所有限公司;MRS肉汤培养基、营养肉汤培养基、麦芽汁培养基:北京奥博星生物技术有限责任公司。其余试剂均为分析纯。
凝结芽孢杆菌(Bacillus coagulans)1.3220;植物乳杆菌(Lactobacillus plantarum)1.555、1.3919;鲁氏接合酵母(Zygosaccharomyces rouxii)2.1913、2.371:均来源于中国普通微生物菌种保藏管理中心。
1.2 仪器与设备
CP114 电子天平:奥豪斯仪器有限公司;KQ3200E超声波清洗器:昆山市超声仪器有限公司;FE20K pH计:梅特勒-托利多仪器有限公司;20133419 超纯水机:贝徕美生物科技有限公司;RTS生长曲线测定仪:浙江BIOSAN生物技术股份有限公司。
1.3 试验方法
1.3.1 菌株生长规律的测定
表1 菌株生长曲线测定详情
Table 1 Growth curve determination details of strains
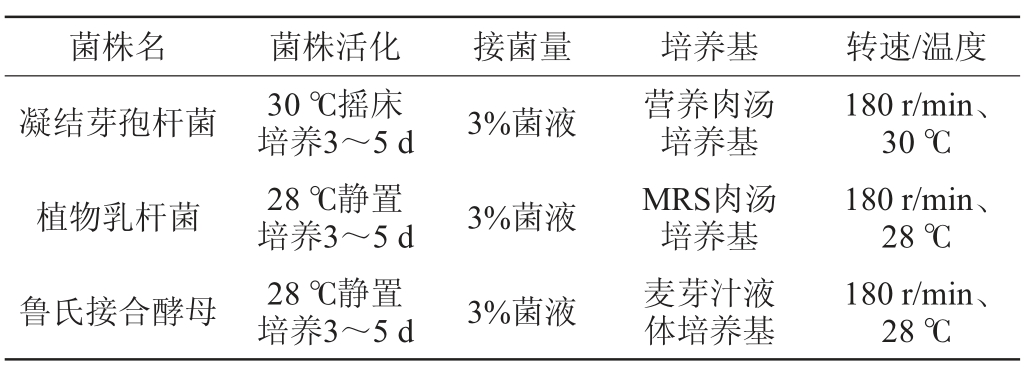
按照表1测定条件,从各斜面挑菌接入对应液体培养基进行不同条件下的菌株活化后,再次分别接入3%菌液于对应的液体培养基中,用RTS生长曲线测定仪每隔30 min测定一次。
1.3.2 试验菌种产酸性能测定
根据表1中菌株活化后,分别取3%菌液接入对应液体培养基,除凝结芽孢杆菌在30 ℃恒温培养箱培养以外,植物乳杆菌和鲁氏接合酵母均在28 ℃恒温培养箱中培养,共培养48 h,期间每4 h测一次酸度。酸度的检测按照国标GB 5009.239—2016《食品中酸度的测定》[21]。
1.3.3 试验菌种耐盐性试验
各试验菌种按表1中的活化方法制作好后,分别取3%的菌液放入盐度6%、8%、10%的培养基中混匀,以不加盐作为对照(P-KB),用RTS生长曲线测定仪进行测定生长规律和产酸能力。
1.3.4 辣椒发酵样品制备工艺流程及操作要点

将盐度为16%的渍辣椒水用无菌蒸馏水稀释至盐度为10%后,作为干辣椒发酵剂。干辣椒粉碎成为片状后按3∶1比例将盐渍辣椒水和干辣椒混合均匀,再按3%接种量接入单一的菌种(对数生长期菌种,细胞浓度控制在108 CFU/mL采用不接种进行对照)分别装于灭菌好的5 L容量的白色食品桶中在30 ℃条件下密封发酵一个月。
2 结果与分析
2.1 试验菌种生长规律测定结果
凝结芽孢杆菌1.3220、鲁氏结合酵母(2.371、2.1913)和植物乳杆菌(1.555、1.3919)在相同环境下的生长曲线见图1。由图1可知,凝结芽孢杆菌1.3220在5~10 h 期间处于生长对数期阶段,OD850nm值由0.51升至1.59,在10~60 h 阶段处于生长稳定期,在60 h时OD850nm值达到整个生长过程的最高值2.5,之后则进入衰亡期。

图1 不同菌株的生长曲线
Fig.1 Growth curves of different strains
植物乳杆菌1.3919在16~32 h期间处于稳定生长期,在32 h之后,该菌则进入衰亡期。1.555的对数生长期处在8~14 h,直至33 h,OD850nm值达到最高为2.8,之后则进入衰亡期。植物乳杆菌1.555较1.3919的对数生长期长2 h,而稳定期短2 h,菌株1.3919的最大OD850nm值要较菌株1.555高0.6,说明植物乳杆菌1.3919在生长速率和后期发酵强度上要更优于1.555。
鲁氏接合酵母菌2.1913的对数生长期是5~26 h,在35 h时最终达到最大OD850nm值为2.8,发酵40 h后,进入衰亡期。而2.371的OD850nm值在5~26 h上升速度较快,OD850nm值在50 h时达到最大为3.4,60 h后处于衰亡期。可知两株鲁氏接合酵母菌中,2.371的OD850nm值比2.1913高0.8,且衰亡时间比2.1913要晚20 h出现,说明2.371较2.1913可能更适于发酵。
2.2 试验菌种产酸性能测定结果
5株菌生长期间产酸能力的对比结果见图2。由图2可知,同类型的菌株产酸能力相似,且植物乳杆菌的产酸能力明显高于鲁氏接合酵母,而凝结芽孢杆菌1.3220则几乎不产酸。菌株1.3919在16~24 h的产酸能力最强,随后上升酸度缓慢并在28 h时达到最高值1.98%,其次为菌株1.555在16~32 h期间酸度上升较快,且在32 h时酸度达到最大值1.8%。菌株2.1913与2.371的酸度变化趋势相似,均在28 h时达到最大酸度值,分别为0.76%、0.65%,且明显弱于植物乳杆菌。而所有菌中产酸能力最弱的则是凝结芽孢杆菌1.3220,在生长期间几乎没有酸度的变化。同时,盐渍辣椒汁的盐度一般在16%~17%,而最后产品脱盐后废弃的辣椒汁盐度在8%~10%左右,为了进一步研究菌株投入发酵的实用性,对所有菌株的耐盐性进行了研究。

图2 不同菌株生长期间的酸度变化
Fig.2 Changes in acidity during growth of different strains
2.3 试验菌种不同盐度下生长情况差异性比较
分别将不同菌株放置于调配成6%、8%、10%的盐度的对应液体培养基中培养,通过RTS生长曲线测试仪测试菌株的生长曲线,以了解其耐盐能力。
2.3.1 凝结芽孢杆菌1.3220在不同食盐浓度中生长情况比较
菌株1.3220在3种不同盐度的营养肉汤培养基中生长曲线的对比情况见图3。由图3可知,菌株1.3220在不同盐度的环境下的生长趋势较为相似,适应期均为0~8 h,且对数期均从8 h开始。随着盐度的增高,对数期结束时间随之延长,6%、8%、10%盐度下对数期时长分别为12 h、13 h、14 h。3种盐度下菌株1.3220的稳定期生长曲线呈相对平行的状态,稳定期时长分别为31 h、32 h、34 h,此外此菌在10%的盐度条件下,在22 h时达到最大OD850nm值(2.53)。综上可得,菌株1.3220在3种不同盐度下的生长曲线较为相似,各最大OD850nm值差距较小,任何盐度环境条件下的生长较正常情况下均更好,说明其菌密度情况相近,也表明此菌耐盐能力较强,且生长较稳定。
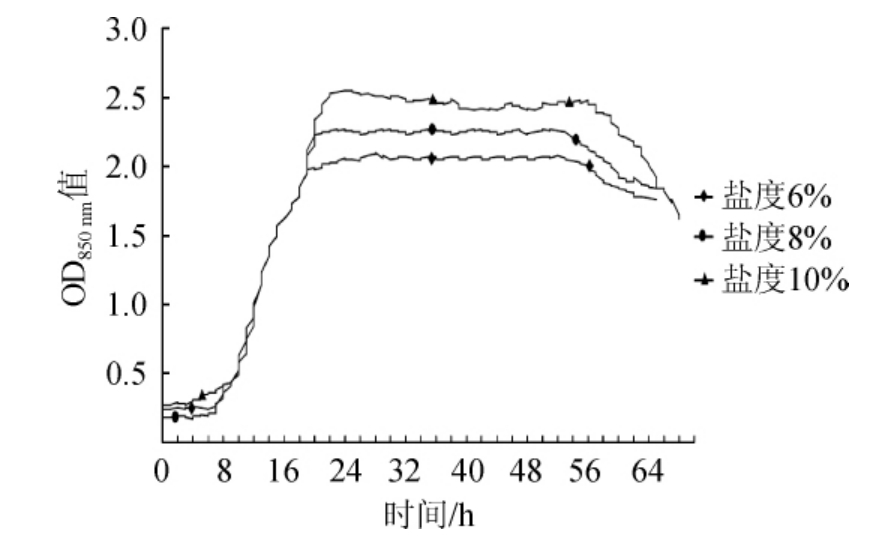
图3 凝结芽孢杆菌1.3220在不同盐度中生长曲线变化
Fig.3 Growth curve change of Bacillus coagulans 1.3220 in different salinities
2.3.2 植物乳杆菌在不同食盐浓度中生长情况比较

图4 菌株1.3919(a)和1.555(b)在不同盐度中的生长曲线
Fig.4 Growth curves in different salinities of strain 1.3919 (a) and 1.555 (b)
由图4(a)可知,1.3919随着生长环境的盐度增加,适应期有所延长,6%盐度条件下适应期为8 h,而10%盐度条件下则延长至12 h。6%、8%、10%盐度环境下此菌的对数生长期分别为8~22 h、12~32 h、12~90 h,其中6%、8%盐度条件下菌的生长曲线上升速率较快,而盐度为10%时则较缓。随着盐度的升高,可达到的OD850nm值也越大,分别为3.85(6%)、5.18(8%)、5.41(10%),均高于图2(a)中最高OD850nm值(3.4)。由图4(b)可知,随着环境盐度的增加,植物乳杆菌1.555与1.3919的对数生长期与最大OD850nm值也随之增加,6%、8%、10%盐度条件下最大OD850nm值分别为3.18(64 h)、5.19(60 h)、5.42(96 h),均高于图1的最高OD850nm值(2.8)。
由此可得两种植物乳杆菌在低盐环境下的生长情况均优于其在普通环境中生长,说明非常适合利用于盐渍等发酵产品。此外,虽然两种植物乳杆菌在10%盐度条件下菌密度相差较小,但菌株1.555的适应期较菌株1.3919长5 h,表明1.3919更加耐盐,在实际发酵中能够更快的适应发酵环境。
2.3.2 鲁氏接合酵母在不同食盐浓度中生长情况比较

图5 菌株2.1913(a)和2.371(b)在不同盐度中的生长曲线
Fig.5 Growth curves in different salinities ofstrain 2.1913 (a) and 2.371 (b)
由图5(a)可知,菌株2.1913在不同盐度下,适应期均为0~20 h左右,但随着盐度增加其对数增长期时长也增加,分别为35 h(6%)、40 h(8%)、77 h(10%),其中8%条件下,增长速率最大,此菌的平稳期时长较短,平均在10 h左右,随后开始进入衰亡期。3种盐度下最大OD850nm值相差较大,10%盐度条件下菌群虽增长速率稍低,但对数增长时期最长,98 h时OD850nm值为最高(5.4),而6%条件下最低(3.38)。
由图5(b)可知,菌株2.371的3条生长曲线差距较大,说明此菌的生长情况受环境盐度影响较大,10%盐度环境下在0~70 h期间的OD850nm值均低于其他2种盐度,但期菌体增长时间持续至100 h,较6%、8%盐度情况下分别长52 h、44 h,且在100 h时达到最高OD850nm值(5.4),可知虽然较高的盐度对2.371前期的生长造成了一定程度的抑制,但也延长了该菌的对数生长期时间。
结果表明,鲁氏接合酵母2.1913、2.371均在10%盐度中生长最佳,且2株菌的生长最旺盛时的菌密度一致,但菌株2.371的对数、稳定生长期都长于2.1913,说明菌株2.371更适合利用于长时间发酵产品。此外,植物乳杆菌1.3919较1.555更加具有耐盐性,在实际发酵中能够更快的适应发酵环境。而凝结芽孢杆菌1.3220的耐盐能力以及产酸能力均要明显低于其他菌株,因此选用植物乳杆菌1.3919与鲁氏接合酵母2.371对辣椒汁进行发酵。
2.4 菌株1.3919与2.371接入辣椒酱发酵过程中酸度变化
综上所述,将单株微生物接入以盐渍辣椒汁作为发酵剂来发酵干辣椒后,通过检测其生长曲线的情况,筛选出两株优良菌株,分别为植物乳杆菌1.3919与鲁氏接合酵母2.371。为了解发酵过程中酸度的变化,则对菌株2.371菌株1.3919在整个发酵过程(30 d)中,每间隔5 d检测一次酸度情况,并且与未接菌样品P-KB进行比较,结果见图6。
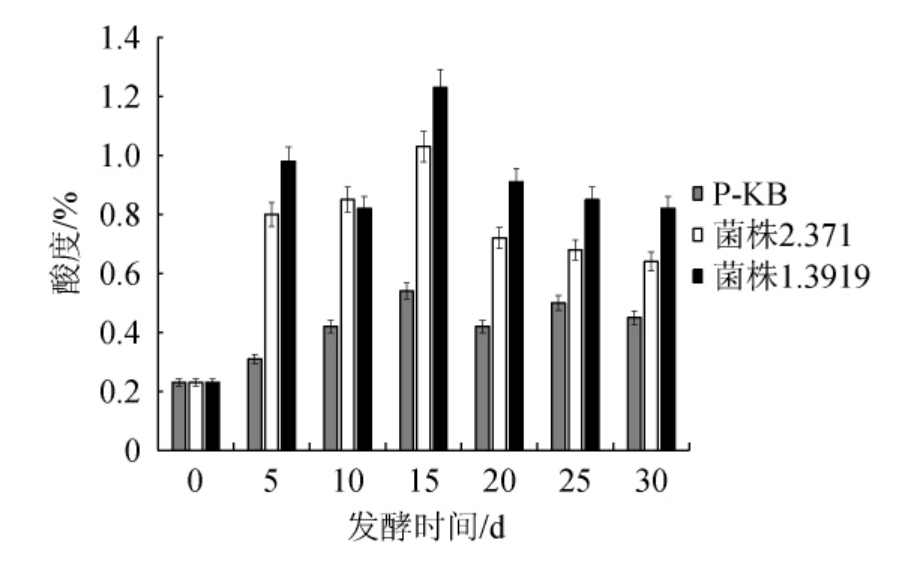
图6 接入不同菌种后辣椒发酵过程中的酸度变化
Fig.6 Changes of acidity in pepper fermentation process after inserting different strains
由图6可知,随着发酵时间的延长,未接菌辣椒汁的酸度也有一定程度的增加,这是因为辣椒发酵本身所带有的菌如乳酸杆菌、明串珠菌等具有一定产酸能力[11];而植物乳杆菌1.3919与鲁氏接合酵母2.371发酵辣椒汁时酸度均呈先上升后下降的趋势,并在15 d达最高值,分别为1.23%、1.03%。发酵结束时(30 d)植物乳杆菌1.3919菌的酸度为1.23%,较未接菌发酵辣椒汁(P-KB)高0.78%。说明,植物乳杆菌1.3919产酸能力更强,与前期实验(图2)结果一致。
3 结论
为筛选出适合接种于盐渍发酵辣椒中的菌株,该研究测定了2株植物乳杆菌(1.3919、1.555)、2株产香鲁氏接合酵母菌(2.1913、2.371)和1株凝结芽孢杆菌1.3220的生长曲线、产酸能力及耐盐性,并利用优势菌株对剁辣椒副产物辣椒汁进行发酵。结果表明:在正常环境下,菌株1.3220对数增长期最短且最快进入平稳期,菌株1.3919的生长繁殖能力最强且最快,OD850nm值在25 h达到最大为3.4;同类型的菌株产酸能力相似,植物乳杆菌中1.3919产酸能力最强(1.98%),其次为鲁氏接合酵母2.1913,而凝结芽孢杆菌1.3220则几乎不产酸。此外,5种菌在含盐条件下的OD850nm值均大于其正常情况,且在10%盐度条件下生长情况最佳。说明这5种菌有较好的耐盐能力,其中鲁氏接合酵母2.371及植物乳酸杆菌1.3919最好。因此将上述所选的两株最佳菌株分别接入以废弃盐渍辣椒水为发酵剂的干辣椒中进行发酵发酵15 d后,各样品酸度均达到最高值,其中以PL-1.3919最高(1.23%),比未接菌的提高了2.28倍,本研究分析了5株常见发酵菌株的产酸能力和耐盐能力,并筛选两株菌株对辣椒汁进行发酵,为辣椒强化发酵提供参考,但对于风味物质以及有机酸形成等的影响还有待研究。
[1]TANIA A C,ISMAEL D S G,DE MELO L A M P,et al.Carotenoid and total vitamin C content of peppers from selected Brazilian cultivars[J]. J Food Compos Anal,2017,57:73-79.
[2]DOGAN A,SELCUK N,ERKAN M.Comparison of pesticide-free and conventional production systems on postharvest quality and nutritional parameters of peppers in different storage conditions[J].Sci Horticult,2016,207:104-116.
[3]KUMAR LAMA,SHARON A T,YAACOV P,et al.Nutritional qualities and aroma volatiles of harvested red pepper fruits stored at suboptimal temperatures[J].Sci Horticult,2016,213:42-48.
[4]GELETA L F,LABUSCHAGNE M T.Combining ability and heritability for vitamin C and total soluble solids in pepper (Capsicum annuum L.)[J].J Sci Food Agr,2010,86(9):1317-1320.
[5]LEE D E,SHIN G R,LEE S,et al.Metabolomics reveal that amino acids are the main contributors to antioxidant activity in wheat and rice gochujangs(Korean fermented red pepper paste)[J].Food Res Int,2016,87:10-17.
[6]唐欣颖,聂相珍,覃琼妮,等.传统发酵型辣椒酱的工艺优化综述[J].农产品加工,2020(1):87-89.
[7]WANG J,WANG R,XIAO Q,et al.Analysis of bacterial diversity during fermentation of Chinese traditional fermented chopped pepper[J]. Lett Appl Microbiol,2019,69(5):346-352.
[8]龚永强,甘增鹏,廖卢艳,等.市售剁辣椒脆性品质评价研究[J].中国酿造,2019,38(10):40-43.
[9]韩俊燕,赵国忠,赵建新,等.发酵辣椒细菌多样性的16S rDNA 测序分析[J].中国食品学报,2018,18(5):246-251.
[10]罗凤莲.湖南剁椒腌制过程中风味及品质变化规律研究[D].长沙:湖南农业大学,2014.
[11]韩俊燕,赵国忠,赵建新,等.发酵辣椒细菌多样性的16S rDNA 测序分析[J].中国食品学报,2018,18(5):246-251.
[12]叶陵,王晶晶,王蓉蓉,等.剁辣椒发酵过程中菌群与有机酸变化规律分析[J].食品科学,2018,39(6):116-121.
[13]谢靓,李梓铭,蒋立文.接种耐盐植物乳杆菌对不同盐渍程度发酵辣椒挥发性成分的影响[J].食品科学,2015,36(16):163-169.
[14]李文青,罗凤莲,曾希珂,等.多菌种接种发酵生产低盐剁辣椒的工艺优化[J].现代食品科技,2019,35(1):212-220.
[15]王雪雅,吴华丽,丁筑红,等.纯种乳酸菌接种发酵辣椒综合品质特性研究[J].中国酿造,2016(9):119-124.
[16]邓放明,李罗明,尹华,等.碎鲜辣椒发酵制品发酵用乳酸菌的选育与接种发酵试验[J].食品科学,2005(3):106-109.
[17]张菊华,许弯,刘伟.发酵蔬菜中乳酸菌资源筛选的研究进展[J].湖南农业科学,2019,400(1):122-126.
[18]MORALES S,EDUARD O,KEBED E,et al.Flavor characterization of native Peruvian chili peppers through integrated aroma fingerprinting and pungency profiling[J].Food Res Int,2018,109:250-259.
[19]唐鑫,夏延斌,吴灿.辣椒汁发酵过程中挥发性成分的变化[J].食品科学,2014,35(16):197-201.
[20]罗凤莲,夏延斌,王燕,等.脱盐盐渍辣椒发酵工艺优化及风味品质研究[J].湖南农业大学学报(自然科学版),2017,43(1):71-78.
[21]中华人民共和国国家卫生和计划生育委员会.GB 5009.239—2016 食品中酸度的测定[S].北京:中国标准出版社,2016.