牛蒡(Arctium lappc L.)为菊科(Compositae)牛蒡属(Synurus)植物,是一种典型的药食同源植物[1],含有蛋白质、菊糖、多种维生素和矿物质,其中胡罗素含量是胡萝卜的150倍,蛋白质和钙含量是根茎类植物之冠,具有降血压、降血脂、抗病毒、抗肿瘤等作用[2]。中国牛蒡产量居世界第一[3],而徐州市丰县年产牛蒡28万t,年销售收入20亿元,因此,徐州丰县有“牛蒡之乡”之称[4]。
钾是植物生长需要量最大的三大类必需营养元素之一,地壳中钾元素含量约占2.47%,但是土壤中92%~98%的钾是以矿物质钾形式存在的[5],是植物不能直接利用的。我国是一个土壤缺钾严重的国家,目前约有0.3亿hm2土地缺钾[6],并且我国钾肥的储量较小、开发难度大,每年需要大量进口钾肥。以江苏为例,江苏每年大约需要钾肥10万t,但江苏自给的钾肥仅有0.15万t,其余需要从俄罗斯等国进口[7]。转化土壤中的无效钾,提高土壤中有效钾含量,是解决我国土壤缺钾的一个有效途径。土壤中存在一些通过自身的代谢作用,能够把无效钾转化为植物可以直接吸收利用的有效钾的微生物,称其为解钾菌(postassium bacteria)。60多年前,前苏联科学家亚历山大罗夫[8]第一次发现硅酸盐细菌以来,解钾菌的研究从未间断过并取得一定的进展。盛下放等[9]分离筛选到一株高效的解钾菌NBT,解钾率达到226.0%,大田试验显示对棉花有一定的增产作用;SUGUMARAN P等[10]筛选得到一株解钾菌,可使土壤中有效钾质量浓度达到99.60 mg/kg,植物干质量增加125%。
目前,关于解钾菌报道较多,但解钾菌的绝对解钾量仍然不高,针对牛蒡专用解钾菌的研究还没有报道。因此,本研究从牛蒡根际土壤中分离筛选解钾菌,通过形态观察、生理生化试验及分子生物学技术对其进行菌种鉴定,并通过单因素试验和响应面试验对其解钾条件进行优化,最后,通过牛蒡盆栽试验验证其促生能力,为牛蒡专用有机肥提供解钾微生物菌剂。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
通过5点取样法在徐州市丰县牛蒡标准化种植基地采集牛蒡根际5~15 cm深土壤样本,采集后混匀装入无菌牛皮纸袋密封,贴上标签,4 ℃保存。
1.1.2 试剂
FeCl3、CaCO3、MgSO4·7H2O、Na2HPO4(均为分析纯):格里斯(天津)医药化学技术有限公司;酵母浸膏、蔗糖、琼脂(均为生化试剂):北京陆桥技术股份有限责任公司;钾长石粉(K2O≥10%):江西佳利生化高科有限公司;Taq聚合酶(2.5 U/μL)、脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker、聚合酶链式反应(polymerase chain reaction,PCR)产物纯化试剂盒:上海生工生物工程技术服务有限公司。
1.1.3 培养基
初筛培养基[11]:FeCl3 0.005 g/L,CaCO3 0.1 g/L,Na2HPO4 2.0 g/L,MgSO4·7H2O 0.5 g/L,(NH4)2SO41.0 g/L,蔗糖5.0 g/L,钾长石粉(去离子水浸泡过夜,反复冲洗8~10次,阴干,去除可溶性钾)1.0 g/L,琼脂18 g/L,蒸馏水1 000 mL,pH值7.0~7.5。121 ℃高压蒸汽灭菌20 min。
种子液培养基[12]:NaCl 0.1 g/L,(NH4)2SO4 1.0 g/L,CaCO3 1.0 g/L,K2HPO4 2.0 g/L,MgSO4·7H2O 0.5 g/L,蔗糖10 g/L,酵母膏0.5 g/L,蒸馏水1 000 mL,pH 7.4。121 ℃高压蒸汽灭菌20 min。固体培养基中添加琼脂粉20 g/L。
发酵培养基[13]:NaCl 0.1 g/L,CaCO3 1.0 g/L,(NH4)2SO4 1.0 g/L,Na2HPO4 2.0 g/L,MgSO4·7H2O 0.5 g/L,蔗糖10.0 g/L,酵母膏0.5 g/L,钾长石粉(去离子水浸泡过夜,反复冲洗8~10次,阴干,去除可溶性钾)10.0 g/L,蒸馏水1 000 mL,pH 7.4。121 ℃高压蒸汽灭菌20 min。
改良LB液体培养基[14]:NaCl 10.0 g/L,L-色氨酸0.5 g/L,酵母提取物5.0 g/L,胰蛋白胨10.0 g/L,双蒸水1 000 mL;pH 6.8~7.2。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
HZ-124/85S半微量电子天平:上海诺宣科学仪器有限公司;HNY-200B恒温摇床:上海乔跃电子科技有限公司;LH-PYX3M生化培养箱:常州金南仪器制造有限公司;VD-850台式超净工作台:杭州旭清科技有限公司;MG96G型基因扩增仪:北京君意东方电泳设备有限公司;XW-80A漩涡混合器:广森实验器材有限公司;TDZ4离心机:青岛诺凯达机械制造有限公司;UV2800S紫外分光光度计:上海力辰仪器科技有限公司;ICP-5000电感耦合等离子体发射光谱(inductivelycoupled plasma-optical emission spectrometer,ICP-OES)仪:北京吉天仪器有限公司。
1.3 方法
1.3.1 牛蒡根际土壤中解钾菌的初筛
称取10 g牛蒡根际土壤,加入90 mL无菌去离子水中充分振荡,采用10倍梯度稀释至10-6,制备土壤悬液。取稀释度为10-4、10-5、10-6的土壤悬液各100 μL均匀涂布于初筛培养基,每个浓度做3个平行,30 ℃倒置培养60 h。挑选菌落直径大、圆形、表面湿润的单菌落进行划线纯化,直至显微观察得到纯菌种。
1.3.2 牛蒡根际土壤中解钾菌的复筛
(1)有效钾含量的测定
挑取初筛解钾菌菌落接种到种子培养基,在37 ℃、200 r/min条件下培养至菌体浓为108 CFU/mL作为种子液。按5%(V/V)的接种量将种子液接种于发酵培养基,30 ℃、200 r/min条件下培养6 d,以等量灭菌的种子液为对照组,每个菌落做3个平行。采用过氧化氢灰化法处理发酵液,利用电感耦合等离子体发射光谱(ICP-OES)仪测定处理后发酵液中钾离子含量[15],并计算有效钾的相对增加率,其计算公式如下:
a=(ρ1-ρ0)/×100%[15]
式中:a:有效钾增加率,%;ρ1:试验组发酵液中有效钾含量,mg/L;ρ0:对照组发酵液中有效钾含量,mg/L。
(2)解钾菌分泌吲哚乙酸(indole-3-acetic acid,IAA)能力的测定
挑取初筛解钾菌菌落接种到改良的LB液体培养基,37℃、200r/min条件下恒温振荡培养48h。取发酵液,10000r/min离心20 min,取上清液50 μL加入等体积Sackowchi's显色剂,倒在白瓷板上避光观察,30 min出现粉红色为阳性,表示该菌株可以分泌吲哚乙酸(IAA)[16]。以接种灭活解钾菌培养液为对照,取上述阳性菌株混合液,测定波长530 nm处的吸光度值,计算阳性解钾菌株分泌IAA的量[17]。
1.3.3 解钾菌株的鉴定
形态观察[18]:借助显微镜进行菌株的形态特征观察和菌落特征观察。
生理生化特性鉴定:参考文献[18-19]进行生理生化试验。
16S rDNA序列分析[20]:利用细菌基因组DNA提取试剂盒提取解钾菌株的DNA,以其为模板,使用通用引物F(5'-AGAGTTTGATCCTGGCTCAG-3')和R(5'-GGTTACCTTGTTACGACTT-3')PCR扩增16S rDNA基因。PCR扩增体系(20 μL):10×PCR缓冲液2 μL,模板DNA 20 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)(10 mmo/L)0.45 μL,上、下游引物(20 μg/L)各0.25 μL,Taq DNA聚合酶(5 U/μL)0.4 μL,加双蒸水(ddH2O)至终体积。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,55.5 ℃退火45 s,72 ℃延伸2 min,共35个循环;72 ℃最后延伸10 min。回收琼脂糖凝胶PCR克隆片段连接到T载体,送至南京世和基因生物技术有限公司进行基因测序,测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库进行BLAST比对搜索,选取同源性较高的模式菌株的16S rDNA,利用Mega 6软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.4 解钾菌株解钾条件优化
(1)单因素试验
考察初始pH值(2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0)、发酵温度(25 ℃、26 ℃、27 ℃、28 ℃、29 ℃、30 ℃、31 ℃、32 ℃)、接种量(1%、2%、3%、4%、5%、6%、7%、8%(V/V))、培养时间(12 h、16 h、20 h、24 h、28 h、32 h、36 h、40 h)对可溶性钾含量的影响,每个试验做3个平行。
(2)响应面试验
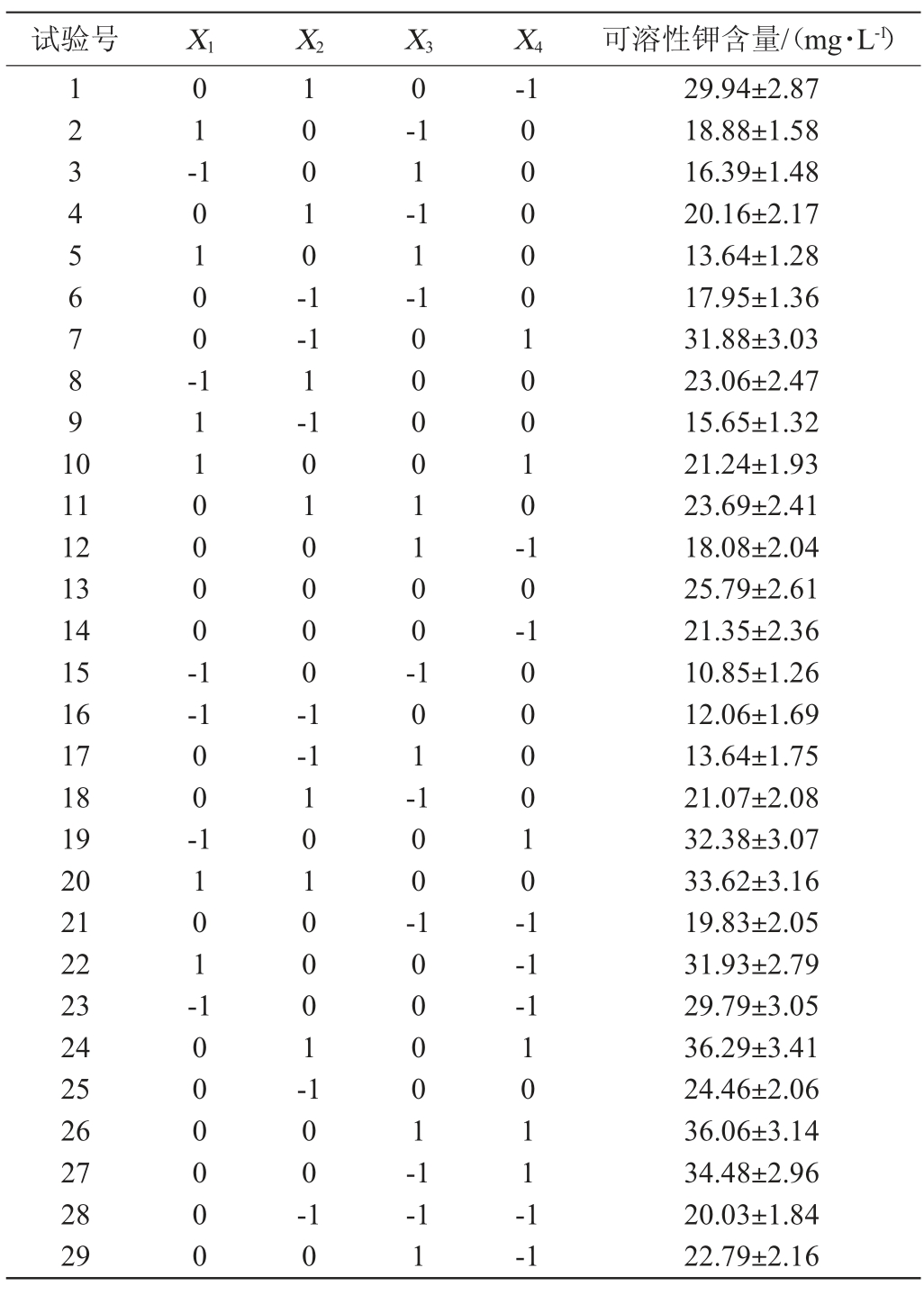
根据单因素试验结果,以发酵温度(X1)、初始pH值(X2)、接种量(X3)和发酵时间(X4)为自变量,以可溶性钾含量(Y)为响应值,进行中心组合响应面试验,试验设计因素与水平见表1。
表1 解钾条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for potassium-dissolving conditions optimization

1.3.5 盆栽试验
对解钾能力优化后的菌株进行盆栽试验,选用0~25 cm耕层的土壤,将土壤风干粉碎后,装入花盆中(底直径25 cm,高29 cm),每盆装3 kg,共装20盆。将20盆土壤随机分成2组(实验组和对照组)。实验组将发酵原液加入适量无菌水稀释,把牛蒡种子浸入稀释液中1~2 h,阴干后播种,剩余的稀释液播种时一起施入土壤。对照组用等量的无菌水处理。30 d后测量牛蒡的株高、茎的直径、叶片数和地上部分鲜质量。
1.3.6 数据处理
使用软件Design Expert 8.0.6[21]对试验结果数据进行统计分析。
2 结果与分析
2.1 解钾菌筛选
通过初筛共获得36株具有解钾能力的菌株。挑选直径较大、圆形、表面湿润的9个菌落进行复筛,对菌株进行编号,分别为PB-1、PB-2、PB-3、PB-4、PB-5、PB-6、PB-7、PB-8和PB-9,测定每株解钾菌发酵液中的有效钾含量,同时测定IAA产量,每株解钾菌做3个平行,结果分别见表2和表3。
表2 9株菌株解钾率的测定结果
Table 2 Determination results of potassium-dissolving rates of 9 strains

注:同一列中不同小写字母表示不同处理间差异显著(P<0.05)。
表3 9株菌株产泌吲哚乙酸能力的测定结果
Table 3 Determination results of indole-3-acetic acid production capacity of 9 strains

注:“-”表示没有颜色反应;“+”表示颜色反应为浅红色;“++”表示颜色反应为红色;“+++”表示颜色反应为深红色。
由表2可知,9株解钾菌解钾率较高,可溶性钾的增加率在116%~136%之间,其中菌株PB-9发酵液中可溶性钾的增加率最高,达到136%。比李新新等[22]筛选的类芽孢杆菌属解钾菌G4可溶性钾增加率(127.6%)、李海龙等[23]分离筛选出的芽孢杆菌QL21的可溶性钾增加率(25.1%)高。由表3可知,9株解钾菌在改良LB液体培养基中培养24 h后,有7株菌株可以产IAA,其中菌株PB-9产IAA的能力最强,IAA产量达到38.64 mg/L。因此,选取菌株PB-9为研究对象,进行下一步研究。
2.2 解磷菌PB-9的鉴定
2.2.1 形态学鉴定
菌株PB-9在种子固体培养基上培养48 h后,菌落及细胞形态见图1。由图1a可知,菌株PB-9的菌落呈圆形,不透明,乳白色,表明光滑、隆起,边缘湿润。由图1b可知,菌株PB-9革兰氏染色阳性,多呈棒状,单个或呈短链排列,大小约(1.2~1.5)μm×(2.0~4.0)μm,有芽孢、菌毛,有鞭毛,能运动。
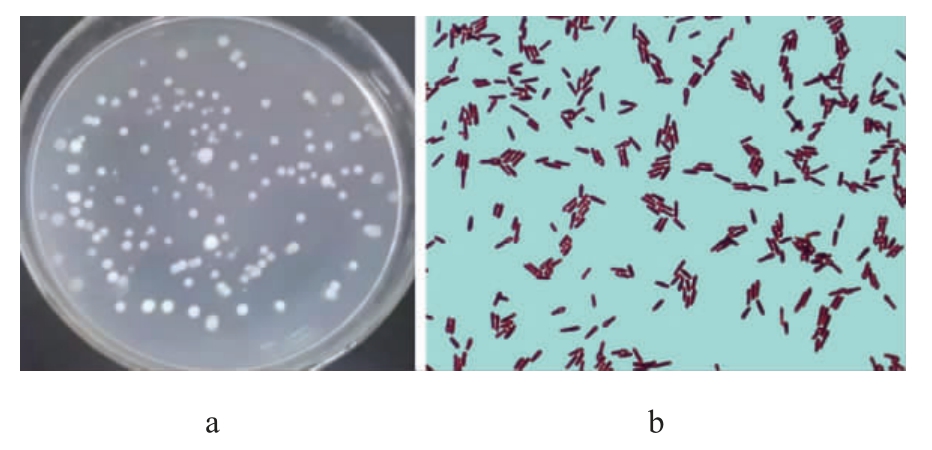
图1 菌株PB-9的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of strain PB-9
2.2.2 生理生化特征鉴定
表4 菌株PB-9的生理生化特性
Table 4 Biophysical and biochemical characteristics of strain PB-9

注:“+”表示结果呈阳性;“―”表示结果呈阴性。
由表4可知,菌株PB-9的生理生化特性与巨大芽孢杆菌的生理生化特性相同,结合菌落特征和显微特征,初步鉴定该菌株为巨大芽孢杆菌(Bacillus megateriums)。
2.2.3 分子生物学鉴定
由图2可知,菌株PB-9与巨大芽孢杆菌(Bacillus megaterium)(GenBank:DQ462195)聚于一支,亲缘关系最近。结合菌株PB-9的菌落特征、显微观察特征和生理生化特性,将菌株PB-9鉴定为巨大芽孢杆菌(Bacillus megaterium)。对于解钾菌的系统发育分类地位,得到国际公认的菌种包括:土壤芽孢杆菌(Bacillus edaphicus)[24]、环状芽孢杆菌(Bacillus edaphicus)[25]、胶质芽孢杆菌(Bacillus mucilagionsus)[26]。但是,随着国内外研究者对解钾菌的深入研究,目前解钾菌的种类出现了多样化趋势:陈宇丰等[27]从香蕉根际土壤中分离筛选出一株高效解钾菌,经鉴定为陕西链霉菌(Streptomyeces shaanxiensis);张朝辉等[28]从烤烟根际分离得到一株解钾菌K03,通过形态观察、生理生化特征及16S rDNA序列分析,鉴定为阿氏肠杆菌(Enterobacter asburiae)。姜霁航等[29]从苹果根际土壤分离得到5株解钾能力较强的菌株,经鉴定1株为不动杆菌属(Acinetobacter sp.)、3株为假单胞菌属(Pseudomonas sp.)、1株为芽孢杆菌属(Bacillus sp.)。

图2 基于16S rDNA基因序列菌株PB-9的系统进化树
Fig.2 Phylogenetic tree of strain PB-9 based on 16S rDNA gene sequences
2.3 巨大芽孢杆菌PB-9的解钾条件优化
2.3.1 解钾条件优化单因素试验结果
由图3可知,可溶性钾含量随着发酵温度的升高呈先增大后减小的趋势,当发酵温度为31 ℃时,可溶性钾含量(36.28 mg/L)最大,表明31 ℃是菌株PB-9解钾的最适温度。原因可能是温度会影响菌株PB-9细胞内酶的活性,温度31 ℃时菌株PB-9细胞内酶活性最高,所以菌株解钾能力最强。可溶性钾含量随着初始pH值的升高呈先增大后减小的趋势,当初始pH值为6.0时,可溶性钾含量(33.16 mg/L)最大,表明初始pH值6.0是菌株PB-9解钾的最适初始pH值。原因可能是环境中的pH值会影响菌株细胞内的pH值,菌株细胞内的pH值也会影响酶的催化活性,从而影响菌株的解钾能力。可溶性钾含量随着接种量的增大呈先增大后减小的趋势,当接种量为7.0%时,可溶性钾含量(36.19 mg/L)最大,表明菌株PB-9解钾的最佳接种量为7.0%。原因可能是当接种量过小时,达到最大解钾能力需要时间较长,当接种量较大时,菌种之间形成竞争过于激烈,同样不利于解钾。可溶性钾含量随着发酵时间的延长呈先增大后减小的趋势,当发酵时间为55 h时,可溶性钾含量(36.16 mg/L)最大,这与菌种本身的遗传特性及培养基丰富程度等因素有关。
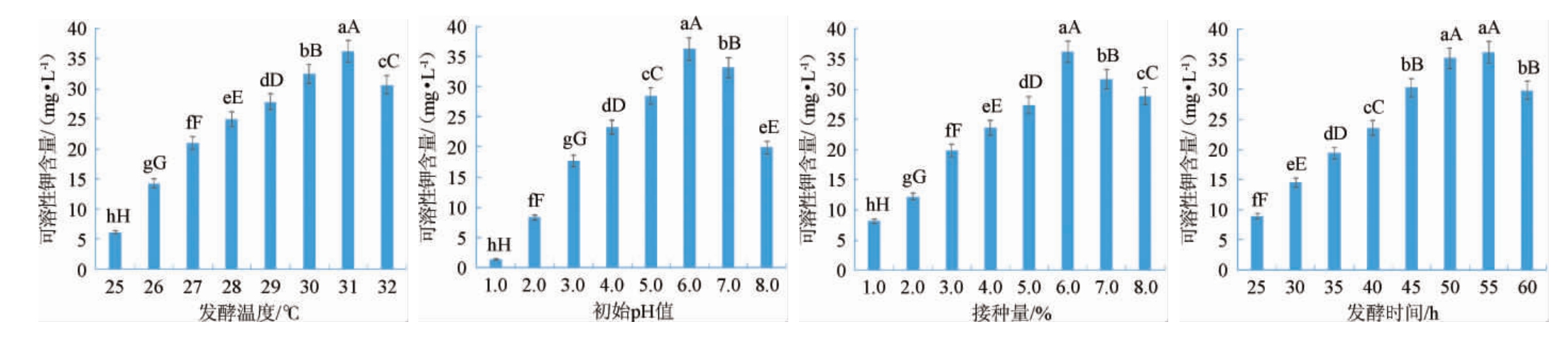
图3 不同培养条件对菌株PB-9解钾能力的影响
Fig.3 Effect of different culture conditions on potassium-solubilizing ability of strain PB-9
不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。
2.3.2 解钾条件优化响应面试验结果
根据单因素试验结果,以发酵温度(X1)、初始pH值(X2)、接种量(X3)和发酵时间(X4)为自变量,以可溶性钾含量(Y)为响应值,进行中心组合响应面试验,响应面试验结果与分析见表5,方差分析见表6。
表5 菌株PB-9解钾条件优化响应面试验结果与分析
Table 5 Results and analysis of response surface tests for potassium-dissolving conditions optimization
对表6结果进行多元回归拟合,得到的回归方程如下:

表6 响应面试验结果方差分析
Table 6 Variance analysis of response surface test results

注:“**”表示对结果影响极显著(P<0.01)。
由表7可知,模型极显著(P<0.01),失拟项不显著(P>0.05),说明模型可靠。一次项及二次项均对结果影响极显著(P<0.01),交互项对结果影响不显著(P>0.05)。对以上回归方程求解可得出:X1=30.86、X2=6.76、X3=6.58、X4=52.61。也就是当发酵温度为30.86 ℃、初始pH值为6.76、接种量为6.58%和发酵时间为52.61 h,可溶性钾含量最高。结合实际情况,最终确定最优的发酵条件为发酵温度31 ℃、初始pH值6.8、接种量6.6%和发酵时间53 h,可溶性钾含量理论值36.28 mg/L,增长率136.24%。
为了检验模型的准确性,在最优条件下进行验证试验,结果可溶性钾含量实际值为38.46 mg/L,与理论值相差较小。由此可以看出预测模型可以很好预测菌株PB-9实际发酵情况。
2.4 盆栽试验结果
盆内种植牛蒡,一组盆内接种PB-9菌液,另一组为等量清水(CK)。30 d后测定牛蒡的生长参数,结果见表7。
表7 菌株PB-9对牛蒡生长的影响
Table 7 Effect of strain PB-9 on the growth of burdock

注:不同小写字母表示与对照相比,差异显著(P<0.05)。
由表7可知,与对照(CK)组相比,牛蒡生长的各项参数除了茎直径差异不显著(P>0.05)外,其他各项指标都有显著差异(P<0.05)。接菌组牛蒡的株高、叶片数、地上部分鲜质量比CK组分别高25.78%、28.48%、26.54%。所以,菌株PB-9可以明显的促进牛蒡的生长。原因主要是菌株PB-9除了具有较强的解钾作用,还可以分泌IAA,并且能降低土壤pH值抑制有害微生物生长和提高土壤中可溶性钾的含量。
3 结论
本研究从徐州丰县牛蒡种植标准区牛蒡土壤中初筛出具有较强解钾能力微生物9株,通过测定发酵液中可溶性钾含量及IAA生产能力,复筛选出1株解钾能力和产IAA能力都是最强的菌株PB-9。利用形态观察、生理生化特性测定和16S rDNA基因序列分析,鉴定菌株PB-9为巨大芽孢杆菌(Bacillus megateriums)。通过单因素试验和响应面试验确定菌株PB-9的最优解钾条件为培养温度31 ℃、初始pH值6.8、接种量6.6%和培养时间为53 h,在此最优条件下,可溶性钾含量为38.46mg/L,增长率为136.24%。最后,通过牛蒡盆栽试验验证菌株PB-9促生能力,结果显示接菌组牛蒡的株高、叶片数和地上部分鲜质量比CK组分别高25.78%、28.48%、26.54%,对牛蒡的生长具有显著的促进作用(P<0.05)。
[1]徐孝梁.牛蒡根有效成分工业化提取技术研究及牛黄饮料的制备[D].济南:齐鲁工业大学,2015.
[2]伏卉,杜丽君,牛先前,等.牛蒡保健饮料加工研究[J].食品研究与开发,2015,36(19):98-101.
[3]赵凯,马维红,赵娜,等.牛蒡提取物防治心血管疾病作用机制的研究现状[J].山东医药,2015,55(14):96-98.
[4]任媛媛,高晓光,祁琪,等.牛蒡多酚提取护色和提取工艺条件的优化研究[J].食品工业科技,2016,37(21):265-268.
[5]孟繁龙,张春枝,李杨,等.解钾菌的筛选及培养条件优化[J].中国酿造,2012,31(4):92-94.
[6]VASANTHI N,SALEENA L M,ANTHONI R S.Evaluation of media for isolation and screening of silicate solubilising bacteria[J].Int J Curr Res,2013,5(2):406-408.
[7]张成省,陈雪,王静,等.烟草根际土壤中解钾细菌的分离与多样性分析[J].中国生态农业学报,2013,21(6):737-743.
[8]袁文功,秀玲,邓伟,等.一株硅酸盐细菌的分离及解钾活性研究[J].中国微生态学杂志,2012,24(3):226-229.
[9]盛下放,黄为一.硅酸盐细菌NBT 菌株解钾机理初探[J].土壤学报,2002,39(6):863-871.
[10]SUGUMARAN P,JANARTHANAM B.Solubilization of potassium containing minerals by bacteria and their effect on plant growth[J].Wor J Agr Sci,2007,3(3):350-355.
[11]易浪波,彭清忠,何齐庄,等.高效钾长石分离菌株的筛选、鉴定及解钾活性研究[J].中国微生态学杂志,2012,24(9):773-776.
[12]ZHANG A M,ZHAO C Y,GAO T G,et al.Solubilization of insoluble potassium and phosphate by Paenibacillus kribensis CX-7:A soil microorganism with biological control potential[J].Afr J Microbiol Res,2013,7(1):41-47.
[13]罗娜,周德明,徐睿,等.降香黄檀、檀香根际解钾菌的筛选与活性研究[J].热带作物学报,2016,37(5):964-970.
[14]罗华元,常寿荣,王绍坤,等.云烟高端品牌植烟区根际土壤高效解钾菌的筛选[J].西南农业学报,2011,24(5):1813-1817.
[15]王珣钰,黄巧云,蔡鹏,等.解钾菌解钾效率检测方法的比较[J].华中农业大学学报,2016,35(1):81-85.
[16]YAN X J,LI Z L,XIE D T,et al.Effect of potassium bacteria on the adsorption of potassium feldspar colloid[J]. J Southwest Univ,2017,2:1-7.
[17]FENG H M,QIN Y S,LI X F,et al.Screening and enzyme production characteristics of thermophilic cellulose producing strains[J].Environ Sci,2016,37(4):1546-1552.
[18]BHATTACHARYA S,BACHANI P,JAIN D,et al.Extraction of potassium from K-feldspar through potassium solubilization in the halophilic Acinetobacter soil(MTCC 5918)isolated from the experimental salt farm[J].Int J Min Process,2016,152:53-57.
[19]VASSILEV N,EICHLER L B,VASSIEVA M.Stress-tolerant P-solubilizing microorganisms[J].Appl Microbiol Biotechn,2012,95(4):851.
[20]GONG J,SONG Y J,ZHANG X L.Phylogenetic and functional diversity of nitrogen cycling microbes in coastal sediments[J].Biodivers Sci,2013,21(4):433-444.
[21]WANG L,WU Y T,LIU H M,et al.Study on full length cDNA of MVA pathwayrelated genes in Eucommia ulmoides[J].J Central South Univer Forest Technol,2014,34(1):94-102.
[22]李新新,高新新,陈星,等.一株高效解钾菌的筛选、鉴定及发酵条件的优化[J].土壤学报,2014,51(2):381-388.
[23]李海龙,谷洁,张宏斌,等.秦岭山区硅酸盐细菌的分离、筛选以及初步鉴定[J].西北农业学报,2011,20(4):194-199.
[24]SHELOBOLINA E S,AVAKYAN ZA,BULYGINA E S,et al.Description of a new species of mucilaginosus bacteria, Bacillus edaphicus sp.nov.and confirmation the taxonomic status of Bacillus mucilaginosus[J].Mikrobiologiya,1997,66:813-822.
[25]ZAHRA M K,MONIB M,ABDEL A S I,et al.Significance of soil inoculation with silicate bacteria[J].Zentralbl Mikrobiol,1984,139(5):349-357.
[26]AVANKYAN Z A,PIVOVAROVA T A,KARAVAILO G I.Properties of a new species,Bacillus mucilanginosus[J].Mikrobiologiya,1986,55:477-482.
[27]陈宇丰,柯春亮,周登博,等.香蕉根际土壤解钾放线菌的筛选鉴定及解钾特性研究[J].生物技术通报,2015,31(6):129-137.
[28]张朝辉,王豹祥,席淑雅,等.一株烤烟根际解钾细菌的鉴定及其在考研生产中的应用[J].浙江农业学报,2011,23(3):553-558.
[29]姜霁航,彭霞薇,颜振鑫,等.苹果树根际高效解钾菌的筛选及鉴定[J].中国农业气象,2017,38(11):738-748.